Координационная химия, 2022, T. 48, № 3, стр. 168-177
Четырехъядерные гидроксокомплексы РЗЭ с кубановым остовом как продукт самоконтролируемого гидролиза
Д. М. Цымбаренко 1, *, Д. И. Гребенюк 1, М. А. Бурлакова 1, А. С. Шуркина 1
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: tsymbarenko@inorg.chem.msu.ru
Поступила в редакцию 26.04.2021
После доработки 16.08.2021
Принята к публикации 18.08.2021
- EDN: KODEVX
- DOI: 10.31857/S0132344X22030057
Аннотация
В условиях самоконтролируемого гидролиза при взаимодействии трифторацетатов лантана и неодима с раствором диэтилентриамина (Deta) на воздухе впервые получены и охарактеризованы методами РСА, РФА, ИК-спектроскопии и элементного анализа четырехъядерные гидроксокомплексы [La4(Deta)4(OH)4(Tfa)3(DetadcH)2](HTfa)(H2O)7(Tfa)3 (I) и [Nd4(Deta)4(OH)4(Tfa)3(DetadcH)2]- (H2O)n(Tfa)3 (II) с диэтилентриамин-N,N′-дикарбамат-анионами (DetadcH–). Соединения I и II содержат однотипный комплексный катионный фрагмент с кубановым металл-кислородным остовом, стабилизированный за счет четырех хелатных Deta и двух мостиковых лигандов DetadcH–. Выполнены DFT расчеты геометрии и колебательного спектра комплексного катиона [La4(Deta)4- (OH)4(Tfa)3(DetadcH)2]3+.
Полиядерные комплексы РЗЭ привлекают внимание исследователей в качестве перспективных соединений для создания люминесцентных и магнитных материалов. Близость нескольких ионов РЗЭ в одной молекуле может обеспечить перенос энергии между ними, что важно для создания новых люминесцентных термометров [1], люминесцентных сенсоров [2], ап-конверсионных [3] и магнетокалорических материалов [4, 5]. Близкие структурные свойства элементов в ряду РЗЭ и различные люминесцентные и магнитные свойства, определяемые числом f-электронов, обеспечивают возможность тонкой настройки функциональных свойств получаемого материала. В последние годы молекулярные кластеры РЗЭ рассматриваются в литературе в качестве вторичных структурных блоков для новых координационных полимеров, в том числе металлорганических каркасов [6].
Дополнительный интерес к системам карбоксилатов РЗЭ с аминами вызван также тем, что они находят применение в качестве прекурсоров в растворном методе получения неорганических тонкопленочных материалов на основе РЗЭ: оксидов и фторидов [7–10]. Важным преимуществом таких систем является легкий гидролиз под действием аминов с образованием аморфного геля, обеспечивающего однородность и сплошность образующейся при его отжиге пленки неорганического материала. Однако склонность к гелеобразованию в большинстве случаев затрудняет выделение промежуточных комплексов в кристаллическом виде и изучение их структуры методами рентгеновской дифракции.
В кислых водных растворах ионы РЗЭ существуют в виде акватированных ионов [Ln(H2O)n]3+ (n = = 8, 9). При повышении pH происходит их ступенчатый гидролиз, в ходе которого в растворе образуются гидроксокомплексы РЗЭ и в конечном счете соответствующий гидроксид Ln(OH)3 при значениях pH от 7.5 (La) до 5.7 (Lu) [11]. В то же время присутствие в растворе анионных или нейтральных хелатирующих лигандов может предотвращать предельную конденсацию гидроксокомплексов до Ln(OH)3 и приводить к образованию молекулярных кластеров РЗЭ.
В литературе описано большое разнообразие полиядерных молекулярных кластеров РЗЭ с различным числом атомов металла [12]. Наиболее изученными среди них являются четрырехъядерные кластеры на основе кубанового фрагмента {Ln4(μ3-OH)4} [13, 14] и плоского фрагмента {Ln4(μ3-OH)2} [15, 16], а также шестиядерные октаэдрические кластеры на основе фрагмента {Ln6(μ3-OH)8} [17–19]. Основным методом получения молекулярных кластеров РЗЭ является реакция контролируемого гидролиза неорганической соли РЗЭ в присутствии органического лиганда, стабилизирующего кластер и предотвращающего его дальнейшую конденсацию. Такой способ позволяет получать разнообразные полиядерные архитектуры, включающие комплексы с аминокислотами [20], основаниями Шиффа [21], дикетонами [22, 23].
Ранее мы сообщали о двухстадийном синтезе октаэдрических молекулярных кластеров РЗЭ, включающем стадию контролируемого гидролиза в присутствии пивалат-аниона, приводящего к образованию 1D координационных полимеров, содержащих плоское ядро {Ln4(μ3-OH)2} [24] и последующее введение хелатирующего нейтрального лиганда диэтилентриамина, углубляющего гидролиз и стабилизирующего октаэдрическую архитектуру за счет водородных связей с пивалат-анионами [17].
В настоящей работе мы сообщаем о синтезе, кристаллическом строении и квантово-химическом моделировании новых четырехъядерных молекулярных кластеров трифторацетатов La и Nd с диэтилентриамином и диэтилентриамин-N,N′-дикарбамат-анионом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных реагентов использовали: La2(CO3)3 · 6H2O (“х. ч.”), Nd2(CO3)3 · 6H2O (“х. ч.”), трифторуксусную кислоту (HTfa, P&M Invest, 98%), диэтилентриамин (Deta, Sigma-Aldrich, 99%), изопропиловый спирт (“х. ч.”). Все синтезы выполняли на воздухе в стеклянных стаканах.
Синтез тригидратов трифторацетатов лантана и неодима Ln(Tfa)3(H2O)3 (Ln = La, Nd) проводили по известной методике из Ln2(CO3)3 · 6H2O [10]. Чистоту продуктов подтверждали методами РФА и ТГА. Выход ~95%.
Синтез полиядерных гидроксокомплексов [Ln4(Deta)4(OH)4(Tfa)3(DetadcH)2]3+$({\mathbf{Tfa}})_{{\mathbf{3}}}^{ - }$ · nH2O · · mHTfa (Ln = La (I), Nd (II)). Навеску Ln(Tfa)3(H2O)3 (0.7 ммоль) диспергировали в 5 мл изопропилового спирта, добавляли при перемешивании Deta (1.4 ммоль, 0.151 мл) и продолжали перемешивание при 60°С до получения прозрачного раствора. Затем раствор медленно охлаждали и оставляли в открытом стакане для испарения растворителя и медленной кристаллизации. Через 3 сут на стенках и на дне стакана обнаружили мелкие пластинчатые кристаллы. Для Ln = La в объеме гелеобразного продукта гидролиза получили единичные бесцветные кристаллы I. Для Ln = Nd получен основной кристаллический продукт II сиреневого цвета. Выход 60%.
| Найдено %: | C 21.9; | H 4.2; | N 11.1. |
| Для C42H95N18O33F21La4 (I) | |||
| вычислено %: | C 21.6; | H 4.1; | N 10.8. |
| Найдено %: | C 22.3; | H 4.2; | N 11.5. |
| Для C40H82N18O25F18Nd4 (II) | |||
| вычислено %: | C 22.5; | H 3.9; | N 11.8. |
ИК-спектр (ν, см–1): 3368 ср, 3309 ср νas(NH2); 3100 сл νas(CH2); 2952 сл, 2920 сл, 2876 ср νs(CH2); 1688 с, 1673 с νas(COО–); 1620 пл δ(NH2); 1596 с δ(NH2) + νas(–NH–COO); 1490 c νs(–NH–COO); 1454 ср δ(СH2) + νs(COO–); 1428 ср δ(CH2) + + νas(‒NH–COO); 1396 ср δw(СH2DetadcH–); 1339 ср δr(С–NH–C) + δw(СH2); 1199 с, 1178 с, 1127 с ν(CF); 959 ср, 923 ср, 829 ср, 799 с, 716 с, 591 ср.
Анализ на C, H и N выполняли на микроанализаторе Elementar Vario Micro Cube. ИК-спектр порошка II регистрировали в режиме нарушенного полного внутреннего отражения на спектрометре Shimadzu IRAffinity-1S в диапазоне волновых чисел 500–4000 cм−1. РФА порошка II выполняли на дифрактометре Rigaku Miniflex 600 (CuKα-излучение, Kβ-фильтр, детектор D/teX Ultra) в геометрии Брэгга–Брентано.
РСА выполнен на дифрактометре Bruker D8 Quest (MoKα-излучение, λ = 0.71073 Å) с детектором Photon III при температуре 100 K. Все кристаллы I и II демонстрировали широкие дифракционные максимумы с быстрым угловым затуханием интенсивности, накопление дифракционных данных проведено с длительностью выдержки 60 с/кадр. Структуры решены прямыми методами с последующими синтезами Фурье и уточнены полноматричным МНК. Все неводородные атомы (за исключением атомов разупорядоченных внешнесферных трифторацетатат-анионов и молекул воды в структуре I) уточнены в анизотропном приближении. Атомы водорода введены в рассчитанные позиции (из геометрических соображений и из соображений образования водородных связей) и уточнены в модели “наездника” с фиксированными изотропными тепловыми параметрами. Все вычисления проведены с использованием комплекса программ SHELXL 2017 [25]. Учет поглощения выполнен в программе SADABS [26]. Основные кристаллографические параметры приведены в табл. 1.
Таблица 1.
Результаты уточнения кристаллических структур
| Параметр | Значение | |
|---|---|---|
| I | II | |
| Формула | C42H95N18O33F21La4 | C40H82N18O25F18Nd4 |
| М | 2334.99 | 2134.19 |
| Сингония | Моноклинная | Триклинная |
| Пр. гр. | C2/c | $P\bar {1}$ |
| a, Å | 28.147(3) | 13.0303(11) |
| b, Å | 12.9228(15) | 13.6954(11) |
| c, Å | 23.830(3) | 22.1635(18) |
| α, град | 90 | 94.646(2) |
| β, град | 96.596(3) | 93.226(2) |
| γ, град | 90 | 109.179(2) |
| V, Å3 | 8610.5(18) | 3708.9(5) |
| Z | 4 | 2 |
| Цвет, форма кристалла | Бесцветный, блок | Сиреневый, блок |
| Размер кристалла, мм | 0.079 × 0.062 × 0.053 | 0.292 × 0.149 × 0.112 |
| ρ(выч.), г см–3 | 1.801 | 1.911 |
| μ, мм–1 | 2.074 | 2.880 |
| Независимых отражений (Rint) | 10 242 (0.1132) | 15 662 (0.0504) |
| Отражений с I > 2σ(I) | 6133 | 11 626 |
| Параметров | 532 | 993 |
| R1 (I > 2σ(I)), wR2 | 0.0762, 0.2361 | 0.0973, 0.2630 |
| Добротность по F 2 | 1.057 | 1.161 |
| Tmin, Tmax | 0.6227, 0.9143 | 0.4935, 1.0000 |
| ρmin/ρmax, e Å–3 | –2.084/2.403 | –4.891/3.662 |
Полный набор кристаллографических параметров для структур I и II депонирован в Кембриджском банке структурных данных (CСDC № 2077216, 2077217 соответственно; deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk/data_request/cif).
Квантово-химическое моделирование проведено для изолированного катионного фрагмента [La4(Deta)4(OH)4(Tfa)3(DetadcH)2]3+ в программном пакете FireFly 8.2 [27] в рамках теории функционала электронной плотности (DFT) c использованием функционала PBE0 и базисных наборов 6-31G* для атомов C, F, O, N, H и квази-релятивисткого эффективного остовного потенциала Штутгарт–Кельн с большим остовом (ECP46MWB) и соответствующим базисным наборам для La [28, 29]. Стартовую геометрию катионного фрагмента строили на основании данных РСА, а затем оптимизировали без ограничений по симметрии. Оптимизированную геометрию проверяли на отсутствие мнимых частот в рассчитанном колебательном спектре.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В настоящее время активно развивается подход к синтезу полиядерных соединений РЗЭ, основанный на реакции контролируемого гидролиза в присутствии органических лигандов, стабилизирующих полиядерный гидроксокомплекс. Процесс самоконтролируемого гидролиза может быть осуществлен за счет использования аминов, способных выступать одновременно и как слабые органические основания (реакция 1), и как хелатирующие лиганды (реакция 2). Самоконтролируемость гидролиза обусловлена близостью констант основности Deta (pKb = 3.8) и кислотности карбоновой кислоты (например, пивалевой кислоты HPiv, pKa = 5.0) и выведением Deta из сферы реакции при образовании хелатных комплексов. Одновременное протекание гидролиза и комплексообразования может приводить к стабилизации полиядерных гидроксокомплексов (реакция 3) [17].
(1)
${\text{Ln(Tfa}}{{{\text{)}}}_{3}} + x{{{\text{H}}}_{{\text{2}}}}{\text{O}} + x{\text{Deta}} \rightleftharpoons {1 \mathord{\left/ {\vphantom {1 m}} \right. \kern-0em} m}{{\left[ {{\text{Ln}}{{{({\text{Tfa}})}}_{{3 - x}}}{{{({\text{OH}})}}_{x}}} \right]}_{m}} + x({\text{DetaH}}){\text{Tfa,}}$(2)
${\text{Ln(Tfa}}{{{\text{)}}}_{3}} + n{\text{Deta}} \rightleftharpoons \left[ {{\text{Ln}}{{{({\text{Tfa}})}}_{3}}{{{({\text{Deta}})}}_{n}}} \right]{\text{,}}$(3)
${1 \mathord{\left/ {\vphantom {1 m}} \right. \kern-0em} m}{{\left[ {{\text{Ln(Tfa}}{{{\text{)}}}_{{3 - x}}}{{{{\text{(OH)}}}}_{x}}} \right]}_{m}} + n{\text{Deta}} \rightleftharpoons {1 \mathord{\left/ {\vphantom {1 m}} \right. \kern-0em} m}{{\left[ {{\text{Ln}}{{{({\text{Tfa}})}}_{{3 - x}}}{{{({\text{OH}})}}_{x}}{{{({\text{Deta}})}}_{n}}} \right]}_{m}}{\text{,}}$В данной работе мы исследовали взаимодействие Deta c трифторацетатами РЗЭ – солями сильной трифторуксусной кислоты (pKa = 0.5). В результате медленной кристаллизации реакционной смеси на воздухе также протекает реакция частичного гидролиза, при этом степень гидролиза меньше, чем в случае пивалатов, образуются молекулярные кластеры с одним из наиболее распространенных для гидроксокарбоксилатов РЗЭ кубановым остовом Ln4(OH)4. Уникальной особенностью проведенного нами синтеза является выделение в кристаллическом виде соединений с in situ образующимся лигандом диэтилентриамин-N,N′-дикарбамат-анионом (DetadcH–), протонированным по центральному атому азота. Формирование DetadcH– происходит за счет поглощения CO2 раствором Deta из воздуха (реакция 4) в процессе медленной кристаллизации реакционной смеси в открытом стакане. Стоит отметить, что De-tadcH– является лишь одним из сложного набора продуктов, соответствующих различной сте-пени протонирования и присоединения CO2 [30, 31].
В литературе описаны процессы деградации алифатических полиаминов под действием углекислого газа и повышенной температуры, приводящие к образованию различных производных мочевины и карбаминовой кислоты [32, 33]. Однако, по нашим данным, ни комплексы металлов с такими дикарбаматными лигандами, ни органические соединения, содержащие подобный фрагмент, до настоящего времени не были описаны. Вероятно, это связано с трудностями получения таких соединений в кристаллическом состоянии. В то же время соответствующие системы с полиаминами представляют большой интерес с точки зрения применения их в технологиях улавливания и хранения углекислого газа [31, 34].
В данной работе нам удалось выделить кристаллы соединений двух металлов – лантана (I) и неодима (II), содержащих, по данным РСА, катионный структурный фрагмент одинакового состава [Ln4(Deta)4(OH)4(Tfa)3(DetadcH)2]3+, внешнесферные анионы Tfa– и молекулы воды.
Идентичность полученного основного порошкообразного продукта II и исследованных методом РСА монокристаллов подтверждена совпадением экспериментальной и теоретической порошковых рентгенограмм (рис. 1).
Рис. 1.
Сопоставление данных РФА порошка II и теоретической рентгенограммы, рассчитанной по кристаллической структуре II. При расчете учтены эффекты теплового расширения (a = 12.988(7), b = = 13.950(8), c = 22.735(9) Å, α = 95.78(5)°, β = = 92.75(4)°, γ = 109.48(6)°, V = 3849(4) Å3) и наличие (00l) текстуры. Вертикальными линиями cнизу показаны рассчитанные положения брэгговских пиков.

По данным РСА, наиболее существенное различие между структурами I и II заключается в том, что соединение I кристаллизуется в моноклинной руппе С2/c, и ось 2 проходит через катионный фрагмент [Ln4(Deta)4(OH)4(Tfa)3(DetadcH)2]3+ (т.е. симметрически независимая часть содержит половину катионного фрагмента), в то время как соединение II кристаллизуется в триклинной группе $P\bar {1}$̅, а симметрически независимая часть элементарной ячейки II содержит полный комплексный катион. В структуре [Ln4(Deta)4(OH)4-(Tfa)3(De-tadcH)2]3+ четыре атома Ln расположены в вершинах тетраэдра (Ln···Ln ≈ 4 Å), над гранями тетраэдра на высоте 0.83–0.98 Å находятся четыре μ3-OH группы, формирующие кубановое металл-кислородное ядро {Ln4(μ3-OH)4} (рис. 2). Примеры соединений с кубановым ядром широко описаны в литературе для d- и f-элементов, причем как в изолированных молекулярных кластерах [13, 14], так и в структурных блоках более сложных полиядерных комплексов [35, 36] и координационных полимеров [37, 38].
Рис. 2.
Строение кубанового металл-кислородного остова в четырехъядерном комплексном катионе [Ln4(D-eta)4(OH)4(Tfa)3(DetadcH)2]3+ в кристаллических структурах I и II. Для ясности показаны только атомы Ln и группы μ3-OH. Штриховыми линиями показаны ребра тетраэдра Ln4.

В комплексном катионе [La4(Deta)4(OH)4(Tfa)3- (DetadcH)2]3+ присутствуют два типа атомов Ln, различающиеся координационным окружением (рис. 3). Первый тип представлен парами атомов La(1), La(1)i в I и Nd(1), Nd(2) в II с однотипным координационным окружением (трехшапочная тригональная призма, КЧ 9), которое целесообразно рассмотреть на примере Nd(1). Атом Nd(1) находится в окружении трех атомов азота N(7)–N(9) бихелатного Deta, атомов кислорода O(1H)–O(3H) трех μ3-OH групп, двух атомов кислорода (O(1) и O(3)) одного мостикового DetadcH–, а также одного атома кислорода (O(9)) мостикового Tfa– (табл. 2). При этом мостиковый Tfa– вторым атомом кислорода (O(10)) входит в координационное окружение Nd(2).
Рис. 3.
Строение комплексного катиона [Nd4(Deta)4(OH)4(Tfa)3(DetadcH)2]3+ в кристаллической структуре II. Атомы водорода для ясности частично не показаны. Штриховыми линиями показаны водородные связи.
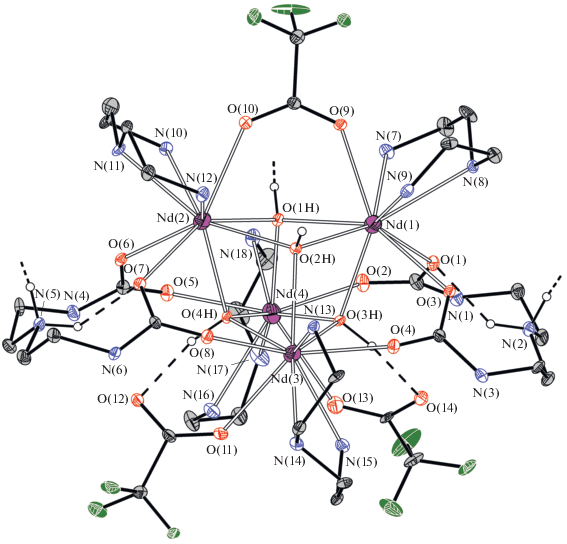
Таблица 2.
Межатомные расстояния (Å) в комплексных катионах [Ln4(Deta)4(OH)4(Tfa)3(DetadcH)2]3+ в структурах I и II по данным РСА и DFT-расчета
| Связь Ln–L | Ln = La (I) | Ln = Nd (II) | |
|---|---|---|---|
| РСА | DFT | РСА | |
| Ln(1)–O(1) | 2.529(7) | 2.611 | 2.456(10) |
| Ln(1)–O(3) | 2.516(8) | 2.562 | 2.541(12) |
| Ln(1)–O(1H) | 2.538(8) | 2.590 | 2.499(10) |
| Ln(1)–O(2H) | 2.538(7) | 2.573 | 2.474(8) |
| Ln(1)–O(3H) | 2.498(6) | 2.495 | 2.426(11) |
| Ln(1)–O(9) | 2.590(8) | 2.588 | 2.509(12) |
| Ln(1)–N(7) | 2.719(10) | 2.730 | 2.663(16) |
| Ln(1)–N(8) | 2.733(11) | 2.722 | 2.692(12) |
| Ln(1)–N(9) | 2.751(11) | 2.742 | 2.629(13) |
| Ln(2)–O(6) | 2.516(8) | 2.543 | 2.500(10) |
| Ln(2)–O(7) | 2.529(7) | 2.621 | 2.453(10) |
| Ln(2)–O(1H) | 2.538(7) | 2.572 | 2.493(8) |
| Ln(2)–O(2H) | 2.538(8) | 2.579 | 2.478(11) |
| Ln(2)–O(4H) | 2.498(6) | 2.497 | 2.421(11) |
| Ln(2)–O(10) | 2.590(8) | 2.599 | 2.535(12) |
| Ln(2)–N(10) | 2.751(11) | 2.732 | 2.642(17) |
| Ln(2)–N(11) | 2.733(11) | 2.726 | 2.688(13) |
| Ln(2)–N(12) | 2.719(10) | 2.743 | 2.681(15) |
| Ln(3)–O(4) | 2.518(8) | 2.561 | 2.432(11) |
| Ln(3)–O(8) | 2.541(7) | 2.613 | 2.424(9) |
| Ln(3)–O(2H) | 2.533(6) | 2.562 | 2.467(12) |
| Ln(3)–O(3H) | 2.474(7) | 2.513 | 2.459(9) |
| Ln(3)–O(4H) | 2.502(8) | 2.505 | 2.436(11) |
| Ln(3)–O(11) | 2.626(9) | 2.623 | 2.584(13) |
| Ln(3)–N(13) | 2.713(9) | 2.733 | 2.665(15) |
| Ln(3)–N(14) | 2.722(9) | 2.756 | 2.699(17) |
| Ln(3)–N(15) | 2.720(9) | 2.708 | 2.633(16) |
| Ln(4)–O(2) | 2.541(7) | 2.604 | 2.471(10) |
| Ln(4)–O(5) | 2.518(8) | 2.544 | 2.511(12) |
| Ln(4)–O(1H) | 2.533(6) | 2.550 | 2.456(11) |
| Ln(4)–O(3H) | 2.502(8) | 2.515 | 2.423(11) |
| Ln(4)–O(4H) | 2.474(7) | 2.520 | 2.434(9) |
| Ln(4)–O(13) | 2.626(9) | 2.634 | 2.639(17) |
| Ln(4)–N(16) | 2.720(9) | 2.709 | 2.679(16) |
| Ln(4)–N(17) | 2.722(9) | 2.759 | 2.684(17) |
| Ln(4)–N(18) | 2.713(9) | 2.726 | 2.63(2) |
Второй тип атомов Ln представлен парами La(3), La(3)i в I и Nd(3), Nd(4) в II также с однотипным координационным окружением (одношапочная квадратная антипризма, КЧ 9), рассмотренным на примере Nd(3). Атом Nd(3) окружен тремя атомами азота N(13)–N(15) бихелатного Deta, атомами кислорода O(2H)–O(4H) трех групп μ3-OH, атомами кислорода O(4) и O(8) двух мостиковых DetadcH–, а также одним атомом кислорода O(13) терминального Tfa– (табл. 2). Терминальные анионы Tfa– образуют внутримолекулярные водородные связи с группами μ3-OH (табл. 3).
Таблица 3.
Параметры внутримолекулярных водородных связей O–H∙∙∙O и N–H∙∙∙O в комплексных катионах [Ln4(Deta)4(OH)4(Tfa)3(DetadcH)2]3+
| D–H···A | Расстояние, Å | ∠DHA, град | ||
|---|---|---|---|---|
| D–H | H∙∙∙A | D–A | ||
| Ln = La (I) | ||||
| O(3H)–H(3)…O(14) | 0.999 | 1.974 | 2.936 | 160.9 |
| O(4H)–H(4)…O(12) | 0.999 | 1.974 | 2.936 | 160.9 |
| N(5)–H…O(7) | 0.911 | 2.214 | 2.834 | 124.6 |
| N(2)–H…O(1) | 0.911 | 2.214 | 2.834 | 124.6 |
| Ln = Nd (II) | ||||
| O(3H)–H(3)…O(14) | 1.000 | 1.911 | 2.883 | 163.3 |
| O(4H)–H(4)…O(12) | 0.999 | 1.894 | 2.863 | 162.7 |
| N(5)–H…O(7) | 0.910 | 2.150 | 2.757 | 123.4 |
| N(2)–H…O(1) | 0.910 | 2.089 | 2.788 | 132.8 |
Отметим, что оба аниона DetadcH– выступают лишь как мостиковые лиганды в отличиe от четырех бихелатных Deta, при этом центральный атом азота DetadcH– протонирован и вообще не участвует в координации с металлом, вместо этого группа NH2+ образует две водородные связи (внутримолекулярную и межмолекулярную).
Несмотря на идентичное строение комплексного катиона, соединения I и II различаются составом внешнесферных лигандов, что объясняет и различия в симметрии кристаллической решетки. В структуре I один из внешнесферных Tfa– и молекула HTfa разупорядочены по двум кристаллографически эквивалентным позициям с равной заселенностью, в структуре II все внешнесферные анионы Tfa– упорядочены. В пустотах упаковки комплексных катионов и анионов расположены внешнесферные молекулы воды, образующие систему водородных связей.
Квантово-химическое моделирование изолированного катионного фрагмента [La4(Deta)4- (OH)4(Tfa)3(DetadcH)2]3+ показало хорошее согласие оптимизированной геометрии с результатами РСА (рис. 4), длины соответствующих связей различаются в среднем на 0.03Å (табл. 2). Необходимо отметить, что локализация протонов на группах ${\text{NH}}_{2}^{ + }$ и анионах OH– в квантово-химических расчетах также подтверждает выводы РСА. Расчет частот и формы нормальных колебания позволяет корректно провести отнесение полос в экспериментальном спектре (рис. 5). Теоретический и экспериментальный спектры достаточно хорошо согласуются и по положению, и по интенсивности полос. Большие относительные интенсивности полос в области 1200–700 см–1 в экспериментальном спектре связано с наличием внешнесферных лигандов, не включенных в расчет. По данным расчета, полосы поглощения при 1596, 1490 и 1339 см–1 связаны с колебаниями карбаматных групп, и их наличие в экспериментальном ИК-спектре порошка II дополнительно подтверждает состав соединения (рис. 5).
Рис. 4.
Оптимизированная геометрия (DFT) комплексного катиона [La4(Deta)4(OH)4(Tfa)3(DetadcH)2]3+. Часть атомов водорода для ясности не показана.
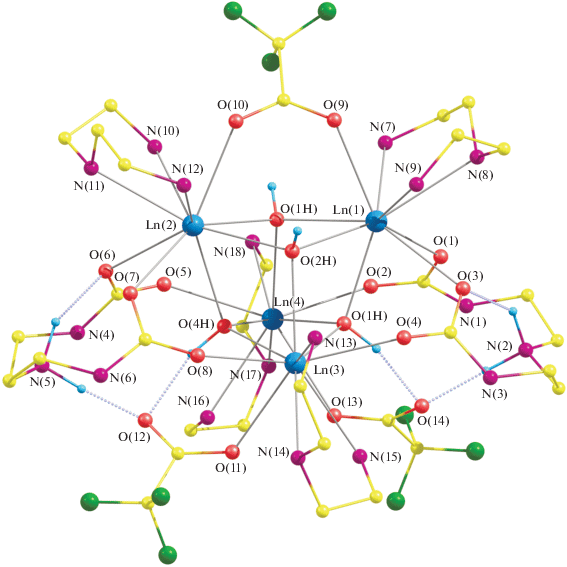
Рис. 5.
Сопоставление экспериментального ИК-спектра II и теоретического (DFT) колебательного спектра катиона [Ln4(Deta)4(OH)4(Tfa)3(DetadcH)2]3+. Частоты нормальных колебаний в теоретическом спектре приведены с учетом масштабирующих коэффициентов (0.93–0.95). Пунктирными линиями показано соответствие полос в спектрах. Для теоретического спектра приведены формы нормальных колебаний с участием карбаматной группы.

В заключение отметим следующее. В результате контролируемого гидролиза трифторацетатов La и Nd под действием диэтилентриамина были синтезированы новые молекулярные гидроксокомплексы с четырхъядерным кубановым остовом {Ln4(μ3-OH)4}. Взаимодействие диэтилентриамина с углекислым газом на воздухе в процессе синтеза привело к in situ образованию анионного лиганда диэтилентриамин-N,N′-дикарбамата, вошедшего в состав комплексов. Комплексы с таким лигандом выделены впервые. Структура комплексов установлена по результатам РСA, а количественный и фазовый состав подтвержден совокупностью методов: РФА, ИК-спектроскопией, элементным анализом. Квантово-химические DFT расчеты показывают хорошее согласие геометрии комплекса с результатами рентгеноструктурного анализа, а рассчитанный колебательный спектр соответствует экспериментальному, дополнительно подтверждая состав и структуру комплексов.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
D’Vries R.F., Álvarez-García S., Snejko N. et al. // J. Mater. Chem. C. 2013. V. 1. P. 6316.
Kreno L.E., Leong K., Farha O.K. et al. // Chem. Rev. 2012. V. 112. P. 1105.
Souri N., Tian P., Platas-Iglesias C. et al. // J. Am. Chem. Soc. 2017. V. 139. P. 1456.
Wang W.-M., Li X.-Z., Zhang L. et al. // New J. Chem. 2019. P. 7419.
Guo F.S., Leng J.D., Liu J.L. et al. // Inorg. Chem. 2012. V. 51. P. 405.
Feng L., Pang J., She P. et al. // Adv. Mater. 2020. V. 66. P. 1.
Nikolaeva A., Nygaard R., Martynova I. et al. // Polyhedron. 2020. P. 114373.
Kendin M., Tsymbarenko D. // J. Anal. Appl. Pyrolysis. 2019. V. 140. P. 367.
Kuzmina N.P., Ibragimov S.A., Makarevich A.M. et al. // Chem. Mater. 2010. V. 22. P. 5803.
Grebenyuk D., Ryzhkov N., Tsymbarenko D. // J. Fluor. Chem. 2017. V. 202. P. 82.
Suzuki Y., Nagayama T., Sekine M. et al. // J. Less-Common Met. 1986. V. 126. P. 351.
Calvez G., Le Natur F., Daiguebonne C. et al. // Coord. Chem. Rev. 2017. V. 340. P. 134.
Wang R., Liu H., Carducci M.D. et al. // Inorg. Chem. 2001. V. 40. P. 2743.
Roitershtein D.M., Vinogradov A.A., Lyssenko K.A. et al. // Inorg. Chem. Commun. 2017. V. 84. P. 225.
Guo P.H., Liu J.L., Zhang Z.M. et al. // Inorg. Chem. 2012. V. 51. P. 1233.
Abbas G., Lan Y., Kostakis G.E. et al. // Inorg. Chem. 2010. V. 49. P. 8067.
Grebenyuk D., Martynova I., Tsymbarenko D. // Eur. J. Inorg. Chem. 2019. P. 3103.
Calvez G., Daiguebonne C., Guillou O. et al. // Eur. J. Inorg. Chem. 2009. P. 3172.
Calvez G., Guillou O., Daiguebonne C. et al. // Inorg. Chim. Acta. 2008. V. 361. P. 2349.
Wang R., Zheng Z., Jin T. et al. // Inorg. Chem. 1999. V. 38. P. 1813.
Langley S.K., Chilton N.F., Gass I.A. et al. // Dalton Trans. 2011. V. 40. P. 12656.
Datta S., Baskar V., Li H. et al. // Eur. J. Inorg. Chem. 2007. P. 4216.
Andrews P.C., Deacon G.B., Frank R. et al. // Eur. J. Inorg. Chem. 2009. P. 744.
Grebenyuk D., Zobel M., Polentarutti M. et al. // Inorg. Chem. 2021. V. 60. P. 8049.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Krause L., Herbst-Irmer R., Sheldrick G.M. et al. // J. Appl. Cryst. 2015. V. 48. P. 3.
Granovsky A.A. Firefly Computational Program Chemistry. Version 8. http://classic.chem.msu.su/ gran/firefly/index.html
Dolg M., Stoll H., Savin A. et al. // Theor. Chim. Acta. 1989. V. 75. P. 173.
Dolg M., Stoll H., Preuss H. // Theor. Chim. Acta. 1993. V. 85. P. 441.
Wong M.K., Shariff A.M., Bustam M.A. // RSC Adv. 2016. V. 6. P. 10816.
Septavaux J., Tosi C., Jame P. et al. // Nat. Chem. 2020. V. 12. P. 202.
Thompson J., Richburg H., Liu K. // Energy Procedia. 2017. V. 114. P. 2030.
Wang P., Fei Y., Li Q. et al. // Green Chem. 2016. V. 18. P. 6681.
Poisson G., Germain G., Septavaux J. et al. // Green Chem. 2016. V. 18. P. 6436.
Zhou Y., Zheng X.Y., Cai J. et al. // Inorg. Chem. 2017. V. 56. P. 2037.
Ma X.-F., Wang H.-L., Zhu Z.-H. et al. // Dalton Trans. 2019. V. 48. P. 11338.
Zhou J., Yan S., Yuan D. et al. // CrystEngComm. 2009. V. 11. P. 2640.
Cheng J.W., Zheng S.T., Liu W. et al. // CrystEngComm. 2008. V. 10. P. 1047.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия



