Координационная химия, 2022, T. 48, № 3, стр. 157-167
Синтез и структура гетерометаллических комплексов палладия и железа
И. А. Якушев 1, *, **, М. А. Дюжева 1, 2, И. А. Стеблецова 2, А. Б. Корнев 1, Н. В. Черкашина 1, М. Н. Варгафтик 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Высший химический колледж РАН, Российский химико-технологический университет
им. Д.И. Менделеева
Москва, Россия
* E-mail: ilya.yakushev@igic.ras.ru
** E-mail: cs68@mail.ru
Поступила в редакцию 12.05.2021
После доработки 09.09.2021
Принята к публикации 13.09.2021
- EDN: AQWGRZ
- DOI: 10.31857/S0132344X22030069
Аннотация
Впервые синтезированы и структурно охарактеризованы гетерометаллические комплексы палладия(II) с ферроценкарбоновой кислотой FcCOOH. Показано, что при взаимодействии с FcCOOH моноядерных комплексов [Pd(Py)2(OOCMe)2] и [Pd(Phen)(OOCMe)2] легко происходит вытеснение ацетат-аниона из внутренней сферы и его замещение на ферроценкарбоксилат-анион с образованием железосодержащих молекулярных комплексов палладия – трех сольватоморфов [Pd(Py)2- (FcCOO)2] с бензолом(I, II) и хлористым метиленом(III), а использование в качестве исходного соединения [Pd(Phen)(OOCMe)2] позволяет получить гетеролигандный ацетатно-ферроценкарбоксилатный комплекс [Pd(Phen)(FcCOO)2 Pd(Phen)(FcCOO)(OOCMe)] (IV). Полностью замещенный [Pd(Phen)(FcCOO)2] (V) получен из ацетата палладия [Pd3(OOCMe)6] при его последовательной обработке FcCOOH и 1,10-фенантролином. Строение комплексов I–V изучено методом РСА (СIF files CCDC № 2078399–2078403).
Актуальной задачей современной химии является поиск путей получения высокоэффективных катализаторов для промышленно важных каталитических процессов, таких как крекинг и риформинг углеводородного сырья в нефтехимии, процессы получения моторных топлив и смазочных материалов из возобновляемых источников, очистка мономеров от примесей, а также разработка гомогенных и гетерогенных катализаторов для фармацевтической индустрии и тонкого органического синтеза. Переход от монометаллических катализаторов к би- и полиметаллическим катализаторам как в случае гомогенно-каталитических процессов [1], так и при получении нанесенных гетерогенных катализаторов [2] зачастую позволяет увеличить селективность катализируемой реакции, повысить активность и продлить срок службы катализатора, улучшить его эксплуатационные характеристики.
Одним из возможных способов приготовления нанесенных смешанных катализаторов является использование би- и полиметаллических металлокомплексов в качестве предшественников наносплавов [2–6] и смешанно-металлических наночастиц [7]; при этом важно, чтобы используемые прекурсоры не содержали фосфора, хлора, серы, других трудноудаляемых компонентов.
Ранее была показана возможность синтеза гетерометаллических ацетатных и пивалатных комплексов палладия общей формулы [PdII(OOCR)4MII] из доступного ацетата палладия и ацетатов дополнительных металлов М [8–12]; ряд полученных соединений показал высокую каталитическую активность и селективность в реакциях гомогенного гидрирования ненасыщенных углеводородов [13], в реакциях азиридирования и аминирования C–H связей [14], в качестве прекурсоров катализаторов селективного гидрирования тройных связей алкинов [15–19] и эффективных катализаторов восстановления кислорода [20].
Подобные смешанные карбоксилатные комплексы были получены и для платины [21], включая ацетатные и пивалатные комплексы платины(II) с железом(III) [22, 23], однако попытки получения комплексов палладия и железа, аналогичных платиновым, не привели к желаемому результату.
Альтернативным способом введения неблагородного металла в соединения-предшественники каталитически активных материалов является использование в качестве лигандов металлосодержащих карбоновых кислот, таких как цимантренкарбоновая кислота (из которой получены би- и даже триметаллические комплексы [24, 25]) и ферроценкарбоновая кислота, ранее использованная для получения смешанно-металлических комплексов с платиной(II) [26]. Применению ферроценкарбоновой кислоты для синтеза гетерометаллических соединений палладия(II) (I–V) посвящена настоящая работа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использованные в настоящей работе растворители (хлористый метилен, ацетон, бензол, пиридин) очищали по стандартным методикам [27]. 1,10-Фенантролин (Phen, 99%, Alfa Aesar) и ферроценкарбоновую кислоту (FcCOOH, 97%, Sigma-Aldrich) использовали без дополнительной очистки. Ацетат палладия(II) [Pd3(OOCMe)6] (“ч.”, Реахим) очищали кипячением в ледяной уксусной кислоте со свежеприготовленной палладиевой чернью и перекристаллизацией из уксусной кислоты.
Элементный анализ выполняли на автоматизированном C,H,N-анализаторе EuroVector EA3000 (Italy, 2008). Инфракрасные спектры получали на ИК-спектрометре с Фурье-преобразованием Bruker Alpha FTIR методом нарушенного полного внутреннего отражения (НПВО) в области 4000–400 см–1.
Синтез [Pd(Py)2(FcCOO)2] · C6H6 (I) выполняли по двухстадийной схеме. Синтез промежуточного соединения [Pd(Py)2(OOCMe)2] проводили по модифицированной методике [28]: [Pd3(OOCMe)6] (117 мг, 0.174 ммоль) растворяли в смеси 16 мл бензола и 4 мл хлороформа, полученный раствор отфильтровывали и к нему добавляли 84 мкл (82 мг, 1.04 ммоль) пиридина, при этом цвет раствора менялся на светло-желтый. К полученному раствору моноядерного комплекса [Pd(Py)2(OOCMe)2] добавляли раствор 240 мг (1.04 ммоль) FcCOOH в 5 мл бензола, перемешивали смесь на магнитной мешалке без нагревания в течение 30 мин и оставляли для кристаллизации при медленном упаривании. Образовавшиеся желтые кристаллы отделяли от маточного раствора декантацией, промывали небольшим количеством холодного бензола и высушивали в токе аргона. Выход комплекса I 400 мг (96% в расчете на Pd). Соединение легко теряет кристаллизационный растворитель при хранении на воздухе.
ИК-спектр (НПВО; ν, см–1): 2928 ш.сл, 1650 сл, 1615 с, 1468 сл, 1467 ср, 1376 сл, 1287 ср, 1156 ср, 1036 сл, 1004 сл, 798 ср, 780 ср, 667 с, 480 ср, 455 ср.
Синтез [Pd(Py)2(FcCOO)2] · 3C6H6 (II). Соединение I (60 мг) растворяли в теплом бензоле (75 мл). После медленного упаривания раствора образовались светло-желтые игольчатые кристаллы, малоустойчивые вне маточного растворителя. Выход комплекса II 64 мг (89%).
ИК-спектр (НПВО; ν, см–1): 2923 ш.сл, 1652 сл, 1615 ср, 1477 ср, 1449 с, 1374 с, 1310 с, 1242 с, 1171 с, 1103 ср, 1066 сл, 1029 сл, 1002 сл, 919 сл, 802 ср, 766 ср, 674 с, 483 с, 452 ср.
Синтез [Pd(Py)2(FcCOO)2] · 2CH2Cl2 (III) выполнен перекристаллизацией комплекса I из хлористого метилена. Комплекс I легко растворяется без нагревания в CH2Cl2 (50 мг комплекса в 25 мл CH2Cl2), и при медленном высыхании раствора кристаллизуется соединение III. Выход комплекса III 52 мг (93%).
ИК-спектр (НПВО; ν, см–1): 3375 ш.сл, 3034 сл, 1564 ср, 1411 с, 1376 ср, 1316 с, 1273 ср, 1173 ср, 1072 ср, 1022 ср, 1003 ср, 918 сл, 788 ср, 764 ср, 731 ср, 691 с, 655 сл, 628 ср, 581 сл, 513 ср, 478 с, 445 сл.
Синтез [Pd(Phen)(FcCOO)2 Pd(Phen)(FcCOO)- (OOCMe)] (IV). Навески [Pd(Phen)(OOCMe)2] (100 мг, 0.247 ммоль) (получен по ранее описанной методике [29]) и FcCOOH (114 мг, 0.495 ммоль) растворяли отдельно в 20 и 15 мл метанола соответственно, растворы смешивали и оставляли при комнатной температуре. Образовавшиеся спустя 5 сут оранжевые кристаллы, пригодные для РСА, отделяли декантацией и промывали небольшим количеством холодного метанола для удаления остатков непрореагировавшей FcCOOH. Выход комплекса IV 78 мг (48% в расчете на Pd).
ИК-спектр (НПВО; ν, см–1): 3166 ш.сл, 1703 с, 1608 с, 1379 с, 1331 с, 1249 с, 1022 ср, 889 ср, 695 с, 622 с, 448 сл.
Синтез [Pd(Phen)(FcCOO)2] (V) выполняли по двухстадийной схеме. На первом этапе проводили обработку [Pd3(OOCMe)6] (100 мг, 0.148 ммоль) стехиометрическим количеством FcCOOH (205 мг, 0.891 ммоль) в растворе хлористого метилена (120 мл). Полученный красно-коричневый раствор кипятили с обратным холодильником в течение 50 мин, а затем трижды переупаривали при пониженном давлении с небольшими порциями хлористого метилена для удаления остатков уксусной кислоты. Полученный темно-коричневый продукт сушили в вакуумном эксикаторе. На второй стадии ферроценкарбоксилат палладия [Pd(FcCOO)2]n (100 мг, 0.177 ммоль) растворяли в 10 мл ацетона и добавляли раствор Phen (32 мг, 0.178 ммоль) в 5 мл ацетона. Оба раствора перед смешиванием отфильтровывали от возможных следов механических примесей. Реакционную смесь перемешивали на магнитной мешалке в течение 30 мин при комнатной температуре. Спустя неделю на стенках колбы обнаружили монокристаллы, пригодные для PCA. Дополнительную порцию вещества получили при упаривании маточного раствора на роторном испарителе до минимального объема с последующей кристаллизацией при пониженной температуре (5°С). Общий выход комплекса V 122 мг (92% по Pd).
ИК-спектр (НПВО, ν, см–1): 2482 с, 2458 с, 2406 ср, 2388 ср, 2360 ср, 2318 с, 2271 с, 2222 с, 2197 сл, 2172 сл, 2117 ср, 2102 ср, 2042 ср, 1994 с, 1960 cр, 1903 с, 1865 ср, 1852 с, 1814 ср, 1797 с, 1751 сл, 1619 ср, 651 ср.
РСА. Данные рентгеновской дифракции для комплексов I и V получены на дифрактометре Bruker D8 Venture Photon в режиме φ- и ω-сканирования в Центре коллективного пользования ИОНХ РАН при температуре 100(2) K (λ = 0.71073 Å, микрофокусный источник рентгеновского излучения Incoatec IµS 3.0). Первичное индицирование, уточнение параметров элементарной ячейки и интегрирование отражений произведены с использованием пакета программ Bruker APEX3 [30]. Поправка на поглощение интенсивности отражений произведена по программе SADABS [30].
Данные рентгеновской дифракции для комплексов II–IV получены на рентгеновском пучке станции “Белок” Курчатовского центра синхротронного излучения в Национальном исследовательском центре “Курчатовский институт” (Москва, Российская Федерация) в режиме φ-сканирования с использованием CCD детектора Rayonix SX165 при 100(2) K (λ = 0.74500 и 0.74539 Å) [31]. Первичное индицирование, уточнение параметров элементарной ячейки, интегрирование отражений, а также поправка на поглощение интенсивности рефлексов произведена с использованием программного пакета XDS [32].
Структуры I–V расшифрованы прямыми методами [33] и уточнены в анизотропном приближении полноматричным методом наименьших квадратов по F 2 для всех неводородных атомов [34]. Ввиду разупорядочения одной из циклопентадиенильных групп ферроценкарбоновой кислоты в комплексе IV по двум положениям (соотношение заселенности позиций атомов 0.52 : 0.48) обе компоненты разупорядочения уточнены с использованием ограничений на геометрические параметры и тепловые смещения атомов (AFIX, SIMU, DELU). В уточнении всех структур атомы водорода помещены в рассчитанные положения и уточнены в модели “наездника” с Uизо(H) = 1.5Uэкв(C) для атомов водорода метильных групп и 1.2Uэкв(C) для атомов водорода бензола, хлористого метилена, ароматических лигандов. Остаточная электронная плотность, относящаяся к разупорядоченному нейтральному растворителю в случае структур IV, V, удалена из модели уточнения при помощи процедуры SQUEEZE в программе PLATON [35].
Расчеты выполнены с помощью программного пакета SHELXTL [34] в среде визуализации и обработки структурных данных OLEX2 [36]. Кристаллографические параметры и детали уточнения структур I–V приведены в табл. 1.
Таблица 1.
Кристаллографические данные и параметры уточнения структуры комплексов I–V
| Параметр | Значение | ||||
|---|---|---|---|---|---|
| I | II | III | IV | V | |
| Эмпирическая формула | C38H34N2O4Fe2Pd | C50H46N2O4Fe2Pd | C34H32Cl4N2O4Fe2Pd | C59H46N4O8Fe3Pd2 | C34H26N2O4Fe2Pd |
| М | 800.77 | 956.99 | 892.51 | 1319.35 | 744.67 |
| Цвет, габитус | Желтый, призма | Желтый, игла | Желтый, призма | Оранжевый, призма | Бледно-оранжевый обломок |
| Размеры кристалла, мм | 0.250 × 0.160 × 0.050 | 0.080 × 0.030 × 0.008 | 0.250 × 0.150 × 0.070 | 0.210 × 0.120 × 0.070 | 0.070 × 0.040 × 0.025 |
| Длина волны, λ | 0.71073 | 0.74539 | 0.74500 | 0.74539 | 0.71073 |
| Сингония | Триклинная | Моноклинная | Триклинная | Триклинная | Триклинная |
| Пр. группа | $P\bar {1}$ | P21/c | $P\bar {1}$ | $P\bar {1}$ | $P\bar {1}$ |
| Параметры ячейки: | |||||
| a, Å | 5.7995(5) | 5.7550(12) | 7.9183(14) | 13.649(5) | 9.411(2) |
| b, Å | 7.4671(6) | 28.948(2) | 9.1314(5) | 14.791(3) | 9.602(2) |
| c, Å | 18.7649(15) | 12.5300(9) | 11.957(3) | 15.367(2) | 17.726(4) |
| α, град | 84.147(3) | 90 | 91.900(8) | 63.878(7) | 90.078(7) |
| β, град | 86.362(3) | 97.814(15) | 106.565(14) | 82.554(14) | 95.867(8) |
| γ, град | 78.466(3) | 90 | 90.156(19) | 84.220(11) | 102.865(7) |
| V, Å3 | 791.29(11) | 2068.1(5) | 828.2(3) | 2758.6(12) | 1552.9(6) |
| Z | 1 | 2 | 1 | 2 | 2 |
| ρ(выч.), г/см3 | 1.680 | 1.537 | 1.790 | 1.588 | 1.593 |
| µ, мм–1 | 1.512 | 1.324 | 1.997 | 1.658 | 1.535 |
| F(000) | 406 | 980 | 448 | 1324 | 748 |
| θmin–θmax, град | 2.184–30.543 | 1.872–30.225 | 1.864–30.993 | 1.555–31.029 | 2.176–30.629 |
| Интервалы индексов отражений | –8 ≤ h ≤ 8, –10 ≤ k ≤ 10, –26 ≤ l ≤ 26 |
–7 ≤ h ≤ 7, –37 ≤ k ≤ 39, –15 ≤ l ≤ 16 |
–10 ≤ h ≤ 10, –12 ≤ k ≤ 12, –16 ≤ l ≤ 16 |
–18 ≤ h ≤ 18, –20 ≤ k ≤ 20, –21 ≤ l ≤ 21 |
–13 ≤ h ≤ 13, –13 ≤ k ≤ 13, –25 ≤ l ≤ 25 |
| Измерено отражений | 13 071 | 25 286 | 23 795 | 61 487 | 35 082 |
| Независимых отражений (Rint) | 4828 (Rint = 0.0243) | 5340 (Rint = 0.0960) | 4411 (Rint = 0.0408) | 14856 (Rint = 0.0654) | 9551 (Rint = 0.0656) |
| Отражений с I > 2σ(I) | 4310 | 3682 | 3783 | 10 558 | 6360 |
| Отражения/ограничения/ параметры | 4828/0/214 | 5340/0/268 | 4411/0/233 | 14 856/82/715 | 9551/0/388 |
| GOOF | 1.094 | 1.018 | 1.060 | 1.031 | 1.010 |
| R-факторы по I > 2σ(I) | R1 = 0.0302, wR2 = 0.0652 | R1 = 0.0544, wR2 = 0.1347 | R1 = 0.0478, wR2 = 0.1290 | R1 = 0.0504, wR2 = 0.1338 | R1 = 0.0552, wR2 = 0.1226 |
| R-факторы по всем отражениям | R1 = 0.0369, wR2 = 0.0677 | R1 = 0.0924, wR2 = 0.1543 | R1 = 0.0556, wR2 = 0.1352 | R1 = 0.0723, wR2 = 0.1444 | R1 = 0.0956, wR2 = 0.1388 |
| Остаточная электронная плотность (min/max), e A–3 | –0.674/0.481 | –1.326/1.308 | –1.914/1.930 | –1.735/1.413 | –1.240/1.086 |
Структурные параметры для соединений I–V депонированы в Кембриджском банке структурных данных (CCDC № 2078399–2078403; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Реакции замещения лабильных ацетатных лигандов – распространенный способ изменения молекулярного дизайна и получения новых соединений для многих карбоксилатных комплексов палладия и платины, в том числе гетероядерных; например, обмен ацетатных групп на пивалатные может быть использован для увеличения растворимости металлокомплексов в неполярных растворителях [11, 23]. Металлорганические карбоновые кислоты, в частности цимантренкарбоновая кислота, вводятся в состав карбоксилатных комплексов благородных и неблагородных металлов аналогично чисто органическим карбоновым кислотам [37–39], в том числе для синтеза комплексов с 2,6-лутидином [40], а ферроценкарбоновая кислота является доступным реагентом для получения гетерометаллических соединений меди [41], платины [26] и других подобных систем.
Ацетат палладия [Pd3(OOCMe)6] легко реагирует в мягких условиях с пиридином, при этом с практически количественным выходом образуется моноядерный комплекс транс-строения [Pd(Py)2(OOCMe)2]. Добавление к реакционной смеси двух эквивалентов ферроценкарбоновой кислоты FcCOOH в неполярной среде приводит к замещению ацетат-анионов и образованию кристаллического продукта [Pd(Py)2(FcCOO)2] · C6H6 (I) (pис. 1). Светло-желтые кристаллы комплекса теряют кристаллизационный растворитель на воздухе, но легко перекристаллизовываются из бензола или хлористого метилена, приводя к сольватоморфам [Pd(Py)2(FcCOO)2 · 3C6H6] (II) (pис. 2) и [Pd(Py)2(FcCOO)2] · 2CH2Cl2 (III) (pис. 3) соответственно. Согласно данным РСА, соединения I и III кристаллизуются в триклинной пространственной группе P$\overline 1 $, в отличие от сольватоморфа II, кристаллизующегося в моноклинной группе P21/c. В каждой молекуле атом палладия находится в плоско-квадратном окружении двух атомов кислорода ферроценкарбоксилатных групп и атомов азота пиридина с близкими значениями межъядерных расстояний Pd(1)–O 2.0056(14)–2.016(2) Å и Pd(1)–N 2.0355(16)–2.035(4) Å. Геометрия и ориентация ригидного ферроценкарбоксилат-аниона не претерпевает значительных изменений в зависимости от растворителя, связанного с основной молекулой лишь за счет слабых ван-дер-ваальсовых взаимодействий. Во всех рассматриваемых системах молекулы комплекса образуют стопки или слои, а пространство между ними заполняется легко теряющимися кристаллизационными молекулами растворителя, связанными с молекулами комплекса лишь относительно слабыми ароматическими взаимодействиями C–H∙∙∙π в случае I и II (pис. 1, 2). В случае комплекса III взаимодействие растворитель–комплекс осуществляется посредством контактов C–H∙∙∙O между атомами водорода молекул хлористого метилена и sp2-атомами кислорода карбоксильных групп ферроценкарбоксилат-анионов, а также взаимодействий C–H∙∙∙Cl между атомами водорода ферроценильных групп и атомами хлора хлористого метилена. (Подробная информация о межатомных расстояниях и углах в кристаллах I–V приведена в табл. 2 и 3.)
Таблица 2.
Избранные расстояния (Å) и углы (град) в молекулах I–III
| Связь | I | II | III |
|---|---|---|---|
| d, Å | |||
| Pd(1)–O(1) | 2.0056(14) | 2.010(3) | 2.016(2) |
| Pd(1)–O(1)#1 | 2.0057(14) | 2.010(3) | 2.016(2) |
| Pd(1)–N(1) | 2.0355(16) | 2.035(4) | 2.016(3) |
| Pd(1)–N(1)#1 | 2.0355(16) | 2.035(4) | 2.016(3) |
| Угол ω, град | |||
| O(1)Pd(1)O(1)#1 | 180 | 180 | 180 |
| O(1)Pd(1)N(1) | 91.04(6) | 88.76(14) | 89.37(10) |
| O(1)#1Pd(1)N(1) | 88.96(6) | 91.24(14) | 90.63(10) |
| O(1)Pd(1)N(1)#1 | 88.96(6) | 91.24(14) | 90.63(10) |
| O(1)#1Pd(1)N(1)#1 | 91.04(6) | 88.76(14) | 89.37(10) |
| N(1)Pd(1)N(1)#1 | 180 | 180 | 180 |
| Операции симметрии#1 | –x + 1, –y + 1, –z + 1 | –x + 2, –y + 1, –z + 2 | –x + 1, –y + 2, –z |
Таблица 3.
Избранные расстояния (Å) и углы (град) в молекулах IV и V
| Связь | IVа | IVб | V |
|---|---|---|---|
| d, Å | |||
| Pd(1)–O(1) | 2.010(3) | 1.987(3) | 1.992(3) |
| Pd(1)–O(3) | 2.014(3) | 2.005(3) | 2.010(3) |
| Pd(1)–N(1) | 2.014(3) | 2.007(4) | 2.017(3) |
| Pd(1)–N(2) | 2.021(3) | 2.008(3) | 2.006(3) |
| Угол | ω, град | ||
| O(7)Pd(2)O(5)/O(1)Pd(1)O(3) | 89.03(12) | 92.53(12) | 90.61(12) |
| O(5)Pd(2)N(4)/O(1)Pd(1)N(1) | 96.80(12) | 93.14(13) | 95.15(13) |
| O(5)Pd(2)N(3)/O(3)Pd(1)N(1) | 177.97(12) | 173.13(12) | 173.94(13) |
| O(7)Pd(2)N(4)/O(1)Pd(1)N(2) | 172.97(13) | 173.36(13) | 174.54(13) |
| O(7)Pd(2)N(3)/O(3)Pd(1)N(2) | 91.89(12) | 92.45(14) | 92.53(13) |
| N(4)Pd(2)N(3)/N(1)Pd(1)N(2) | 82.15(12) | 82.20(15) | 81.87(14) |
Введение в реакцию обмена ацетатного комплекса цис-строения с Phen, [Pd(Phen)(OOCMe)2], при попытке синтеза производных с аналогичным I соотношением металлов (2Fe : 1Pd), приводит к образованию кристаллов смешанно-металлического гетероанионного комплекса [Pd(Phen)(FcCOO)2 Pd(Phen)(FcCOO)(OOCMe)] (IV) (pис. 4) с cоотношением железа и палладия 3Fe : 2Pd, образующихся за счет сильного π–π-стекинг-взаимодействия между промежуточным продуктом [Pd(Phen)(FcCOO)(OOCMe)] (IVа) (pис. 5), в котором замещен только один из ацетатных лигандов исходного комплекса, и продуктом реакции полного замещения [Pd(Phen)(FcCOO)2] (IVб) (pис. 6). В соответствии с данными РСА, комплекс кристаллизуется в триклинной пространственной группе $P\bar {1}$. Оба фрагмента (IVа и IVб) можно рассматривать как независимые нейтральные молекулы. Центральный атом палладия каждой из них имеет плоско-квадратное окружение, состоящее из атомов азота 1,10-фенантролина (Pd(1)–N 2.007(4)–2.008(3), Pd(2)–N 2.014(3)–2.021(3) Å), и из атомов кислорода ферроценкарбоксилата или ацетата (Pd(1)–O 1.987(3)–2.005(3), Pd(2)–O 2.010(3)–2.014(3) Å). Анализ кристаллической упаковки соединения IV показал, что молекулы комплексов (IVа и IVб) чередуются, образуя бесконечные стопки молекул, располагающиеся вдоль оси b, при этом подобная упаковка обусловлена сильным π–π-стекинг-взаимодействием ароматических систем координированного на атом палладия 1,10-фенантролина. Следует отметить, что плоскости фенантролиновых лигандов в симметрически независимой части элементарной ячейки несколько непараллельны друг другу (межплоскостной угол составляет 5.13(8)°), а минимальное расстояние между основными плоскостями, образованными фенантролином и ближайшим координационным окружением палладия, составляет всего 3.322(2) Å (в пределах независимой части элементарной ячейки).
Поскольку в предыдущей реакции продуктом, выделенным в кристаллическом состоянии, стал гетероанионный комплекс IV, для получения полностью замещенного комплекса [Pd(Phen)- (FcCOO)2] (V) и исключения возможного образования побочных продуктов ацетат палладия на первой стадии подвергали замене ацетат-анионов на ферроценкарбоксилатные, получая при этом мелкокристаллический коричневый продукт состава [Pd(FcCOO)2]n, который в дальнейшем вводили в реакцию с Phen. Образующееся в результате этой реакции соединение V (pис. 7) кристаллизуется в триклинной пространственной группе $P\bar {1}$. Основные межъядерные расстояния и углы близки к расстояниям и углам в комплексе IVб (Pd(1)–O 1.992(3)–2.010(3), Pd(1)–N 2.006(3)–2.017(3) Å). Аналогично структуре IV, в кристаллической упаковке обнаруживается π–π-стекинг-взаимодействие, однако плоскости фенантролиновых лигандов ориентированы параллельно, поскольку в кристаллографически независимой части структуры содержится только одна молекула комплекса, а минимальное межплоскостное расстояние несколько больше (3.413(2) Å).
Рис. 1.
Структура комплекса [Pd(Py)2(FcCOO)2] · C6H6 (I). Тепловые эллипсоиды приведены с вероятностью 50%, и показан короткий C–H···π контакт с расстоянием атом водорода–центроид ароматической системы 2.786 Å.
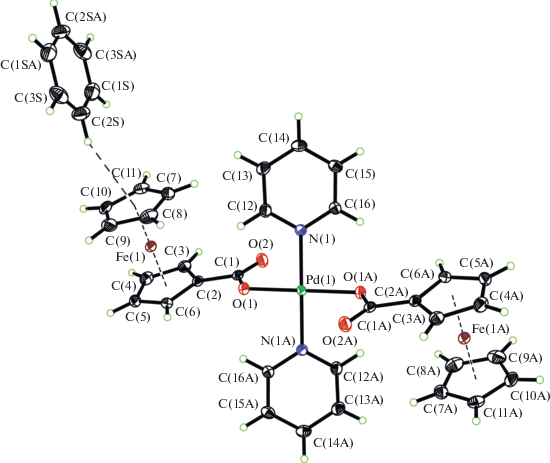
Рис. 2.
Структура комплекса [Pd(Py)2(FcCOO)2 · 3C6H6] (II). Тепловые эллипсоиды показаны с вероятностью 35%, и приведены ближайшие C–H∙∙∙π контакты с расстоянием атом водорода – центроид ароматической системы менее 3 Å.

Рис. 3.
Структура комплекса [Pd(Py)2(FcCOO)2] · 2CH2Cl2 (III). Тепловые эллипсоиды показаны с вероятностью 35%.

Рис. 4.
Структура сокристаллизата [Pd(Phen)(FcCOO)2 Pd(Phen)(FcCOO)(OOCMe)] (IV). Тепловые эллипсоиды показаны с вероятностью 35%. Атомы водорода не показаны.

Рис. 5.
Структура комплекса [Pd(Phen)(FcCOO)(OOCMe)] (IVа), гетероанионный фрагмент. Тепловые эллипсоиды показаны с вероятностью 35%.

Рис. 6.
Структура комплекса [Pd(Phen)(FcCOO)2] (IVб), гомоанионный фрагмент. Тепловые эллипсоиды показаны с вероятностью 35%.

Рис. 7.
Структура триядерного комплекса [Pd(Phen)(FcCOO)2] (V). Тепловые эллипсоиды показаны с вероятностью 50%.

В результате реакций обмена лигандов в ацетатных комплексах палладия(II) с высоким выходом синтезированы три новых гетероядерных комплекса: [Pd(Py)2(FcCOO)2], [Pd(Phen)-(Fc-COO)2 Pd(Phen)(FcCOO)(OOCMe)], [Pd(Phen)-(FcCOO)2], установлена их структура в кристаллическом состоянии, в том числе получено три сольватоморфа для [Pd(Py)2(FcCOO)2]. Показана возможность применения ферроценкарбоновой кислоты для синтеза биметаллических систем на основе палладия(II) с различным соотношением элементов для дальнейших исследований их физико-химических свойств и термических превращений с получением биметаллических наноразмерных фаз.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Smidt J., Hafner W., Jira R. et al. // Angew. Chem. 1959. V. 71. P. 176.
Buchwalter P., Rosé J., Braunstein P. // Chem. Rev. 2015. V. 115. P. 28.
Kozitsyna N.Yu., Nefedov S.E., Klyagina A.P. et al. // Inorg. Chim. Acta. 2011. V. 370. P. 382.
Wang A.L., He X.J., Lu X.F. et al. // Angew. Chem. Int. Ed. 2015. V. 54. P. 3669.
Ghosh S., Bera S., Bysakh S., Bas R.N. // ACS Appl. Mater. Interfaces. 2017. V. 9. P. 33775.
Chen A., Holt-Hindle P. // Chem. Rev. 2010. V. 110. P. 3767.
Cherkashina N.V., Churakov A.V., Yakushev I.A. et al. // Russ. J. Coord. Chem. 2019. V. 45. № 4. P. 253. https://doi.org/10.1134/S107032841904002X
Pasynskii A.A., Shapovalov S.S., Skabitskii I.V. et al. // Russ. J. Coord. Chem. 2016. V. 42. P. 608. https://doi.org/10.1134/S1070328416090062
Kozitsyna N.Yu., Nefedov S.E., Dolgushin F.M. et al. // Inorg. Chim. Acta. 2006. V. 359. P. 2072.
Kozitsyna N.Yu., Nefedov S.E., Yakushev I.A. et al. // Mendeleev Commun. 2007. V. 17. № 5. P. 261.
Nefedov S.E., Kozitsyna N.Yu., Vargaftik M.N. et al. // Polyhedron. 2009. V. 28. P. 172.
Nefedov S.E., Kozitsyna N.Yu., Akhmadullina N.S. et al. // Inorg. Chem. Commun. 2011. V. 14. P. 554.
Stolarov I.P., Yakushev I.A., Churakov A.V. et al. // Inorg. Chem. 2018. V. 57. P. 11482.
Huang G.-H., Li J.-M., Huang J.-J. et al. // Chem. Eur. J. 2014. V. 20. № 18. P. 5240.
Mashkovsky I.S., Markov P.V., Bragina G.O. et al. // Nanomaterials. 2018. V. 8. P. 769.
Mashkovsky I.S., Baeva G.N., Stakheev A.Y. et al. // Mendeleev Commun. 2014. V. 24. P. 355.
Markov P.V., Bragina G.O., Rassolov A.V. et al. // Mendeleev Commun. 2016. V. 26. P. 494.
Stakheev A.Y., Smirnova N.S., Krivoruchenko D.S. et al. // Mendeleev Commun. 2017. V. 27. P. 515.
Smirnova N.S., Khramov E.V., Stolarov I.P. et al. // Intermetallics. 2021. V. 132. P. 107160.
Grinberg V.A., Mayorova N.A., Pasynsky A.A. et al. // Electrochim. Acta. 2019. V. 299. P. 886.
Yakushev I.A., Stolarov I.P., Cherkashina N.V. et al. // Inorg. Chim. Acta. 2020. V. 508. P. 119631.
Mayorova N.A., Modestov A.D., Grinberg V.A. et al. // Mater. Chem. Phys. 2021. V. 259. P. 123968.
Stolarov I.P., Cherkashina N.V., Yakushev I.A. et al. // Russ. J. Inorg. Chem. 2020. V. 65. P. 507. https://doi.org/10.1134/S003602362004021X
Shapovalov S.S., Gordienko A.V., Pasynskii A.A. et al. // Russ. J. Coord. Chem. 2011. V. 37. P. 447. https://doi.org/10.1134/S1070328411050125
Pasynskii A.A., Shapovalov S.S. // Russ. J. Coord. Chem. 2016. V. 42. P. 574. https://doi.org/10.1134/S1070328416090050
Tanaka S., Mashima K. // Inorg. Chem. 2011. V. 50. № 22. P. 11384.
Perrin D.D., Armarego W.L.F. Purification of Laboratory Chemicals. Oxford: Pergamon, 1988.
Stephenson T.A., Morehouse S.M., Powel A.R. et al. // J. Chem. Soc. 1965. P. 3632.
Milani B., Alessio E., Mestroni G. et al. // Dalton Trans. 1994. V. 13. P. 1903.
APEX3, SAINT and SADABS. Madison (WI, USA): Bruker AXS Inc., 2016.
Svetogorov R.D., Dorovatovskii P.V., Lazarenko V.A. // Cryst. Res. Technol. 2020. V. 55. P. 1900184.
Kabsch W. // Acta Crystallogr. D. 2010. V. 66. P. 125.
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. P. 3.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Spek A.L. // Acta Crystallogr. C. 2015. V. 71. P. 9.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Cryst. 2009. V. 42. P. 339.
Grineva A.A., Uvarova M.A., Datchuk R.R. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 610. https://doi.org/10.1134/S0036023618050091
Pasynskii A.A., Shapovalov S.S., Gordienko A.V. et al. // Inorg. Chim. Acta. 2012. V. 384. P. 18.
Ageshina A.A., Uvarova M.A., Nefedov S.E. // Russ. J. Inorg. Chem. 2015. V. 60. P. 1085. https://doi.org/10.1134/S0036023615090028
Shapovalov S.S., Pasynskii A.A., Skabitskii I.V. et al. // Russ. J. Coord. Chem. 2014. V. 40. P. 77. https://doi.org/10.1134/S1070328414020092
Churchill M.R., Li Y.J., Nalewajek D. et al. // Inorg. Chem. 1985. V. 24. № 17. P. 2684.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия


