Координационная химия, 2022, T. 48, № 4, стр. 223-228
Синтез и строение дикарбоксилатов (3-фторфенил)сурьмы [(3-FC6H4)3Sb][OC(O)R]2 (R = СH2С6H4F-3, С6H3F2-2,3, С6F5)
В. В. Шарутин 1, *, О. К. Шарутина 1, Д. А. Жеребцов 1, О. С. Ельцов 2
1 Национальный исследовательский Южно-Уральский государственный университет
Челябинск, Россия
2 Уральский федеральный университет
Екатеринбург, Россия
* E-mail: sharutin50@mail.ru
Поступила в редакцию 24.05.2021
После доработки 30.06.2021
Принята к публикации 05.07.2021
- EDN: NOFJLO
- DOI: 10.31857/S0132344X2204003X
Аннотация
Дикарбоксилаты (3-фторфенил)сурьмы [(3-FC6H4)3Sb][OC(O)R]2 (R = СH2С6H4F-3 (I), С6H3F2-2,3 (II), С6F5 (III)) синтезированы из трис(3-фторфенил)сурьмы, карбоновой кислоты и трет-бутилгидропероксида в растворе диэтилового эфира по реакции окислительного присоединения. Структура соединений охарактеризована методами ИК, 1Н, 13С{1Н} и 19F{1Н} ЯМР-спектроскопии, элементного анализа и монокристальной рентгеновской дифракции (CIF files CCDC № 2055807 (I), 2055816 (II), 2055817 (III)). Кристаллы комплексов I−III содержат тригонально-бипирамидные молекулы с аксиально расположенными карбоксилатными лигандами.
В настоящее время получен и исследован достаточно широкий ряд дикарбоксилатов три-арилсурьмы [1]. Интерес к такому типу соединений связан с большими возможностями их применения. Некоторые из указанных производных проявляют противоопухолевую активность [2–4] и используются для лечения лейшманиоза [5–8]. Активно развивается химия полимеров, содержащих сурьму. В литературе имеются данные о введении в полиметилметакрилат, полиакриловую кислоту, поливинилацетат металлической сурьмы в коллоидном состоянии [9, 10]. Сурьмаорганические производные могут встраиваться как в основную цепь макромолекул [11, 12], так и в качестве заместителей в боковой цепи. Акрилаты, метакрилаты, винилбензоаты и другие производные сурьмы, способные к полимеризации, уже использованы для синтеза металлосодержащих полимеров на основе метилметакрилата, стирола, винилацетата, акриловой кислоты, проявляющих фунгицидную и биоцидную активность [13, 14]. Добавки таких соединений в полимерные материалы улучшают их термическую стойкость [15], а также поглощение рентгеновского излучения [16]. Отметим, что свойства дикарбоксилатов триарилсурьмы зависят от природы и типа лигандов при атоме металла [1], поэтому синтез дикарбоксилатов с гетероатомами в арильных заместителях является актуальной задачей. В литературе известны дикарбоксилаты триарилсурьмы с атомами галогена в арильных лигандах [1, 17–20], среди которых выделим немногочисленные дикарбоксилаты трис(3-фторфенил)сурьмы [19, 20].
В продолжение исследований соединений пятивалентной сурьмы синтезированы дикарбоксилаты трис(3-фторфенил)сурьмы [(3‑FC6H4)3Sb][OC(O)R]2 (R = СH2С6H4F-3 (I), С6H3F2-2,3 (II), С6F5 (III)) и изучено их строение.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза использовали коммерческие реактивы (Alfa Aesar).
Синтез бис(3-фторфенилацетато)трис(3-фторфенил)сурьмы (I). Смесь трис(3-фторфенил)сурьмы (203 мг, 0.5 ммоль), 3-фторфенилуксусной кислоты (154 мг, 1.0 ммоль) и 64 мг 70%-ного раствора трет-бутилгидропероксида в 20 мл эфира перемешивали 1 ч. Через 18 ч образовавшиеся кристаллы отфильтровывали и высушивали на воздухе. Выход 290 мг (81%). Тпл = 99°C.
ИК-спектр (ν, см–1): 3088, 3065, 1659, 1616, 1585, 1522, 1489, 1472, 1450, 1425, 1310, 1287, 1265, 1217, 1163, 1140, 1088, 1053, 997, 962, 924, 893, 870, 853, 783, 766, 721, 679, 658, 633, 584, 555, 538, 523, 486, 440. ЯМР 1H (CDCl3; δ, м.д.) 7.58–7.49 (м., 6H), 7.39 (т.д., J = 8.0, 5.4 Гц, 3H), 7.25–7.14 (м., 5H), 6.90 (т.д., J = 8.5, 2.6 Гц, 2H), 6.80 (д., J = = 7.6 Гц, 2H), 6.69 (д.д., J = 9.8, 2.0 Гц, 2H), 3.43 (с., 2H). ЯМР 13C{1H} (CDCl3; δ, м.д.): 175.33, 162.77 (д., J = 245.8 Гц), 162.71 (д., J = 251.4 Гц), 139.15 (д., J = 5.5 Гц), 137.10 (д., J = 8.3 Гц), 130.80 (д., J = 7.4 Гц), 129.92 (д., J = 7.9 Гц), 129.31 (д., J = = 3.3 Гц), 124.88 (д., J = 2.2 Гц), 120.95 (д., J = 22.8 Гц), 118.79 (д., J = 20.8 Гц), 116.06 (д., J = 21.7 Гц), 113.77 (д., J = 20.8 Гц), 42.39. ЯМР 19F (CDCl3; δ, м.д.): –109.36 м., –113.40 м.
Соединения II и III получали аналогично.
Бис(2,3-дифторбензоато)трис(3-фторфенил)сурь-ма (II). Выход 83%, Тпл = 183°C.
ИК-спектр (ν, см–1): 3102, 3073, 1634, 1587, 1487, 1474, 1425, 1348, 1273, 1215, 1184, 1163, 1151, 1088, 1067, 999, 959, 899, 878, 853, 835, 789, 773, 762, 675, 660, 635, 544, 511, 492, 459, 440. ЯМР 1H (600 МГц; хлороформ-d; δ, м.д.) 7.85–7.81 (м., 3H), 7.80 (д., J = 7.8 Гц, 3H), 7.48–7.37 (м., 5H), 7.21–7.10 (м., 5H), 6.95 (т.д.д., J = 8.0, 4.6, 1.4 Гц, 2H). ЯМР 13C{1H} (151 МГц, хлороформ-d; δ, м.д.) 167.43 (т., J = 3.6 Гц), 162.94 (д., J = 251.8 Гц), 151.16 (д.д., J = 248.1, 13.5 Гц), 150.49 (д.д., J = = 260.2, 14.0 Гц), 138.84 (д., J = 5.4 Гц), 131.20 (д., J = 7.5 Гц), 129.58 (д., J = 3.3 Гц), 127.27 (д., J = 3.3 Гц), 124.49–123.36 (м.), 122.61 (д., J = 6.6 Гц), 121.28 (д., J = 23.0 Гц), 120.99 (д., J = 17.5 Гц), 119.16 (д., J = = 20.7 Гц). ЯМР 19F (565 МГц, хлороформ-d; δ, м.д.) –108.93…–109.03 м., –135.74 (д.т., J = 20.6, 6.3 Гц), –137.21 (д.д.д., J = 21.2, 9.7, 4.1 Гц).
Бис(пентафторбензоато)трис(3-фторфенил)сурь-ма (III). Выход 79%, Тпл = 131°C.
ИК-спектр (ν, см–1): 3102, 3074, 1699, 1682, 1653, 1591, 1522, 1499, 1476, 1427, 1333, 1252, 1217, 1167, 1105, 1090, 1059, 995, 926, 870, 856, 822, 787, 748, 698, 677, 660, 623, 582, 523, 492, 440. ЯМР 1H (хлороформ-d; δ, м.д.): 7.79–7.70 (м., 6H), 7.49 (т.д., J = 8.0, 5.4 Гц, 3H), 7.21 (д.д.д., J = 8.3, 2.5, 1.0 Гц, 3H). ЯМР 13C{1H} (151 МГц, хлороформ-d; δ, м.д.): 163.07 (д., J = 252.9 Гц), 162.18, 145.16 (д.т.д., J = 255.2, 7.6, 3.9 Гц), 142.57 (д.м., J = 259.7 Гц), 137.72 (д.д.д.д., J = 253.0, 17.4, 12.8, 5.5 Гц), 136.56 (д., J = 5.9 Гц), 131.63 (д., J = 7.2 Гц), 129.52 (д., J = = 3.9 Гц), 128.47, 121.13 (д., J = 23.7 Гц), 119.86 (д., J = 20.8 Гц), 110.18 т.д., J = 17.0, 3.9 Гц). ЯМР 19F{1H} (CDCl3; δ, м.д.): –104.82…–114.20 м., ‒139.75…139.81 м., –150.43 (т., J = 20.6 Гц), –160.72 (т.д., J = 20.2, 6.1 Гц).
ИК-спектры записывали на ИК-Фурье-спектрометре Shimadzu IR Affinity-1S в таблетках KBr в диапазоне 4000−400 см−1. Спектры ЯМР 1H (600 МГц), 13C (151 МГц), 19F (565 МГц) регистрировали для растворов соединений в CDCl3 на ЯМР-спектрометре Bruker AVANCE NEO 600 МГц, оборудованном Prodigy Cryoprobe. Сигналы растворителя использовали в качестве внутреннего стандарта для спектров ЯМР 1H (7.26 м.д.) и 13C (77.16 м.д.), а CFCl3 в качестве внешнего стандарта для спектров ЯМР 19F.
Элементный анализ на C и H выполняли на элементном анализаторе Carlo Erba CHNS-O EA 1108. Температуры плавления измеряли на синхронном термоанализаторе Netzsch 449C Jupiter.
РСА. Исследование структуры монокристаллов соединений I−III проведено на дифрактометре Bruker D8 QUEST (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведено с помощью программ SMART и SAINT-Plus [21]. Все расчеты проведены с использованием программ SHELXTL/PC [22], OLEX2 [23]. Структуры расшифрованы прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Параметры кристаллов, сбор данных и детали уточнения соединений I−III представлены в табл. 1.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I−III
| Параметр | Значение | ||
|---|---|---|---|
| I | II | III | |
| M | 713.28 | 721.21 | 829.17 |
| Сингония | Моноклинная | Триклинная | Моноклинная |
| Пр. гр. | C2/c | $P\bar {1}$ | C2/c |
| a, Å | 18.813(12) | 8.751(7) | 26.308(15) |
| b, Å | 9.851(6) | 11.126(8) | 13.078(10) |
| c, Å | 16.259(11) | 15.367(16) | 19.015(11) |
| α, град | 90 | 99.40(3) | 90 |
| β, град | 97.05(3) | 95.22(3) | 111.121(14) |
| γ, град | 90 | 93.21(2) | 90 |
| V, Å3 | 2990(3) | 1466(2) | 6103(7) |
| Z | 4 | 2 | 8 |
| ρ(выч.), г/см3 | 1.584 | 1.634 | 1.805 |
| μ, мм−1 | 0.992 | 1.022 | 1.022 |
| F(000) | 1424.0 | 712.0 | 3232.0 |
| Размер кристалла, мм | 0.48 × 0.24 × 0.2 | 0.65 × 0.46 × 0.45 | 0.48 × 0.36 × 0.17 |
| 2θ, град | 6.256–56.994 | 5.77–57 | 5.88−59.26 |
| Интервалы индексов отражений | –25 ≤ h ≤ 25, –13 ≤ k ≤ 13, –21 ≤ l ≤ 21 |
–11 ≤ h ≤ 11, –14 ≤ k ≤ 14, –20 ≤ l ≤ 20 |
–36 ≤ h ≤ 33, –18 ≤ k ≤ 18, –26 ≤ l ≤ 26 |
| Всего отражений | 37 362 | 60 514 | 138 680 |
| Независимых отражений (Rint) | 3783 (0.0275) | 7436 (0.0327) | 8583 (0.0381) |
| Число уточняемых параметров | 210 | 401 | 451 |
| GOOF | 1.099 | 1.157 | 1.050 |
| R-факторы по F 2 > 2σ(F 2) |
R1 = 0.0293, wR2 = 0.0882 |
R1 = 0.0367, wR2 = 0.0872 |
R1 = 0.0307, wR2 = 0.0737 |
| R-факторы по всем отражениям | R1 = 0.0306, wR2 = 0.0903 |
R1 = 0.0416, wR2 = 0.0902 |
R1 = 0.0458, wR2 = 0.0838 |
| Остаточная электронная плотность (max/min), e/Å−3 | 1.71/–0.63 | 1.77/–0.99 | 0.74/–0.69 |
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (CCDC № 2055807 (I), 2055816 (II), 2055817 (III); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Известно, что окисление триарилсурьмы трет-бутилгидропероксидом в присутствии карбоновых кислот приводит к синтезу дикарбоксилатов триарилсурьмы общей формулы Ar3Sb[OC(O)R)]2 [24–27]. Мы установили, что реакции трис(3-фторфенил)сурьмы с такими карбоновыми кислотами, как 3-фторфенилуксусная, 2,3-дифторбензойная и пентафторбензойная кислоты в присутствии трет-бутилгидропероксида (мольное соотношение 1 : 2 : 1) протекают в эфире с образованием дикарбоксилатов трис(3-фторфенил)сурьмы, выделяемых с выходом до 83%:
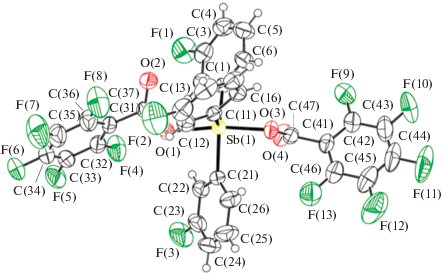
По данным РСА, в соединениях I–III атомы Sb имеют искаженную тригонально-бипирамидальную координацию с атомами кислорода карбоксилатных лигандов в аксиальных положениях и арильными заместителями − в экваториальной плоскости (рис. 1–3).
Аксиальные углы OSbO в I, II, III составляют 175.96(9)°, 174.63(8)°, 171.32(7)° соответственно. Длины связей Sb−C в I−III изменяются в интервале 2.094(2)−2.123(3) Å, расстояния Sb−O (2.099(2)−2.128(2) Å) несколько меньше суммы ковалентных радиусов атомов сурьмы и кислорода (2.14 Å [28]). Суммы углов CSbC в экваториальной плоскости молекул I−III составляют 360°. Плоские арильные кольца в структурах развернуты вокруг связей Sb−C таким образом, чтобы свести к минимуму внутри- и межмолекулярные контакты. В молекулах I−III наблюдаются внутримолекулярные контакты Sb⋅⋅⋅O(=C), которые изменяются в интервале 2.862(9)−3.381(3) Å. Двугранные углы между плоскостями карбоксильных групп в I и II составляют 13.93° и 2.62°, а карбоксилатные лиганды имеют относительно фрагмента SbC3цис-ориентацию, что характерно для большинства дикарбоксилатов триорганилсурьмы [29]. Двугранные углы расположены таким образом, что внутримолекулярные контакты Sb⋅⋅⋅O(=C) формируются внутри одного экваториального угла, значение которого возрастает до 138.30(14)°, 144.20(12)° соответственно при понижении значений двух других экваториальных углов. В молекулах III двугранный угол между плоскостями карбоксильных групп имеет необычно большое значение (76.27°), в результате чего карбонильные атомы кислорода находятся напротив разных экваториальных углов и углы СSbC (111.99(9)°, 117.56(10)°, 130.37(9)°) изменяются в обычном для соединений общей формулы Ar3SbX2 интервале (120° ± 10° [30]).
Из сравнительного анализа данных рентгеноструктурных исследований дикарбоксилатов трис(3-фторфенил)сурьмы (табл. 2) можно заключить, что упрочение внутримолекулярных контактов в молекулах (3-FC6H4)3Sb[OC(O)R]2 приводит к увеличению одного из экваториальных углов (со стороны внутримолекулярных контактов) и, наоборот, при наименьших внутримолекулярных взаимодействиях различия в экваториальных углах менее заметны.
Таблица 2.
Основные геометрические параметры молекул (3-FC6H4)3Sb[OC(O)R]2
| R | Связь, Å | Угол, град | |||
|---|---|---|---|---|---|
| Sb⋅⋅⋅O=C (средн.) | Sb−О (средн.) | Sb−C (средн.) | OSbO | CSbC (макс.) | |
| CH=CHPh | 2.601 | 2.142 | 2.116 | 175.81 | 152.12 [19] |
| CH2Br | 2.872 | 2.119 | 2.105 | 175.92 | 143.09 [19] |
| C6F4H-2 | 2.878 | 2.131 | 2.114 | 175.72 | 142.47 [20] |
| C6H3F2-2,3 (II) | 2.906 | 2.120 | 2.122 | 174.63 | 144.20 |
| C6H3(NO2)2-3,5 | 2.931 | 2.127 | 2.111 | 174.70 | 141.08 [19] |
| CH2C6H4F-3 (I) | 3.122 | 2.099 | 2.117 | 175.96 | 138.30 |
| C6F5 (III) | 3.246 | 2.115 | 2.098 | 171.32 | 130.37 |
В ИК-спектрах соединений I–III наблюдается интенсивная полоса поглощения валентных колебаний фрагмента SbC3 при ∼440 см–1. Наличие интенсивных полос при 1659 (I), 1634 (II) и 1682 см–1 (III) определяет валентные колебания карбонильных групп С=О. Полосы поглощения при 1585, 1471, 1425 см–1 (I); 1587, 1473, 1425 см–1 (II); 1591, 1476, 1427 см–1 (III) характеризуют валентные колебания углеродного скелета арильных колец. Валентным колебаниям связей CAr–H отвечают полосы поглощения средней интенсивности при 3088 (I), 3102 (II), 3102 (III) см–1, а внеплоскостным деформационным колебаниям этих же связей – интенсивные полосы при 766, 762, 748 см–1. В ИК-спектрах I, II, III присутствуют полосы поглощения валентных колебаний C−F при 1217, 1215, 1252 см–1. По причине симметричности молекул комплексов во всех спектрах ЯМР 1H, 13C и 19F наблюдается изохронность сигналов. Наличие атомов фтора обусловливает дополнительное расщепление сигналов в спектрах ЯМР 1Н и характерное расщепление ряда сигналов в спектрах ЯМР 13С с появлением типичных С−F констант спин-спинового взаимодействия.
Таким образом, наличие различного количества электроотрицательных атомов фтора в органическом радикале карбоновой кислоты не оказывает влияния на схему протекания реакции окислительного присоединения с участием трис(3-фторфенил)сурьмы. Геометрические характеристики полученных дикарбоксилатов трис(3-фторфенил)сурьмы (длины связей Sb–C, Sb–О, внутримолекулярные контакты Sb⋅⋅⋅O и величины валентных углов) близки между собой при одинаковом координационном полиэдре атомa сурьмы и его координационном числе.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Шарутин В.В., Поддельский А.И., Шарутина О.К. // Коорд. химия. 2020. Т. 46. № 10. С. 579 (Sharutin V.V., Poddel’sky A.I., Sharutina O.K. // Russ. J. Coord. Chem. 2020. V. 46. № 10. P. 663). https://doi.org/10.1134/S1070328420100012
Silvestru C., Haiduc I., Tiekink R.T. et al. // Appl. Organomet. Chem. 1995. V. 9. P. 597. https://doi.org/10.1002/aoc.590090715
Liu R.C., Ma Y.Q., Yu L. et al. // Appl. Organomet. Chem. 2003. V. 17. P. 662. https://doi.org/10.1002/aoc.491
Wang G.C., Xiao J., Yu L. et al. // J. Organomet. Chem. 2004. V. 689. P. 1631. https://doi.org/10.1016/j.jorganchem.2004.02.015
Mishra J., Saxena A., Singh S. // Curr. Med. Chem. 2007. V. 14. P. 1153. https://doi.org/10.2174/092986707780362862
Islam A., Da Silva J.G., Berbet F.M. // Molecules. 2014. V. 19. P. 6009. https://doi.org/10.3390/molecules19056009
Ali M.I., Rauf M.K., Badshah A. et al. // Dalton Trans. 2013. V. 42. P. 16733. https://doi.org/10.1039/c3dt51382c
Duffin R.N., Blair V.L., Kedzierski L., Andrews P.C. // Dalton Trans. 2018. V. 47. P. 971. https://doi.org/10.1039/c7dt04171c
Cardenas-Trivino G., Retamal C., Klabunde K.J. // Polym. Bull. 1991. V. 25. P. 315. https://doi.org/10.1007/BF00316900
Cardenas-Trivino G., Retamal C., Tagle L.H. // Thermochim. Acta. 1991. V. 176. P. 233. https://doi.org/10.1016/0040-6031(91)80278-Q
Naka K., Nakahashi A., Chujo Y. // Macromolecules. 2006. V. 39. P. 8257. https://doi.org/10.1021/ma061220l
Naka K., Nakahashi A., Chujo Y. // Macromolecules. 2007. V. 40. P. 1372. https://doi.org/10.1021/ma0622332
Котон М.М. Металлоорганические соединения и радикалы. М.: Наука, 1985. С. 13.
Карраер Ч., Шитс Дж., Питтмен Ч. Металлоорганические полимеры. М.: Мир, 1981. 352 с.
Додонов В.А., Гущин А.В., Кузнецова Ю.Л., Моругова В.А. // Вестник ННГУ. Сер. Химия. 2004. Т. 14. P. 86.
Kensuke N., Akiko N., Yoshiki C. // Macromolecules. 2006. V. 39. P. 8257. https://doi.org/10.1021/ma061220l
Лобанова Е.В. // Вестник ЮУрГУ. Сер. Химия. 2020. Т. 12. № 2. С. 23. https://doi.org/10.14529/chem200203
Хайбуллина О.А. // Вестник ЮУрГУ. Сер. Химия. 2021. Т. 13. № 1. С. 39. https://doi.org/10.14529/chem210104
Шарутин В.В., Шарутина О.К., Ефремов А.Н., Андреев П.В. // Коорд. химия. 2018. Т. 44. С. 333 (Sharutin V.V., Sharutina O.K., Efremov A.N., Andreev P.V. // Russ. J. Coord. Chem. 2018. V. 44. № 10. P. 635). https://doi.org/10.1134/S107032841810010X
Шарутин В.В., Шарутина О.К., Ефремов А.Н., Слепухин П.А. // Журн. неорган. химии. 2020. Т. 65. № 7. С. 907 (Sharutin V.V., Sharutina O.K., Efremov A.N., Slepukhin P.A. // Russ. J. Inorg. Chem. 2020. V. 65. № 7. P. 992). https://doi.org/10.1134/S0036023620070190
SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Madison (WI, USA): Bruker AXS Inc., 1998.
SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Madison (WI, USA): Bruker AXS Inc., 1998.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Додонов В.А., Гущин А.В., Брилкина Т.Г. // Журн. общ. химии. 1985. Т. 55. С. 73.
Сенчурин В.С., Орленко Е.Д. // Вестник ЮУрГУ. Сер. Химия. 2019. Т. 11. № 2. С. 66. https://doi.org/10.14529/chem190207
Малеева А.И., Гущин А.В., Калистратова О.С. и др. // Вестник ЮУрГУ. Сер. Химия. 2019. Т. 11. № 3. С. 66. https://doi.org/10.14529/chem190308
Гущин А.В., Малеева А.И., Калистратова О.С., Хамалетдинова Н.М. // Вестник ЮУрГУ. Сер. Химия. 2021. Т. 13. № 1. С. 5. https://doi.org/10.14529/chem210101
Бацанов С.С. // Журн. неорган. химии. 1991. Т. 36. № 12. С. 3015.
Cambridge Crystallographic Data Center. 2020. http://www.ccdc.cam.ac.uk.
Шарутина О.К., Шарутин В.В. Молекулярные структуры органических соединений сурьмы(V). Челябинск: Издательский центр ЮУрГУ, 2012. 395 с.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия