Координационная химия, 2022, T. 48, № 6, стр. 370-377
Синтез, кристаллическое строение и термическая устойчивость комплексов платины(II): [Ph3PCH2OH]2[PtCl4] и транс-PtCl2(PPh3)2] ⋅ CHCl3
А. Р. Зыкова 1, *, В. В. Шарутин 1, О. К. Шарутина 1, О. С. Ельцов 2
1 Южно-Уральский государственный университет
(национальный исследовательский университет)
Челябинск, Россия
2 Уральский федеральный университет, Химико-технологический институт
Екатеринбург, Россия
* E-mail: zykovaar@susu.ru
Поступила в редакцию 11.10.2021
После доработки 20.10.2021
Принята к публикации 22.10.2021
- EDN: BRPQRJ
- DOI: 10.31857/S0132344X22060081
Аннотация
Комплексы двухвалентной платины [Ph3PCH2OH]2[PtCl4] (I) и транс-[PtCl2(PPh3)2] (II ⋅ CHCl3) получены взаимодействием гексахлороплатиноводородной(IV) кислоты с хлоридом (гидроксиметил)трифенилфосфония в смеси ацетонитрил–вода (4 : 1). Растворение кристаллов комплекса I в диэтилсульфоксиде приводит к образованию кристаллов комплекса II. Строение комплексов установлено методами ИК-, ЯМР-спектроскопии и рентгеноструктурного анализа (CCDC № 2055552 (I), 2055809 (II ⋅ CHCl3)). Атомы платины в комплексах I и II ⋅ CHCl3 имеют плоско-квадратную координацию. Кристаллическая структура комплексов I и II ⋅ CHCl3 стабилизируется за счет межионных и межмолекулярных контактов. Термический анализ кристаллов комплекса I показал неустойчивость соединения и потерю веса при 170 и 305°С. Термограмма кристаллов комплекса II ⋅ CHCl3 показала потерю молекулы растворителя при 170°C и плавное падение TГ-кривой после доведения платформы до 310°C.
Координационные комплексы платины представляют фундаментальный интерес, поскольку обладают широким спектром применимости. С момента открытия цитотоксического действия, комплексы платины активно применяют в химиотерапии [1–6]. Кроме того, они проявляют противовоспалительные, противомикробные, противогрибковые [7, 8], а также каталитические свойства [9–12]. Комплексы платины, содержащие в качестве лиганда амины, сульфиды, фосфины и стибины, широко исследуются в различных областях металлорганической химии [13, 14]. Липофильные катионы [Ph3PR]+ являются важными прекурсорами для платиновых комплексов, содержащих органические лиганды [15]. Соли тетраорганилфосфония проявляют дезинфицирующие свойства [16–19].
В литературе описано малое количество комплексов платины с моноядерными тетрахлороплатинат-анионами и катионами органилтрифенилфосфония [20–24]. Наиболее эффективным методом синтеза таких соединений является взаимодействие галогенидов тетраорганилфосфония с калиевой солью тетрахлороплатиновой кислоты в воде [21].
Ранее мы исследовали реакции комплексной кислоты H2PtCl6 с хлоридами органилтрифенилфосфония в ацетонитриле, которые приводили к образованию соответствующих гексахлороплатинатов(IV) [25]. В настоящей работе показано, что такая реакция с хлоридом (гидроксиметил)трифенилфосфония в смеси ацетонитрил–вода (4 : 1) идет нетипично, а с образованием смеси новых комплексных соединений платины(II): [Ph3PCH2OH]2[PtCl4] (I) и транс-[PtCl2(PPh3)2] (II ⋅ CHCl3). Мы осуществили синтез новых комплексов и изучили их кристаллическую структуру и термическую устойчивость.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции, связанные с синтезом новых комплексов, выполняли на воздухе с использованием ацетонитрила и дистиллированной воды. В работе использовали гексахлороплатиноводородную кислоту, полученную по методике, описанной в [26].
ИК-спектры комплексов снимали на ИК-Фурье-спектрометре SHIMADZU IRAffinity-1S в области 4000–400 см–1. Твердые образцы готовили в таблетках KBr.
Спектры ЯМР 1H, 31P регистрировали на спектрометре Bruker AVANCE NEO NMR (600 МГц). Химические сдвиги измеряли от внутреннего стандарта ТМС для ядер 1H, от внешнего стандарта H3PO4 для 31P. Элементный анализ проводили на элементном анализаторе Carlo Erba CHNS-O EA1108 CHNS-O.
Термографический анализ (ТГ) и метод дифференциальной сканирующей калориметрии (ДСК) образцов проводили с использованием термического анализатора STANetzschSTA 449C Jupiter (в атмосфере воздуха, динамический режим, температура 0–380 К).
Синтез тетрахлороплатината(II) (гидроксиметил)трифенилфосфония I. К раствору 0.66 г (2.0 ммоль) хлорида (гидроксиметил)трифенилфосфония в 5 мл смеси ацетонитрил–вода (4 : 1) приливали раствор 0.5 г (2.0 ммоль) гексагидрата гексахлороплатиноводородной кислоты в 5 мл смеси ацетонитрил–вода. Раствор концентрировали. Наблюдали образование двух типов кристаллов: красно-коричневые I (0.37 г, 40%, Тпл = 195°С) и бесцветные кристаллы II. Смесь кристаллов разделяли перекристаллизацией из хлороформа, при этом кристаллы комплекса I не растворялись, их отфильтровывали и высушивали.
ИК-спектр I (ν, см–1): 3255 (О–Н), 3039 (CAr–H), 1484 (СAr), 1438 (СAr). Спектр ПМР I (DMSO-d6; 600 МГц; δ, м.д.): 4.80 (м., 1H, OH); 4.67 (м., 2H, CH2); 7.42 (d., 6H, м-HPh, 2JHH = 7.81 Гц); 7.55 (м., 6H, p-HPh); 7.67 (м., 2H, o-HPh). 31P ЯМР (δ, м.д.): 25.56.
Синтез транс-дихлоро-бис(трифенилфосфин)платина II ∙ CHCl3. 0.1 г кристаллов комплекса I растворяли в 3 мл диэтилсульфоксида. Раствор концентрировали, наблюдали обесцвечивание раствора и образование бесцветных кристаллов. Выход II 0.045 г (53%), Тпл = 308°С. Сольват II ∙ CHCl3 образуется перекристаллизацией транс-[(Ph3P)2PtCl2] из хлороформа. ИК-спектры и Тпл комплексов II и II ∙ CHCl3 совпадают.
ИК-спектр II ∙ CHCl3 (ν, см–1): 3052 (CAr–H), 1480 (СAr), 1434 (СAr). Спектр ПМР II ∙ CHCl3 (DMSO-d6; 600 МГц; δ, м.д.): 7.27 (м., 2H, o-HPh); 7.42 (м., 9H, м- + p-HPh), 7.95 (с., H, CHCl3). 31P ЯМР (δ, м.д.): 13.83.
РСА кристаллов комплексов I и II ∙ CHCl3 проведен на автоматическом четырехкружном дифрактометре D8 QUEST Bruker (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор) при 296(2) K. Структуры расшифрованы прямым методом, позиции и температурные параметры неводородных атомов уточнены в изотропном, а затем в анизотропном приближении полноматричным МНК. Атомы водорода помещены в геометрически рассчитанные положения и включены в уточнение в модели наездника. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [27]. Все расчеты по определению и уточнению структур выполнены по программам SHELXL/PC [28] и OLEX2 [29]. Кристаллографические данные и основные параметры уточнения приведены в табл. 1, основные длины связей и валентные углы – в табл. 2.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I и II ∙ CHCl3
| Параметр | Значение | |
|---|---|---|
| I | II ∙ CHCl3 | |
| М | 923.50 | 1819.79 |
| T, K | 293.15 | 293.15 |
| Сингония | Моноклинная | Моноклинная |
| Пр. группа | P21/n | C2/m |
| a, Å | 9.103(4) | 12.392(6) |
| b, Å | 15.709(5) | 14.184(7) |
| c, Å | 13.155(4) | 11.660(6) |
| α, град | 90 | 90 |
| β, град | 105.826(15) | 117.550(17) |
| γ, град | 90 | 90 |
| V, Å3 | 1809.8(11) | 1817.1(17) |
| Z | 2 | 1 |
| ρ(выч.), г/см3 | 1.695 | 1.663 |
| μ, мм−1 | 4.294 | 4.343 |
| F(000) | 912.0 | 892.0 |
| Область измерений θ, град | 6.104–56.998 | 6.596–56.996 |
| Число измеренных отражений | 41 121 | 21 027 |
| Число независимых отражений | 4571 | 2400 |
| Rint | 0.0272 | 0.1623 |
| Переменных уточнения | 221 | 144 |
| GOOF | 1.092 | 1.041 |
| R-факторы поF2 > 2σ(F2) | R1 = 0.0178, wR2 = 0.0387 | R1 = 0.0323, wR2 = 0.0807 |
| R-факторы по всем отражениям | R1 = 0.0244, wR2 = 0.0413 | R1 = 0.0323, wR2 = 0.0807 |
| Остаточная электронная плотность (min/max), e/Å3 | –0.39/0.81 | –1.48/1.29 |
Таблица 2.
Основные длины связей и валентные углы в структурах I и II ∙ CHCl3
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| I | |||
| Pt(1)Cl(1) | 2.3121(11) | P(1)–C(11) | 1.790(2) |
| Pt(1)Cl(1') | 2.3121(11) | P(1)–C(1) | 1.794(2) |
| Pt(1)–Cl(2) | 2.3044(10) | P(1)–C(21) | 1.796(2) |
| Pt(1)–Cl(2') | 2.3044(10) | P(1)–C(7) | 1.822(2) |
| II ∙ CHCl3 | |||
| Pt(1)–P(1) | 2.3224(17) | P(1)–C(11) | 1.854(4) |
| Pt(1)–P(2) | 2.3223(17) | P(1)–C(1) | 1.796(4) |
| Pt(1)–Cl(1) | 2.3119(18) | P(1)–C(21) | 1.828(4) |
| Pt(1)–Cl(2) | 2.3119(18) | ||
| Угол | ω, град | Угол | ω, град |
| Ι | |||
| Cl(1')Pt(1)Cl(1) | 180.0 | C(11)P(1)C(1) | 109.28(10) |
| Cl(2)Pt(1)Cl(1') | 90.43(3) | C(11)P(1)C(21) | 110.02(10) |
| Cl(2')Pt(1)Cl(1') | 89.57(3) | C(11)P(1)C(7) | 107.95(12) |
| Cl(2')Pt(1)Cl(1) | 90.43(3) | C(1)P(1)C(21) | 110.90(10) |
| Cl(2)Pt(1)Cl(1) | 89.57(3) | C(1)P(1)C(7) | 109.81(11) |
| Cl(2)Pt(1)Cl(2') | 180.0 | C(21)P(1)C(7) | 108.84(11) |
| II ∙ CHCl3 | |||
| P(2) Pt(1)P(1) | 180.0 | Cl(1)Pt(1)Cl(2) | 180.0 |
| Cl(1)Pt(1)P(2) | 87.48(5) | C(11)P(1) Pt(1) | 109.48(15) |
| Cl(2)Pt(1)P(1) | 87.47(5) | C(21)P(1) Pt(1) | 113.41(17) |
| Cl(1)Pt(1)P(1) | 92.52(5) | C(1)P(1)C(1) | 119.6(2) |
| Cl(2)Pt(1)P(2) | 92.53(5) | C(1)P(1)Pt(1) | 118.95(16) |
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (CCDC № 2055552 (I), 2055809 (II ∙ CHCl3); http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Взаимодействие эквимолярных количеств гексагидрата гексахлороплатиноводородной кислоты с хлоридом (гидроксиметил)трифенилфосфония в смеси ацетонитрил–вода сопровождается образованием красно-коричневых кристаллов тетрахлороплатината(II) (гидроксиметил)трифенилфосфония (I) и бесцветных кристаллов транс-дихлоро-бис(трифенилфосфин)платины (II), которые после перекристаллизации из хлороформа были выделены в виде сольвата транс-[PtCl2(PPh3)2] (II ⋅ CHCl3).
Очевидно, в ходе реакции происходит превращение катиона фосфония с элиминированием формальдегида, который восстанавливает Pt(IV) до Pt(II):
В [30] представлен процесс образования формальдегида и трифенилфосфина при обработке (гидроксиметил)трифенилфосфония карбонатом калия:
При растворении кристаллов комплекса I в диэтилсульфоксиде (Et2SO) наблюдали постепенное обесцвечивание раствора и образование бесцветных кристаллов комплекса II, а не предполагаемый продукт встраивания молекулы растворителя в координационную сферу платины:
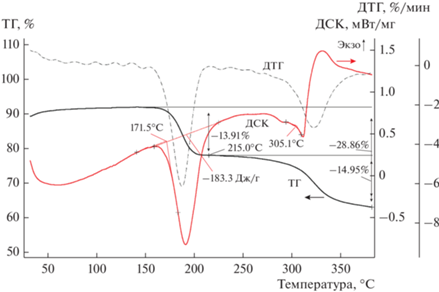
Превращение комплекса I в II заслуживает подробного изучения. Измерение температуры плавления комплекса I в отрытом капилляре показало, что при 195–197°С происходит обесцвечивание красно-коричневых кристаллов комплекса. Полное разложение кристаллов наблюдается при 308–310°С. Мы предположили, что в указанном интервале температуры комплекс I переходит в комплекс II.
Для оценки термического поведения комплексов был использован метод ДСК в интервале температур 0–380 К.
При нагревании на кривой ДСК I наблюдаются тепловые эффекты: интенсивный эндотермический сигнал в интервале 165–225°C и сигнал малой интенсивности, переходящий в экзотермический при 290–320°C. На кривой ДСК комплекса II ∙ CHCl3 наблюдается экзотермический сигнал при 295–340°C. При проведении термогравиметрического анализа, кривая ТГ I показывает потерю веса 13.91% при 165–215°C, соответствующую высвобождению 2CH2O и HCl (теор. 13.51%). Процесс превращения, согласно данным калориметрии, начинается при 171°С (рис. 1). Плавление вещества происходит при 305°С (температура плавления транс-[PtCl2(PPh3)2] 310°С [31]. Кривая ТГ II ∙ CHCl3 показывает потерю веса 15.51% в диапазоне температур 300–360°C, связанную с высвобождением сольватной молекулы растворителя, после 310°C TG-кривая плавно падает. Полученные данные дифференциальной сканирующей калориметрии и термогравиметрического анализа подтверждают неустойчивость комплекса I и его превращение в II ∙ CHCl3 при термической обработке.
Строение синтезированных комплексов доказано методами спектроскопии ИК, ЯМР 1H, 31P, элементным и рентгеноструктурным анализами.
ИК-спектры и Тпл бесцветных кристаллов комплексов II и II ∙ CHCl3, полученных по схемам 3 и 1 соответственно, идентичны. ИК-спектры соединений I и II ∙ CHCl3 содержат характерные полосы валентных колебаний углеродного скелета ароматических фрагментов: 1484, 1438 см–1 для I и 1480, 1434 см–1 для II ∙ CHCl3, а также наблюдаются полосы средней интенсивности при 3039 см–1 (I), 3052 см–1 (II ∙ CHCl3), соответствующие валентным колебаниям CAr–H. В спектре комплекса I присутствует уширенная полоса при 3255 см–1, обусловленная валентными колебаниями связи ν(О–Н).
В спектрах ЯМР 1H в области слабого поля (7.36−7.67 м.д.) наблюдаются сигналы протонов фенильных колец. Мультиплетный сигнал протона гидроксильной группы –OH комплекса I фиксируется при 4.80 м.д. Спектр II ∙ CHCl3 содержит сигнал сольватной молекулы CHCl3 в виде синглета в области 7.95 м.д. В спектрах ЯМР 31P наблюдаются одиночные сигналы фосфора при 25.56 м.д. (I) и 13.83 м.д. (II ∙ CHCl3).
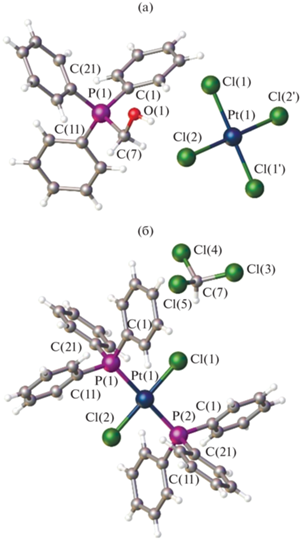
По данным РСА, катион [Ph3PCH2OH]+ комплекса I имеет тетраэдрическую координацию атома фосфора с арильными лигандами и гидроксиметильным заместителем в вершинах тетраэдра (рис. 2а). Гидроксиметильная группа разупорядочена по двум положениям. Углы СРС близки к теоретическому значению 108.84(11)°–110.90(10)°. Расстояние P–CR (1.822(2) Å) больше, чем длины связей P–CAr (1.790(2)–1.796(2) Å). С целью минимизирования внутримолекулярных взаимодействий плоскости трех фенильных колец повернуты друг к другу почти перпендикулярно, наклоны составляют: 88.94° между С(1)–С(6) и С(11)–С(16), 87.17° между С(11)–С(16) и С(21)–С(26), 77.81° между С(1)–С(6) и С(21)–С(26).
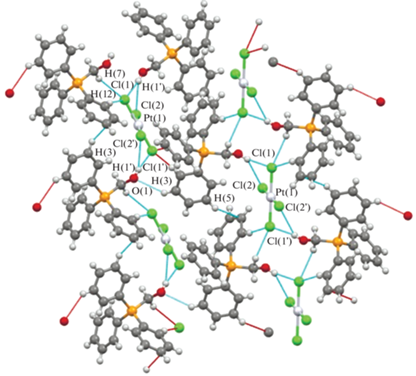
Плоско-квадратная координация атома платины в анионе [PtCl4]2– не искажена. Анион высокосимметричен, имеет симметричные плоскости Cl(1)PtCl(2) и Cl(1')PtCl(2'). Атом платины располагается в центре инверсии, длины связей Pt–Cl составляют 2.304(10), 2.312(11) Å, что несколько меньше суммы ковалентных радиусов атомов платины и хлора (2.35 Å) [32] и практически не отличаются от аналогичных анионов [PtCl4]2– [21, 23]. Транс-углы ClPtCl равны 180°, цис-углы ClPtCl 89.57(3)° и 90.43(3)°. Наличие коротких контактов между катионами и анионами является особенностью строения галогеноплатинатов тетраорганилфосфония. Каждый катион связан с двумя анионами слабыми межионными контактами СAr–H···Cl 2.77–2.853 Å, O–H···Cl 2.35–2.87 Å (рис. 3). Каждый катион взаимодействует с двумя соседними катионами, образуя цепочки из катионов. Так, мета-протоны фенильного кольца образуют слабые контакты с атомами углерода фенильного кольца С–H···СAr (2.82 Å) и атомами кислорода С–H···O (2.52 Å) соседних катионов. Между катионами и анионами присутствуют опорные контакты С–O···Cl (3.13 Å, что составляет 95% от суммы ван-дер-ваальсовых радиусов контактирующих атомов) [33]. Каждый анион окружен четырьмя катионами, образуя цепочку, экранированную с обеих сторон цепочками катионов, вдоль кристаллографической оси c. Короткие контакты между анионами отсутствуют ввиду большого размера фосфониевых катионов.
Дихлоро-бис(трифенилфосфин)платина известна в цис- и транс-изомерных формах [34, 35], причем транс-изомер получают фотохимической изомеризацией комплекса цис-[PtCl2(PPh3)2] [31].
Структуры триклинной модификации транс-дихлоро-бис(трифенилфосфин)платины и орторомбической модификации, содержащей две молекулы дихлорметана, представлены в [31] и [35] соответственно.
Кристаллы комплекса транс-[PtCl2(PPh3)2] II ∙ ∙ CHCl3 имеют моноклинную модификацию. Атом платины комплекса II ∙ CHCl3 имеет плоско-квадратную координацию, объемные фосфиновые лиганды имеют транс-ориентации (рис. 2б). Длины связей и валентные углы комплекса II ∙ ∙ CHCl3 близки к аналогичным в транс-[PtCl2(PPh3)2] [34] и транс-[PtCl2(PPh3)2] ∙ 2CH2Cl2 [35]. Длины связей Pt–P равны 2.3224(17), (2.3163(11) Å [34], 2.3095(7) Å [35], Pt–Cl – 2.3119(18), 2.2997(11) Å [34], 2.3086(7) Å [35]. Атомы платины имеют искаженную плоско-квадратную геометрию: P(1)PtCl(1) 87.47(5)° (87.88(4)° [34], 86.62(3)° [35]) и P(1)PtCl(2) 92.52(5)° (92.12(4)° [34], 93.38(3)° [35]), транс-углы P(1)PtP(2) и Cl(1)PtCl(2) равны 180° (i 1 – x, 1 – y, 2 – z). Полученные значения несколько отличаются от подобных в цис-[PtCl2(PPh3)2], в котором присутствуют пространственные затруднения [31]. Длины связи Р–С варьируют в интервале 1.796(4)–1.854(4) Å, величина угла C(1)P(1)Pt 118.95(16)° значительно отклоняется от двух других углов (109.48(15)° и 113.41(17)°). Сольватная молекула хлороформа разупорядочена по четырем позициям с заселенностью 0.25. Одно фенильное кольцо разупорядочено по двум положениям со вкладами 0.5/0.5, два других фенильных кольца – по двум положениям с вкладами 0.48/0.52.
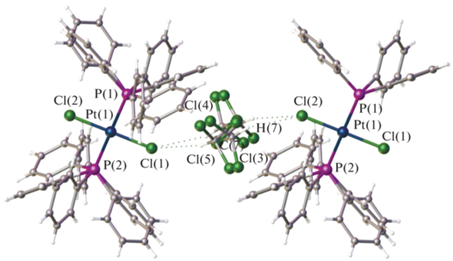
Кристаллическая структура комплекса II ∙ CHCl3 стабилизируется межмолекулярными контактами C–H∙··H 2.1 Å и C–H∙··C 2.3, 2.8 Å (рис. 4). Пространственная сетка кристалла образуется за счет водородных связей с участием атома водорода сольватной молекулы хлороформа и атома хлора молекулярного комплекса С–H(7)∙··Cl(2) (2.9 Å).
Таким образом, реакция гексахлороплатиноводородной кислоты с хлоридом (гидроксиметил)трифенилфосфония в смеси ацетонитрил–вода сопровождается восстановлением платины(IV) до платины(II). Образование смеси комплексных соединений платины(II): [Ph3PCH2OH]2[PtCl4] и транс-[PtCl2(PPh3)2] обусловлено превращением катиона, сопровождающееся элиминированием формальдегида, который выполняет роль восстановителя. Особенности строения полученных комплексов изучены с помощью РСА.
Показано, что комплекс тетрахлороплатинатa(II) (гидроксиметил)трифенилфосфония (I) неустойчив при растворении в диэтилсульфоксиде или при нагревании и переходит в молекулярный комплекс транс-дихлоро-бис(трифенилфосфин)платины (II).
Данные реакции являются новыми и легкими методами синтеза транс-дихлоро-бис(трифенилфосфин)платины, который используется в качестве промежуточного соединения в синтезе других платиновых комплексов.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Кулинчик T.В. // Медицинские технологии, оценка и выбор. 2013. Т. 1. С. 87.
Hizal S., Hejl M., Jakupec M.A. et al. // Inorg. Chem. Acta. 2019. V. 491. P. 76.
Varbanov H.P., Jakupec M.A., Roller A. et al. // J. Med. Chem. 2013. V. 56. P. 330.
Gramatica P., Papa E., Luini M. et al. // J. Biol. Inorg. Chem. 2010. V. 15. P. 1157.
Galanski M., Jakupec M.A., Keppler B.K. // Current Medicin. Chem. 2005. V. 12. P. 2075.
Johnstone T.C., Suntharalingam K., Lippard S.J. // Chem. Rev. 2016. V. 116. № 5. P. 3436.
Öğütçü H., Yetim N.K., Özkan E.H. // Pol. J. Chem. Tech. 2017. V. 19. P. 74.
Watanabe T., Takano M., Ogasawara A. et al. // Antimicrob. Agents. Chemother. 2000. V. 44. P. 2853.
Ura Y., Gao G., Bao F. et al. // Organometallics. 2004. V. 23. P. 4804.
Lukin R.Yu., Kuchkaev A.M., Sukhov A.V. et al. // Polymers. 2020. V. 12. № 10. P. 2174.
Meister T.K., Riener K., Gigler P. et al. // ACS Catal. 2016. V. 6. P. 1274.
Troegel D., Stohrer J. // Coordination Chemistry Reviews. 2011. V. 255. P. 1440.
Cotton F.A., Francis R. // J. Am. Chem. Soc. 1960. V. 82. P. 2986.
Meek D.W., Straub D.K., Drago R.S. // J. Am. Chem. Soc. 1960. V. 82. P. 6013.
Bokach N.A., Izotova Yu.A., Haukka M. // Acta Crystallogr. E. 2007. V. 63. P. 1261.
Popa A., Davidescu C., Trif R. et al. // React. Funct. Polym. 2003. V. 55. P. 151.
Masayo I., Tomoo I., Biyuuki K. Patent JP 2002308713. 2002.
Satoshi H., Hideto O. Patent JP 2000263706. 2000.
Galkina I.V., Egorova S. // Medical Almanac. Pharmacy. 2009. V. 8. P. 142.
Cambridge Crystallografic Datebase. Cambridge. Release. 2021.
Kuzniak-Glanowska E., Glosz D., Niedzielski G. et al. // Dalton Trans. 2021. V. 50. P. 170.
Albrecht C., Steinborn D., Lis T. // CSD Communication. 2019. 1895372.
Suslonov V.V., Eliseeva A.A., Novikov A.S. et al. // Cryst-EngComm. 2020. V. 22. № 24. P. 4180.
Rheingold A.L. CSD Communication. 2017. 1573034.
Ткачёва А.Р., Шарутин В.В., Шарутина О.К. и др. // Журн. общ. химии. 2019. Т. 89. № 89. С. 1414 (T-kacheva A.R., Sharutin V.V., Sharutina O.K. et al. // J. Gen. Chem. 2019. V. 89. P. 1816).
Черняев И.И. Синтез комплексный соединений металлов платиновой группы. М.: Наука. 1964. 340 с.
SMART and SAINT-Plus. Versions 5.0. Madison (WI, USA): Bruker AXS Inc., 1998.
SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Madison (WI, USA): Bruker AXS Inc., 1998.
Dolomanov O.V., Bourhis L.J., Gildea R.J. at al. // J. Ap-pl. Cryst. 2009. V. 42. P. 339.
Huang W., Xu J. // Synth. Commun. 2015. V. 45. P. 1777.
Johansson M.H., Otto S. // Acta Crystallogr. C. 2000. V. 56. P. 12.
Cordero B., Gomez V., Platero-Prats A.E. et al. // Dalton Trans. 2008. V. 21. P. 2832.
Mantina M., Chamberlin A.C., Valero R. et al. // J. Phys. Chem. A. 2009. V. 113. P. 5806.
Fun H.K., Chantrapromma S., Liu Y.C. et al. // Acta Crystallogr. E. 2006. V. 62. P. 1252.
Sunkel K., Bernhartzeder S., Birk U. // Z. Naturforsch. 2012. B. V. 67. P. 557.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия