Координационная химия, 2022, T. 48, № 7, стр. 414-421
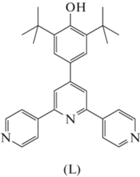
Генерирование долгоживущего феноксильного радикала в биядерном пивалатном комплексе меди(II) с 2,6-ди-трет-бутил-4-(3,5-бис(4-пиридил)пиридил)фенолом
В. Н. Дорофеева 1, А. В. Павлищук 1, 2, М. А. Кискин 3, *, Н. Н. Ефимов 3, В. В. Минин 3, К. С. Гавриленко 2, 4, С. В. Колотилов 1, В. В. Павлищук 1, И. Л. Еременко 3, 5
1 Институт физической химии им. Л.В. Писаржевского НАН Украины
Киев, Украина
2 Киевский национальный университет им. Т. Шевченко
Киев, Украина
3 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
4 Научно-производственное предприятие “Енамин”
Киев, Украина
5 Институт элементорганических соединений им. А.Н. Несмеянова PAH
Москва, Россия
* E-mail: mkiskin@igic.ras.ru
Поступила в редакцию 15.12.2021
После доработки 24.12.2021
Принята к публикации 27.12.2021
- EDN: WFEZPB
- DOI: 10.31857/S0132344X22070040
Аннотация
Синтезирован новый биядерный комплекс меди(II) состава Cu2(Piv)4(L)2, где Piv– = пивалат, L = = 2,6-ди-трет-бутил-4-(3,5-бис(4-пиридил)пиридил)фенол, и определена его молекулярная и кристаллическая структурa при температурах 160, 173 и 296 K (CCDC № 2144104, 2144105, 2144106 соответственно). Методом циклической вольтамперометрии найдено три необратимых процесса окисления в диапазоне потенциалов 0.5–1.2 В относительно потенциала пары Fc+/Fc. На основе анализа зависимости магнитной восприимчивости Cu2(Piv)4(L)2 от температуры показано, что в комплексе доминируют антиферромагнитные взаимодействия ионов Cu2+. Найдено, что окисление Cu2(Piv)4(L)2 при растирании с PbO2 или обработке твердого образца водным раствором K3[Fe(CN)6] приводит к образованию долгоживущего феноксильного радикала, зафиксированного методом ЭПР.
Комплексные соединения переходных металлов, в которых незначительные изменения химического состава при взаимодействии с другими веществами или при внешнем воздействии ведут к существенному изменению физических характеристик, рассматриваются как основа для создания новых молекулярных магнитов [1–3], мультифункциональных веществ и материалов с регулируемыми свойствами [5–10]. Такие материалы могут найти применение для создания магнитных материалов нового поколения, а также активных тел сенсоров, отклик которых обусловлен, например, изменением оптических, магнитных, электропроводящих характеристик [11–15], дисплеев [16], термоиндикаторых красок [17]. Для разработки таких материалов особенно интересны вещества, в которых такие изменения могут проходить обратимо. Одним из подходов к созданию таких систем является генерирование стабильных радикалов в комплексах переходных металлов путем окисления или восстановления органических фрагментов в составе лигандов. Появление радикала в комплексном соединении может влиять на его магнитные свойства, поскольку неспаренный электрон радикала повышает магнитную восприимчивость соединения за счет увеличения полного спина молекулы [18, 19] или уменьшать магнитную восприимчивость из-за антиферромагнитных взаимодействий с ионом металла [20, 21]. Кроме того, образование свободного радикала может проводить к изменению оптических свойств координационного соединения из-за собственной окраски радикала [22] или гашения люминесценции другого структурного элемента [23]. Исследование влияния строения координационных соединений на возможность генерирования у них свободных радикалов является актуальной задачей современной координационной и физической химии. Большой вклад в развитие координационной химии металл-радикальных систем внесли работы академика РАН В.И. Овчаренко с сотрудниками, в которых были установлены закономерности влияния строения комплексов 3d-металлов c нитронил-нитроксильными радикалами на их магнитные свойства [24, 25], а также были открыты аномальные изменения магнитных свойств, связанные со структурными перестройками отдельных представителей таких систем [26–28].
Ранее нами была показана возможность генерирования стабильного феноксильного радикала в координационных соединениях, содержащих фрагмент 2,6-ди-трет-бутилфенола – в комплексах с 2,6-ди-трет-бутил-4-карбоксифенолом [29], а также c 2,6-ди-трет-бутил-4-(3,5-бис(4-пиридил)пиридил)фенолом (L) [30, 31].
Цель настоящей работы – исследование строения и магнитных свойств биядерного пивалатного комплекса меди(II) с лигандом L и определение условий образования феноксильного радикала в составе такого соединения.
В работе описан синтез нового комплекса Cu2(Piv)4(L)2, где Piv– = пивалат, определена его молекулярная и кристаллическая структура при трех температурах и проанализированы изменения структуры при разных температурах (зависимости χMT от T), изучены электрохимические и магнитные свойства, а также исследована возможность генерирования долгоживущего радикала при облучении УФ-светом и окислении разными окислителями.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Новые соединения синтезировали на воздухе с коммерчески доступными реагентами (Укроргсинтез, Химлаборреактив) и растворителей (Укроргсинтез) без дополнительной очистки. Исходный комплекс I получали по известной методике [32]. Лиганд L синтезировали, как описано ранее [30].
Синтез Cu2(Piv)4(L)2 · 5.5H2O · 0.75CH3CN. Горячий раствор 70 мг (0.3 ммоля) Cu(Piv)2 · 2H2O в 20 мл CH3CN смешали с горячим раствором 100 мг (0.3 ммоля) L в 50 мл CH3CN. При охлаждении смеси образуются зеленые кристаллы, которые через 24 ч отфильтровывали, промывали 5 мл холодного CH3CN и высушивали на воздухе. Выход 140 мг (70%).
| Найдено, %: | C 62.0; | H 7.05; | N 6.27. |
| Для C79.5H111.25N6.75O15.5Cu2 | |||
| вычислено, %: | C 62.1; | H 7.30; | N 6.15. |
Состав массивного образца отличается от состава монокристаллов, которые хранили под маточным раствором и исследовали методом РСА. Зависимость магнитной восприимчивости от температуры измерена для массивного образца состава Cu2(Piv)4(L)2 · 5.5H2O · 0.75CH3CN.
РCA монокристаллов комплекса Cu2(Piv)4(L)2 · · 5CH3CN выполнен на дифрактометре Bruker Apex II (CCD-детектор, MoKα, λ = 0.71073 Å, графитовый монохроматор) [33]. Структуры расшифрованы прямыми методами и уточнены полноматричным МНК в анизотропном приближении для всех неводородных атомов. Атомы водорода при атомах углерода органических лигандов генерированы геометрически и уточнены в модели “наездника”. Расчеты проведены по комплексу программ SHELX [34] с использованием OLEX 2 [35]. В структуре комплекса, определенной при 296 K, присутствуют разупорядоченные молекулы растворителя, вклад которых в интенсивность отражений оценен с помощью программы SQUEEZE/PLATON [36]. В результате решения структуры комплекса, определенной при 173 K, в кристаллографически неэквивалентном фрагменте локализованы две молекулы CH3CN с фактором заполнения 1 и одна – с фактором заполнения 0.5; при 160 К – одна молекула CH3CN локализована с фактором заполнения 1 и две – с фактором заполнения 0.5. Такое отличие, очевидно, не связано с десольватацией монокристалла при охлаждении и может быть объяснено разупорядочением молекул CH3CN, связанном с их неравновесной переориентацией при быстром охлаждении монокристалла, и качеством конкретного кристалла. Одна из трет-бутильных групп в кристаллографически неэквивалентном фрагменте комплекса для всех экспериментов разупорядочена по двум позициям. Кристаллографические параметры приведены в табл. 1.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структуры Cu2(Piv)4(L)2 · · 5CH3CN
| Параметр | Значение | ||
|---|---|---|---|
| Температура, K | 160 | 173 | 296 |
| Брутто-формула | C86H110N10O10Cu2 | C88H113N11O10Cu2 | C78H98N6O10Cu2 |
| М | 1570.92 | 1611.97 | 1406.70 |
| Сингония | Моноклинная | ||
| Пр. гр. | P21/c | ||
| a, Å | 14.6615(13) | 14.5609(17) | 14.175(10) |
| b, Å | 27.534(3) | 27.392(3) | 27.59(2) |
| c, Å | 11.5852(11) | 11.7917(13) | 12.676(9) |
| β, град | 96.295(2) | 96.501(2) | 93.926(12) |
| V, Å3 | 4648.7(7) | 4672.9(9) | 4947(6) |
| Z | 2 | ||
| ρ(выч.), г/см3 | 1.122 | 1.146 | 0.944 |
| μ, мм–1 | 0.514 | 0.513 | 0.476 |
| F(000) | 1668 | 1712 | 1492 |
| Диапазон углов θ, град | 2.26–28.27 | 1.59–25.03 | 2.06–24.71 |
| Общее количество рефлексов | 38 766 | 30 788 | 31 468 |
| Независимых рефлексов (Rint) | 11 205 (0.1085) | 8249 (0.1853) | 8370 (0.1892) |
| Рефлексов с I > 2σ(I) | 4933 | 4417 | 2753 |
| R1 (I > 2σ(I))a | 0.0495 | 0.0586 | 0.0544 |
| wR2 (I > 2σ(I))b | 0.0983 | 0.1393 | 0.1117 |
| Остаточная электронная плотность (max/min), e/Å3 | 0.644/–0.410 | 0.837/–0.554 | 0.276/–0.261 |
Полный набор кристаллогафических параметров для Cu2(Piv)4(L)2 · 5CH3CN при разных температурах депонирован в Кембриджском банке структурных данных (№ 2144104 (160 K), 2144105 (173 K), 2144106 (296 K); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
Элементный C,H,N-анализ выполняли с использованием прибора Carlo Erba 1106. Спектры ЭПР измеряли на спектрометре Bruker Elexsys II (X-диапазон) при комнатной температуре.
Магнитные свойства мелкокристаллического порошка соединения Cu2(Piv)4(L)2 · 5.5H2O · · 0.75CH3CN измеряли с помощью автоматизированного комплекса измерения физических свойств PPMS-9 Quantum Design. Температурные зависимости намагниченности измеряли в интервале температур Т = 9–300 K во внешнем магнитном поле напряженностью H = 5 кЭ. Вводили поправку на магнитные свойства прободержателя, а также на диамагнетизм соединения с использованием схемы Паскаля [37].
Методом циклической вольтамперометрии (ЦВА) измерили циклические вольтамперограммы с использованием потенциостата ПИ-50 с платиновым рабочим и вспомогательным электродами и Ag|AgNO3 (0.1 М, CH3CN) как электродом сравнения. Для контроля потенциала электрода сравнения использовали раствор ферроцена (Fc), все потенциалы в тексте приведены относительно потенциала пары Fc+/Fc. Потенциал пары Fc+/Fc в условиях эксперимента составлял 35 мВ, что близко к ожидаемому значению 37 мВ [38]. Концентрация раствора Cu2(Piv)4(L)2 в CH3CN составляла 3 × 10–3 М, скорость развертки потенциала 100 мВ/с, другие параметры и концентрации указаны в тексте.
Эксперименты по генерированию радикалов проводили, как описано в [30]. Для генерирования радикалов использовали два метода – облучение УФ-светом и химическое окисление с использованием PbO2 и K3[Fe(CN)6]. В работе исследовали облучение твердых образцов комплекса I УФ-светом в кварцевой ампуле в атмосфере аргона, окисление диоксидом свинца твердого образца комплекса при растирании с добавлением капли CH2Cl2, окисление диоксидом свинца раствора комплекса в CH2Cl2 в атмосфере аргона (реакционную смесь фильтровали и измеряли спектр ЭПР фильтрата), окисление суспензии твердого Cu2(Piv)4(L)2 водным раствором K3[Fe(CN)6] в атмосфере аргона (реакционную смесь фильтровали и измеряли спектр ЭПР твердого остатка). Для облучения УФ-светом использовали газоразрядную лампу Philips TUV-6 (λмакс = 256 нм, полное поглощение УФ-излучения при λмакс < 185 нм). Концентрации растворов и другие параметры соответствовали данным, приведенным в [30].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Комплекс Cu2(Piv)4(L)2 получен путем взаимодействия пивалата меди(ІІ) с лигандом L при соотношении Cu : L = 1 : 1 в растворе в ацетонитриле. По данным монокристального РСА, это вещество кристаллизуется с шестью молекулами CH3CN на формульную единицу (не все молекулы CH3CN удалось надежно локализовать при уточнении кристаллических структур), но при высушивании на воздухе большая часть захваченного ацетонитрила меняется на воду.
Структура Cu2(Piv)4(L)2 · 5CH3CN установлена методом монокристального РСА при трех разных температурах – 160, 173 и 296 К. Это координационное соединение имеет молекулярное строение, молекулы Cu2(Piv)4(L)2 кристаллизуются в виде сольвата с пятью молекулами ацетонитрила. Молекула Cu2(Piv)4(L)2 центросимметрична и может быть описана как биядерный пивалат меди(II) со структурой “китайского фонарика”, у которого аксиальные позиции ионов меди заняты атомами азота пиридиновых групп из состава L (рис. 1). Соответственно, в каждом лиганде L только один “терминальный” фрагмент пиридина связан с ионом меди(II). Строение комплекса типично для биядерных карбоксилатов меди, содержащих лиганды с пиридиновыми группами, длины связей Cu–O и Cu–N лежат в ожидаемых пределах (табл. 2) [39, 40]. При уменьшении температуры длины связей ожидаемо сокращаются, а расстояние Cu…Cu уменьшается от 2.6211(18) (296 К) до 2.5883(7) Å (160 К).
Рис. 1.
Молекулярное строение комплекса Cu2(Piv)4(L)2 · 5CH3CN при 160 К. Атомы водорода не показаны.

Таблица 2.
Межатомные расстояния (Å) в Cu2(Piv)4(L)2 · 5CH3CN
| Расстояние | Температура, K | ||
|---|---|---|---|
| 160 | 173 | 296 | |
| Cu(1)–O(2) | 1.959(2) | 1.966(3) | 1.976(4) |
| Cu(1)–O(4) | 1.959(2) | 1.972(3) | 1.969(4) |
| Cu(1)–O(1) | 1.965(2) | 1.976(3) | 1.966(4 |
| Cu(1)–O(3) | 1.966(2) | 1.979(3) | 1.972(4) |
| Cu(1)–N(1) | 2.140(2) | 2.150(3) | 2.166(4) |
| Cu(1)…Cu(1) | 2.5883(7) | 2.5944(10) | 2.6211(18) |
В кристаллической решетке Cu2(Piv)4(L)2 · · 4CH3CN за счет водородных связей между атомами азота пиридиновых колец и гидроксогруппами ди-трет-бутилфенольных фрагментов соседних молекул формируются почти плоские 2D-слои “сотового” типа (рис. 2) с полостями размером около 19 Å (определено как кратчайшее расстояние между атомами водорода трет-бутильных групп, расположенных по разные стороны от центра полости). Наличие больших полостей в кристаллической решетке согласуется с найденными отличиями в сольватном составе массивного образца и монокристалла, который хранили под маточным раствором.
Рис. 2.
Фрагмент 2D-слоя в кристаллической решетке Cu2(Piv)4(L)2 · 5CH3CN, образованного водородными связями (показаны пунктиром). Рисунок сделан по данным РСА при 160 К. Молекулы CH3CN не показаны.

Соседние 2D-слои в кристаллической решетке Cu2(Piv)4(L)2 · 4CH3CN связаны π-стекинг-взаимодействиями между ароматическими циклами лигандов (рис. 3). Такие слои располагаются в плоскостях, параллельных векторам b и (a – c) и перпендикулярно к вектору (a + c). При уменьшении температуры с 296 до 160 К параметр ячейки b практически не меняется, тогда как параметр a увеличился на 3%, а параметр c уменьшился на 9%. Такие изменения параметров связаны с переориентацией молекул в 2D-слоях, которая наиболее существенно выражается в сжатии кристалла вдоль вектора (a + c). Так, ближайшие контакты между атомами в ароматических циклах, участвующих в π-стекинг-взаимодействиях, уменьшаются с 3.44 Å (при 296 К) до 3.31 Å (при 160 К) – это уменьшение отражается в сжатии кристалла в направлении (a + c). Расстояния N…O, характеризующие межмолекулярные водородные связи в пределах 2D-слоя, практически не меняются (увеличиваются от 2.70 до 2.74 Å), что отражается в практической неизменности параметра b.
Рис. 3.
Взаимное расположение соседних 2D-слоев в кристаллической решетке Cu2(Piv)4(L)2 · 4CH3CN (pисунок сделан по данным РСА при 160 К. Молекулы CH3CN не показаны).
Значение χMT (χM = молярная магнитная восприимчивость на формульную единицу Cu2) Cu2(Piv)4(L)2 · 5.5H2O · 0.75CH3CN при комнатной температуре равняется 0.59 см3 К моль–1, что существенно ниже значения, ожидаемого для системы, состоящей из двух невзаимодействующих ионов меди(II) со спинами S = 1/2 (0.75 см3 К моль–1 при g = 2.0). Существенно заниженное значение, по сравнению с ожидаемым, может объясняться сильными антиферромагнитными взаимодействиями в биядерном фрагменте Cu2(Piv)4, что типично для карбоксилатных димеров меди(II) такого типа [41]. При 2 К величина χMT составляет 0.006 см3 К моль–1; низкое значение χMT может быть признаком отсутствия металлсодержащей парамагнитной примеси. Необычная температурная зависимость χMT в диапазоне температур от 2 до 300 К (рис. 4), а именно завышенные значения χMT по сравнению с зависимостью, ожидаемой для биядерного комплекса меди(II), может быть описана как суперпозиция χMT биядерного фрагмента (Cu2) и кислорода, адсорбированного в порах кристаллической решетки комплекса [42].
Рис. 4.
Зависимость χMT для Cu2(Piv)4(L)2 · 5.5H2O · · 0.75CH3CN от температуры (точки) и кривая, рассчитанная с приведенными в тексте параметрами.

Для расчета параметров обменных взаимодействий в димерном фрагменте Cu2(Piv)4(L)2 была использована модель, основанная на гамильтониане (1), и было сделано предположение, что обменные взаимодействия между соседними блоками пренебрежимо малы [43]:
Применение такого подхода позволило описать экспериментальные данные в диапазоне температур 300–85 K с параметрами J = –182(5) см–1, g = 2.0 (фиксированное), tip = 8.2(5) × 10–4 (R 2 = = 2.0 × 10–4, R2 = Σ(χMTрасч – χMTэксп)2/Σ(χMTэксп)2). Учет межмолекулярных взаимодействий с использованием модели молекулярного поля не привел к снижению R2.
Методом ЦВА установлено, что в растворах лиганда L в CH3CN в диапазоне потенциалов от ‒1 до 2.3 В, в ДМФ в диапазоне потенциалов от ‒2 до 1.9 В, в CH2Cl2 в диапазоне потенциалов от 0 до 3 В отсутствуют пики каких-либо окислительно-восстановительных процессов (во всех случаях с(L) = 9 × 10–3 моль/л, фоновый электролит 0.1 М NEt4BF4, платиновый электрод, потенциалы приведены относительно пары относительно пары Fc+/Fc). В аналогичных экспериментах при исследовании раствора L в CH3CN с фоновым электролитом NaClO4 (с = 0.1 моль/л) в диапазоне потенциалов от 0 до 2.5 В, а также при проведении эксперимента с использованием платинового электрода с нанесенным L (электролит – 0.1 М раствор NEt4BF4 в CH3CN) в диапазоне потенциалов от –1 до 2.3 В проявлений электрохимической активности L также не найдено.
На циклической вольтамперограмме раствора Cu2(Piv)4(L)2 в CH3CN найдены три последовательных слабовыраженных анодных процесса при потенциалах 0.5, 0.9 и 1.2 В (относительно потенциала пары Fc+/Fc), первый из которых на основании сравнения с аналогичными системами может быть отнесен к необратимому процессу окисления L до феноксила [29]. Отнесение двух последующих процессов неоднозначно – по аналогии с результатами исследования редокс-свойств карбоксилатных димеров меди(II) эти процессы могут относиться к последовательным процессам окисления двух ионов Cu2+ до Cu3+ в составе Cu2(Piv)4 [44], однако не исключено, что они могут быть связаны с необратимым окислением феноксила до хинона и окисления иона Cu2+ до Cu3+ соответственно.
Генерирование долгоживущих феноксильных радикалов при облучении раствора L или окислении L в растворе суспензией PbO2 описано нами ранее [30]. Для исследования возможности генерирования феноксильных радикалов при окислении Cu2(Piv)4(L)2 были измерены спектры ЭПР образцов после облучения на воздухе или в вакууме, а также спектры реакционных смесей, полученных путем растирания этого комплексного соединения с PbO2. Установлено, что описанные выше методы не приводят к образованию феноксила (как минимум количество феноксила недостаточно для детектирования методом ЭПР). В то же время сигналы в спектрах ЭПР с g = 2.00, которые могут быть отнесены к феноксильным радикалам, были найдены в растворе, полученном после обработки раствора Cu2(Piv)4(L)2 в СH2Cl2 суспензией PbO2 (рис. 5), а также в твердом образце, полученном в результате интенсивного перемешивания суспензии Cu2(Piv)4(L)2 с водным раствором K3[Fe(CN)6]. Отметим, что в растворах биядерных пивалатов меди(II), в отличие от моноядерных комплексов, сигнал ЭПР ионов Cu2+ не наблюдается из-за быстрой релаксации комплекса, ведущей к существенному уширению сигнала ЭПР [45].
Cигнал в спектре ЭПР образца комплекса после обработки раствором K3[Fe(CN)6] был повторно зафиксирован в течение как минимум месяца. Эти результаты согласуются с опубликованными ранее результатами окисления комплексов кобальта(II) с L – обработка твердых образцов [Co(L)Cl2]n, [Co3(L)2(OH)(Piv)5]n и Co3(H2O)4(L)2Cl6 раствором K3[Fe(CN)6] приводила к появлению устойчивого сигнала ЭПР в спектрах, который мог быть отнесен к феноксильному радикалу [30]. Как и в случае описанных ранее комплексов кобальта, связывание L в составе координационного соединения меди(II) ведет к заметному повышению стабильности радикала (по сравнению с радикалом, полученным из L в растворе), что можно объяснить меньшей скоростью реакций, ведущих к его гашению в твердом образце. В то же время окисление твердого образца, по-видимому, ведет к генерированию феноксильных радикалов только на поверхности кристаллов.
Таким образом, при взаимодействии пивалата меди с L получен комплекс Cu2(Piv)4(L)2 (I) молекулярного строения. Из-за особенностей упаковки в кристаллической решетке комплекса I образуются поры, что проявляется как в способности этого соединения захватывать растворитель, так и в проявлении вклада захваченного кислорода на зависимости χMT от T. Установлено, что L в составе Cu2(Piv)4(L)2 может окисляться как электрохимически, так и химически, при этом электрохимическое окисление необратимо. При химическом окислении L образуется феноксильный радикал, устойчивость которого в твердом образце заметно превышает стабильного аналогичного радикала, генерированного в растворе L.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Rinehart J.D., Long J.R. // Chem. Sci. 2011. V. 2. P. 2078.
Craig. G.A., Murrie M. // Chem. Soc. Rev. 2015. V. 44. P. 2135.
Liu J.-L., Chen Y.-C., Tong M.-L. // Chem. Soc. Rev. 2018. V. 47. P. 2431.
D’Alessandro D.M. // Chem. Commun. 2016. V. 52. P. 8957.
Falcaro P., Ricco R., Doherty C.M. et al. // Chem. Soc. Rev. 2014. V. 43. P. 5513.
DeGayner J.A., Jeon I.-R., Sun L. et al. // J. Am. Chem. Soc. 2017. V. 139. P. 4175.
Feng T., Ye Y., Liu X. et al. // Angew. Chem. Int. Ed. 2020. V. 59. P. 21752.
Calbo J., Golomb M.J., Walsh A. // J. Mater. Chem. A. 2019. V. 7. P. 16571.
Sasaki K., Yamate H., Yoshino H. et al. // Chem. Commun. 2020. V. 56. P. 12961.
Li H.-Y., Zhao S.-N., Zang S.-Q. et al. // Chem. Soc. Rev. 2020. V. 49. P. 6364.
Li Z., Wang G., Ye Y. et al. // Angew. Chem. Int. Ed. 2019. V. 58. P. 18025.
Espallargas M.G., Coronado E. // Chem. Soc. Rev. 2018. V. 47. P. 533.
Zhou Y., Yu F., Su J. et al. // Angew. Chem. Int. Ed. 2020. V. 59. P. 18763.
Pasha S.S., Yadav H.R., Choudhury A.R. et al. // J. Mater. Chem. C. 2017. V. 5. P. 9651.
García-Valdivia A.A., Pérez-Yáñez S., García J.A. et al. // Sci. Rep. 2020. V. 10. P. 8843.
Wang Z., Yuan X., Cong S. et al. // ACS Appl. Mater. Interfaces. 2018. V. 10. P. 15065.
Kragt A.J.J., Zuurbier N.C.M., Broer D.J. et al. // ACS Appl. Mater. Interfaces. 2019. V. 11. P. 28172.
Shimizu D., Ide Y., Ikeue T. et al. // Angew. Chem. Int. Ed. 2019. V. 58. P. 5023.
Woods T.J., Stout H.D., Dolinar B.S. et al. // Inorg. Chem. 2017. V. 56. P. 12094.
Kumar P., SantaLucia D.J., Kaniewska-Laskowska K. et al. // Inorg. Chem. 2020. V. 59. P. 16178.
Alexandropoulos D.I., Vignesh K.R., Xie H. et al. // Chem. Commun. 2020. V. 56. P. 9122.
Liu J. // Dyes Pigments. 2019. V. 160. P. 476.
Tansakul C., Lilie E., Walter E.D. et al. // J. Phys. Chem. C. 2010. V. 114. P. 7793.
Tretyakov E.V., Ovcharenko V.I. // Russ. Chem. Rev. 2009. V. 78. P. 971.
Ovcharenko V. // In Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds / Ed. Hicks R.G. John Wiley and Sons, 2010. P. 461.
Ovcharenko V.I., Maryunina K.Yu., Fokin S.V. et al. // Russ. Chem. Bul. 2004. V. 53. P. 2406.
Fedin M., Veber S., Gromov I. et al. // Inorg. Chem. 2007. V. 46. P. 11405.
Romanenko G.V., Maryunina K.Y., Bogomyakov A.S. et al. // Inorg. Chem. 2011. V. 50. P. 6597.
Yakovenko A.V., Kolotilov S.V., Addison A.W. et al. // Inorg. Chem. Commun. 2005. V. 8. P. 932.
Dorofeeva V.N., Pavlishchuk A.V., Kiskin M.A. et al. // ACS Omega. 2019. V. 4. P. 203.
Dorofeeva V.N., Lytvynenko A.S., Kiskin M.A. et al. // Book of abstracts of VI International Conference “High-Spin Molecules and Molecular Magnets”, Rostov on Don (Russia), 2012. P. 92.
Денисова Т.О., Амельченкова Э.В., Прусс И.В. и др. // Журн. неорган. химии. 2006. Т. 7. С. 1098.
SMART (control) and SAINT (integration) Software. Version 5.0. Madison (WI, USA): Bruker AXS Inc., 1997.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Crystallogr. 2009. V. 42. P. 339.
Spek A.L. PLATON. A Multipurpose Crystallographic Tool. Utrecht (The Netherlands): Utrecht University, 2006.
Kahn O. Molecular Magnetism. VCH Publishers Inc. Weinheim, 1993.
Pavlishchuk V.V., Addison A.W. // Inorg. Chim. Acta. 2000. V. 298. P. 97.
Dorofeeva V.N., Mishura A.M., Lytvynenko A.S. et al. // Theor. Exp. Chem. 2016. V. 52. P. 111.
Полунин Р.А., Бурковская Н.П., Колотилов С.В. и др. // Изв. АН. Сер. хим. 2014. Т. 1. С. 252.
Reger D.L., Debreczeni A., Smith M.D. et al. // Inorg. Chem. 2012. V. 51. P. 1068.
Kawamura K., Makishima Y., Ochiai Y. // Carbon – Sci. Tech. 2009. V. 2. P. 73.
Калинников В.Т., Ракитин Ю.В. Введение в магнетохимию. Метод статической магнитной восприимчивости в химии. М.: Наука, 1980. 302 с.
Fomina I., Dobrokhotova Z., Aleksandrov G. et al. // Polyherdron. 2010. V. 29. P. 1734.
Carrington A., McLachlan A.D. // Introduction to Magnetic Resonance: With Applications to Chemistry and Chemical Physics (Science Books). Chapman and Hall Ltd., 1979. 266 p.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия