Координационная химия, 2022, T. 48, № 7, стр. 422-427
Ацетилацетонатный комплекс Pt(II) на основе 5-(3-аминофенил)-2-(2-тиенил)пиридина, синтез, кристаллическая структура, фотофизические свойства
Д. С. Копчук 1, 2, *, П. А. Слепухин 1, 2, О. С. Тания 1, 2, А. П. Криночкин 1, 2, Г. В. Зырянов 1, 2, О. Н. Чупахин 1, 2
1 Уральский федеральный университет
Екатеринбург, Россия
2 Институт органического синтеза, УрО РАН
Екатеринбург, Россия
* E-mail: dkopchuk@mail.ru
Поступила в редакцию 15.01.2022
После доработки 19.01.2022
Принята к публикации 27.01.2022
- EDN: XDLBEB
- DOI: 10.31857/S0132344X22070052
Аннотация
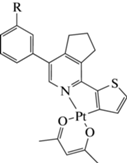
На основе аминофенилзамещенного 2-(2-тиенил)пиридина (L) синтезирован ацетилацетонатный комплекс Pt(II) [(L)Pt(Acac)] и изучены его фотофизические свойства, проведено их сравнение с таковыми для аналогичного комплекса, не имеющего в составе лиганда аминогруппы. Структура комплекса подтверждена методом рентгеноструктурного анализа (CIF file CCDC № 2144689), а также данными ЯМР 1Н и 13С, масс-спектрометрии (электроспрей) и элементного анализа.
Интерес к циклометаллированным комплексам платины(II) обусловлен проявляемыми ими полезными свойствами, в частности люминесцентными [1, 2]. Эти комплексы могут использоваться для создания OLED [3] и жидкокристаллических материалов [4]. Следует отметить их антираковую активность [5], а также использование для фотогенерации синглетного кислорода [6].
Объектом исследования в рамках данной работы являются комплексы Pt(II) на основе 2-(2-тиенил)пиридинов, имеющие ацетилацетон в качестве вспомогательного лиганда. Эти комплексы интересны своими фотофизическими характеристиками [7, 8], применением для создания устройств хранения информации [9], реагентов для фотогенерации синглетного кислорода [10] и т.д. Также следует отметить применение такого рода комплексов для создания фосфоресцентных меток [11].
Ранее [12] были изучены фотофизические свойства комплексов Pt(II) такого типа на основе 5-арил-2-(2-тиенил)пиридинов, которые показали время жизни люминесценции в диапазоне 17–21 мкс и квантовый выход люминесценции до 28%. Дальнейшая функционализация ароматических заместителей пиридина позволяет вводить различные функциональные группы, способные связываться с биологическими молекулами и действовать как линкеры, сохраняя при этом излучающий центр вдали от биологического субстрата. В частности, ранее это было показано на примере введения в состав арильного заместителя карбоксильной группы [11].
В настоящей статье мы иллюстрируем возможности создания предшественника фосфоресцентной метки при введении в арильный заместитель пиридина аминогруппы (которая интересна возможностью превращения в изотиоцианатную [13]) для получения аминореактивного люминесцентного красителя, а именно, мы показываем возможность получения аминофенилсодержащего комплекса Pt(II) на основе 5-арил-2-(2-тиенил)пиридина, а также сообщаем результаты изучения его фотофизических свойств. Следует отметить, что ранее в литературе не было описано примеров получения подобных комплексов на основе 2-(2-тиенил)пиридинов, содержащих ароматическую аминогруппу.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР 1H и 13С регистрировали на спектрометре Bruker Avance-400 (400 МГц), внутренний стандарт – SiMe4. Масс-спектры (тип ионизации – электроспрей) записывали на приборе MicrOTOF-Q II фирмы Bruker Daltonics (Бремен, Германия). Элементный анализ выполняли на CHN-анализаторе РЕ 2400 II фирмы Perkin Elmer. В качестве сорбента для колоночной хроматографии использовали силикагель фирмы Macherey-Nagel, LOT045334009 (0.040–0.063 мм, 230–400 mesh). Тонкослойную хроматографию выполняли на алюминиевых пластинах, покрытых силикагелем Silica gel on TLC Alu foils 91835. Исходный 3-(1-(2-тиенил)-6,7-дигидро-5H-циклопента[c]пиридин-4-ил)анилин (лиганд L) получали по описанной методике [14]. Все остальные реагенты коммерчески доступны.
УФ-спектры поглощения регистрировали на спектрофотометре Lambda 45 (Perkin Elmer). Спектры люминесценции регистрировали с помощью спектрофлуориметра Fluoromax-4 (Horiba) с источником возбуждения NanoLED (без предварительной деаэрации). Абсолютные квантовые выходы измеряли на спектрофлуориметре Fluoromax-4 (Horiba) согласно описанному ранее методу [15].
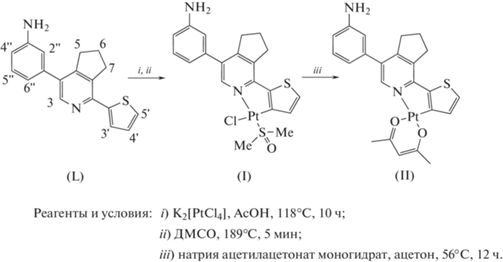
Синтез комплекса [(L)Pt(DMSO)(Cl)] (I). В 30 мл уксусной кислоты растворяли тиенилпиридин L (200 мг, 0.68 ммоль) и добавляли раствор K2[PtCl4] (280 мг, 0.68 ммоль) в воде (5 мл). Смесь перемешивали при кипячении в течение 10 ч в атмосфере аргона. Образовавшийся в ходе реакции мостиковый димерный интермедиат отфильтровывали, промывали уксусной кислотой и высушивали в вакууме. Затем к нему добавляли ДМСО (2 мл), реакционную смесь кипятили в течение 5 мин, охлаждали до комнатной температуры и добавляли 15 мл воды. Образовавшийся осадок отфильтровывали, промывали водой, высушивали в вакууме и растворяли в 10 мл хлороформа. Нерастворимые примеси отфильтровывали. После упаривания маточного раствора при пониженном давлении получили целевой продукт, использованный на следующей стадии без дополнительной очистки. Выход 200 мг (0.33 ммоль, 49%). Тпл > 250°C.
ЯМР 1Н (СDCl3, δ, м.д.): 2.22 (м., 2Н, СН2СН2СН2), 3.16 (м., 4Н, СН2СН2СН2), 3.63 (с., 6Н, СН3), 3.81 (уш.с., 2Н, NH2), 6.72 (м., 2Н, Н-2′′,4′′), 6.80 (м., 1Н, Н-6′′), 7.22 (д.д., J = 7.6 Гц, 1Н, Н-5′′), 7.48 (д., J = 5.2 Гц, 1Н, Н-5′), 7.73 (д., J = 5.2 Гц, 1Н, Н-4′), 9.20 (с., 1Н, Н-3).
Синтез комплекса [(L)Pt(Acac)] (II). В 50 мл ацетона вносили смесь комплекса I (170 мг, 0.28 ммоль) и моногидрата ацетилацетоната натрия (400 мг, 2.8 ммоль). Полученную смесь кипятили в течение 12 ч. Ацетон удаляли при пониженном давлении, образовавшийся остаток очищали колоночной хроматографией (Rf = 0.35, дихлорметан (ДХМ)). Полученный продукт высушивали в вакууме. Выход 95 мг (0.16 ммоль, 57%). Тпл > 250°C.
ЯМР 1Н (СDCl3; δ, м.д.): 1.95 и 1.97 (оба с., 3Н, СН3), 2.20 (м., 2Н, CH2-6), 3.08 (т., J = 7.4 Гц, 2Н, CH2-7), 3.21 (т., J = 7.4 Гц, 2Н, CH2-5), 3.78 (уш.с., 2Н, NH2), 5.46 (с., 1Н, СН), 6.71 (м., 1Н, Н-4′′), 6.75 (д.д., J = 1.8 Гц, 1Н, Н-2′′), 7.25 (м., 2Н, Н-6′′,5′), 7.57 (д., J = 4.8 Гц, 1Н, Н-4′), 8.65 (м., 1Н, Н-3). ЯМР 13C (СDCl3; δ, м.д.): 24.8, 26.7, 28.2, 31.7, 33.0, 100.0, 102.4, 114.5, 114.9, 118.7, 128.3, 129.6, 129.8, 133.3, 138.1, 138.5, 142.2, 144.7, 146.8, 154.9, 158.0, 183.7, 185.3. ESI-MS, m/z (Iотн, %), найдено: 583.11 (1.89), 584.11 (0.58), 585.11 (77), 586.11 (100), 587.11 (85), 588.11 (22), 589.11 (22), 590.12 (5.4) (М + Н)+; рассчитано: 583.11 (1.84), 584.11 (0.49), 585.11 (77), 586.11 (100), 587.11 (87), 588.11 (24), 589.11 (23), 590.12 (5.7).
Кристаллы комплекса II, пригодные для РСА, получали в результате медленного упаривания его растворa в CDCl3.
РСА комплекса II проведен на оборудовании ЦКП “Спектроскопия и анализ органических соединений” ИОС УрО РАН. Эксперимент проведен для пластинчатого бурого кристалла 0.25 × 0.13 × × 0.03 мм на автоматическом четырехкружном дифрактометре с CCD-детектором Xcalibur 3 по стандартной процедуре (МоKα-излучение, графитовый монохроматор, ω-сканирование с шагом 1°) при Т = 295(2) К. Введена эмпирическая поправка на поглощение. Структура определена прямым статистическим методом и уточнена полноматричным МНК по F 2 в анизотропном приближении для всех неводородных атомов. Атомы водорода помещены в геометрически рассчитанные положения и уточнены в изотропном приближении в модели “наездника”. Все расчеты проведены в программной оболочке Olex [16] c использованием программного пакета SHELX [17].
Полный набор рентгеноструктурных параметров структуры II депонирован в Кембриджском банке структурных данных (CCDC № 2144689; deposit@ccdc.cam.uk).
Основные кристаллографические параметры соединения II: кристалл ромбический, пр. гр. Pbca, a = 7.2592(3), b = 25.1219(18), c = 26.115(2) Å, μ = = 6.005 мм–1. На углах 2.85° < θ < 26.37° собрано 23 796 отражений, из них независимых 4851 (Rint = = 0.0839), в том числе 1943 с I > 2σ(I). Окончательные параметры уточнения: R1 = 0.1114, wR2 = 0.1000 (по всем отражениям), R1 = 0.0395, wR2 = 0.0944 (по отражениям с I > 2σ(I)) при факторе добротности GООF = 1.002. Пики остаточной электронной плотности 1.198/–0.521 е Å–3.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исходный лиганд L был получен по ранее описанному методу [14] путем применения “1,2,4-триазиновой” методологии [18]. Циклометаллированный комплекс II был получен согласно протоколу, ранее описанному для схожих лигандов [12]. Так, мостиковый димерный комплекс, полученный взаимодействием соединения L и K2[Pt-Cl4], был превращен в растворимый диметилсульфоксидный комплекс I кратковременным нагреванием в ДМСО. Целевой ацетилацетонатный комплекс II был получен при взаимодействии I с ацетилацетонатом натрия; очистка осуществлена с использованием колоночной хроматографии (схема 1 ).
Наличие незащищенной аминогруппы не влияло на направление описанного выше синтеза.
Схема 1 .
Структура полученного комплекса подтверждена данными спектров ЯМР 1Н, 13С, масс-спектрометрии (электроспрей) и элементного анализа. Кроме этого, удалось получить кристаллы хелата II, пригодные для РСА, и изучить его строение этим методом.
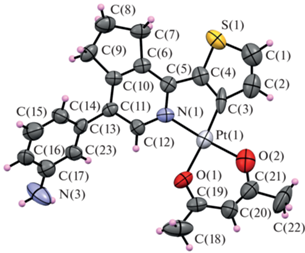
В Кембриджской базе структурных данных на начало 2022 г. имеются сведения о 80 структурах с фрагментом (пиридин-2-ил)-тиен-3-ил платины, в том числе 20 структур с 1,3-дикетонатным хелатным фрагментом. Детальное рассмотрение структуры и свойств данных комплексов проведено в работах [11, 19–21]. По данным РСА, соединение кристаллизуется в центросимметричной пространственной группе ромбической системы. Общий вид молекулы нейтрального комплекса представлен на рис. 1. Атом платины имеет обычную для подобных комплексов искаженную квадратную конфигурацию с плоским расположением неводородных атомов 1,3-дикетонатного и пиридинилтиенильного фрагментов (рис. 1). Асимметрия длин связей 1,3-дикетонатного хелатного цикла вопреки ожиданиям довольно хорошо выражена. При этом атом О(1) (O–C 1.27(1) Å) оказывается включен в состав карбонильного фрагмента, а атом О(2) (O–C 1.34(1) Å) входит в состав енольного, что также хорошо согласуется с асимметрией длин связей Pt–O (2.055(7) и 1.994(8) Å для О(1) и О(2) соответственно). К сожалению, довольно низкое качество дифракционных данных, обусловленное малыми размерами кристалла и низкой интенсивностью дифракционной картины, не позволяет дать более точную оценку геометрических характеристик молекулы.
Азагетероциклический фрагмент комплекса неплоский. В частности, циклопентиленовый фрагмент имеет конформацию “конверт” с отклонением атома С(8) на 0.2 Å от плоскости пиридинового кольца. 3-Аминофенильный фрагмент развернут относительно плоскости пиридинового кольца на угол 50°. Возможно, образуются укороченные контакты, строгое доказательство наличие которых требует дополнительных исследований.
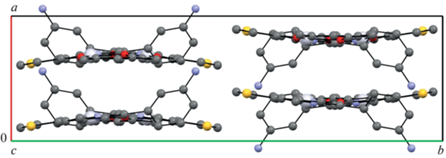
В кристалле молекулы образуют стопки (рис. 2 и 3), при этом ни специфических контактов типа металл–металл, ни существенно укороченных межатомных π–π-контактов в кристалле не наблюдается. Тем не менее относительно небольшое расстояние от центрального атома платины до плоскости пиридинового цикла соседней молекулы (3.54 Å) допускает возможность возникновения специфических взаимодействий внутри стопки молекул. Между стопками молекул имеются полости (рис. 3), заполненные растворителем. Ввиду сложности локализации атомов растворителя из-за больших атомных тепловых параметров, растворитель в модель включен в виде разупорядоченных в позиции 2 молекул воды с коэффициентами заселенности 0.5. Подобная модель дает удовлетворительные результаты по параметру сходимости, тепловым параметрам и геометрии межмолекулярных взаимодействий, но не исключает возможное нахождение в полостях кристалла иных малых молекул сольвента (например, МеОН или СН3СN). Окончательно данный вопрос может быть решен только при проведении низкотемпературного эксперимента с кристаллом более высокого качества.
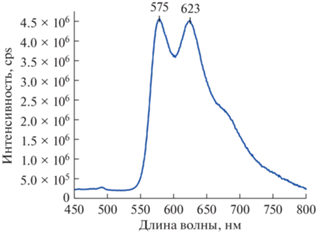
Мы также изучили фотофизические свойства нового комплекса II. Так, в растворе дихлорметана он показывает поглощение и испускание, характерное для ранее описанных комплексов на основе подобных лигандов [12] (табл. 1, рис. 4 и 5). Однако введение в состав ароматического заместителя лиганда аминогруппы привело к заметному падению квантового выхода и времени жизни люминесценции (его среднее значение составляет 2935.03 нс со сходимостью 1.25; измерения проводили при длине волны возбуждения 425 нм с максимумом эмиссии 575 нм). Обнаруженная закономерность совпадает с наблюдаемой ранее при введении ароматической аминогруппы в состав европиевых комплексов на основе 5-арил-2,2'-бипиридинов, имеющих остаток DTTA в положении С(6′) [22], несмотря на различные механизмы тушения люминесценции.
Таблица 1.
Фотофизические свойства комплекса II в сравнении с ранее описанным аналогом
 |
R | Максимум поглощения в ДХМ, нм | Максимум испускания в ДХМ, нм | Квантовый выход, % | Время жизни люминесценции, мкс |
| Н [12] | 255, 284, 302, 331, 361, 405, 426 | 575, 625 | 28 | 18 | |
| NH2 | 254, 331, 405, 425 | 575, 623 | <0.1 | 2.94 |
Таким образом, мы впервые синтезировали ацетилацетонатный комплекс Pt(II) на основе аминофенилзамещенного 2-(2-тиенил)пиридина; ароматическая аминогруппа при этом может быть рассмотрена в качестве предшественника линкера для биоконъюгации. Изучены фотофизические свойства нового комплекса, а также методом РСА его кристаллическая структура.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Yoshida M., Kato M. // Coord. Chem. Rev. 2020. V. 408. P. 213194.
Huo S., Carroll J., Vezzu D.A.K. // Asian J. Org. Chem. 2015. V. 4. № 11. P. 1210.
Haque A., Moll H.E., Alenezi K.M. et al. // Materials. 2021. V. 14. № 15. P. 4236.
Spencer M., Santoro A., Freeman G.R. et al. // Dalton Trans. 2012. V. 41. № 47. P. 14244.
Cutillas N., Yellol G.S., de Haro C. et al. // Coord. Chem. Rev. 2013. V. 257. № 19–20. P. 2784.
Djurovich P.I., Murphy D., Thompson M.E. et al. // Dalton Trans. 2007. № 34. P. 3763.
Shafikov M.Z., Kozhevnikov D.N., Bodensteiner M. et al. // Inorg. Chem. 2016. V. 55. № 15. P. 7457.
Usuki T., Uchida H., Omoto K. et al. // J. Org. Chem. 2019, V. 84. № 17. P. 10749.
Poh W.C., Au-Yeung H.-L., Chan A.K.-W. et al. // Chem. Asian J. 2021. V. 16. № 22. 3669.
Shafikov M.Z., Suleymanova A.F., Kutta R.J. et al. // J. Mater. Chem. C. 2021. V. 9. № 17. P. 5808.
Suleymanova A.F., Kozhevnikov D.N., Prokhorov A.M. // Tetrahedron Lett. 2012. V. 53. № 39. P. 5293.
Kozhevnikov D.N., Kozhevnikov V.N. Ustinova M.M. et al. // Inorg. Chem. 2009. V. 48. № 9. P. 4179.
Hovinen J., Guy P.M. // Bioconjugate Chem. 2009. V. 20. № 3. P. 404.
Kopchuk D.S., Khasanov A.F., Kovalev I.S. et al. // Mendeleev Commun. 2013. V. 23. № 4. P. 209.
Porrès L., Holland A., Pålsson L.-O. et al. // J. Fluoresc. 2006. V. 16. № 2. P. 267.
CrysAlisPro. Agilent Technologies. Version 1.171.39.38a.
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. № 1. P. 3.
Прохоров А.М., Кожевников Д.Н. // Химия гетероцикл. соединений. Т. 48. № 8. C. 1237 (Prokhorov A.M., Kozhevnikov D.N. // Chem. Heterocycl. Compd. 2012. V. 48. № 8. P. 1153). https://doi.org/10.1007/s10593-012-1117-9
Hao Z., Zhang K., Chen K. et al. // Chem. Asian J. 2020. V. 15. № 19. P. 3003.
Kumar G.R., Thilagar P. // Inorg. Chem. 2016. V. 55. № 23. P. 12220.
Venkatesan K., Kouwer P.H.J., Yagi S. et al. // J. Mater. Chem. 2008. V. 18. № 4. P. 400.
Prokhorov A.M., Kozhevnikov V.N., Kopchuk D.S. et al. // Tetrahedron. 2011. V. 67. № 3. P. 597.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия