Координационная химия, 2022, T. 48, № 8, стр. 473-482
Пятикоординационные комплексы трифенилолова(IV) с бидентатными N-фенил-о-иминофенолами
Н. А. Протасенко 1, С. В. Барышникова 1, А. В. Черкасов 1, А. И. Поддельский 1, *
1 Институт металлоорганической химии им. Г.А. Разуваева РАН
Нижний Новгород, Россия
* E-mail: aip@iomc.ras.ru
Поступила в редакцию 20.12.2021
После доработки 30.12.2021
Принята к публикации 11.01.2022
- EDN: AGSXXR
- DOI: 10.31857/S0132344X22070076
Аннотация
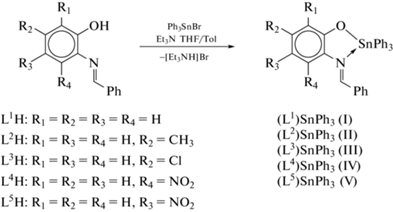
Взаимодействие функционализированных о-иминофенолов L1H–L5H (L1H = 2-бензилиденаминофенол, L2H = 2-бензилиденамино-5-метилфенол, L3H = 2-бензилиденамино-5-хлорфенол, L4H = = 2-бензилиденамино-3-нитрофенол, L5H = 2-бензилиденамино-4-нитрофенол) с бромидом три-фенилолова(IV) в присутствии основания позволяет получить соответствующие комплексы трифенил-олова I–V с о-иминофенолятными лигандами общего вида (Ln)SnPh3. Молекулярное строение комплексов II и III в кристаллическом виде установлено с помощью РСА (CIF files CCDC № 2131549 (I), 2131548 (II)).
Комплексы металлов с основаниями Шиффа играют важную роль в современной координационной химии [1–6]. В настоящее время координационные соединения переходных металлов с лигандами данного класса являются хорошо изученными, с одной стороны, благодаря простоте их получения и, с другой – благодаря широким возможностям функционализации, которые предоставляют лиганды – основания Шиффа. Такие комплексы находят свое применение в различных областях химии и технологии, а также являются перспективными объектами в биохимических и медицинских исследованиях [7–14].
Среди комплексов металлов главных подгрупп с основаниями Шиффа особое внимание уделяется комплексам олова [15–19]. Помимо того, что эти соединения являются эффективными фунгицидами, пестицидами, аэрозолями и противоопухолевыми агентами, они также способны проявлять себя в качестве активных катализаторов. Комплексы олова с основаниями Шиффа являются объектами комплексных исследований светоизлучающих и оптических свойств, что обусловлено высокой эмиссионной способностью комплексов и их хорошей термической стабильностью [20–23]. Также комплексы привлекательны и с точки зрения разнообразия структурных мотивов. Комплексы олова(IV) с Шиффовыми основаниями проявляют антибактериальное, противогрибковое, противоопухолевое действие в фармакологии и являются модельными объектами для изучения широкого спектра биохимической активности [24–28].
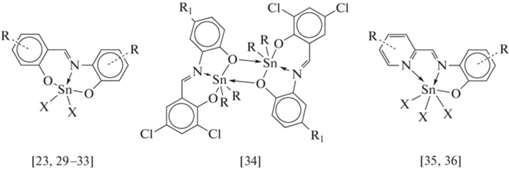
Среди комплексов олова(IV) с о-иминофенолятными основаниями Шиффа наиболее широко представлены соединения на основе тридентатных O,N,O-, O,N,S- и O,N,N-лигандов (cхемa 1) [23, 29–36].
Однако данные о комплексах олова с бидентатными иминофенолятными лигандами представлены значительно меньшим числом публикаций, например комплекс олова(IV) с N-бензилиден-o-анизидином [37] и бис-иминофеноляты олова(II) и олова(IV) на основе ферроценсодержащих оснований Шиффа [38–40]. В настоящей работе были синтезированы о-иминофеноляты трифенилолова(IV) на основе замещенных 2-бензилиден-аминофенолов, кристаллическое строение (2-бензилиденамино-5-метилфенолято)трифенилолова(IV) и (2-бензилиденамино-5-хлорфенолято)трифенилолова(IV) установлено с помощью рентгеноструктурного анализа.
Схема 1 .
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции по синтезу комплексов олова с о-иминофенолятными лигандами проводили в условиях отсутствия кислорода и влаги воздуха. Использованные в синтезах растворители очищали и обезвоживали по стандартным методикам [41, 42]. Коммерчески доступные реактивы (о‑аминофенолы, бензальдегид, 2-пиридинальдегид, трифенилолова бромид, триэтиламин) использовали без дополнительной очистки.
Спектры ЯМР 1Н регистрировали на спектрометрах Bruker Avance DPX-200 (200 МГц). Для регистрации спектров ЯМР использовали CDCl3 и ДМСО-d6. ИК-спектры в области 400–4000 см–1 регистрировали на спектрометре с Фурье-преобразователем ФСМ-1201 в вазелиновом масле. Молекулярное строение комплексов в кристаллическом состоянии установили с помощью монокристальных дифрактометров Bruker D8 Quest (100 K) и Agilent Xcalibur.
Общая методика синтеза лигандов L1H–L5H на основе замещенных и незамещенного о-аминофенолов и бензальдегида. Замещенный о-аминофенол (1 экв) растворяли в 100 мл метанола. При комнатной температуре к полученному раствору добавляли по каплям соответствующий ароматический альдегид (1 экв). В течение нескольких часов кипятили реакционную смесь с обратным холодильником при постоянном перемешивании и затем оставляли на всю ночь при –18°С. Выпавший осадок отделяли фильтрованием, промывали холодным метанолом и сушили на воздухе.
2-Бензилиденаминофенол (L1H): мелкокристаллический порошок желтого цвета получали из 1.85 мл (18 ммоль) бензальдегида и 2 г (18 ммоль) 2-аминофенола. Выход 2.48 г (69%).
ИК (ваз. масло; ν, см–1): 3328 c, 3059 сл, 3041 сл, 3019 сл, 2953 сл, 2923 с, 2854 с, 2729 сл, 1940 сл, 1906 сл, 1625 с, 1584 с, 1574 с, 1482 с, 1450 ср, 1359 сл, 1314 сл, 1290 с, 1251 с, 1197 ср, 1168 ср, 1148 ср, 1102 сл, 1072 сл, 1026 ср, 999 сл, 968 ср, 936 сл, 918 сл, 895 сл, 875 сл, 846 ср, 790 ср, 766 с, 735 ср, 689 с, 646 с, 566 сл, 502 с, 486 ср.
ЯМР 1H (CDCl3; δ, м.д.): 6.92 (м., 1H, C6H4), 7.00–7.13 (м., 1H, C6H4), 7.20 (д.д., 1H, C6H4), 7.30 (м., 1H, C6H4), 7.50 (м., 3H, Ph), 7.93 (м., 2H, Ph), 8.69 (c., 1H, –HC=N–).
2-Бензилиденамино-5-метилфенол (L2H): мелкокристаллический образец лиганда желтого цвета получали из 0.82 мл (8 ммоль) бензальдегида и 1 г (8 ммоль) 2-амино-5-метилфенола. Выход 0.96 г (58%).
ИК (ваз. масло; ν, см–1): 3397 с, 3059 сл, 3034 сл, 2953 сл, 2924 с, 2855 с, 2729 сл, 1892 сл, 1874 сл, 1628 с, 1579 с, 1531 сл, 1499 с, 1332 с, 1295 ср, 1260 ср, 1243 сл, 1221 ср, 1184 ср, 1170 сл, 1156 с, 1123 сл, 1100 сл, 1072 ср, 1025 сл, 1007 ср, 967 с, 944 с, 870 с, 801 с, 763 с, 692 с, 628 сл, 619 сл, 584 с, 512 с, 480 ср.
ЯМР 1H (CDCl3; δ, м.д.): 2.35 (с., 3H, CH3), 6.72 (д., 1H, C6H3), 6.86 (с., 1H, C6H3), 7.24 (д., 1H, C6H3), 7.49 (м., 3H, Ph), 7.91 (м., 2H, Ph), 8.68 (c., 1H, –HC=N–).
2-Бензилиденамино-5-хлорфенол (L3H): мелкокристаллический порошок серо-коричневого цвета получали из 0.7 мл (6.96 ммоль) бензальдегида и 1 г (6.96 ммоль) 2-амино-5-хлорфенола. Выход 0.56 г (35%).
ИК (ваз. масло; ν, см–1): 3329 с, 3082 сл, 3061 сл, 2953 сл, 2922 с, 2847 с, 1878 сл, 1711 сл, 1628 с, 1600 сл, 1582 с, 1533 сл, 1518 сл, 1480 ср, 1451 ср, 1333 с, 1313 сл, 1280 с, 1256 ср, 1236 сл, 1222 с, 1182 ср, 1114 сл, 1071 с, 1022 сл, 999 сл, 970 с, 940 сл, 906 с, 872 ср, 857 с, 843 сл, 812 с, 758 с, 689 с, 609 сл, 585 с, 511 с.
ЯМР 1H (CDCl3; δ, м.д.): 7.03 (д., 1H, C6H3), 7.26 (д., 1Н, C6H3), 7.32 (с., 1Н, C6H3), 7.51 (м., 3Н, Ph), 7.91 (м., 2H, Ph), 8.68 (c., 1H, –N=CH–).
2-Бензилиденамино-3-нитрофенол (L4H): мелкокристаллический порошок красного цвета получали из 0.26 мл (2.60 ммоль) бензальдегида и 0.4 г (2.60 ммоль) 2-амино-3-нитрофенола. Выход 0.44 г (69%).
ИК (ваз. масло; ν, см–1): 3508 с, 3397 ср, 3099 сл, 2953 сл, 2923 с, 2855 с, 2725 сл, 1902 сл, 1844 сл, 1787 сл, 1687 ср, 1636 с, 1588 с, 1529 с, 1438 ср, 1410 сл, 1375 сл, 1351 с, 1250 с, 1201 сл, 1168 с, 1081 сл, 1072 сл, 1028 сл, 944 сл, 901 сл, 846 с, 792 с, 735 с, 710 сл, 685 сл, 668 сл, 654 сл, 635 сл, 595 сл, 560 сл, 500 ср.
ЯМР 1H (DMSO-d6; δ, м.д.): 6.47 (д.д., 1H, C6H3), 6.76–6.97 (м., 3H, C6H3, Ph), 7.39–7.55(м., 2Н,Ph), 7.88–7.99 (м., 1H, Ph), 8.26 (с., 1H, ‒N=CH–), 10.43 (с., 1H, OH).
2-Бензилиденамино-4-нитрофенол (L5H): мелкокристаллический порошок серого цвета получали из 0.26 мл (2.60 ммоль) бензальдегида и 0.4 г (2.60 ммоль) 2-амино-4-нитрофенола. Выход 0.35 г (55%).
ИК (ваз. масло; ν, см–1): 3317 ср, 3110 сл, 3078 сл, 2953 сл, 2921 с, 1968 сл, 1899 сл, 1787 сл, 1691 сл, 1629 с, 1578 с, 1510 с, 1484 сл, 1444 сл, 1353 с, 1298 ср, 1271 с, 1242 сл, 1202 ср, 1176 сл, 1154 с, 1119 сл, 1087 сл, 1025 сл, 999 сл, 981 ср, 946 сл, 894 с, 873 ср, 828 с, 803 сл, 764 с, 746 с, 685 с, 665 сл, 636 с, 590 ср, 544 сл, 494 с, 471 ср.
ЯМР 1H (CDCl3; δ, м.д.): 7.11 (д., 1H, C6H3), 7.56 (д.д, 3H, Ph), 7.77 (с., 1H, C6H3), 7.97 (д., 2Н, Ph), 8.15 (д., 1H, C6H3), 8.26 (с., 1H, –N=CH–), 8.82 (с., 1H, OH).
Синтез (2-бензилиденаминофенолято)трифенилолово(IV) (L1)SnIVPh3 (I). Раствор лиганда L1H (4.1 ммоль, 0.8 г) в толуоле (25 мл) приливали к раствору Ph3SnBr (4.1 ммоль, 1.75 г) в том же растворителе (10 мл). К полученному раствору добавляли триэтиламин (4.1 ммоль, 0.56 мл) и реакционную смесь перемешивали в течение 2 ч. Раствор фильтровали от осадка [Et3NH]Br и оставляли на ночь при –18°C. Желтый мелкокристаллический осадок комплекса I отфильтровывали и высушивали в вакууме. Комплекс чувствителен к влаге воздуха в растворе и стабилен в кристаллическом состоянии. Выход 1.31 г (59%).
ИК (ваз. масло; ν, см–1): 3062 сл, 3019 сл, 2952 сл, 2924 с, 2854 с, 1907 сл, 1828 сл, 1605 сл, 1587 ср, 1574 ср, 1561 сл, 1492 сл, 1477 с, 1464 сл, 1453 сл, 1428 с, 1279 сл, 1257 ср, 1248 ср, 1191 сл, 1170 сл, 1158 сл, 1113 сл, 1074 ср, 1060 сл, 1043 сл, 1022 сл, 996 сл, 968 сл, 939 сл, 915 сл, 873 ср, 797 ср, 762 с, 734 с, 700 с, 689 с, 658 сл, 625 сл, 574 сл, 536 сл, 514 сл, 478 сл, 454 сл.
ЯМР 1H (CDCl3; δ, м.д.): 6.93 (д., 1H, С6H4), 7.02 (д., 1H, С6H4), 7.16 (д., 1H, С6H4), 7.30 (д.д., 1H, С6H4), 7.30–7.97 (м, 20H, аром., SnPh3, C6H5), 8.71 (c., 1H, –CH=N–). ЯМР 119Sn (148 МГц; CDCl3; 25°C; δ, м.д.): –127.41.
Синтез (2-бензилиденамино-5-метилфенолято)трифенилолово(IV) (L2)SnIVPh3 (II). Раствор лиганда L2H (0.95 ммоль, 0.2 г) в 15 мл толуола приливали к раствору Ph3SnBr (0.95 ммоль, 0.408 г) и Et3N (0.95 ммоль, 0.13 мл) в том же растворителе (25 мл). Реакционную смесь перемешивали при 35°C в течение 2 ч. Полученный раствор фильтровали от осадка [Et3NH]Br, толуол заменяли на гексан (15 мл), затем смесь фильтровали повторно. Полученный таким образом темно-желтый осадок сушили в вакууме. Выход комплекса II 0.316 г (60%). Перекристаллизация из гексана позволила получить монокристаллы комплекса желтого цвета, подходящие для РСА.
ИК (ваз. масло; ν, см–1): 3064 с, 3036 сл, 3019 сл, 2953 сл, 2923 с, 2855 с, 2720 сл, 2599 сл, 1953 сл, 1881 сл, 1822 сл, 1754 сл, 1609 с, 1593 ср, 1574 с, 1564 сл, 1481 с, 1430 с, 1414 ср, 1365 сл, 1331 сл, 1303 с, 1270 сл, 1261 с, 1228 сл, 1189 с, 1173 ср, 1158 с, 1123 с, 1076 с, 1062 сл, 1022 сл, 1010 сл, 997 ср, 955 с, 926 сл, 912 сл, 885 ср, 859 с, 811 сл, 790 с, 754 с, 698 с, 659 ср, 624 с, 586 с, 504 с, 479 сл.
ЯМР 1H (CDCl3; δ, м.д.): 2.35 (с., 3H, CH3), 6.73 (д.д., 1H, C6H3), 6.86 (д., 1H, C6H3), 7.24 (д., 1H, C6H3), 7.11–8.01 (м., 20H, аром., SnPh3, Ph), 8.69 (с., 1H, –CH=N–). ЯМР 119Sn (148 МГц; CDCl3; 25°C; δ, м.д.): –132.45.
Синтез (2-бензилиденамино-5-хлорфенолято)трифенилолово(IV) (L3)SnIVPh3 (III). Раствор лиганда L3H (0.6 ммоль, 0.14 г) в ТГФ (15 мл) приливали к раствору Ph3SnBr (0.6 ммоль, 0.26 г) в том же растворителе (20 мл). К реакционной смеси добавляли триэтиламин (0.6 ммоль, 0.08 мл) и перемешивали при 40°C в течение 2 ч. Образовавшийся осадок [Et3NH]Br удаляли фильтрованием. Растворитель заменили на толуол (15 мл) и после выдерживания раствора при –18°C в течение 12 ч, выделили желтые кристаллы комплекса III, пригодные для РСА. Данный комплекс чувствителен к влаге воздуха в растворе и стабилен в кристаллическом состоянии. Выход 0.105 г (30%).
ИК (ваз. масло; ν, см–1): 3330 ср, 3136 сл, 3065 ср, 3052 сл, 3005 сл, 2952 сл, 2924 с, 2853 с, 2725 сл, 2646 сл, 2595 сл, 2350 сл, 2144 сл, 2094 сл, 1981 сл, 1959 сл, 1883 сл, 1823 сл, 1766 сл, 1713 сл, 1628 с, 1601 сл, 1576 с, 1534 сл, 1479 с, 1451 сл, 1429 с, 1410 сл, 1332 с, 1313 сл, 1303 сл, 1280 ср, 1258 ср, 1236 сл, 1224 с, 1182 ср, 1158 сл, 1116 сл, 1021 с, 996 с, 971 с, 940 сл, 921 сл, 906 с, 872 сл, 857 с, 812 с, 790 сл, 758 ср, 695 с, 678 сл, 662 сл, 610 сл, 586 с, 511 с.
Синтез (2-бензилиденамино-3-нитрофенолято)трифенилолово(IV) (L4)SnIVPh3 (IV). Раствор лиганда L4H (1.24 ммоль, 0.30 г) в ТГФ (15 мл) приливали к раствору Ph3SnBr (1.24 ммоль, 0.53 г) в том же растворителе (20 мл). К реакционной смеси добавляли триэтиламин (1.24 ммоль, 0.17 мл) и перемешивали при 40°C в течение 2 ч. Образовавшийся осадок [Et3NH]Br удаляли фильтрованием. ТГФ заменили на смесь гексан–эфир (20 мл) и после выдерживания раствора при –18°C в течение 12 ч появился смолянистый осадок бордового цвета, его снова растворяли в ТГФ. Нерастворившийся мелкокристаллический порошок IV оранжевого цвета отфильтровывали, сушили в вакууме. Выход 0.053 г (7%).
ИК (ваз. масло; ν, см–1): 3067 сл, 3044 сл, 2953 сл, 2924 с, 2854 ср, 2726 сл, 1954 сл, 1920 сл, 1890 сл, 1819 сл, 1608 ср, 1575 ср, 1497 ср, 1479 ср, 1429 ср, 1353 сл, 1334 сл, 1298 с, 1191 сл, 1169 ср, 1125 сл, 1089 сл, 1076 ср, 1022 сл, 996 ср, 948 сл, 922 сл, 902 ср, 878 ср, 857 ср, 838 ср, 759 сл, 750 сл, 696 с, 674 ср, 659 сл, 646 сл, 617 сл, 569 сл, 539 сл, 499 ср.
ЯМР 1H (CDCl3; δ, м.д.): 7.38 (д.д., 2H, C6H3), 7.67 (д., 1H, C6H3), 7.30–8.01 (м., 20H, аром., SnPh3, Ph), 8.83 (с., 1H, –НC=N–).
Синтез (2-бензилиденамино-4-нитрофенолято)трифенилолово(IV) (L5)SnIVPh3 (V). Раствор лиганда L5H (0.21 ммоль, 0.050 г) в ТГФ (15 мл) приливали к раствору Ph3SnBr (0.21 ммоль, 0.90 г) в том же растворителе (20 мл). К реакционной смеси добавляли триэтиламин (0.21 ммоль, 0.03 мл) и перемешивали при 40°C в течение 2 ч. Образовавшийся осадок [Et3NH]Br удаляли фильтрованием. После упаривания растворителя, наблюдали образование смолянистого осадка. При растворении в пентане (20 мл) из смеси выпадал мелкокристаллический осадок V, который отфильтровывали и сушили в вакууме. Выход 0.053 г (4%).
ИК (ваз. масло; ν, см–1): 3346 сл, 3104 сл, 3065 сл, 3046 сл, 2952 сл, 2923 с, 2854 с, 1629 ср, 1579 с, 1512 с, 1479 сл, 1465 ср, 1430 сл, 1377 сл, 1349 с, 1273 с, 1154 сл, 1075 сл, 1023 сл, 997 сл, 981 сл, 948 сл, 893 сл, 873 сл, 828 сл, 802 сл, 791 сл, 761 сл, 746 ср, 730 ср, 697 ср, 685 сл, 650 сл, 631 сл, 590 сл, 545 сл, 493 сл, 472 сл.
РСА соединений II и III проведен на дифрактометрах Bruker D8 Quest (II) и Rigaku OD Xcalibur E (III). Измерение и интегрирование экспериментальных наборов интенсивностей, учет поглощения, решение и уточнение структур проведены с использованием программных пакетов APEX3 [43], CrysAlisPro [44], SADABS [45] и SHELX [46]. Структуры решены с помощью алгоритма dual-space [47] и уточнены полноматричным МНК по $F_{{hkl}}^{2}$ в анизотропном приближении для неводородных атомов. Водородные атомы в II и III были помещены в геометрически рассчитанные положения и уточнены изотропно с фиксированными тепловыми параметрами U(H)изо = 1.2U(C)экв (U(H)изо = 1.5U(C)экв для метильных групп). Кристаллографические данные, параметры рентгеноструктурных экспериментов и уточнения структур приведены в табл. 1.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур II и III
| Параметр | Значение | |
|---|---|---|
| II | III | |
| Состав | C32H27NOSn | C31H24ClNOSn |
| М | 560.23 | 580.65 |
| Сингония | Триклинная | Триклинная |
| Пр. группа | $P\bar {1}$ | $P\bar {1}$ |
| T, K | 298 | 100 |
| λ, Å | 0.71073 (Mo) | 0.71073 (Mo) |
| a, Å | 9.0356(2) | 8.9326(8) |
| b, Å | 9.6545(3) | 9.5885(8) |
| c, Å | 16.3057(5) | 15.8917(13) |
| α, град | 72.928(3) | 73.198(2) |
| β, град | 84.124(2) | 82.224(2) |
| γ, град | 85.335(2) | 85.600(2) |
| V, Å3 | 1350.63(7) | 1290.02(19) |
| Z | 2 | 2 |
| ρ(выч.), г/см3 | 1.378 | 1.495 |
| µ, мм–1 | 0.969 | 1.118 |
| F(000) | 568 | 584 |
| Размеры кристалла, мм | 0.28 × 0.21 × 0.18 | 0.33 × 0.17 × 0.12 |
| Область сканирования θ, град | 3.08–28.70 | 2.53–30.11 |
| Количество измеренных/ независимых отражений | 31 183/6959 | 18 289/7568 |
| Rint | 0.0322 | 0.0335 |
| Количество независимых отражений с I > 2σ(I) | 5979 | 6611 |
| Число уточняемых параметров/ограничений | 317/0 | 316/0 |
| R (F 2 > 2σ(F 2)) | R1 = 0.0309, wR2 = 0.0715 |
R1 = 0.0368, wR2 = 0.0777 |
| R (по всем данным) | R1 = 0.0401, wR2 = 0.0752 |
R1 = 0.0466, wR2 = 0.0808 |
| S(F 2) | 1.040 | 1.057 |
| Остаточная электронная плотность (max/min), e/Å3 | 0.65/–0.33 | 2.10/–1.34 |
Структуры зарегистрированы в Кембриджском банке структурных данных (CCDC № 2131549 (I), 2131548 (II); ccdc.cam.ac.uk/structures).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Комплексы олова(IV) I–V с фенолсодержащими основаниями Шиффа общей формулы (Ln)SnPh3, где n = 1–5 (соответствует номеру лиганда), были получены по обменной реакции соответствующего о-иминофенола L1H–L5H с бромидом трифенилолова в эквимолярном соотношении в растворе толуола или ТГФ в присутствии эквивалента триэтиламина (схема 2 ).
Схема 2 .
Комплексы I–V в твердом виде представляют собой мелкокристаллические порошки желтого или оранжевого цвета. Их растворы имеют темно-желтую (I–III) или оранжево-красную (IV, V) окраску. Соединения IV и V, в отличие от I–III, нерастворимы в толуоле, диэтиловом эфире, ацетонитриле, гексане. Полученные комплексы достаточно устойчивы в твердом виде к действию кислорода и влаги воздуха.
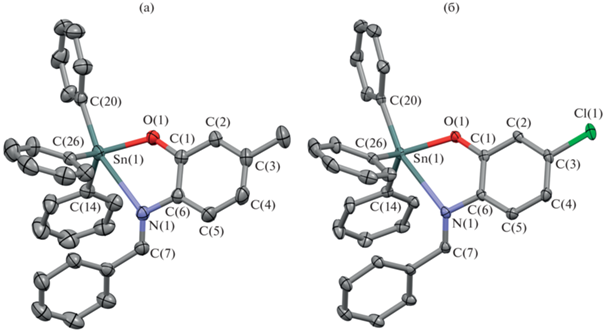
Соединения I–V исследовали методами ИК-, ЯМР 1H-спектроскопии, молекулярное строение II и III в кристаллическом виде установлено с помощью метода РСА.
ИК-спектры фенолятных комплексов олова(IV) содержат набор характерных полос, отвечающих валентным колебаниям одинарных C–O связей фенольного фрагмента в области 1280–1220 см–1. Подобно исходным о-иминофенолятным лигандам валентные колебания связи –C=N– проявляются в виде полос средней и сильной интенсивности при 1640–1570 см–1.
Спектры ЯМР 1Н комплексов содержат сигналы от протонов групп (ароматические, фенильные, иминная группа), входящих в состав комплексов. Протоны иминной группы в комплексах проявляются в спектрах ЯМР 1Н в виде интенсивных синглетов при химических сдвигах, находящихся в диапазоне 8.4–8.8 м.д. В спектрах ЯМР 119Sn комплексов I, II наблюдаются сигналы при –127.4 и –132.45 м.д. соответственно. Из литературных данных известно, что для четырехкоординационных комплексов олова(IV) характерен химический сдвиг в интервале от –40 до –120 м.д., а для пятикоординационных от –180 до –260 м.д. Исходя из данных спектроскопии ЯМР, полученные соединения в растворе хлороформа можно отнести скорее к четырехкоординационным комплексам, что означает лишь слабую координацию иминогруппы на центральный атом олова. Эти наблюдения подтверждаются данными РСА.
Молекулярное строение комплексов (5-Me(L)O)SnPh3 (II) и (5-Cl(L)O)SnPh3 (III) в кристаллическом состоянии установлено с помощью РСА. Избранные длины связей и углы приведены в табл. 2. Молекулярное и кристаллическое строение комплексов близко (рис. 1, 2).
Таблица 2.
Избранные длины связей (Å) и углы (град) в (L2)SnPh3 (II) и (L3)SnPh3 (III) согласно данным РСА
| Связь | II | III |
|---|---|---|
| d, Å | ||
| Sn(1)–O(1) | 2.0112(15) | 2.0298(16) |
| Sn(1)–N(1) | 2.781(2) | 2.727(2) |
| Sn(1)–C(14) | 2.122(2) | 2.126(2) |
| Sn(1)–C(26) | 2.127(2) | 2.129(2) |
| Sn(1)–C(20) | 2.155(2) | 2.147(2) |
| O(1)–C(1) | 1.347(2) | 1.338(3) |
| N(1)–C(7) | 1.277(3) | 1.283(3) |
| N(1)–C(6) | 1.403(3) | 1.415(3) |
| C(1)–C(2) | 1.396(3) | 1.402(3) |
| C(1)–C(6) | 1.398(3) | 1.405(3) |
| C(2)–C(3) | 1.385(3) | 1.378(3) |
| C(3)–C(4) | 1.378(4) | 1.388(4) |
| C(4)–C(5) | 1.375(4) | 1.388(3) |
| C(5)–C(6) | 1.401(3) | 1.396(3) |
| C(7)–C(8) | 1.466(3) | 1.469(3) |
| Угол | ω, град | |
| O(1)Sn(1)C(14) | 114.65(8) | 115.49(8) |
| O(1)Sn(1)C(26) | 113.53(7) | 114.09(8) |
| C(14)Sn(1)C(26) | 120.42(8) | 120.55(9) |
| O(1)Sn(1)C(20) | 94.32(7) | 93.65(8) |
| C(14)Sn(1)C(20) | 104.36(8) | 104.11(9) |
| C(26)Sn(1)C(20) | 104.80(8) | 103.37(9) |
| C(20)Sn(1)N(1) | 162.17(8) | 162.36(9) |
| O(1)Sn(1)N(1) | 68.31(8) | 69.00(9) |
Центральный атом олова Sn(1) в II и III находится в искаженном тригонально-бипирамидальном лигандном окружении. Основание пирамиды образовано атомами углерода С(26), С(14) двух фенильных групп и атомом кислорода О(1) о‑иминофенолятного лиганда, в то время как атом углерода С(20) третьей фенильной группы и атом азота N(1) хелатирующего лиганда располагаются в апикальных положениях. Расстояния C–С ароматического кольца С(1–6) в о-иминофенолятном лиганде (1.375(4)–1.401(3) Å, средн. 1.389 Å в II; 1.378(3)–1.405(3) Å, средн. 1.393 Å в III) близки к таковым в о-иминофенолятных комплексах олова [38–40]. Длины связей C(1)–O(1), C(6)–N(1) (1.347(2) и 1.403(3) Å в II; 1.338(3) и 1.415(3) Å в III соответственно) находятся в интервале для длин связей, характерном для одинарных C–O (1.32–1.36 Å) и C–N (1.38–1.43 Å) связей [48–57]. Связь Sn(1)–O(1) (2.0301(16) Å) несколько меньше, чем сумма ковалентных радиусов соответствующих атомов (rков(Sn) = 1.47 Å, rков(O) = 0.73 Å [58]), но соответствует таким связям в подобных о-иминофенолятных комплексах олова [38–40]. С другой стороны, расстояния Sn(1)–N(1) (2.781(2) Å в II и 2.727(2) Å в III) превышают сумму ковалентных радиусов соответствующих атомов (rков(Sn) = 1.47 Å, rков(N) = 0.74 Å [58]), но меньше суммы ван-дер-ваальсовых радиусов (rв(Sn) = 2.25 Å, rв(N) = 1.6 Å [59]). При этом расстояния Sn(1)–N(1) в II и III значительно больше соответствующих расстояний в ряде других бис-о-иминофенолятных производных олова (2.1–2.3 Å [38–40]), что свидетельствует о более слабом характере донорно-акцепторной связи Sn(1)–N(1) в II и III по сравнению с ранее описанными о‑иминофенолятными комплексами олова(II,IV). Эти данные подтверждают наблюдения, сделанные на основании спектров ЯМР 119Sn для растворов комплексов I и II.
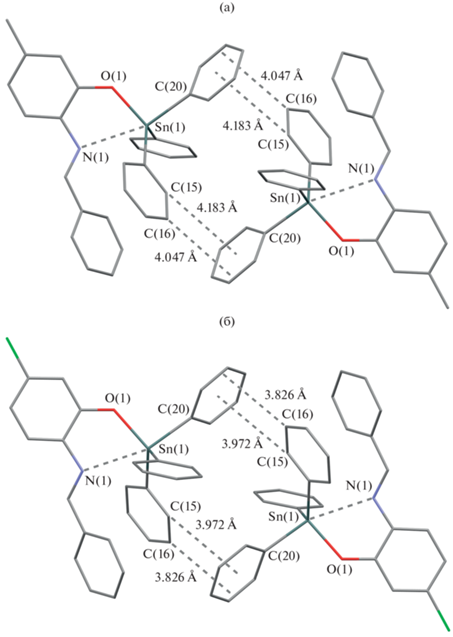
В кристаллах молекулы комплексов упакованы изолированно таким образом, что образуют пары (рис. 2), в которых фрагменты SnPh3 направлены друг к другу. При этом наименьшие расстояния между атомами углеродов фенильных колец соседних фрагментов SnPh3 в данных парах составляют 4.06(1) Å для II и 3.84(1) Å для III, что больше суммы ван-дер-ваальсовых радиусов атомов углерода (rв(С) = 1.7 Å [59]).
Таким образом, получен ряд комплексов трифенилолова(IV) c бидентатными о-иминофенолятными лигандами, молекулярное строение двух комплексов (2-бензилиденамино-5-метилфенолята трифенилолова(IV) и 2-бензилиденамино-5-хлорфенолята трифенилолова(IV)) в кристаллическом виде установлено с помощью рентгеноструктурного анализа.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Pervaiz M., Sadiq S., Sadiq A. et al. // Coord. Chem. Rev. 2021. V. 447. 214128.
Catalano A., Sinicropi M.S., Iacopetta D. et al. // Appl. Sci. 2021. V. 11. P. 6027.
Hazra S., Mohanta S. // Coord. Chem. Rev. 2019. V. 395. P. 1.
Al Zoubi W., Ko Y.G. // J. Organomet. Chem. 2016. V. 822. P. 173.
Hanif M., Chohan Z.H. // Spectrochim. Acta. A. 2013. V. 104. P. 468.
Singh B.K., Rajour H.K., Prakash A. // Spectrochim. Acta. A. 2012. V. 94. P. 143.
More M.S., Joshi P.G., Mishra Y.K., Khanna P.K. // Mater. Today Chem. 2019. V. 14. 100195.
Tadele K.T., Tsega T.W. // Anti-Cancer Agents Med. Chem. 2019. V. 19. P. 1786.
Liu X., Manzur C., Novoa N. et al. // Coord. Chem. Rev. 2018. V. 357. P. 144.
Malik M.A., Dar O.A., Gull P. et al. // Med. Chem. Commun. 2018. V. 9. P. 409.
Hameed A., al-Rashida M., Uroos M. et al. // Expert. Opin. Ther. Pat. 2017. V. 27. P. 63.
Al Zoubi W., Al-Hamdani A.A.S., Kaseem M. // Appl. Organometal. Chem. 2016. V. 30. P. 810.
Abu-Dief A.M., Mohamed I.M.A. // Beni-Suef Univ. J. Appl. Sci. 2015. V. 4. № 2. P. 119. https://doi.org/10.1016/j.bjbas.2015.05.004
Sobha S., Mahalakshmi R., Raman N. // Spectrochim. Acta. A. 2012. V. 92. P. 175.
Butler P.W.V., Ward J.S. // Z. Anorg. Allg. Chem. 2019. V. 645. P. 694.
Basu Baul T.S., Kehie P., Duthie A., Höpfl H. // J. Organomet. Chem. 2017. V. 838. P. 24.
Hamid M.H.S.A., Said A.N.A.H., Mirza A.H et al. // Inorg. Chim. Acta. 2016. V. 453. P. 742.
Manju M.N., Kumar D. // Russ. J. Coord. Chem. 2014. V. 40. P. 343. https://doi.org/10.1134/S1070328414050091
Dubey R.K., Singh A.P., Dwivedi N. // Main Group Metal Chem. 2011. V. 34. P. 77.
Cantón-Díaz A.M., Muñoz-Flores B.M., Moggio I. et al. // New J. Chem. 2018. V. 42. P. 14586.
Enríquez-Cabrera A., Vega-Peñaloza A., Álvarez-Venicio V. et al. // J. Organomet. Chem. 2018. V. 855. P. 51.
Muñoz-Flores B.M., Santillán R., Farfán N. et al. // J. Organomet. Chem. 2014. V. 769. P. 64.
García-López M.C., Muñoz-Flores B.M., Jiménez-Pérez V.M. et al. // Dyes Pigm. 2014. V. 106. P. 188.
Yusof E.N. Md, Latif M.A.M., Tahir M.I.M. et al. // J. Mol. Struct. 2020. V. 1205. 127635.
Devi J., Yadav J., Singh N. // Res. Chem. Intermed. 2019. V. 45. P. 3943.
Lee S.M., Sim K.S., Lo K.M. // Inorg. Chim. Acta. 2015. V. 429. P. 195.
Prasad K.S., Kumar L.S., Chandan S. et al. // Spectrochim. Acta. A. 2011. V. 81. P. 276.
Nath M., Saini P.K. // Dalton Trans. 2011. V. 40. P. 7077.
Celebier M., Sahin E., Ancin N. et al. // Appl. Organometal. Chem. 2007. V. 21. P. 913.
Beltrán H.I., Damian-Zea C., Hernández-Ortega S. et al. // J. Inorg. Biochem. 2007. V. 101. P. 1070.
Galván-Hidalgo J.M., Chans G.M., Ramírez-Apan T. et al. // Appl. Organometal. Chem. 2017. V. 31. P. 1.
Galván-Hidalgo J.M., Ramírez-Apan T., Nieto-Camacho A. et al. // J. Organomet. chem. 2017. V. 848. P. 332.
Pettinari C., Marchetti F., Pettinari R. et al. // Inorg. Chim. Acta. 2001. V. 325. P. 103.
Tan Y.-X., Zhang Zh.-J., Liu Y. et al. // J. Mol. Struct. 2017. V. 1149. P. 874.
Teo S.-B., Teo H.-Sh., Chang S.-T. et al. // J. Coord. Chem. 2000. V. 49. P. 269.
Ramírez-Jiménez A., Gómez E., Hernández S. // J. Organomet. Chem. 2009. V. 694. P. 2965.
Rasmussen K.G., Hazell R.G., Jørgensen K.A. // Chem. Commun. 1997. P. 1103.
Baryshnikova S.V., Bellan E.V., Poddel’sky A.I. et al. // Inorg. Chem. Commun. 2016. V. 16. P. 94.
Барышникова С.В., Беллан Е.В., Поддельский А.И. и др. // Докл. РАН. 2017. Т. 474. № 1. С. 46 (Baryshnikova S.V., Bellan E.V., Poddel’skii A.I. // Dokl. Chem. 2017. V. 474. № 1. P. 101).
Baryshnikova S.V., Poddel’sky A.I., Bellan E.V. et al. // Inorg. Chem. 2020. V. 59. P. 6774.
Гордон А., Форд Р. Спутник химика. М.: Мир, 1976. С. 437.
Райхардт К. Растворители и эффекты среды в органической химии. М.: Мир, 1991. 763 с.
APEX3. Madison (WI, USA): Bruker AXS Inc., 2018.
Rigaku Oxford Diffraction, CrysAlisPro software system. Version 1.171.38.46. Wroclaw (Poland): Rigaku Corporation, 2015.
Krause L., Herbst-Irmer R., Sheldrick G., Stalke D. // J. Appl. Crystallogr. 2015. V. 48. P. 3.
Sheldrick G. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Sheldrick G. // Acta Crystallogr. A. 2015. V. 71. P. 3.
Baryshnikova S.V., Poddel’sky A.I., Cherkasov A.V., Smolyaninov I.V. // Inorg. Chim. Acta. 2019. V. 495. 118963.
Протасенко Н.А., Барышникова С.В., Астафьева Т.А. и др. // Коорд. химия. 2021. Т. 47. № 6. С. 381. (Protasenko N.A., Baryshnikova S.V., Astaf’eva T.V. et al. // Russ. J. Coord. Chem. 2021. V. 47. № 6. P. 417). https://doi.org/10.1134/S1070328421060038
Baryshnikova S.V., Bellan E.V., Poddel’sky A.I. et al. // Eur. J. Inorg. Chem. 2016. V. 2016. № 33. P. 5230.
Novoa N., Roisnel T., Hamon P. et al. // Dalton Trans. 2015. V. 44. P. 18019.
Perez S., Lopez C., Caubet A. et al. // J. Organomet. Chem. 2007. V. 692. P. 2402.
Wölfle H., Kopacka H., Wurst K. et al. // J. Organomet. Chem. 2006. V. 691. P. 1197.
Poddel’sky A.I., Baranov E.V., Fukin G.K. et al. // J. O-rganomet. Chem. 2013. V. 733. P. 44.
Poddel’sky A.I., Smolyaninov I.V., Berberova N.T. et al. // J. Organomet. Chem. 2015. V. 789–790. P. 8.
Poddel’sky A.I., Smolyaninov I.V., Fukin G.K. et al. // J. Organomet. Chem. 2016. V. 824. P. 1.
Briel O., Fehn A., Polborn K., Beck W. // Polyhedron. 1998. V. 18. P. 225.
Бацанов С. // Журн. неорган. химии. 1991. Т. 36. № 12. С. 3015 (Batsanov S. // Russ. J. Inorg. Chem. 1991. V. 36. P. 1694).
Бацанов С.С. // Неорган. материалы. 2001. Т. 37. № 9. С. 1031 (Batsanov S.S. // Inorg. Mater. 2001. V. 37. P. 871).
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия