Координационная химия, 2022, T. 48, № 8, стр. 483-488
Синтез и строение малонатов железа(III) с катионами рубидия и цезия
Д. О. Блинов 1, Е. Н. Зорина-Тихонова 1, *, Ю. К. Воронина 1, М. А. Кискин 1, И. Л. Еременко 1, 2
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Институт элементоорганических соединений им. А.Н. Несмеянова PAH
Москва, Россия
* E-mail: ezorinatikhonova@gmail.com
Поступила в редакцию 12.01.2022
После доработки 24.01.2022
Принята к публикации 28.01.2022
- EDN: HWIVSY
- DOI: 10.31857/S0132344X22080011
Аннотация
Получены новые координационные соединения железа(III) с дианионами малоновой кислоты (H2Mal) и катионами рубидия [Rb3Fe(Mal)3(H2O)]n (I) и цезия [Cs3Fe(Mal)3(H2O)]n (II). По данным РСА (CCDC № 2125054 (I); 2125055 (II)) соединения в кристалле представляют собой изоструктурные 3D-координационные полимеры, в которых повторяющейся структурной единицей является тетраядерный блок [${\text{M}}_{3}^{{\text{I}}}$Fe(Mal)3(H2O)] (MI = Rb (I) или Cs (II)), состоящий из центрального трисхелатного фрагмента {Fe(Mal)3}3–, связанного малонатными мостиками с ионами Rb или Cs.
Карбоксилатные координационные соединения железа(III) представляют большой интерес для исследователей благодаря разнообразным и подчас нетривиальным свойствам этих объектов. Так, широко исследуются их магнитные характеристики, каталитическая активность и биологические свойства [1–5]. Многие из известных соединений этого типа, например, с ионами Li–Fe, Fe–Mn, Fe–Co, Fe–Ni, Fe–Zn и др., перспективны для направленного получения сложных оксидов и зачастую могут выступать в качестве прекурсоров для их получения, в том числе в виде наночастиц, пригодных для создания магнитных или катодных материалов [6–9].
Однако важным шагом в развитии этой области химии соединений железа(III) по-прежнему остается понимание возможностей известных способов сборки полиядерных гетерометаллических комплексов с разными по своей электронной природе ионами металлов и установление их строения. Ведь именно в этом случае полученная информация позволяет определять пути направленного трансформирования таких сложных архитектур в сложные оксиды с определенным расположением ионов в твердой фазе (кристаллах, пленках, покрытиях и т.п.), что, как правило, и определяет свойства конечного материала [10, 11]. В такой ситуации можно воспользоваться известными в химии методологиями, позволяющими достаточно направленно управлять сборкой полиядерных и полимерных соединений. Использование полидентатных лигандов, таких как дикарбоновые кислоты, при синтезе гетерометаллических 3d–s-соединений позволяет получать полимерные системы различной размерности, в том числе пористые координационные полимеры, интересные с точки зрения сорбции и разделения газов, гетерогенных катализаторов или сенсоров [12–14]. Известно, что соединения переходных металлов с анионами малоновой кислоты и атомами s-металлов имеют полимерное строение [15, 16]. Малонат-дианионы в соединениях с двухвалентными металлами формируют бисхелатный фрагмент [7, 17], а в соединениях с железом(III) – трисхелатные [18, 19]. В некоторых случаях эта тенденция сохраняется при переходе к замещенным аналогам малоновой кислоты [20–29]. Для хрома(III) также описано образование трисхелатных фрагментов с анионами замещенных малоновых кислот [30]. Малонаты и их замещенные аналоги могут координироваться к атомам металла как с образованием шестичленных хелатных циклов, так и проявлять исключительно мостиковую функцию не только в случае гетерометаллических, но и гомометаллических соединений [31–33], что во многом связано с природой металлоцентра. Образование бисхелатных фрагментов может наблюдаться не только в случае дикарбоновых кислот, но также и ароматических монокарбоновых, имеющих донорый заместитель в орто-положении относительно карбоксильной группы. Например, анионы дииодосалициловой кислоты с атомами меди(II) образуют бисхелатный фрагмент [34], а с атомами цинка(II) наблюдается монодентатный тип координации аниона [35, 36].
Однако среди большого числа координационных соединений 3d-металлов с анионами малоновой кислоты и ее замещенных аналогов известно лишь несколько соединений железа(III) [7, 18, 19, 37]. Гетерометаллические комплексы d-металлов с ионами рубидия и цезия описаны единичными примерами, включающими малонаты меди(II) c ионами рубидия или цезия [38], а также два диметилмалоната кобальта(II) с ионами цезия [20].
В настоящей работе представлены результаты по синтезу координационных соединений железа(III) с анионами малоновой кислоты и катионами рубидия и цезия – [M3Fe(Мal)3(H2O)]n (M = Rb (I) или Cs (II)), исследованию их строения, а также выполнен анализ влияния ионов щелочного металла на молекулярное и кристаллическое строение новых соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все процедуры, связанные с синтезом соединений, проводили на воздухе с использованием дистиллированной воды и следующих коммерчески доступных реактивов: FeCl3 ∙ 6H2O (х.ч., Реахим), малоновая кислота (H2Мal, 99%, Fluka), Rb2CO3 (99.9%, Ланхит), Cs2CO3 (99.9%, Ланхит).
Инфракрасные спектры полученных соединений регистрировали на спектрометре Perkin Elmer Spectrum 65, оснащенном приставкой Quest ATR Accessory (Specac) методом нарушенного полного внутреннего отражения (НПВО) в диапазоне 400–4000 см–1.
Синтез [Rb3Fe(Мal)3(H2O)]n (I). Малоновую кислоту (1.5 ммоль, 0.1561 г) растворяли в 10 мл H2O, добавляли Rb2CO3 (1.5 ммоль, 0.3464 г), затем раствор FeCl3 ∙ 6H2O (0.5 ммоль, 0.1351 г) в 10 мл H2O. Полученный раствор светло-зеленого цвета перемешивали 30 мин, фильтровали и оставляли медленно испаряться на воздухе. Через 10 дней образовывались зеленые кристаллы, пригодные для РСА.
ИК-спектр (НПВО, ν, см–1): 3395 сл, 1602 ср, 1518 сл, 1506 сл, 1478 сл, 1360 ср, 1303 ср, 1202 сл. 959 сл, 926 ср, 800 сл, 717 ср, 636 сл, 540 сл, 444 сл.
Синтез [Cs3Fe(Мal)3(H2O)]n (II) проводили по методике, аналогичной для I за исключением использования Cs2CO3 (1.5 ммоль, 0.4887 г) вместо Rb2CO3.
ИК-спектр (НПВО, ν, см–1): 3398 сл, 1595 с, 1356 с, 1303 ср, 1200 ср, 958 ср, 924 ср, 797 сл, 713 с, 636 сл, 604 сл, 536 ср. 458 ср, 438 ср.
РСА монокристаллов I и II проведен при использовании дифрактометра Bruker D8 Venture (MoKα-излучение, графитовый монохроматор, φ- и ω-сканирование). Для I и II введена полуэмпирическая поправка на поглощение по программе SADABS [39]. Структуры решены прямым методом и уточнены МНК сначала в изотропном, а затем в анизотропном приближении. Позиции атомов водорода рассчитаны геометрически. Все расчеты проведены с помощью программы OLEX2 [40]. Кристаллографические характеристики и детали дифракционного эксперимента приведены в табл. 1.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I и II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| Брутто-формула | C9H8O13FeRb3 | C9H8O13FeCs3 |
| М | 636.41 | 778.73 |
| Сингония | Oрторомбическая | |
| Пр. группа | Pbcm | |
| Т, K | 100 | 293 |
| a, Å | 14.2362(12) | 14.4218(8) |
| b, Å | 7.9061(6) | 8.1305(5) |
| c, Å | 14.2841(11) | 15.0429(8) |
| V, Å3 | 1607.7(2) | 1763.88(17) |
| Z | 4 | 4 |
| μ, мм–1 | 10.03 | 7.02 |
| Размер кристалла, мм | 0.12 × 0.12 × 0.1 | 0.13 × 0.12 × 0.09 |
| Tmin, Tmax | 0.097, 0.381 | 0.208, 0.381 |
| Число измеренных рефлексов | 11 527 | 17 151 |
| Число независимых рефлексов | 1651 | 2432 |
| Число рефлексов с I > 2σ(I) | 1538 | 2240 |
| Rint | 0.086 | 0.032 |
| (sin θ/λ)max, Å−1 | 0.617 | 0.682 |
| R (F 2 > 2σ(F 2)) | 0.052 | 0.022 |
| wR (F 2) | 0.135 | 0.053 |
| S | 1.14 | 1.14 |
| Число уточняемых параметров | 125 | 130 |
| Δρmax/Δρmin, e Å−3 | 2.45/−1.10 | 0.82/−0.75 |
Координаты атомов и полные кристаллографические параметры депонированы в Кембриджском банке структурных данных (КБСД) (№ 2125054 (I); 2125055 (II); deposit@ ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ structures).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При взаимодействии FeCl3 ∙ 6H2O, малоновой кислоты и карбоната рубидия или цезия образуются изоструктурные координационные соединения [${\text{M}}_{3}^{{\text{I}}}$Fe(Мal)3(H2O)]n (MI = Rb (I) или Cs (II)), которые кристаллизуются в ромбической сингонии, пространственная группа Pbcm. Для полученных образцов проведен рентгенофазовый анализ (РФА), показавший присутствие кристаллической примеси и аморфной фазы, которые не удалось идентифицировать.
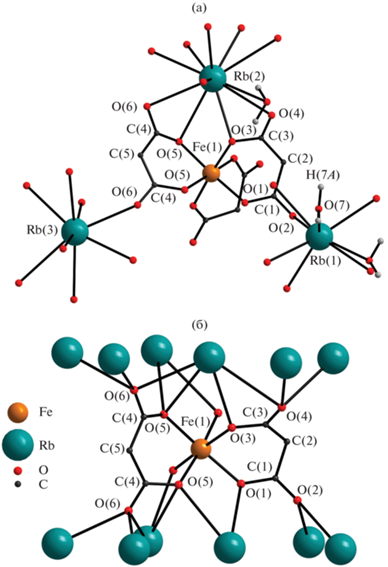
В кристаллах соединения I и II представляют собой трехмерные координационные полимеры, в которых на один атом железа(III) приходится три атома щелочного металла, три дианиона малоновой кислоты и одна молекула воды. Атом железа(III) находится в октаэдрическом окружении, сформированном атомами кислорода трех малонат-анионов с образованием трисхелатного фрагмента (рис. 1а). Расстояния Fe–O при этом составляют 1.981(5)–2.022(5) и 1.980(2)–2.031(2) Å в I и II соответственно. Два атома щелочных металлов координируют по 8 и один – 11 атомов кислорода, в том числе от молекулы воды. Диапазоны расстояний Rb–O(O2CR) и Rb–O(H2O) составляют 2.930(5)–3.287(5) и 3.188(8)–3.239(8) Å, диапазоны расстояний Cs–O(O2CR) и Cs–O(H2O) – 3.089(3)–3.439(2) и 3.294(4)–3.319(4) Å соответственно. Атомы кислорода молекул воды координированы тремя атомами щелочных металлов и дополнительно связаны водородными связями с атомами кислорода дианионов кислоты (расстояние O…O составляет 2.828(6) Å в I и 2.911(3) Å в II). В соединении присутствует два типа малонат-анионов, которые проявляют k2-, μ7-тип координации (дианион O(1)/C(1)/C(2)/C(3)/O(3)) и k2-, μ9-тип (дианион O(5)/C(4)/C(5)/C(4)/O(5)) (рис. 1б).
Рис. 1.
Фрагмент соединения Iа, два структурно-независимых аниона Iб (атомы водорода показаны только для молекул воды).
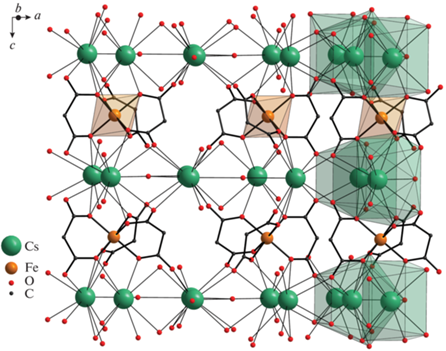
Атомы каждого типа металлов формируют параллельные слои (рис. 2). Расстояния между ионами металлов в слоях: Rb…Rb 3.8432, Cs…Cs 3.989, Fe…Fe 7.070 (I) и 7.132 Å (II). Расстояние между плоскостями составляет 3.571 Å в I и 3.761 Å в II. Плотность кристаллов велика – коэффициент упаковки составляет 88.6 в комплексе с рубидием и 87.8 в комплексе с цезием.
Как показал анализ КБСД, на сегодняшний день описано три трисмалонатных комплекса железа(III), из них один имеет молекулярное строение (в составе соли [Co(NH3)6][Fe(Мal)3] [18]), а два – структуру координационных гетерометаллических полимеров с натрием {Na6[Fe(Mal)3]2 ∙ 8H2O}n и натрием и барием {NaBa[Fe(Mal)3] ∙ 3H2O}n [19]. Интересно отметить, что фрагменты {Fe(Mal)3}3– во всех случаях имеют одинаковое строение, при котором полиэдр железа представляет собой практически идеальный октаэдр, а расстояния Fe–O составляют 1.957–2.030 Å. Строение гетерометаллических комплексов, описанных в [19], различно. Так, в полимерном комплексе железа(III) с натрием и барием на один атом железа(III) приходится по одному атому натрия и бария, три малонатных лиганда и три молекулы воды. В гетерометаллическом полимере железа(III)-натрия соотношение железа и натрия (Fe : Na = 1 : 3), как и в полученных соединениях I и II, однако комплекс с ионами натрия содержит в своем составе восемь молекул воды, в то время как в I и II содержится одна молекула воды, координированная к одному из атомов щелочного металла, что несколько изменяет геометрию полимера и усложняет систему водородных связей, однако не оказывает значимого влияния на трехмерное строение полимера – аналогично изученным нами гетерометаллическим комплексам. Однако, в отличие от I и II, слои атомов металлов в комплексе железа(III)-натрия не плоские, а слегка гофрированные, что затрудняет оценку расстояния между ними. Анализ трехмерного строения координационного полимера железа(III)-натрия-бария показал, что в кристалле этого соединения также можно выделить слои металлов, однако один из них гетерометаллический – образован ионами железа и натрия, а другой – гомометаллический, образован ионами бария.
В результате проведeнной работы были получены координационные соединения железа(III) с анионами малоновой кислоты и катионами рубидия и цезия. Показано, что радиус катиона (1.66 Å для Rb+, 1.88 Å для Cs+) не влияет на строение продуктов. В обоих соединениях наблюдаются слои из трисхелатных фрагментов железа(III), связанные атомами щелочных металлов в 3D-полимерную структуру.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Raptopoulou C.P., Sanakis Y., Boudalis A.K. et al. // Polyhedron. 2005. V. 24. № 5. P. 711.
Raptopoulou C.P., Boudalis A.K., Sanakis Y. et al. // Inorg. Chem. 2006. V. 45. № 5. P. 2317.
Trettenhahn G., Nagl M., Neuwirth N. et al. // Angew. Chem. Int. Ed. 2006. V. 45. P. 2794.
Chen G., Leng X., Luo J. et al. // Molecules. 2019. V. 24. № 7. P. 1211.
Lutsenko I.A., Yambulatov D.S., Kiskin M.A. et al. // ChemistrySelect. 2020. V. 5. № 38. P. 11837.
Луценко И.А., Кискин М.А., Александров Г.Г. и др. // Изв. АН. Сер. хим. 2018. Т. 67. № 3. С. 449 (Lutsenko I.A., Kiskin M.A., Aleksandrov G.G. et al. // Russ. Chem. Bull. 2018. V. 67. № 3. P. 449).
De Muro I.G., Insausti M., Lezama L. et al. // Eur. J. In-org. Chem. 1999. V. 1999. № 6. P. 935.
Yu W.W., Falkner J.C., Yavuz C.T., Colvin V.L. // Chem. Commun. 2004. P. 2306.
ippong Th., Levei E.A., Borodi Gh. et al. // J. Therm. Anal. Calorim. 2015. V. 119. P. 1001
Patra A.K., Dutta A., Bhaumik A. // ACS Appl. Mater. Interfaces. 2012. V. 4. № 9. P. 5022.
Pahalagedara M.N., Pahalagedara L.R., Kuo Ch.-H. et al. // Langmuir. 2014. V. 30. № 27. P. 8228.
Dybtsev D.N., Sapianik A.A., Fedin V.P. // Mendeleev Commun. 2017. V. 27. № 4. P. 321.
Sapianik A.A., Kiskin M.A., Samsonenko D.G. et al. // Polyhedron. 2018. V. 145. P. 147.
Sapianik A.A., Barsukova M.O., Kovalenko K.A. et al. // Dalton Trans. 2021. V. 50. P. 2807.
Sy A., Barry A.H., Gaye M. et al. // Acta Crystallogr. E. 2011. V. 67. P. m601.
Ruiz-Pérez C., Hernández-Molina M., Sanchiz J. et al. // Inorg. Chim. Acta. 2000. V. 298. № 2. P. 245.
Rodríguez-Martín Y., Sanchiz J., Ruiz-Pérez C. et al. // CrystEngComm. 2002. V. 4. № 107. P. 631.
Clegg W. // Acta Crystallogr. C. 1985. V. 41. P. 1164.
Calogero S., Stievano L., Diamandescu L. et al. // Polyhedron. 1997. V. 16. № 23. P. 3953.
Зорина-Тихонова Е.Н., Матюхина А.К., Александров Г.Г. и др. // Журн. неорган. химии. 2021. Т. 66. № 2. С. 178 (Zorina-Tikhonova E.N., Matyukhina A.K., Aleksandrov G.G. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 2. P. 179).https://doi.org/10.1134/S0036023621020212
Pasán J, Sanchiz J., Ruiz-Pérez C. et al. // New J. Chem. 2003. V. 27. № 11. P. 1557.
Pérez-Yáñez S., Castillo O., Cepeda J. et al. // Eur. J. Inorg. Chem. 2009. V. 2009. № 26. P. 3889.
Zauzolkova N., Dobrokhotova Zh., Lermontov A. et al. // J. Solid State Chem. 2013. V. 197. P. 379.
Bazhina E.S., Aleksandrov G.G., Bogomyakov A.S. et al. // Polyhedron. 2014. V. 77. P. 47.
Dobrokhotova Zh.V., Gogoleva N.V., Zorina-Tikhonova E.N. et al. // Eur. J. Inorg. Chem. 2015. V. 2015. № 19. P. 3116.
Bazhina E.S., Aleksandrov G.G., Kiskin M.A. et al. // Eur. J. Inorg. Chem. 2018. V. 2018. № 47. P. 5075.
Bazhina E.S., Gogoleva N.V., Aleksandrov G.G. et al. // ChemistrySelect. 2018. V. 3 № 48. P. 13765.
Kurganskii I.V., Bazhina E.S., Korlyukov A.A. et al. // Molecules. 2019. V. 24. P. 4582.
Зорина-Тихонова Е.Н., Гоголева Н.В., Александров Е.В. и др. // Изв. АН. Сер. хим. 2016. Т. 65. № 3. С. 759 (Zorina-Tikhonova E.N., Gogoleva N.V., Aleksandrov G.G. et al. // Russ. Chem. Bull. 2016. V. 65. № 3. P. 759).
Бажина Е.С., Шмелев М.А., Кискин М.А и др. // Коорд. химия. 2021. Т. 47. № 3. С. 159. (Bazhina E.S., Shmelev M.A., Kiskin M.A., et al. // Russ. J. Coord. Chem. 2021. V. 47. № 3. P. 186). https://doi.org/10.1134/S1070328421030015
Déniz M., Hernández-Rodríguez I., Pasán J. et al. // CrystEngComm. 2014. V. 16. P. 2766.
Stone B.S., Staples R.J., LaDuca R.L. // Inorg. Chim. Acta. 2016. V. 446. P. 176.
Ushakov I.E., Goloveshkin A.S., Zorina-Tikhonova E.N. et al. // Mendeleev Commun. 2019. V. 29. № 6. P. 643.
Bondarenko M.A., Novikov A.S., Sukhikh T.S. et al. // J. Mol. Struct. 2021. V. 1244. P. 130942.
Bondarenko M.A., Rakhmanova M.I., Plyusnin P.E. et al. // Polyhedron. 2021. V. 194. P. 114895.
Бондаренко М.А., Новиков А.С., Адонин С.А. // Журн. неорган. химии. 2021. Т. 66. № 6. С. 715 (Bondarenko M.A., Novikov A.S., Adonin S.A. // Russ. J. Inorg. Chem. 2021. V. 66. № 6. P. 814). https://doi.org/10.1134/S0036023621060061
Déniz M., Pasán J., Fabelo O. et al. // New J. Chem. 2010. V. 34. № 11. P. 2515.
Delgado F.S., Ruiz-Pérez C., Sanchiz J., et al. // Crys-tEngComm. 2006. V. 8. № 7. P. 507.
Krause L., Herbst-Irmer R., Sheldrick GM., Stalke D. // J. Appl. Crystallogr. 2015. V. 48. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Crystallogr. 2009. V. 42. P. 339.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия