Координационная химия, 2022, T. 48, № 8, стр. 489-499
Сольватоморфы комплекса железа(II) с N,N'-дизамещенным 2,6-бис(пиразол-3-ил)пиридином, претерпевающего в растворе температурно-индуцированный спиновый переход
Е. К. Мельникова 1, 2, И. А. Никовский 1, 3, А. В. Полежаев 1, 3, Ю. В. Нелюбина 1, 3, *
1 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 Московский государственный технический университет им. Н.Э. Баумана
Москва, Россия
* E-mail: unelya@ineos.ac.ru
Поступила в редакцию 26.11.2021
После доработки 18.01.2022
Принята к публикации 19.01.2022
- EDN: RHAXXH
- DOI: 10.31857/S0132344X22080047
Аннотация
При взаимодействии тридентатного лиганда 4-(2,6-бис(5-трет-бутил-1-(2,6-дихлорофенил)-1H-пиразол-3-ил)пиридин-4-ил)бензонитрила (L) с солью двухвалентного железа получен комплекс [Fe(L)2](BF4)2, выделенный в индивидуальном виде и охарактеризованный при помощи элементного анализа, спектроскопии ЯМР и рентгеновской дифракции в виде двух кристаллических модификаций, различающихся природой сольватного растворителя (сольватоморфов I, II). По результатам рентгеноструктурного анализа (CCDС № 2104367 (I), 2104368 (II)) ион железа(II) в них находится в разных спиновых состояниях и не претерпевает температурно-индуцированный спиновый переход, ранее наблюдавшийся у данного комплекса в растворе. Особенности супрамолекулярной организации двух сольватоморфов, препятствующие такому переходу, изучены с привлечением анализа поверхностей Хиршфельда.
Разработка функциональных материалов, свойствами которых можно управлять на молекулярном уровне, является важным шагом на пути создания наноразмерных устройств [1]. Один из типов материалов образуeт комплексные соединения переходных металлов, способные переключать свое спиновое состояние под действием внешних возмущений [2], таких как изменение температуры и давления, приложение магнитного и электрического поля или даже присутствие различных аналитов [3]. Данная способность [4] чаще всего встречается у комплексов железа(II) в (псевдо)октаэдрическом окружении азотсодержащих лигандов [5, 6], у которых переход происходит между низкоспиновым (НС) диамагнитным и высокоспиновым (ВС) парамагнитным состояниями. Сопутствующее этому изменение магнитных и других свойств [7, 8] позволяет использовать такие соединения в качестве переключаемых компонентов различных устройств и материалов, включая оптические дисплеи [9], устройства памяти [10], молекулярные сенсоры [11–14], термометры [15, 16] и контрастные агенты [17] для медицинской диагностики.
Хотя явление спинового перехода известно давно [2], рациональный дизайн перечисленных выше материалов значительно осложняется не всегда предсказуемым влиянием кристаллической упаковки [18, 19], которое может приводить к появлению в кристаллическом образце резкого спинового перехода с гистерезисом [20, 21] или, наоборот, к его отсутствию [22, 23]. Одним из классов соединений, у которых изменение спинового состояния в растворе [24] и в твердом состоянии [25] наиболее изучено, являются комплексы железа(II) c бис(пиразол-1-ил)пиридинами [26, 27]. Их обширные исследования позволили выработать ряд рекомендаций по химической модификации лиганда для управления параметрами спинового перехода [24], которые не удалось до сих пор обнаружить для изомерных бис(пиразол-3-ил)пиридинов [28, 29]. Ключевое отличие двух типов лигандов – наличие во втором NH-групп, образующих водородные связи с противоионами или молекулами растворителя в растворе [30, 31]. Однако до недавнего времени [32] любой заместитель в первом положении бис(пиразол-3-ил)пиридина приводил к комплексам железа(II), стабилизированным исключительно в состоянии ВС [28]. Сочетание двух этих факторов ранее не позволяло управлять спиновым состоянием иона металла в соответствующих комплексах методами “молекулярного дизайна” [28].
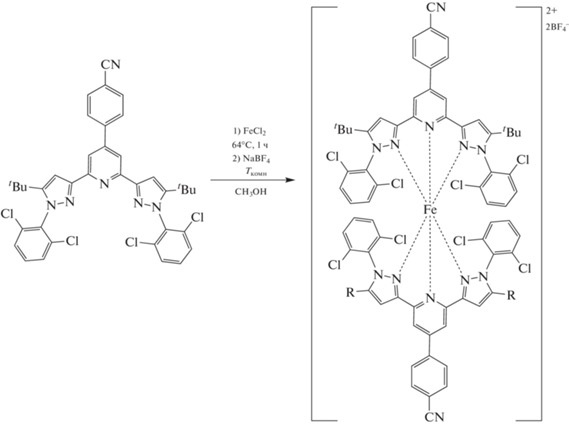
Недавно мы синтезировали первые комплексы железа(II) с N,N'-дизамещенными бис(пиразол-3-ил)пиридинами, претерпевающими температурно-индуцированный спиновый переход путем подбора размеров орто-заместителей в N-фенильных группах лигандов данного типа [32]. Кроме того, введение п-цианофенильного заместителя в четвертое положение пиридинового кольца одного из них (схема 1 ) [33] позволило впервые сдвинуть температуру такого перехода в область комнатной температуры, необходимой для практических применений [34].
В настоящей работе синтезирован комплекс [Fe(L)2](BF4), содержащий электронодонорные трет-бутильные группы в положении 5 пиразол-3-ильного кольца N,N'-дизамещенного лиганда L (схема 1 ) и по этой причине претерпевающий в растворе температурно-индуцированный спиновый переход в районе 210 К [33]. Комплекс существует в виде двух кристаллических модификаций (I, II), отличающихся как природой сольватного растворителя, т.е. являющихся сольватоморфами, так и спиновым состоянием иона железа(II), что однозначно установлено при помощи рентгеноструктурного анализа.
Схема 1 .
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции, связанные с синтезом лиганда L и комплекса [Fe(L)2](BF4)2, выполняли на воздухе с использованием коммерчески доступных органических растворителей, перегнанных в атмосфере аргона. Хлорид железа(II) и NaBF4 (Sigma-Aldrich) использовали без дополнительной очистки. 2,6-Дихлорфенилгидразин синтезировали из коммерчески доступного 2,6-дихлоранилина с использованием стандартного протокола диазотирования с последующим восстановлением SnCl2 [32]. Лиганд L и комплекс I получали по ранее описанной методике [33]. Анализ на углерод, азот и водород проводили на микроанализаторе CarloErba, модель 1106. Регистрацию спектров ЯМР 1Н проводили при комнатной температуре на спектрометре Varian Inova 400. Химические сдвиги приведены в миллионных долях относительно остаточного сигнала растворителя.
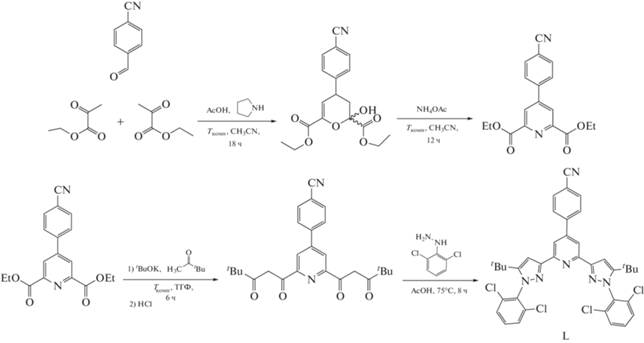
Синтез диэтил 4-(4-цианофенил)пиридин-2,6-дикарбоксилата. К раствору 4-цианобензальдегида (6.55 г, 50 ммоль) и этилпирувата (11.6 мл, 150 ммоль) в ацетонитриле (50 мл) добавляли уксусную кислоту (2.86 мл, 50 ммоль) и пирролидин (1.64 мл, 20 ммоль) при комнатной температуре (25°C). При этой температуре смесь перемешивали в течение 30 ч, после чего к ней добавляли NH4OAc (11.6 г, 150 ммоль) и уксусную кислоту (2.86 мл, 50 ммоль). Полученную смесь перемешивали при той же температуре в течение 24 ч. Затем смесь выливали в насыщенный водный раствор NaHCO3 (5.0 мл) и экстрагировали этилацетатом. Органические слои объединяли, сушили над Na2SO4, фильтровали, концентрировали и очищали колоночной флэш-хроматографией (элюент – гексан : этилацетат (5 : 1)). Выход 4.2 г (26%).
ЯМР 1H (CDCl3; 400 MГц; δ, м.д.): 1.48 (т., 3JНН= = 7.2 Гц, 6H, CH3), 4.53 (к., 3JНН= 7.2 Гц, 4H, CH2), 7.87–7.83 (м., 4H, 2-PhCN + 3-PhCN), 8.49 (c., 2H, 3-Py).
Синтез 4-(2,6-бис(5-трет-бутил-1-(2,6-дихлорофенил)-1H-пиразол-3-ил)пиридин-4-ил)бензонитрила (L). Пинаколон (0.962 мл, 7.71 ммоль) добавляли к раствору трет-бутилата калия (1.04 г, 9.24 ммоль) и диэтил 4-(4-цианофенил)пиридин-2,6-дикарбоксилата (1 г, 3.08 ммоль) в сухом ТГФ (100 мл). Смесь перемешивали при комнатной температуре в течение 3 ч. Продукт диспергировали в воде (30 мл), а полученный раствор обрабатывали 1 М соляной кислотой до тех пор, пока он не становился кислым (pH 5). Выпавший осадок отфильтровывали, промывали водой и сушили в высоком вакууме. Продукт использовали без дополнительной очистки. Смесь 4-(2,6-бис(4,4-диметил-3-оксопентаноил)пиридин-4-ил)бензонитрила (0.863 г, 1.995 ммоль) и 2,6-дихлорфенилгидразина (0.742 г, 4.19 ммоль) растворяли в 20 мл уксусной кислоты с образованием оранжевой суспензии, которую затем нагревали при 70°С в течение 8 ч до образования светло-желтого осадка. Осадок отфильтровывали, промывали уксусной кислотой, небольшим количеством ДМФА, затем водой и сушили в вакууме. Продукт использовали без дополнительной очистки. Выход 1.15 г (81%).
ЯМР 1H (ДМСО-d6; 400 MГц; δ, м.д.): 1.23 (с., 18Н, t-Bu), 7.14 (с., 2H, Pz–CH), 7.64 (т., 3JH,H= 8.5 Гц, 2H, 4-Ph), 7.74 (д., 3JH,H= 8.5 Гц, 4H, 4-Ph), 7.90 (д., 3JH,H= 8.0 Гц, 2H, 2-PhCN), 8.04 (д., 2H, 2-PhCN), 8.07 (c., 2H, 3-Py).
Синтез [Fe(L)2](BF4)2. В колбе объемом 50 мл лиганд L (0.112 г, 0.157 ммоль) суспендировали в 15 мл метанола. К полученной суспензии по каплям добавляли раствор безводного FeCl2 (0.0099 г, 0.0785 ммоль) в метаноле (5 мл) и кипятили в течение 1 ч. К горячему раствору добавляли твердый NaBF4 (0.0172 г, 0.157 ммоль), перемешивали в течение 15 мин и доводили температуру до комнатной. Непрореагировавший лиганд отфильтровывали, метанольный раствор упаривали. Твердый остаток сушили в вакууме. Выход 120 мг (92%).
ЯМР 1H (CD3CN; 600 MГц; δ, м.д.): 1.45 (уш.с., 36H, t-Bu), 9.95 (уш.с., 8H, 3-Ph), 11.12 (уш.с., 4H, 2-PhCN/3-PhCN), 12.91 (уш.с., 4H, 2-PhCN/3-PhCN), 19.17 (уш.с., 4H, 4-Ph), 51.07 (уш.с., 4H, Pz–CH), 66.61 (уш.с., 4H, м-Py-H).
РСА сольватоморфов I и II, полученных медленным испарением на воздухе раствора комплекса [Fe(L)2](BF4)2 в метаноле [33] и газовой диффузией диэтилового эфира в его раствор в ацетонитриле соответственно, проводили на дифрактометре Bruker APEX2 DUO CCD (MoKα-излучение, графитовый монохроматор, ω-сканирование). Структуры расшифрованы с использованием программы ShelXT [35] и уточнены в полноматричном МНК с помощью программы Olex2 [36] в анизотропном приближении по $F_{{hkl}}^{2}$. Положения атомов водорода рассчитаны геометрически и уточнены в изотропном приближении по модели наездника. Разупорядоченные молекулы растворителя (воды) в сольватоморфе I описывали в виде диффузного вклада в общее рассеяние с помощью опции Solvent Mask программы Olex2 [36]. Основные кристаллографические данные и параметры уточнения представлены в табл. 1.
Таблица 1.
Основные кристаллографические данные и параметры уточнения для сольватоморфов I и II
| Параметр | Значения | |
|---|---|---|
| I | II | |
| Брутто-формула | C76H64B2N12F8Cl8Fe | C78H67B2N13F8Cl8Fe |
| Молекулярная масса | 1658.46 | 1699.51 |
| T, K | 120 | 120 |
| Кристаллическая система | Ромбическая | Триклинная |
| Пр. группа | P21212 | $P\bar {1}$ |
| Z | 8 | 2 |
| Z' | 2 | 1 |
| a, Å | 24.465(6) | 15.434(3) |
| b, Å | 48.605(11) | 16.106(3) |
| c, Å | 13.499(3) | 17.372(3) |
| α, град | 90 | 73.592(5) |
| β, град | 90 | 69.381(4) |
| γ, град | 90 | 70.419(5) |
| V, Å3 | 16052(6) | 3741.2(12) |
| ρ(выч.), г см–3 | 1.373 | 1.509 |
| μ, см–1 | 5.23 | 5.63 |
| F(000) | 6784 | 1740 |
| 2θmax, град | 56 | 54 |
| Число измеренных отражений | 183 700 | 38 156 |
| Число независимых отражений | 38 727 | 15 869 |
| Число отражений с I > 3σ(I) | 13 633 | 6440 |
| Количество уточняемых параметров | 2019 | 1072 |
| R1 | 0.0954 | 0.0766 |
| wR2 | 0.2580 | 0.1595 |
| GOОF | 0.956 | 0.917 |
| Остаточная электронная плотность (max/min), e Å–3 | 1.121/–0.530 | 0.798/–0.681 |
Координаты атомов и полные кристаллографические параметры для сольватоморфов I и II депонированы в Кембриджском банке структурных данных (CCDC № 2104367, 2104368; http://www.ccdc.cam.ac.uk/).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Комплекс [Fe(L)2](BF4)2 получен с практически количественным выходом при взаимодействии безводного хлорида железа(II) с N,N'-дизамещенным бис(пиразол-3-ил)пиридином (L) в метаноле и последующей замене противоиона на тетрафторборат-анион, обеспечивающий более высокую растворимость целевого продукта (cхема 1). Сам предшественник лиганда L синтезировали из диэтил-4-(4-цианофенил)пиридин-2,6-дикарбоксилата по предложенной нами ранее методике [33], включающей конденсацию Кляйзена между ним и пинаконом под действием трет-бутилата калия в ТГФ и конденсацию образующегося дикетона и 2,6-дихлорфенилгидразина с последующей циклизацией в одну стадию в уксусной кислоте (cхема 2).
Схема 2 .
Комплекс [Fe(L)2](BF4)2 выделен в индивидуальном виде и охарактеризован при помощи элементного анализа и спектроскопии ЯМР, которая ранее [33] показала наличие у него температурно-индуцированного спинового перехода в растворе ДМФА и ацетонитрила с температурой такого перехода около 210 К согласно данным традиционно используемого для этих целей метода Эванса [28, 37].
Однако попытки его получения в виде монокристаллов, пригодных для проведения РСА, привели к образованию двух типов кристаллов при медленном испарении на воздухе раствора комплекса [Fe(L)2](BF4)2 в метаноле [33] (темно-красные призмы) и при диффузии диэтилового эфира в его раствор в ацетонитриле (оранжевые иглы). Их последующее рентгеноструктурное исследование показало, что они принадлежат разным сольватоморфам I и II, отличающимся природой сольватного растворителя (вода и ацетонитрил), а их цвет указывал на разное спиновое состояние иона железа(II) [2]. Действительно, согласно данным РCА при 120 К (рис. 1), комплекс [Fe(L)2](BF4)2 в сольватоморфах I и II находится в состояниях НС и ВС соответственно, что однозначно следует из анализа его геометрических параметров (табл. 2). В сольватоморфе II длины связей иона железа(II) с атомами азота двух N,N'-дизамещенных лигандов L находятся в диапазоне, типичном для ВС-комплексов железа(II) с азотсодержащими гетероциклами (2.0–2.2 Å), тогда как в сольватоморфе I [33] они едва превышают 2 Å, что указывает на состояние НС [2].
Рис. 1.
Общий вид катиона [Fe(L)2]2+ в сольваторморфах I (а) и II (б) в представлении атомов эллипсоидами тепловых колебаний (p = 20%). Атомы водорода и минорные компоненты разупорядоченных фрагментов не показаны для ясности. Нумерация приведена только для ионов железа(II) и координированных к ним атомов азота.
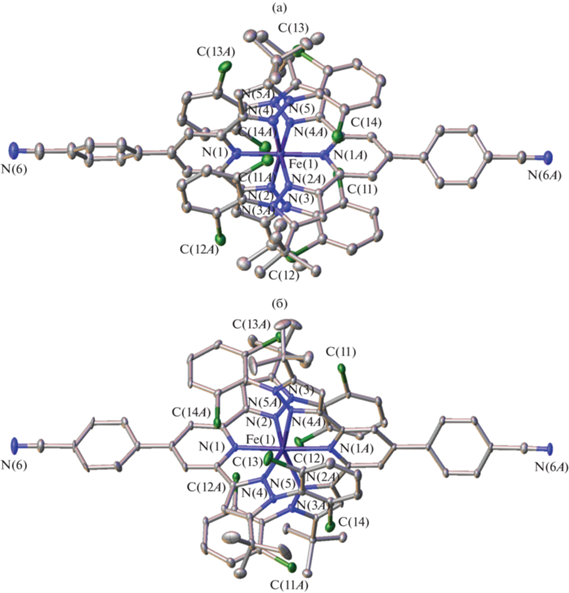
Таблица 2.
Основные геометрические параметры* комплекса [Fe(L)2](BF4)2 в сольватомофах I и II по данным рентгеноструктурного исследования при 120 К
| Параметр | I | II |
|---|---|---|
| Fe–N(Py), Å | 1.891(11)–1.935(10) | 2.053(6)–2.062(6) |
| Fe–N(Pz), Å | 2.011(11)–2.049(11) | 2.202(4)–2.236(4) |
| θ, град | 89.65(11) [89.93(10)]* | 87.36(4) |
| N(Py)-Fe-N(Py), град | 179.1(4) [179.6(4)] | 177.21(17) |
| S(OC-6) | 2.351 [2.461] | 4.755 |
* θ – двугранный угол между среднеквадратичными плоскостями 2,6-бис(пиразол-3-ил)пиридиновых лигандов, а атомы N(Py) и N(Pz) соответствуют атомам азота пиридинового и пиразол-3-ильного фрагментов. S(OC-6) – отклонение формы координационного полиэдра от идеального октаэдра (OC-6). В квадратных скобках приведены параметры для второго симметрически-независимого катиона [Fe(L)2]2+ в сольватоморфе I.
Аналогичный вывод можно сделать и при сопоставлении значений угла N(Py)FeN(Py) и угла между среднеквадратичными плоскостями двух лигандов L в комплексе [Fe(L)2](BF4)2, которые равны 90° и 180° в случае идеального октаэдра, характерного для N(6)-координационного окружения иона железа(II) в состоянии НС. Соответствующие значения в сольватоморфе I составляют 89.65(11)° и 179.1(4)° (89.93(10)° и 179.6(4)° для второго симметрически независимого катиона [Fe(L)2]2+) и 87.36(4)° и 177.21(17)° в сольватоморфе II. Наблюдаемое в последнем искажение координационного полиэдра в сторону тригональной призмы типично для комплексов железа(II) в состоянии ВС [2].
Для количественного описания такого искажения удобно использовать так называемые “меры симметрии” [38]. Чем меньше значение “меры симметрии”, соответствующей выбранному идеальному многограннику (например, октаэдру), тем точнее форма координационного полиэдра может быть описана соответствующей фигурой. Значения октаэдрической “меры симметрии”, оцененной на основе рентгенодифракционных данных для I и II с помощью программы Shape 2.1 [38] (табл. 2), позволяют описать форму координационного полиэдра иона железа(II) в обоих сольватоморфах как искаженный октаэдр. Однако это искажение ожидаемо более выражено у ВС-комплекса [Fe(L)2](BF4)2 в сольватоморфе II, тогда как наблюдаемое у НС-комплекса в сольватоморфе I небольшое отличие октаэдрической “меры симметрии” от нуля вызвано жесткостью тридентатных бис(пиразол-3-ил)пиридиновых лигандов [39].
Все вышеперечисленные параметры позволяют сделать вывод о различном спиновом состоянии комплекса [Fe(L)2](BF4)2 в двух сольватоморфах, которое не меняется с температурой. Об этом, например, свидетельствует сохранение кристаллами своего характерного цвета (темно-красного и оранжевого [2]) при комнатной температуре. К сожалению, недостаточно хорошее качество монокристаллов для сольватоморфа I, который мог бы переходить в ВС состояние при нагревании, не позволило нам получить для него рентгеноструктурные данные при этой температуре.
Отсутствие температурно-индуцированного спинового перехода у комплекса [Fe(L)2](BF4)2, претерпевающего такой переход в растворе [33], является следствием упомянутого выше влияния кристаллической упаковки [18, 19], которая приводит к стабилизации его состояний НС и ВС в сольватоморфах I и II соответственно. Ключевую роль в этом, очевидно, играет природа сольватного растворителя. В сольватоморфе I, содержащем в независимой части элементарной ячейки два катиона [Fe(L)2]2+, таким растворителем, предположительно, является вода, которая попадает в процессе кристаллизации на воздухе и которую из-за сильного разупорядочения нам пришлось описать в виде диффузного вклада в общее рассеяние рентгеновских лучей кристаллом. Напротив, сольватоморф II содержит одну молекулу ацетонитрила, приходящуюся на одну симметрически независимую формульную единицу комплекса [Fe(L)2](BF4)2, в результате чего он имеет совершенно другое кристаллическое окружение.
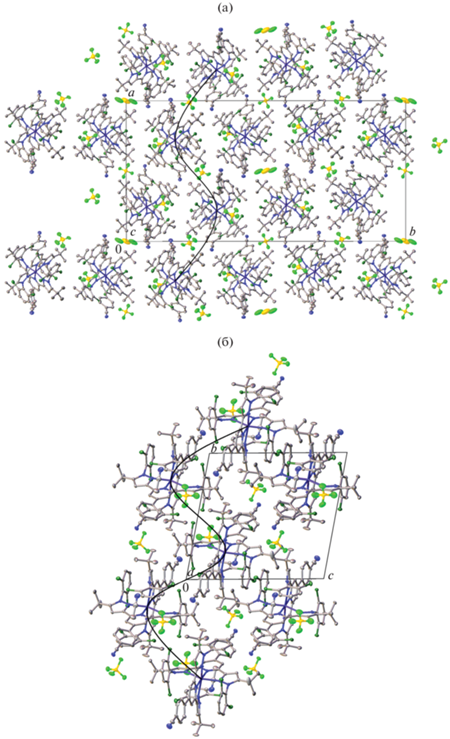
Одной из характерных особенностей супрамолекулярной организации комплексов металлов, оказывающей решающее влияние на параметры спинового перехода в их кристаллических образцах [40], являются так называемые “терпиридиновые объятия” (от англ. “terpyridine embraces”), образование которых происходит за счет стекинг-взаимодействий между пиридиновыми или аналогичными гетероциклическими фрагментами соответствующих лигандов [41, 42]. Подобных ассоциатов, однако, нет в обоих сольватоморфах I, II, что согласуется с отсутствием в них температурно-индуцированного спинового перехода. Напротив, их кристаллическую упаковку можно представить в виде бесконечных спиралей из катионов [Fe(L)2]2+, связанных между собой только слабыми межмолекулярными контактами вдоль кристаллографической оси a в сольватоморфе I и оси b в сольватоморфе II (рис. 2). Между ними располагаются тетрафторборат-анионы и соответствующие молекулы растворителя (рис. 2) – воды, стабилизирующей состояние НС иона железа(II) в бис(пиразол-3-ил)пиридиновых комплексах [31], или ацетонитрила.
Рис. 2.
Фрагменты кристаллической упаковки комплекса [Fe(L)2](BF4)2 в сольватоморфах I (а) и II (б), иллюстрирующие образование бесконечных спиралей из катионов [Fe(L)2]2+.
Наблюдаемые различия в кристаллическом окружении катиона [Fe(L)2]2+ в двух сольватоморфах можно визуализировать при помощи поверхностей Хиршфельда [43, 44], которые делят кристалл на “молекулярные” домены с доминирующим вкладом в электронную плотность определенных молекул или ионов, и 2D-разверток этих поверхностей [45], отражающих частоту реализации различных типов межмолекулярных взаимодействий по расстояниям от точки на поверхности Хиршфельда до ближайшего атома внутри (di) и снаружи (de) указанной поверхности. С поправкой на сумму ван-дер-ваальсовых радиусов таких пар атомов (dnorm) эти расстояния позволяют кодировать прочность взаимодействий на поверхности Хиршфельда цветом: синие области отвечают межатомным расстояниям меньше суммы ван-дер-ваальсовых радиусов, а красные, наоборот, расстояниям больше этой суммы.
На поверхностях Хиршфельда катиона [Fe(L)2]2+ в сольватоморфах I и II (рис. 3, 4) ярко-красные области наблюдаются в местах его соприкосновения с тетрафторборат-анионами, образующими с ним C–H…F контакты, парциальный вклад которых в формирование этих поверхностей составляет 18.2 и 14.0% в I и II соответственно (табл. 3). Им отвечают области с невысокой концентрацией точек di, de по краям 2D-разверток (рис. 3, 4), а наиболее интенсивно заселенные области на этих развертках – N…H и H…H – контактам с парциальными вкладами 10.5 и 49.7% (11.0 и 47.4% для второго симметрически независимого катиона) в сольватоморфе I и, соответственно, 12.8 и 47.2% в сольватоморфе II. По краям 2D-разверток также располагаются области контактов Cl…H, вносящих примерно одинаковый вклад в поверхность Хиршфельда в I и II (~9.5%), и контактов C…H, для которых соответствующие значения составляют 7.6% (9.2% для второго симметрически независимого катиона) и 12.3%. Хотя в N,N'-дизамещенном лиганде L присутствует множество ароматических фрагментов, включая п-цианофенильную группу в положении 4 пиридина, они не участвуют в образовании стекинг-взаимодействий ни в одном, ни в другом сольватоморфе. При этом основное отличие во вкладах межмолекулярных взаимодействий (табл. 3) касается контактов C–H…F с тетрафторборат-анионами, которые отличаются в двух сольватоморфах на 4.1%, и контактов C…H (в том числе с сольватными молекулами ацетонитрила в I), для которых различие в среднем составляет 3.9%.
Рис. 3.
Поверхности Хиршфельда для двух симметрически независимых катионов [Fe(L)2]2+ (a, в) в сольватоморфе I и 2D-развертки этих поверхностей (б, г), созданные с помощью программы Crystal Explorer [46]. Здесь и далее на поверхностях Хиршфельда межмолекулярные взаимодействия с межатомными расстояниями меньше, равны или больше суммы ван-дер-ваальсовых радиусов и показаны красными, белыми и синими областями соответственно. Зеленые и синие области на 2D-развертках этих поверхностей отвечают более высокой и более низкой концентрации точек, соответствующих парам расстояний (di, de).
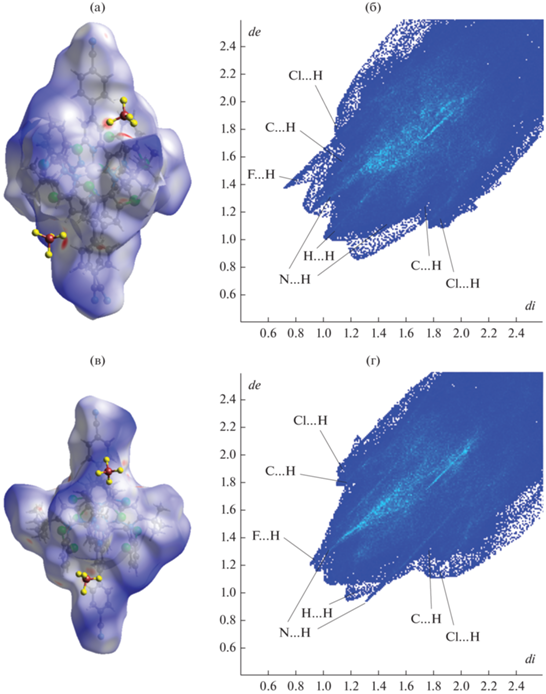
Рис. 4.
Поверхность Хиршфельда для катиона [Fe(L)2]2+ в сольватоморфе II (а) и 2D-развертка этой поверхности (б), созданные с помощью программы Crystal Explorer [46].
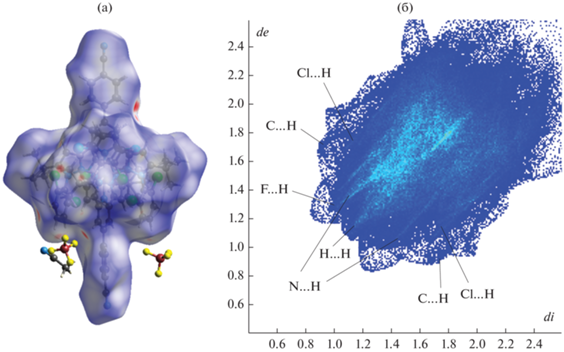
Таблица 3.
Парциальные вклады (в %) различных типов взаимодействий в образование поверхности Хиршфельда катиона [Fe(L)2]2+ в сольватоморфах I и II
| Взаимодействия | I* | II |
|---|---|---|
| С…Н | 7.6 [9.2] | 12.3 |
| N…H | 10.5 [11.0] | 12.8 |
| H…H | 49.7 [47.4] | 47.2 |
| F…H | 18.2 [18.1] | 14.0 |
| Cl…H | 9.8 [9.9] | 9.4 |
Таким образом, описанный нами ранее [33] комплекс железа(II) [Fe(L)2](BF4)2 с N,N'-замещенным 2,6-бис(пиразол-3-ил)пиридином, который претерпевает температурно-индуцированный спиновый переход в различных растворителях, имеет разное спиновое состояние в двух обнаруженных нами кристаллических модификациях (сольватоморфах). На это однозначно указывают полученные для них низкотемпературные рентгенодифракционные данные, в первую очередь, длины связей Fe–N и форма координационного полиэдра, характерная для состояний НС или ВС иона железа(II) в (псевдо)октаэдрическом окружении тридентатных гетероциклических лигандов [2].
При наличии спинового перехода в растворах комплекса [Fe(L)2](BF4)2 [33] отсутствие его в указанных сольватоморфах, очевидно, связано с эффектами кристаллической упаковки, в том числе с природой сольватного растворителя – ацетонитрила в ВС-сольватоморфе II и воды в его НС-аналоге I. Последняя, например, хорошо известна своей способностью стабилизировать состояние НС комплексов железа(II) с бис(пиразол-3-ил)пиридинами [31]. Согласно анализу поверхностей Хиршфельда и их 2D-разверток, основное отличие во вкладах различных типов межмолекулярных взаимодействий в двух сольватоморфах наблюдается для контактов C–H…F с тетрафторборат-анионами и C…H, в том числе с сольватными молекулами ацетонитрила в сольватоморфе I. Они, по-видимому, и стабилизируют комплекс [Fe(L)2](BF4)2 в разных спиновых состояниях (НС и ВС), тем самым препятствуя протеканию температурно-индуцированного спинового перехода в соответствующих кристаллических образцах.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Song J.-H., Min S.-H., Kim S.-G. et al. // Int. J. Prec. Eng. Manufactur. Green Tech. 2021. V. 9. P. 323.
Halcrow M.A. Spin-Crossover Materials: Properties and Applications. Chichester (United Kingdom): John Wiley & Sons, Ltd., 2013.
Neville S.M., Halder G.J., Chapman K.W. et al. // J. Am. Chem. Soc. 2009. V. 131. № 34. P. 12106.
Yamasaki M., Ishida T. // J. Mat. Chem. C. 2015. V. 3. № 30. P. 7784.
Guionneau P., Le Gac F., Kaiba A. et al. // Chem. Commun. 2007. P. 3723.
Guionneau P., Costa J.S., Létard J.F. // Acta Crystallogr. C. 2004. V. 60. № 11. P. 587.
Molnár G., Rat S., Salmon L. et al. // Adv. Mater. 2017. V. 30. № 5. P. 1703862.
Senthil Kumar K., Ruben M. // Coord. Chem. Rev. 2017. V. 346. P. 176.
Kahn O., Kröber J., Jay C. // Adv. Mater. 1992. V. 4. № 11. P. 718.
Villalva J., Develioglu A., Montenegro-Pohlhammer N. et al. // Nat. Commun. 2021. V. 12. № 1. P. 1578.
Linares J., Codjovi E., Garcia Y. // Sensors. 2012. V. 12. № 4. P. 4479.
Thorarinsdottir A.E., Gaudette A.I., Harris T.D. // Chem. Sci. 2017. V. 8. № 3. P. 2448.
Gaudette A.I., Thorarinsdottir A.E., Harris T.D. // Chem. Commun. 2017. V. 53. № 96. P. 12962.
Wang J., Gondrand C., Touti F., Hasserodt J. // Dalton Trans. 2015. V. 44. № 35. P. 15391.
Thorarinsdottir A.E., Gaudette A.I., Harris T.D. // Chem. Sci. 2017. V. 8. № 3. P. 2448.
Jeon I.-R., Park J.G., Haney C.R., Harris T.D. // Chem. Sci. 2014. V. 5. № 6. P. 2461.
Tsukiashi A., Min K.S., Kitayama H. et al. // Sci. Rep. 2018. V. 8. № 1. P. 14911.
Elhaïk J., Kilner C.A., Halcrow M.A. // CrystEngComm. 2005. V. 7. № 23. P. 151.
Kershaw Cook L.J., Kulmaczewski R., Cespedes O., Halcrow M.A. // Chem. Eur. J. 2015. V. 22. № 5. P. 1789.
Brooker S. // Chem. Soc. Rev. 2015. V. 44. № 10. P. 2880.
Halcrow M.A. // Chem. Lett. 2014. V. 43. № 8. P. 1178.
Nikovskiy I.A., Polezhaev A.V., Novikov V.V. et al. // Crystals. 2021. V. 11. № 8. P. 922.
Melnikova E.K., Aleshin D.Y., Nikovskiy I.A. et al. // Crystals. 2020. V. 10. № 9. P. 793.
Kershaw Cook L.J., Kulmaczewski R., Mohammed R. et al. // Angew. Chem. Int. Ed. 2016. V. 55. № 13. P. 4327.
Halcrow M.A., Capel Berdiell I., Pask C.M., Kulmaczewski R. // Inorg. Chem. 2019. V. 58. № 15. P. 9811.
Halcrow M.A. // Coord. Chem. Rev. 2005. V. 249. № 25. P. 2880.
Halcrow M.A. // Coord. Chem. Rev. 2009. V. 253. № 21. P. 2493.
Halcrow M.A. // Crystals. 2016. V. 6. № 5. P. 58.
Kershaw Cook L.J., Mohammed R., Sherborne G. et al. // Coord. Chem. Rev. 2015. V. 289. P. 2.
Barrett S.A., Halcrow M.A. // RSC Adv. 2014. V. 4. № 22. P. 11240.
Barrett S.A., Kilner C.A., Halcrow M.A. // Dalton Trans. 2011. V. 40. № 45. P. 12021.
Nikovskiy I., Polezhaev A.V., Novikov V.V. et al. // Chem. Eur. J. 2020. V. 26. P. 5629.
Aleshin D.Y., Nikovskiy I., Novikov V.V. et al. // ACS Omega. 2021. V. 6. № 48. P. 33111.
Khusniyarov M.M. // Chem. Eur. J. 2016. V. 22. № 43. P. 15178.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Ap-pl. Cryst. 2009. V. 42. P. 339.
Evans D.F. // J. Chem. Soc. 1959. P. 2003.
Alvarez S. // Chem. Rev. 2015. V. 115. P. 13447.
Craig G.A., Costa J.S., Roubeau O. et al. // Chem. Eur. J. 2012. V. 18. № 37. P. 11703.
Pritchard R., Kilner C.A., Halcrow M.A. // Chem. Commun. 2007. P. 577.
Scudder M.L., Goodwin H.A., Dance I.G. // New J. Chem. 1999. V. 23. № 7. P. 695.
McMurtrie J., Dance I. // CrystEngComm. 2010. V. 12. № 10. P. 2700.
McKinnon J.J., Mitchell A.S., Spackman M.A. // Chem. Eur J. 1998. V. 4. № 11. P. 2136.
Spackman M.A., Jayatilaka D. // CrystEngComm. 2009. V. 11. № 1. P. 19.
Spackman M.A., McKinnon J.J. // CrystEngComm. 2002. V. 4. № 66. P. 378.
Wolff S.K., Grimwood D.J., McKinnon J.J. et al. CrystalExplorer. Version 3.1. Perth (Australia): Univ. of Western Australia, 2012.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия