Координационная химия, 2022, T. 48, № 9, стр. 543-550
Комплексы цимантренатов цинка, никеля(II) и кобальта(II) с пиразолом и 3,5-диметилпиразолом: синтез и особенности строения
М. А. Уварова 1, *, С. Е. Нефедов 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: yak_marin@mail.ru
Поступила в редакцию 10.03.2022
После доработки 18.03.2022
Принята к публикации 21.03.2022
- EDN: GEHYMZ
- DOI: 10.31857/S0132344X22090092
Аннотация
Показано, что взаимодействие цимантренатов M[(OOC5CH4)Mn(CO)3]2(MeOH)4 (M = Zn, Co(II), Ni(II)) с пиразолом (HPz) приводит к замене лабильных молекул метилового спирта на гетероцикличекий лиганд, образуя моноядерные комплексы Zn[(OOCC5H4)Mn(CO)3]2(HPz)2 (I), Ni[(OOCC5H4)-Mn(CO)3]2 (HPz)4 (II) и Co[(OOCC5H4)Mn(CO)3]2(HPz)4 (III). Аналогичная реакция цимантрената кобальта с более основным и стерически объемным 3,5-диметилпиразолом (HDmpz) приводит к образованию комплекса Co[(OOCC5H4)Mn(CO)3]2(HDmpz)2 (IV). Соединения I–IV охарактеризованы методами РСА (CCDC № 2157671 (I), 2157672 (II), 2157669 (III), 2157670 (IV)), ИК-спектроскопии и элементного анализа.
Поиск синтетических подходов к получению гетерометаллических соединений продолжает оставаться актуальной задачей современной координационной химии [1–3]. Комбинирование фрагментов с различной природой металлоцентров позволяет создавать материалы, обладающие уникальными физико-химическими свойствами [4–10]. Существует несколько подходов к сборке гетерометаллических комплексов, одним из которых является получение карбоксилатов переходных металлов, содержащих атом гетерометалла в карбоксилат-анионе (циментрен, хромоцен, ферроцен) [11–20]. Также немалую роль в сборке гетерометаллических соединений играет дополнительный лиганд, например пиразол.
Пиразол при взаимодействии с карбоксилатами переходных металлов может координироваться монодентатно или депротонироваться и формировать пиразолат-мостиковые комплексы вплоть до координационных полимеров [21–28]. Особенности реакции, состав и строение образующихся продуктов зависят от природы переходного металла, заместителя R в карбоксилат-анионе и заместителей в молекуле пиразола [29–33]. В частности, реакции цимантренатов марганца(II) с пиразолом и 3,5-диметилпиразолом не приводят к его депротонированию [19–30], а карбоксилаты кобальта(II) и цинка (пивалаты, ацетаты, бензоаты) дают пиразолат-мостиковые комплексы [34–36].
Ранее были получены комплексы цимантренатов кобальта, цинка, никеля и марганца с четырьмя координированными молекулами метанола M[(OOCC5H4)Mn(CO)3]2(MeOH)4 (M = Zn, Co(II), Ni(II), Mn(II)) [37–40]. В настоящей работе сообщается о синтезе и строении продуктов реакций цимантренатов цинка, никеля и кобальта с пиразолом и 3,5-диметилпиразолом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали растворители: метанол, ацетонитрил, хлороформ, гептан (Химмед), пиразол и 3,5-диметилпиразол фирмы ACROS. Исходные комплексы M[(OOCC5H4)Mn(CO)3]2(MeOH)4 (M = Zn, Co(II), Ni(II)) синтезировали по методикам [37–40], цимантрен-карбоновую кислоту синтезировали согласно методикe, приведенной в [41].
Синтез Zn[(OOCC5H4)Mn(CO)3]2(HPz)2 (I). К раствору 0.1 г (0.15 ммоль) Zn[(OOCC5H4)-Mn(CO)3]2(MeOH)4 в 10 мл хлороформа добавляли 0.04 г (0.6 ммоль) пиразола и кипятили 1 ч. К полученному раствору добавляли 2 мл гексана и оставляли в холодильнике (5°С) на сутки. Образовавшиеся белые кристаллы отделяли от маточного раствора декантацией и сушили в токе аргона. Выход 0.1 г (80%).
ИК-спектр (ν, см–1): 2961 сл, 2854 сл, 2021 с, 1928 с., 1580 ср, 1482 ср, 1390 с, 1362 с, 1259 с, 1189 ср, 1067 с, 1013 с, 954 сл, 864 сл, 793 с, 746 с, 703 сл, 665 ср, 629 с, 538 ср, 464 ср, 430 сл, 421 сл, 411 ср.
Синтез Ni[(OOCC5H4)Mn(CO)3]2(HPz)4 (II). К раствору 0.1 г (0.15 ммоль) Ni[(OOCC5H4)-Mn(CO)3]2(MeOH)4 в 10 мл хлороформа добавляли 0.04 г (0.6 ммоль) пиразола и кипятили 1 ч. К полученному раствору добавляли 5 мл гептана и оставляли в холодильнике (5°С) на сутки. Образовавшиеся кристаллы салатового цвета отделяли от маточного раствора декантацией и сушили в токе аргона. Выход 76% (0.095 г).
ИК-спектр (ν, см–1): 3134 сл, 2893 сл, 2013 с, 1924 с, 1570 ср, 1536 ср, 1474 с, 1390 с, 1355 с, 1264 ср, 1211 сл, 1167 сл, 1136 ср, 1047 с, 1059 с, 1028 ср, 934 ср, 854 сл, 840 ср, 815 ср, 755 с, 663 ср, 630 с, 604 с, 540 с, 488 ср, 459 ср, 441 сл.
Синтез Co[(OOCC5H4)Mn(CO)3]2(Hpz)4 (III). К раствору 0.1 г (0.15 ммоль) Co [(OOCC5H4)-Mn(CO)3]2(MeOH)4 в 10 мл хлороформа добавляли 0.04 г (0.6 ммоль) пиразола и кипятили 1 ч. К полученному раствору добавляли 5 мл гептана и оставляли при комнатной температуре на сутки. Образовавшиеся фиолетовые кристаллы отделяли от маточного раствора декантацией и сушили в токе аргона. Выход 89% (0.11 г).
ИК-спектр (ν, см–1): 3210 сл, 2965 сл, 2022 с, 1930 с, 1588 сл, 1563 ср, 1483 ср, 1416 сл, 1393 ср, 1355 с, 1298 сл, 1258 с, 1159 ср, 1124 с, 1054 ср, 1024 с, 988 сл, 910 сл, 836 сл, 826 ср, 797 с, 717 сл, 665 ср, 625 с, 565 ср, 531 с, 475 ср, 428 сл.
Синтез Co[(OOCC5H4)Mn(CO)3]2(HDmpz)2 (IV). К раствору 0.1 г (0.15 ммоль) Co [(OOCC5H4)-Mn(CO)3]2 (MeOH)4 в 10 мл хлороформа добавляли 0.028 г (0.3 ммоль) 3,5-диметилпиразола и кипятили 1 ч. К полученному раствору добавляли 5 мл гептана и оставляли при комнатной температуре на сутки. Образовавшиеся кристаллы синего цвета отделяли от маточного раствора декантацией и сушили в токе аргона. Выход 85% (0.095 г).
ИК-спектр (ν, см–1): 3181 сл, 2863 сл, 2017 с, 1932 с, 1919 c, 1553 с, 1536 ср, 1472 ср, 1393 с, 1356 с, 1393 с, 1292 ср, 1193 сл, 1027 с, 1027 с, 930 ср, 815 ср, 792 с, 662 ср, 630 с, 537 с, 509 сл, 449 ср, 418 сл.
Элементный анализ выполняли на автоматическом С,H,N-анализаторе Carlo Erba EA 1108. ИК-спектры соединения регистрировали на ИК-спектрофотометре с Фурье-преобразованием Perkin-Elmer Spectrum 65 методом нарушенного полного внутреннего отражения (НПВО) в интервале частот 400–4000 см–1.
Монокристаллы комплексов для проведения РСА извлекали непосредственно из маточного раствора и быстро переносили в ток испаряющегося жидкого азота.
РСА I–IV выполнен по стандартной методике на автоматическом дифрактометре Bruker SMART Apex II, оборудованном CCD-детектором (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор, ω-сканирование). Уточнение структур проводили с использованием комплекса программ SHELXTL PLUS (PC версия) [42–46]. Кристаллографические данные и детали уточнения структур I–IV приведены в табл. 1, длины связей и валентные углы – в табл. 2, 3.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I–IV
| Параметр | Значение | |||
|---|---|---|---|---|
| I | II | III | IV | |
| Брутто-формула | C24H16N4O10ZnMn2 | C30H24N8O10Mn2Ni | C30H24N8O10Mn2Co | C28H24N4O10Mn2Co |
| М | 695.68 | 825.16 | 825.38 | 745.32 |
| Температура, К | 150(2) | |||
| Цвет | Бесцветный | Салатовый | Розовый | Розовый |
| Сингония | Триклинная | |||
| Пр. группа | $P\bar {1}$ | |||
| a, Å | 10.212(3) | 8.0100(8) | 14.394(4) | 11.2348(5) |
| b, Å | 12.222(3) | 14.2896 | 15.846(5) | 11.4078(5) |
| c, Å | 22.747(6) | 15.8650(16) | 17.549(8) | 13.0979(5) |
| α, град | 98.947(4) | 108.285(2) | 99.890(6) | 97.4780(10) |
| β, град | 99.111(4) | 93.491(2) | 107.245(6) | 103.9410(10) |
| γ, град | 90.153(4) | 95.334(2) | 111.063(4) | 102.8800(10) |
| V, Å3 | 2768.06(120) | 1708.9(3) | 3389(2) | 1557.97(11) |
| Z | 4 | 2 | 4 | 2 |
| ρ(выч.), мг/м3 | 1.66918 | 1.604 | 1.618 | 1.589 |
| μ, мм–1 | 1.819 | 1.340 | 1.286 | 1.385 |
| F(000) | 1392 | 836 | 1668 | 754 |
| Размеры кристалла, мм | 0.22 × 0.2 × 0.18 | 0.2 × 0.18 × 0.16 | 0.24 × 0.22 × 0.2 | 0.24 × 0.22 × 0.2 |
| Oбласть сканирования θ, град | 3.38–53.994 | 2.716–59.994 | 2.558–59.998 | 5.418–59.998 |
| Интервалы индексов отражений | –14 ≤ h ≤ 14, –17 ≤ k ≤ 17, –32 ≤ l ≤ 32 |
–11 ≤ h ≤ 11, –19 ≤ k ≤ 18, 0 ≤ l ≤ 22 |
–20 ≤ h ≤ 20, –22 ≤ k ≤ 22, –24 ≤ l ≤ 24 |
–15 ≤ h ≤ 15, –15 ≤ k ≤ 16, –18 ≤ l ≤ 18 |
| Число измеренных отражений | 26 012 | 20 372 | 30 905 | 18 422 |
| Число независимых отражений (Rint) | 12 008 (0.0610) | 9903 (0.0765) | 18 536 (0.0700) | 8999 (0.0171) |
| GOOF | 1.043 | 0.789 | 0.759 | 1.027 |
| R (I > 2σ(I)) | R1 = 0.0834 , wR2 = 0.2173 |
R1 = 0.0434, wR2 = 0.0710 |
R1 = 0.0501, wR2 = 0.0692 |
R1 = 0.0293 , wR2 = 0.0783 |
| R (по всем рефлексам) | R1 = 0.1164, wR2 = 0.2475 |
R1 = 0.0777, wR2 = 0.0783 |
R1 = 0.1410, wR2 = 0.0822 |
R1 = 0.0356, wR2 = 0.0820 |
| Электронная плотность (max/min), e Å–3 | 2.77/–1.41 | 0.69/–0.64 | 0.61/–0.82 | 0.50/–0.34 |
Таблица 2.
Основные длины связей и валентные углы в комплексах I, II
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| I | |||
| Zn(1)–O(3) | 1.940 | Zn(1)–N(3) | 1.972 |
| Zn(1)–O(1) | 1.970 | Zn(1)–N(1) | 2.017 |
| II | |||
| Ni(1)–O(1) | 2.0910 | Ni(1)–O(1A) | 2.0910 |
| Ni(1)–N(3) | 2.0915 | Ni(1)–N(3A) | 2.0915 |
| Ni(1)–N(1) | 2.1191 | Ni(1)–N(1A) | 2.1191 |
| Угол | ω, град | Угол | ω, град |
| I | |||
| Zn(1)O(3)O(1) | 98.263 | Zn(1)O(1)N(3) | 113.067 |
| Zn(1)O(3)N(3) | 111.798 | Zn(1)O(1)N(1) | 101.639 |
| Zn(1)O(3)N(1) | 113.862 | Zn(1)N(3)N(1) | 116.308 |
| II | |||
| Ni(1)O(1)O(1А) | 180.000 | Ni(1)N(3А)N(3) | 180.000 |
| Ni(1)O(1)N(3) | 94.244 | Ni(1)N(3)N(1) | 91.142 |
| Ni(1)O(1)N(3А) | 85.756 | Ni(1)N(3А)N(1) | 88.858 |
| Ni(1)O(1)N(1) | 95.851 | Ni(1)N(1А)N(1) | 180.000 |
| Ni(1)O(1А)N(1) | 84.149 | Ni(1)N(3)N(1А) | 91.142 |
Таблица 3.
Основные длины связей и валентные углы в комплексах III, IV
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| III | |||
| Co(1)–N(1) | 2.1029 | Co(1)–N(3А) | 2.1342 |
| Co(1)–N(1А) | 2.1029 | Co(1)–O(1) | 2.1601 |
| Co(1)–N(3) | 2.1342 | Co(1)–O(1А) | 2.1601 |
| IV | |||
| Co(1)–O(1) | 1.9324 | Co(1)–N(3) | 2.0053 |
| Co(1)–O(3) | 1.9420 | Co(1)–N(1) | 2.0176 |
| Угол | ω, град | Угол | ω, град |
| III | |||
| Co(1)N(1)N(1A) | 180.000 | Co(1)N(1A)O(1) | 88.870 |
| Co(1)N(1)N(3) | 93.357 | Co(1) N(1A)O(1A) | 91.130 |
| Co(1)N(1A)N(3) | 86.643 | Co(1)N(3)N(3A) | 180.000 |
| Co(1)N(1)O(1) | 91.130 | Co(1)N(3)O(1) | 94.844 |
| Co(1)N(1)O(1A) | 88.870 | Co(1)N(3)O(1A) | 85.156 |
| Co(1)N(1)N(3A) | 86.643 | Co(1)N(3A)O(1) | 85.156 |
| Co(1)N(1)N(3A) | 93.357 | Co(1)O(1)O(1A) | 180.000 |
| IV | |||
| Co(1)O(1)O(3) | 110.147 | Co(1)O(3)N(1) | 102.681 |
| Co(1)O(1)N(3) | 107.927 | Co(1)N(3)N(1) | 108.727 |
| Co(1)N(1)O(1) | 112.142 | Co(1)O(1)O(3) | 110.147 |
| Co(1)O(3)N(3) | 115.233 | ||
Дополнительная кристаллографическая информация для структур I–IV представлена в Кембриджском банке структурных данных (CCDC № 2157671 (I), 2157672 (II), 2157669 (III), 2157670 (IV); http://www.ccdc.cam.ac.uk/).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Реакция моноядерного комплекса Zn[(OOCC5H4)Mn(CO)3]2(MeOH)4 с избытком пиразола (HPz) при кипячении в хлороформе приводит к образованию моноядерного комплекса Zn[(OOCC5H4)Mn(CO)3]2(HPz)2 (I) (выход 80%).
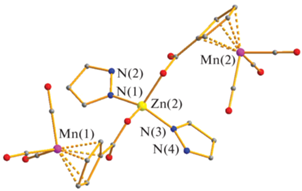
По данным РСА, в I в результате удаления четырех лабильных молекул метанола, атом цинка оказывается в тетраэдрическом окружении двух атомов кислорода, принадлежащих цимантренат-анионам (Zn–O 1.938(6)–1.971(6) Å) и двух атомов азота, принадлежащих координированным молекулам пиразола (Zn–N 1.984(7)–2.009(8) Å) (рис. 1). В кристаллической ячейке молекулы комплекса I оказываются связанными в линейный полимер за счет межмолекулярных водородных связей атомов кислорода цимантренат-анионов с атомами водорода фрагментов NH координированного гетероцикла (N…O 2.735–2.957 Å).
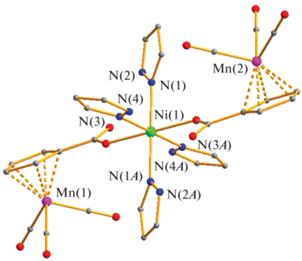
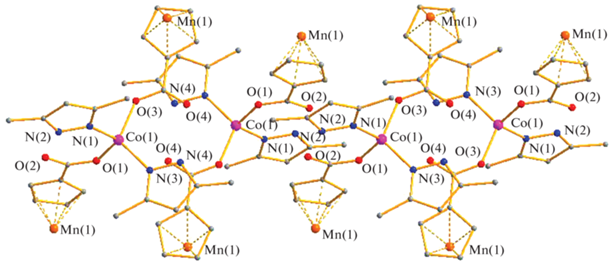
Реакции метанолсодержащих цимантренатов никеля и кобальта M[(OOCC5H4)-Mn(CO)3]2(MeOH)4 (M = Co(II), Ni(II)) с PzH при кипячении в хлороформе приводят к изоструктурным моноядерным комплексам Ni[(OOCC5H4)Mn(CO)3]2 (HPz)4 (II) (выход 76%) и Co[(OOCC5H4)Mn(CO)3]2(HPz)4 (III) (выход 89%), в которых все четыре лабильные молекулы метилового спирта заменяются на четыре молекулы пиразола. В соединении II, по данным РСА, центральный атом металла сохраняет характерное для Ni(II) октаэдрическое окружение четырех атомов азота пиразола (Ni–N 2.091(3)–2.119(2) Å) и двух атомов кислорода карбоксилат-анионов (Ni–O 2.091(2) Å) (рис. 2).
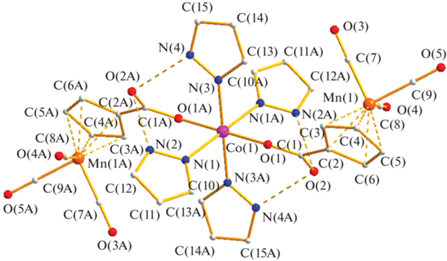
В центросимметричном комплексе Co[(OOCC5H4)Mn(CO)3]2(HPz)4 (III), по данным РСА (рис. 3), атом кобальта также имеет октаэдрическое окружение четырех атомов азота, принадлежащих координированным молекулам пиразола (Co–N 2.102(4)–2.134(5) Å) и двух атомов кислорода цимантенат-анионов (Co–O 2.161(3) Å). В кристаллах комплексов II и III наблюдаются внутримолекулярные водородные связи между атомами кислорода карбоксилат-аниона и атомами водорода координированных молекул пиразола (NH…O 2.751–2.833 Å).
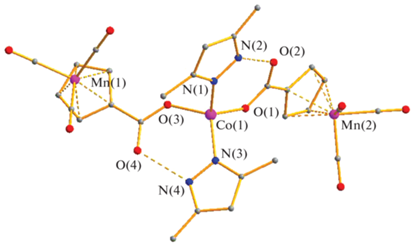
При взаимодействии метанольного цимантрената кобальта(II) с 3,5-диметилпиразолом в тех же условиях образуется моноядерный комплекс Co[(OOCC5H4)Mn(CO)3]2(HDmpz)2 (IV) (рис. 4). Введение в положения 3 и 5 гетероцикла донорных метильных заместителей приводит к увеличению основности пиридинового атома азота по сравнению с пиразолом и, соответственно, к уменьшению кислотности атомов водорода пиррольных фрагментов. Это существенно сказывается на упаковке молекул в кристалле, в котором наблюдаются внутримолекулярные водородные связи NH…O, а кристалл формируется за счет необычных π–π-контактов.
В отличие от III, в комплексе IV атом кобальта(II) оказывается в тетраэдрическом окружении двух атомов кислорода цимантренат-анионов и двух атомов азота координированных гетероциклов. Тетраэдрическое окружение центрального атома искажено несимметричным образом: длина связи Со–O составляют 1.932 и 1.942 Å, тогда как длины связей M–N различаются больше – 2.018 и 2.005 Å. Среди прочных невалентных взаимодействий необходимо выделить наличие стандартных внутримолекулярных водородных связей N–H…O и прочного межмолекулярного стекинг-взаимодействия молекулы пиразола и циклопентадиенильного кольца аниона цимантренкарбоновой кислоты (С(6)…C(25) ~3.17 Å). Такие стекинг-взаимодействия (два на две молекулы) приводят к образованию центросимметричных димеров молекул комплекса в кристалле, причем геометрия последних такова, что атом O(4) одной из молекул комплекса находится над связью другой M–N(1) (соответствующий угол O(4)СоN(1) составляет ~176°, M…O(4) 3.595(1) Å (рис. 5).
Таким образом, обнаружено, что молекулы пиразола и 3,5-диметилпиразола не депротонируются цимантренатами никеля, цинка и кобальта, а координируются монодентатно, формируя моноядерные комплексы, дополнительно стабилизированные водородными связями.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Cotton F.A., Wilkincon G., Murillo C.A., Bochmann M. Advanced Inorganic Chemistry. John Wiley & Sons Inc., 1999. P. 493.
Mehrotra R.C., Bohra R. Metal Carboxylates. London: Acad. Press, 1983. P. 396.
Cotton F.A., Lin C., Murillo C.A. // Acc. Chem. Res. 2001. V. 34. № 10. P. 759.
Molenveld P., Engbersen J.F.J., Reinhoudt D.N. // Chem. Soc. Rev. 2000. V. 29. P. 75.
Meurig J., Thomas B., Johnson F.G. et al. // Acc. Chem. Res. 2003. V. 36. P. 20.
Bondarenko M.A., Novikov A.S., Sokolov M.N., Adonin S.A. // Inorg. Chim. Acta. 2021. V. 524. P. 120436.
Yashkova K.A., Mel’nikov S.N., Nikolaevskii S.A. et al. // J. Struct. Chem. 2021. V. 62. P. 1378.
Adonin S., Petrov M., Abramov P. et al. // Polyhedron. 2019. V. 159. P. 171.
Adonin S.A., Petrov M.D., Novikov A.S. et al. // J. Cluster Sci. 2019. V. 30. P. 857.
Lutsenko I., Kiskin M., Nikolaevskii S. et al. // Chem. Select. 2019. V. 38. P. 14261.
Li H., Marks T. J. // Proc. Natl. Acad. Sci. USA. 2006. V. 103. P. 15295.
Murugesapandian B., Roesky P.W. // Z. Anorg. Allg. Chem. 2011. V. 637. P. 1818.
Шаповалов С.С., Пасынский А.А., Скабицкий И.В. и др. // Коорд. химия. 2014. Т. 40. № 2. С. 75. (Shapovalov S.S., Pasynskii A.A., Skabitskii I.V. et al. // Russ. J. Coord. Chem. 2014. V. 40. P. 77). https://doi.org/10.1134/S1070328414020092
Pasynskii A.A., Shapovalov S.S., Gordienko A.V. et al. // Inorg. Chim. Acta. 2012. V. 384. P. 18.
Valyaev D.A., César V., Lugan N. et al. // Dalton Trans. 2016. V. 45. P. 11953.
Guo Dong, Li Yu-ting, Duan Chun-ying et al. // Inorg. Chem. 2003. V. 42. P. 2519.
Koroteev P.S., Kiskin M.A., Dobrokhotova Zh.V. et al. // Polyhedron. 2011. V. 30. P. 2523.
Koroteev P.S., Dobrokhotova Zh.V., Kiskin M.A. et al. // Polyhedron. 2012. V. 43. P. 36.
Koroteev P.S., Dobrokhotova Z.V., Il’ukhin A.B. et al. // Polyhedron. 2015. V. 85. P. 941.
Koroteev P.S., Ilyukhin A.B., Gavrikov A.V. // Molecules. 2022. V. 27. P. 1082.
Chandrasekhar V., Nagarajan L. // Dalton Trans. 2009. V. 34. P. 6712
Перова Е.В., Яковлева М.A., Баранова Е.О. и др. // Журн. неорган. химии. 2010. Т. 55. С. 768. (Perova E.V., Yakovleva M.A., Baranova E.O. et al. // Russ. J. Inorg. Chem. 2010. V. 55. P. 714). https://doi.org/10.1134/S0036023610050104
Aмельченкова Э.В., Денисова Т.О., Нефедов С.Е. // Журн. неорган. химии. 2006. Т. 51. № 8. С. 1303. (Amel’chenkova E.V., Denisova T.O., Nefedov S.E. // Russ. J. Inorg. Chem. 2006. V. 51. P. 1218). https://doi.org/10.1134/S0036023606080110
Yoshida J., Kondo S., Yuge H. // Dalton Trans. 2013. V. 7. P. 42.
Cingolani A., Galli S., Masciocchi N. et al. // Dalton Trans. 2006. V. 20. P. 2479.
Уварова М.А., Нефедов С.Е. // Журн. неорган. химии. 2021. Т. 66. № 11. С. 1538. (Uvarova M.A., Nefedov S.E. // Russ. J. Inorg. Chem. 2021. V. 66. P. 1660). https://doi.org/10.1134/S0036023621110218
Appavoo D., Omondi B., Guzei I.A. et al. // Polyhedron. 2014. V. 69. P. 55.
Carlotto S., Casarin M., Lanza A. et al. // Cryst. Growth Des. 2015. V. 15. P. 5910.
Уварова М.А., Агешина А.А., Голубничая М.А., Нефедов С.Е. // Журн. неорган. химия. 2015. Т. 60. № 8. С. 1032. (Uvarova M.A., Ageshina A.A., Golubnichaya M.A., Nefedov S.E. // Russ. J. Inorg. Chem. 2015. V. 60. P. 934). https://doi.org/10.1134/S0036023615080215
Уварова М.А., Нефедов С.Е. // Журн. неорган. химии. 2015. Т. 60. № 11. С. 1473. (Uvarova M.A., Nefedov S.E. // Russ. J. Inorg. Chem. 2015. V. 60. P. 1348). https://doi.org/10.1134/S0036023615110212
Kaikai Hu, Shouwen Jin, Zuoran Xie et al. // Polyhedron. 2018. V. 139. P. 17.
Ananyev I.V., Nefedov S.E., Lyssenko K.A. // Eur. J. Inorg. Chem. 2013. P. 2736.
Deka K., Laskar M., Baruah J.B. // Polyhedron. 2006. V. 25. P. 2525.
Cingolani A., Galli S., Masciocchi N. et al. // Dalton Trans. 2006. V. 20. P. 2479.
Ананьев И.В., Яковлева М.А., Перова Е.В., Нефедов С.Е. // Журн. неорган. химии. 2010. Т. 55. С. 1127 (Anan’ev I.V., Yakovleva M.A., Perova E.V., Nefedov S.E. // Russ. J. Inorg. Chem. 2010. 55. P. 1057). https://doi.org/10.1134/S0036023610070119
Уварова М.А., Агешина А.А., Гринева А.А. и др. // Журн. неорган. химии. 2015. Т. 60. № 5. С. 633 (Uvarova M.A., Ageshina A.A., Grineva A.A. et al. // Russ. J. Inorg. Chem. 2015. V. 60. P. 566). https://doi.org/10.1134/S0036023615050186
Уварова М.А., Агешина А.А., Нефедов С.Е. и др. // Журн. неорган. химии. 2015. Т. 60. № 10. С. 1326 (Uvarova M.A., Ageshina A.A., Nefedov S.E. et al. // Russ. J. Inorg. Chem. 2015. V. 60. P. 1210). https://doi.org/10.1134/S0036023615100198
Агешина А.А., Уварова М.А., Нефедов С.Е. // Журн. неорган. химии. 2015. Т. 60. № 9. 1192 (Ageshina A.A., Uvarova M.A., Nefedov S.E. // Russ. J. Inorg. Chem. 2015. Т. 60. № 9. С. 1085). https://doi.org/10.1134/S0036023615090028
Агешина А.А., Уварова М.А., Нефедов С.Е. // Журн. неорган. химии. 2015. Т. 60. № 10. P. 1334 (Ageshina A.A., Uvarova M.A., Nefedov S.E. // Russ. J. Inorg. Chem. 2015. V. 60. P. 1218). https://doi.org/10.1134/S0036023615100022
Уварова М.А., Нефедов С.Е. // Журн. неорган. химии. 2015. Т. 60. № 9. P. 1181 (Uvarova M.A., Nefedov S.E. // Russ. J. Inorg. Chem. 2015. V. 60. P. 1074). https://doi.org/10.1134/S003602361509020X
Nesmeyanov A.N., Anisimov K.N., Kolobova, N.E. Makarov Y.V. // Russ. Chem. Bull. 1968. V. 17. P. 672.
SMART (control) and SAINT (integration) Software. Version 5.0. Madison (WI, USA): Bruker AXS Inc., 1997.
SAINT. Area-Detector Integration Sofware. Madison (WI, USA): Bruker AXS Inc., 2012.
Sheldrick G.M. SADABS. Program for Scaling and Correction of Area Detector Data. Göttingen (Germany): Univ. of Göttingen, 1997.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053229614024218
Halcrow M.A., Streib W.E., Folting K., Christou G. // Acta Crystallogr. C. 1995. V. 51. P. 1263. https://doi.org/10.1107/S0108270194013764
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия