Кристаллография, 2019, T. 64, № 1, стр. 99-105
Исследование методом молекулярной динамики тимидинфосфорилазы из E. Coli в АПО-ферменте и в комплексах с субстратами
Д. Д. Сидоров-Бирюков 1, Д. Д. Подшивалов 1, 2, 3, В. И. Тимофеев 1, 2, Н. Е. Жухлистова 1, И. П. Куранова 1, 2, *
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
2 НБИКС-центр, Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
3 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: inna@crys.ras.ru
Поступила в редакцию 11.04.2018
После доработки 12.04.2018
Принята к публикации 17.05.2018
Аннотация
Методом молекулярного докинга получены модели комплексов тимидинфосфорилазы из E. coli c субстратами – фосфатом, а также с фосфатом и тимидином. Методом молекулярной динамики прослежено влияние субстратов на движение доменов в димерной молекуле тимидинфосфорилазы. Показано, что обе субъединицы функционируют асинхронно. В комплексах тимидинфосфорилаза/фосфат и тимидинфосфорилаза/фосфат/тимидин фосфат более слабо связан в активном центре и на траектории 60 нс выходит из фосфатсвязывающего центра, в то время как тимидин остается в активном центре, но меняет свою конформацию.
ВВЕДЕНИЕ
Тимидинфосфорилаза (ТФ) относится к нуклеозидфосфорилазам, катализирующим обратимый фосфоролиз пуриновых и пиримидиновых нуклеозидов, и играет центральную роль в метаболизме нуклеозидов. Нуклеозидфосфорилазы по типу пространственной организации разделяют на два семейства [1]. К первому относятся пуриннуклеозидфосфорилазы и уридинфосфорилаза, ко второму – остальные пиримидинфосфорилазы, в том числе ТФ. Нуклеозидфосфорилазы типа II имеют двухдоменную субъединицу, гомодимерную четвертичную структуру и значительную степень гомологии. В низших организмах субстратами нуклеозидфосфорилаз являются тимидин и уридин, но эти ферменты у млекопитающих и других высших организмов имеют высокую специфичность к тимидину. Изучение структур нуклеозидфосфорилаз дает массу информации, проливающей свет на многие вопросы фундаментальной биологии. Эти ферменты привлекают внимание исследователей вследствие вовлеченности их в метаболизм противораковых и противовирусных препаратов – аналогов нуклеозидов, а так же из-за их важности для жизнедеятельности ряда паразитических микроорганизмов. Известно, что в тканях злокачественных опухолей концентрации уридин- и тимидинфосфорилазы повышены по сравнению с нормальными тканями [2]. Высказано предположение, что ТФ играет важную роль в пролиферации и дифференциации лейкоцитов, а также в пролиферации клеток опухоли [3]. Установлено, что ТФ вовлечена в процесс ангиогенеза, и ее функционирование необходимо для роста кровеносных сосудов в опухолях [4, 5]. Потенциальные терапевтические возможности подавления активности нуклеозидфосфорилаз, принадлежащих любому из двух семейств, стимулируют усилия по созданию потенциальных ингибиторов этих ферментов. В случае подавления активности пиримидинфосфорилаз теоретически возможно применять лекарства в меньших концентрациях, что уменьшило бы многочисленные побочные эффекты [6].
К настоящему моменту известны структуры пиримидиннуклеозидфосфорилаз семейства II: ТФ из Escherichia coli (в нативной форме и в комплексах) [7–9], из Bacillus stearothermophillus в комплексе с фосфатом и ингибитором (псевдоуридином) [10], а также структуры ТФ человека в комплексе с малой молекулой (ингибитором) [11] и в комплексе с тимином [12]. Члены семейства нуклеозидфосфорилаз типа II показывают большую степень гомологии аминокислотных последовательностей (или первичных структур), что объясняет сходство вторичных структур и пространственного строения ферментов из этого семейства.
Пространственная структура ТФ из E. сoli, исследованная методом рентгеноструктурного анализа (РСА) с разрешением 2.8 Å, была впервые описана в 1990 г. [7]. ТФ из E. coli состоит из двух идентичных субъединиц с молекулярной массой 45 кДа каждая [13]. Согласно данным РСА пространственная структура ТФ представляет собой S-образный гомодимер, в котором каждая субъединица содержит большой (α/β) и малый (α) домены [7–9, 13]. Аминокислотные остатки α-домена более консервативны, чем α/β-домена. Между доменами имеется большая полость. Три подвижных полипептидных петли соединяют большой и малый домены. В катализируемой ТФ реакции участвуют два субстрата – нуклеозид и ион фосфата. При этом фосфатсвязывающий центр расположен в большом домене, а нуклеозидсвязывающий – в малом. Поэтому сближение доменов необходимо для протекания реакции. Присутствие петель, соединяющих два домена, обеспечивает возможность протекания каталитической реакции, позволяя доменам двигаться навстречу друг другу. Сближение доменов необходимо для уменьшения расстояния между участком связывания фосфата, находящегося в α/β-домене, и тимидинсвязывающего участка, локализованного в α-домене. Исследование TФ из E. coli [8] методами РСА и молекулярной динамики (МД) [14] выявило различные конформации ферментов, подтверждающие движение доменов и сближение связанных субстратов для достижения близкого контакта между двумя субстратами.
В настоящей работе, чтобы проследить влияние лигандов на движение доменов в молекуле ТФ, с использованием данных РСА методами молекулярного докинга и МД исследован димер ТФ в апо-форме, а также в комплексах с субстратами: фосфатом и тимидином (THM).
МАТЕРИАЛЫ И МЕТОДЫ
Стартовая модель комплекса ТФ с тимидином и ионом фосфата получена методом молекулярного докинга. При докировании использовались программа Autodock VINA [15] и координаты молекулы ТФ, полученные при РСА кристаллов фермента (PDB_ID: 4LHM) [16]. Было проведено докирование тимидина в полностью неподвижный белок и белок с подвижными аминокислотными остатками. В результате на основе данных об изменении общей энергии системы (таблица) получено девять различных вариантов структуры комплекса. Каждый из них сравнивался с рентгеноструктурными данными для ТФ из St. Aureros (PDB_ID: 3H5Q), гомологичного белка, структура которого известна в комплексе с тимидином. На основании этого сравнения и анализа оценочной функции докинга выбрана одна модель для последующих молекулярно-динамических исследований.
Таблица 1.
Свободная энергия системы для различных моделей тимидинфосфорилазы в комплексе с тимидином и фосфатом
| Модель | Свободная энергия, ккал/моль | |
|---|---|---|
| Докирование тими-дина в жесткую структуру | Докирование тимиди-на в структуру с по-движными остатками активного центра | |
| 1 | –6.9 | –7.8 |
| 2 | –6.7 | –7.5 |
| 3 | –6.6 | –7.5 |
| 4 | –6.5 | –7.3 |
| 5 | –6.3 | –7.2 |
| 6 | –6.3 | –7.1 |
| 7 | –6.2 | –7.1 |
| 8 | –6.1 | –7.1 |
| 9 | –6.1 | –7.0 |
Для проведения численного эксперимента по МД использовано поле CHARMM36 [17]. Исследовались три системы: димер апо-формы ТФ из E. coli; димер комплекса фермента с ионом фосфата в обеих субъединицах; димер ТФ с тимидином и фосфатом в каждой субъединице димера, связанными в тимидин- и фосфатсвязывающем центрах соответственно. Область моделирования представляла собой кубическую ячейку с ребром 140 Å. Белок был помещен в центр ячейки, весь объем ячейки заполнялся водой с использованием трехатомной модели воды – TIP3P [18]. Перед началом численных экспериментов была выполнена предварительная минимизация энергии системы с тимидином и фосфатом и комплекса с фосфатом соответственно.
После минимизации энергии проведены процедуры стабилизации температуры и давления системы. Величина температуры была выбрана равной 310 К, величина давления – 1 атм. Использовались алгоритмы поддержания температуры и давления, термостат Berendsen [19] и баростат Parrinello-Rahman [20] соответственно. Системы были промоделированы на временном интервале общей продолжительностью 60 нс с шагом 2 фс.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Методом МД исследовалось поведение во времени димера апо-формы ТФ из E. coli и двух ее комплексов: с ионом фосфата, а также с тимидином и ионом фосфата. Анализ движения доменов в ТФ в определенных точках симулируемой траектории осуществлялся с помощью совмещения структурных моделей белка в этих точках с кристаллической структурой белка (PDB_ID: 4LHM). Совмещение проводилось по Сα-атомам малых доменов субъединиц фермента. Для каждой субъединицы димера получены графики зависимости от времени эксперимента среднеквадратичных отклонений расстояний (RMSD) Сα-атомов больших доменов ТФ (рис. 1). Структуры совмещались по Сα-атомам следующих аминокислотных остатков малых доменов: 1–66 и 162–194.
Рис. 1.
Графики зависимости среднеквадратичного отклонения (RMSD) атомов большого домена от времени для субъединиц А (черный цвет) и В (серый цвет) в апо-форме ТФ (а), в комплексе с фосфатом (б), в комплексе с тимидином и фосфатом (в).
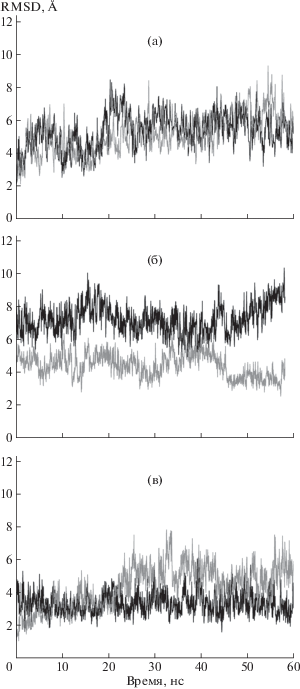
МД-исследование димера фермента при отсутствии каких-либо лигандов в его активных центрах показало, что для субъединиц А и B величины RMSD колеблются в диапазоне порядка 5 Å (рис. 1а). К моменту времени ~30 нс происходит стабилизация конформационных состояний в обеих субъединицах. Сравнение пространственного строения субъединиц в исходный момент времени и момент стабилизации конформационного состояния показало изменение положения доменов друг относительно друга. К моменту стабилизации конформационного состояния активный центр становится более открытым, смещаются петля 366–382, спираль 356–365 и спираль 407–420.
Графики RMSD атомов большого домена для комплекса ТФ с фосфатом в зависимости от времени эксперимента представлены на рис. 1б. Для каждой субъединицы RMSD изменяются в пределах ~ 5 Å, но они различаются по значению.
Пространственная структура комплекса ТФ/фосфат на разных точках траектории проанализирована с использованием программы PyMol. Начиная с ~36 нс, как показали исследования, отмечается выход иона фосфата из субъединицы А. При этом различия значений RMSD для субъединиц димера уменьшаются. Начиная с 43 нс, поведение субъединиц различается. Субъединица В, по-видимому, сохраняет свою конформацию: график отражает незначительные колебания величины RMSD. Значения RMSD для субъединицы А возрастают практически линейно.
Среднеквадратичные отклонения Сα-атомов большого домена в комплексе с тимидином и фосфатом представлены на рис. 1в. Большая разница в значениях RMSD Сα-атомов больших доменов наблюдается после ~23 нс (рис. 1в). Начиная с момента ~46 нс согласно полученным результатам исследования уходит ион РО4 из субъединицы А, конформационное состояние этой субъединицы становится более стабильным, чем субъединицы В.
Согласно [21] движение доменов друг относительно друга можно оценивать по расстоянию между Сα-атомами остатков Leu117 и Arg171. Сближение этих остатков, принадлежащих различным доменам субъединицы ТФ, соответствует закрытой конформации субъединицы, а удаление – открытой. В [8] утверждается, что связывание иона фосфата в активном центре пиримидиннуклеозидфосфорилаз приводит к формированию водородной связи между остатками His119 и Gly208 большого домена. При этом образование водородной связи между остатками His119 и Gly208 ассоциируется с подвижностью большого домена. В связи с этим были оценены расстояния Cα_Leu117…Cα_Arg171 (рис. 2) и NE2_His119…O_Gly208 (рис. 3) на МД-траектории для всех рассматриваемых структур: апо-формы ТФ, комплексов ТФ с фосфатом, тимидином и ионом фосфата.
Рис. 2.
Изменение расстояния между Сα-атомами остатков Leu117 и Arg171 в течение 60-наносекундной симуляции для апо-формы ТФ (а), комплекса ТФ с ионом фосфата (б), комплекса ТФ с ионом фосфата и тимидином (в).
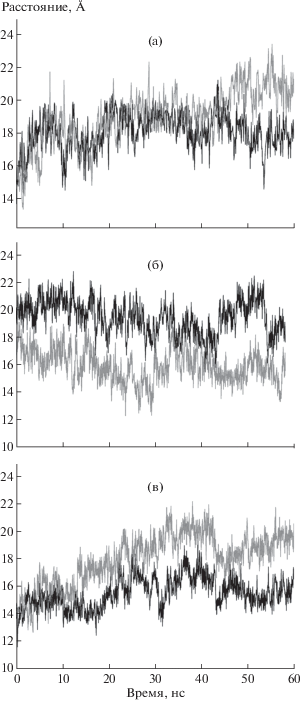
Рис. 3.
Изменение расстояния между атомами O_Gly208 и NE2_His119 в течение 60-наносекундной симуляции для апо-формы ТФ (а), для комплекса ТФ с ионом фосфата (б), для комплекса ТФ с ионом фосфата и тимидином (в).
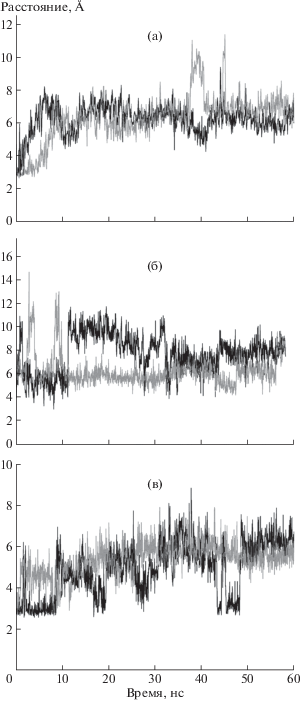
Как видно на рис. 2а, по мере увеличения времени эксперимента в обеих субъединицах апо-формы ТФ домены (Сα-атомы остатков Leu117, Arg171) сначала значительно удаляются друг от друга, затем происходит их сближение, и в последующем расстояния между Сα-атомами изменяются в диапазоне 16–21 Å приблизительно до момента 45 нс, когда степень открытости активных центров практически не изменяется, хотя она разная в субъединицах. Домены приблизительно сохраняют взаимное расположение, отмечаются только изменения, по-видимому, связанные с тепловыми колебаниями, что согласуется с ранее приведенным графиком зависимости RMSD от времени (рис. 1а). Отметим, что после 45 нс симуляции расстояние между остатками Leu117 и Arg171 в субъединице А меньше, чем в субъединице В. Как показывает анализ пространственных структур, Arg171 в основном сохраняет свое положение, а Leu117 более подвижен. Процесс изменения расстояния между Сα-атомами Arg171 и Leu117 в некоторой степени согласуется с процессом изменения расстояния O_Gly208…NE2_His119 в зависимости от времени эксперимента, особенно для субъединицы А (рис. 3а).
В комплексе ТФ/фосфат расстояния между Сα-атомами остатков Leu117 и Arg171 показывают разную степень открытости активных центров субъединиц А и В вплоть до момента времени ~35 нс, когда разница расстояний Leu117…Arg171 уменьшается. В этот момент времени при анализе пространственной структуры наблюдается выход иона фосфата из активного центра субъединицы А и его последующее удаление от димера. В субъединице В димера положение фосфата несколько изменяется, однако он остается в активном центре субъединицы. Как видно на рис. 2б, субъединица А характеризуется большей подвижностью после ухода иона РО4 за пределы димера, в субъединице В расстояния между Сα-атомами остатков Leu117 и Arg171 изменяются в незначительных пределах, степень открытости активного центра сохраняется.
Расстояния между O_Gly208…NE2_His119, приведенные на рис. 3б для субъединиц А и В, говорят о разных состояниях α/β-доменов в субъединицах А и В вплоть до ~35 нс, когда ион фосфата уходит за пределы активного центра субъединицы А. Эти расстояния становятся сходными после ~48 нс, когда фосфат значительно удаляется от субъединицы А.
Расстояния между Сα-атомами остатков Leu117, Arg171 в субъединицах А и В комплекса ТФ с тимидином и ионом фосфата, судя по графику (рис. 2в), сначала мало различаются, но различия увеличиваются со временем симуляции МД. В субъединице А домены ближе друг к другу, чем в субъединице В, причем можно отметить периодические сближения пары Сα-атомов остатков Leu117, Arg171 в обеих субъединицах, хотя процессы сближения доменов в субъединицах явно не согласованы. После ухода иона РО4 из субъединицы А (~46 нс) расстояния между Сα-атомами остатков Leu117, Arg171 заметно стабилизируются в обеих субъединицах, хотя и различаются по величине. Присутствие лигандов не коррелирует с величиной расстояния между Сα-атомами, т.е., по-видимому, не влияет на расстояние между доменами.
На графике зависимости между временем эксперимента и расстоянием NE2_His119…O_Gly208 в комплексе ТФ с тимидином и фосфатом (рис. 3в) для субъединицы А наблюдается тенденция периодического сближения остатков His119 и Gly208 до расстояний, соответствующих водородной связи. Если сравнить графики временной зависимости расстояний NE2_His119…O_Gly208 и Cα_Leu117…Cα_Arg171, то для субъединицы А можно отметить некоторое соответствие между сближением доменов и возможным образованием водородных связей.
При анализе среднеквадратичных флуктуаций Сα-атомов аминокислотных остатков в процессе МД оказалось, что наибольшие флуктуации наблюдаются в петлях или смежных с ними α-спиралях и β-лентах. Петли 66–71, 155–160, 194–197, соединяющие большой и малый домены, испытывают значительные флуктуации особенно в комплексе ТФ/РО4.
МД-исследование комплексов E. coli ТФ с субстратами позволило оценить характер изменения расстояния между тимидином и фосфатом на траектории 60 нс. В [22] показано, что атом O3' рибозной группы нуклеозида играет важную роль при формировании фермент-субстратного комплекса и протекании реакции. При этом связывание нуклеозида в активном центре ТФ сопровождается движением доменов, которое приводит к сближению нуклеозида и фосфата, в результате нуклеозид и фосфат размещаются в позициях, удобных для осуществления нуклеофильной атаки.
В настоящей работе характер изменения со временем расстояния O3'_THM…O_PO4 в комплексе ТФ с тимидином и фосфатом на МД-траектории 60 нс представлен на рис. 4. В субъединицах А и В в исходном состоянии расстояние O_PO4…O3' соответственно равно 6.57 и 6.70 Å, ион фосфата расположен в сайте связывания фосфата и координируется остатками His85, Ser86, Lys84, Ser95, Ser113, Thr123. На 31.2 нс МД-траектории ион фосфата образует водородную связь с O5'-атомом нуклеозида (2.87 Å) и координируется атомами N_Gly114 (2.96 Å), OG_Ser113 (2.78 Å). В момент времени 34 нс вплоть до ~43 нс (ранее 6.48 нс) в субъединице А наблюдается тенденция сближения нуклеозида и фосфата до расстояния, достаточного для образования водородной связи между атомом кислорода фосфата и O3' оксигруппой рибозного кольца (O_PO4…O3'). На рис. 5 показаны МД-модели, иллюстрирующие расположение в активном центре иона фосфата и тимидина в моменты максимального их сближения (34.0–45.6 нс МД-траектории). Поворот рибозных колец молекулы тимидина сопровождается смещением фосфатных групп, связанных с O3´ атомом кислорода рибозной группы тимидина водородной связью. При образовании водородной связи O_PO4…O3'_THM между лигандами в субъединице А, например, на 38.6 нс МД-траектории ион РО4 координируется остатками Gly114, Gln156, Lys165. Расстояние между атомами Сα остатков Leu117 и Arg171 равно 16.83 Å. В субъединице В в этот момент времени атом O3' находится на расстоянии 6.80 Е от атома кислорода фосфата, располагающегося в фосфатсвязывающем центре активного центра ТФ. Пиримидиновое кольцо тимидина во все время эксперимента остается в нуклеозидсвязывающем сайте и контактирует с остатками Arg171, Ser186. Lys190, Tyr168. Полученный результат согласуется с механизмом, предложенным для катализа ТФ в [23], где предполагается, что ион фосфата покидает фосфатсвязывающий сайт и размещается в позиции, удобной для нуклеофильной атаки [23].
Рис. 4.
График изменения расстояния O3'_THM…O_PO4 в зависимости от времени в комплексе ТФ с тимидином и фосфатом; 1 – субъединица А, 2 – субъединица В. На выноске приведен фрагмент графика в пределах 45 нс в увеличенном масштабе.
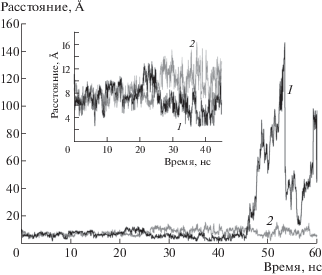
Рис. 5.
Модели взаимного расположения в области активного центра иона фосфата и тимидина в промежуток времени 34.0–45.6 нс МД-траектории. Черным выделены первая и последняя модели.
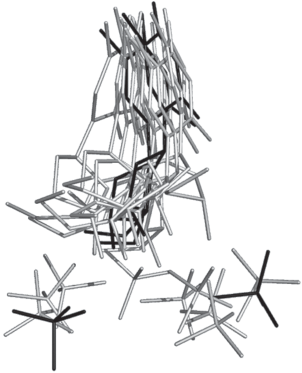
По результатам МД-эксперимента проведено сравнение конформаций субъединиц А на 38.6 нс и В на 50.6 нс МД-траектории соответственно, когда тимидин и фосфат в обеих субъединицах сближаются на расстояние водородной связи. Совмещение субъединиц осуществлялось по Сα-атомам малых доменов. Средняя величина RMSD для сравниваемых атомов равна 0.670 Å. Сравнение субъединиц показало некоторые различия в их пространственных структурах. Расстояния Cα_Leu117…Cα_Arg171 равны 16.83 и 17.66 Å, NE2_His119…O_Gly209 равны 6.44 и 6.60 Å соответственно для А и В субъединиц.
Существенные различия при сравнении субъединицы А на 38.6 нс и субъединицы В на 50.6 нс МД-траектории наблюдаются в конформациях нуклеозидов, связанных в активном центре (рис. 6). Плоскости оснований нуклеозидов развернуты друг относительно друга приблизительно на 10°; торсионный угол гликозидной связи между рибозным кольцом и пиримидиновым основанием (O4'–C1'–N1–C2) равен –161.78° для нуклеозида в А-субъединице и –83.01° для нуклеозида в В-субъединице. В комплексе E. coli ТФ/тимидин/фосфат в моменты времени 38.6 и 50.6 нс, когда образуется водородная связь между лигандами в субъединицах А и В, соответственно атом О2 пиримидинового фрагмента нуклеозида взаимодействует с Lys190, N3 – с Ser186, атом О4 – с Arg171, входящими в нуклеозидсвязывающий сайт активного центра. Кроме этого, наблюдается стекинг-взаимодействие между пиримидиновым основанием нуклеозида и шестичленным циклом тирозина 168. В обеих субъединицах при образовании Н-связи между лигандами, когда ион фосфата покидает фосфатсвязывающий центр, он координируется остатками Gly114, Gln156, Lys165, а не остатками His85, Ser86, Lys84, Ser95, Thr123, Ser113, связывающими ион PO4 в исходный момент эксперимента.
Рис. 6.
Нуклеозиды в активных центрах субъединиц А (38.6 нс, черный) и В (50.6 нс, серый). Совмещение проведено по Сα-атомам малых доменов.
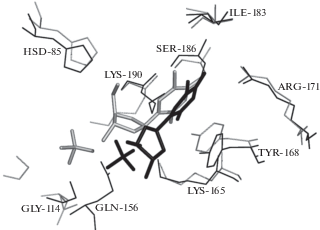
Положения аминокислотных остатков, координирующих основание нуклеозида, различаются несущественно. Тирозиновый цикл “следует” за циклом пиримидинового основания, лишь боковая группа Lys190 имеет разные конформации в сравниваемых субъединицах А и В. Торсионные углы гликозидных связей в нуклеозидах существенно различаются, что обусловлено различной локализацией фосфатных групп, связанных с тимидином водородной связью. В результате положения аминокислотных остатков, координирующих ионы фосфата, различаются.
ЗАКЛЮЧЕНИЕ
Методом молекулярной динамики прослежено влияние субстратов, присутствующих в активном центре, на движение доменов в димерной молекуле тимидинфосфорилазы. Показано, что обе субъединицы молекулы функционируют асинхронно. В комплексах ТФ/фосфат и ТФ/фосфат/тимидин фосфат связан более слабо и на траектории 60 нс выходит из фосфатсвязывающего центра, в то время как тимидин остается в активном центре, но меняет свою конформацию.
В процессе выхода из фосфатсвязывающего центра фосфат образует водородную связь с O3'-атомом нуклеозида. Пиримидиновое основание в молекуле тимидина практически не меняет свое положение, в то время как дезоксирибозный фрагмент смещается вслед за фосфатом в интервале МД-траектории 33.8–43.0 нс, сохраняя водородную связь O_PO4…O3'. Факт выхода иона фосфата из активного центра, установленный в данной работе, согласуется с механизмом, предложенным для катализа ТФ в [23], где предполагается, что ион фосфата покидает фосфатсвязывающий сайт и размещается в позиции, удобной для нуклеофильной атаки.
Анализ среднеквадратичных флуктуаций Сα-атомов в процессе молекулярной динамики показал, что наибольшие отклонения наблюдаются в петлях или смежных с ними α-спиралях и β-лентах, значительные флуктуации – в комплексе ТФ/РО4; конформация субъединиц фермента со связанным ионом фосфата менее стабильна по сравнению с апо-ферментом и комплексом ТФ/тимидин/фосфат.
Работа выполнена при поддержке Министерства науки и высшего образования в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН.
Список литературы
Pugmire M.J., Ealick S.E. // Biochem. J. 2002. V. 361. P. 1.
Ligo M., Nishikata K., Nakajiama Y. et al. // Biochem. Pharmacol. 1990. V. 39. № 7. P. 1247.
Yoshimura A., Kuwazuru Y., Furukawa T. et al. // Biochim. Biophys. Acta. 1990. V. 1034. P. 107.
Usuki K., Saras J., Waltenberger J. et al. // Biochem. Biophys. Res. Commun. 1992. V. 184. P. 1311.
Akiyama S., Furukawa T., Sumizawa T. et al. // Cancer Sci. 2004. V. 95. № 11. P. 851.
Schwartz E.L., Baptiste N., Megati S. et al. // Cancer Res. 1995. V. 55. P. 3543.
Walter M.R., Cook W.J., Cole L.B. et al. // J. Biol. Chem. 1990. V. 265. P. 14016.
Pugmire M.J., Cook W.J., Jasanoff A. et al. // J. Mol. Biol. 1998. V. 281. P. 285.
Тимофеев В.И., Абрамчик Ю.А., Фатеев И.В. и др. // Кристаллография. 2013. Т. 58. № 6. С. 828.
Pugmire M.J., Ealick S.E. // Structure. 1998. V. 6. P. 1467.
Norman R.A., Barry S.T., Bate M. et al. // Structure. 2004. V. 12. P. 75.
El Omari K., Bronckaers A., Liekens S. et al. // Biochem. J. 2006. V. 399. P. 199.
Pugmire M.J., Ealick S.E. // Biochem. J. 2002. V. 361. P. 1.
Rick S.W., Abashkin Y.G., Hilderbrandt R.L., Burt S.K. // PROTEINS: Structure, Function, Genetics. 1999. V. 37. P. 242.
Trott O., Olson A.J. // J. Comput. Chem. 2010. V. 31. P. 455.
Timofeev V., Abramchik Yu., Zhukhlistova N. et al. // Acta Cryst. D. 2014. V. 70. P. 1155.
Soteras Gutierrez I., Lin F.-Y., Vanommeslaeghe K. et al. // Bioorg. Med. Chem. 2016.
Jorgensen W.L., Chandrasekhar J., Madura J.D. et al. // J. Chem. Phys. 1983 V. 79. P. 926.
Berendsen H.J.C., Postma J.P.M., van Gunsteren W.F. et al. // J. Chem. Phys. 1984. V. 81 (8). P. 3684. Bibcode:1984JChPh..81.3684B. doi 10.1063/1.448118
Parrinello M., Rahman A. // J. Chem. Phys. 1982. V. 76. № 5. P. 2662.
Mendieta J., Martı’n-Santamarı’a S., Priego E.-M. et al. // Biochem. 2004. V. 43. № 2. P. 409.
Панова Н.Г., Алексеев К.С., Кузьмичев А.С. и др. // Биохимия. 2007. Т. 72. № 1. С. 27.
Burton N., Harrison M., Hart J. et al. // Faraday Discuss. 1998. V. 110. P. 463.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


