Кристаллография, 2019, T. 64, № 6, стр. 891-894
Особенности молекулярного и кристаллического строения двух кристаллосольватов 4-амино-N-(4-нитрофенил)бензолсульфонамида
В. В. Ткачев 1, *, А. Н. Утенышев 1, 4, В. П. Казаченко 2, О. В. Авраменко 3
1 Институт проблем химической физики РАН
Черноголовка, Россия
2 Институт физиологически активных веществ РАН
Черноголовка, Россия
3 Российский университет дружбы народов
Москва, Россия
4 Первый Московский государственный медицинский университет им. И.М. Сеченова Министерства здравоохранения РФ
Москва, Россия
* E-mail: uten@icp.ac.ru
Поступила в редакцию 02.04.2018
После доработки 12.02.2019
Принята к публикации 25.02.2019
Аннотация
Проведено рентгеноструктурное исследование (РСИ) двух новых кристаллосольватов на основе 4-амино-N-(4-нитрофенил)бензолсульфонамида с диметилсульфоксидом и с N,N-диметилацетамидом. Показано, что присутствие растворителя практически не влияет на молекулярное строение соединения 4-амино-N-(4-нитрофенил)бензолсульфонамида, исследованного ранее (кристалл без растворителя), но оказывает влияние на его конформационное строение. В обеих новых кристаллических структурах реализуется межмолекулярная связь типа NH···O (молекулы растворителя).
ВВЕДЕНИЕ
Сульфонамиды (СА) являются лекарственными средствами, широко применяющимися при лечении заболеваний, вызванных грамположительными и грамотрицательными микроорганизмами, а также некоторыми грибами [1, 2]. Можно попытаться модифицировать соединения, используя различные растворители. В случае, если эти растворители войдут в состав соединения, находящегося в твердом состоянии, это может увеличить спектр физиологических проявлений известных препаратов и расширить представления о строении биологически активных соединений.
В [3] показано, что молекулы СА в кристаллах принимают участие в образовании межмолекулярных водородных связей. В [4] было исследовано влияние йодо- и нитрогрупп на конформацию СА. Знание конформации молекулы СА необходимо при разработке лекарственных средств, так как СА-группа является чрезвычайно важной биологической функциональной группой и определяет биологическую активность препарата.
Цель настоящей работы – изучение влияния растворителей (диметилсульфоксида и N,N-диметилацетамида) на конформационное строение молекулы СА и топологию межмолекулярных водородных связей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Кристаллосольваты 4-амино-N-(4-нитрофенил)бензолсульфонамида с диметилсульфоксидом и с N,N-диметилацетамидом получены путем растворения при нагревании и непрерывном перемешивании 4-амино-N-(4-нитрофенил)бензолсульфонамида в указанных растворителях. Полученные растворы охлаждались до комнатной температуры и медленно испарялись при той же температуре через небольшие отверстия в защитной пленке, закрывающей бюксы с растворами, которые, в свою очередь, помещались в закрытую емкость с водой. При поиске кристаллосольватов был осуществлен перебор разных растворителей. Кристаллы, выделенные из разных растворителей, первоначально изучались методом термогравиметрии, который позволяет увидеть признаки получения кристаллосольвата, а затем исследовались методом рентгеноструктурного анализа.
Исследование соединений 4-амино-N-(4-нитрофенил)бензолсульфонамида с диметилсульфоксидом (1) и с N,N-диметилацетамидом (2) проведено на монокристаллах на дифрактометре КМ4 фирмы KUMA DIFFRACTION, Польша (λ(МоKα) = 0.71073 Å, ω/2θ-сканирование). Кристаллографические данные и основные параметры уточнения представлены в табл. 1. Структуры расшифрованы прямым методом [5]. Позиции и температурные параметры неводородных атомов уточнены в анизотропном приближении полноматричным МНК. Позиции атомов водорода выявлены из разностных синтезов и в дальнейшем уточнялись с наложением ограничений по модели “всадника”, все расчеты выполнены с использованием комплекса программ SHELXTL [6].
Таблица 1.
Основные кристаллографические данные и характеристики эксперимента для соединений 1 и 2
| Характеристика | Соединение 1 | Соединение 2 |
|---|---|---|
| Формула | C14 H17N3O5S2 | C16H20N4O5S |
| Mr | 371.43 | 380.42 |
| Т, K | 293(2) | 120.01(10) |
| Сингония | Моноклинная | Орторомбическая |
| Пр. гр. | P2(1)/c | Pbca |
| a, b, c, Å | 14.8011(4), 7.3250(3), 15.9426(3) | 11.7440(10), 13.676(3), 23.363(2) |
| α, β, γ, град | 90.0, 102.562(2), 90.0 | 90.0, 90.0, 90.0 |
| Z | 4 | 8 |
| dx, г/см3 | 1.462 | 1.347 |
| V, Å3 | 1687.09(8) | 3752.2(10) |
| μ, мм–1 | 0.345 | 0.207 |
| F(000) | 776 | 1600 |
| Форма кристалла | Призма | Призма |
| Размер, мм | 0.40 × 0.37 × 0.32 | 0.50 × 0.45 × 0.30 |
| Количество измеренных/независимых отражений | 29 149/11 545 | 12 022/4976 |
| I > 2σ(I) | 8268 | 2929 |
| Число уточняемых параметров | 229 | 238 |
| Область сканирования, град | 3.07–42.04 | 2.88–29.00 |
| Пределы h, k, l | –27 ≤ h ≤ 24, –13 ≤ k ≤ 13, –22 ≤ l ≤ 30 | –16 ≤ h ≤ 13, –18 ≤ k ≤ 8, –16 ≤ l ≤ 31. |
| S | 1.026 | 1.002 |
| R-фактор по F 2 > σ(F 2) | 0.0630 | 0.0560 |
| R-фактор по всем отражениям | 0.0909 | 0.1141 |
| wR2 для всех отражений | 0.1560 | 0.1192 |
| Остаточная электронная плотность (min/max), э/Å3 | –0.484/0.985 | –0.312/0.916 |
CIF-файлы исследованных структур депонированы в Кембриджский банк структурных данных (CCDC № 1561491, 1561492) и могут быть свободно получены по запросу на www.ccdc.cam.ac.uk/data_request/cif.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
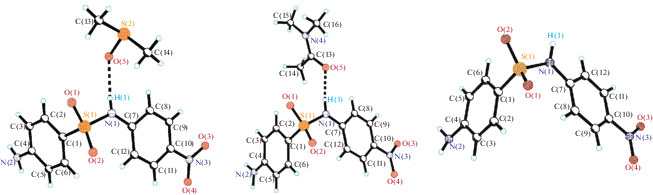
Молекулярное строение соединений 1, 2 и 4-амино-N-(4-нитрофенил)бензолсульфонамида (3), исследованного в [1], представлено на рис. 1.
Молекулы во всех трех соединениях не плоские. Угол между фрагментами NH2–Ph–SO2– и NO2–Ph–NH– составляет 68.8°, 96.5° и 98.2° соответственно в соединениях 1–3. На рис. 2 представлены соединения 1–3, совмещенные по центральному фрагменту С(1)S(1)N(1)C(7). Нитрогруппы незначительно отклоняются от плоскости фенильных колец: 10.9°, 3.7° и 2.7° в 1–3 соответственно. Присутствие молекул растворителя диметилсульфоксида и N,N-диметилацетамида практически не влияет на распределение длин связей и величин валентных углов в 4-амино-N-(4-нитрофенил)бензолсульфонамиде. Длины некоторых связей и величины валентных углов в соединениях 1–3 приведены в табл. 2.
Рис. 2.
Молекулы соединений 1 (сплошная линия) и 2, 3 (пунктирные линии), совмещенные по центральному фрагменту С(1)S(1)N(1)C(7).

Таблица 2.
Длины некоторых связей (Å) и величины валентных углов (град) в соединениях 1–3
| Связь | 1 | 2 | Угол | 1 | 2 |
|---|---|---|---|---|---|
| S(1)–C(1) | 1.748(1) | 1.741(2) | O(2)S(1)O(1) | 119.92(6) | 118.7(1) |
| S(1)–O(1) | 1.4391(9) | 1.437(2) | O(2)S(1)N(1) | 108.82(6) | 109.5(1) |
| S(1)–O(2) | 1.436(1) | 1.433(2) | O(1)S(1)N(1) | 103.05(6) | 103.9(1) |
| S(1)–N(1) | 1.636(1) | 1.627(2) | O(2)S(1)C(1) | 108.31(6) | 107.9(1) |
| N(1)–C(7) | 1.398(2) | 1.395(3) | O(1)S(1)C(1) | 108.23(6) | 108.9(1) |
| N(2)–C(4) | 1.370(2) | 1.356(3) | N(1)S(1)C(1) | 107.91(5) | 107.4(1) |
| N(3)–C(10) | 1.460(2) | 1.461(3) | C(7)N(1)S(1) | 128.34(9) | 126.4(2) |
| N(3)–O(3) | 1.225(2) | 1.225(3) | O(3)N(3)O(4) | 123.3(1) | 123.3(3) |
| N(3)–O(4) | 1.227(2) | 1.235(3) | O(3)N(3)C(10) | 118.4(1) | 118.6(3) |
| O(4)N(3)C(10) | 118.4(1) | 118.1(3) |
Конформационные состояния исследуемых молекул зависят от подвижности моста, соединяющего два фенильных кольца: Ph1 (C(1)–C(6)) и Ph2 (C(7)–C(12)). Для описания конформационного состояния молекул в [7] были предложены три параметра: угол между SO2-группой и фенильным фрагментом Ph1, C(2)–C(1)–S(1)–N(1) (τ1); угол C(7)–N(1)–S(1)–С(1) (τ2), описывающий подвижность связи S(1)–N(1), и торсионный угол C(12)–C(7)–N(1)–S(1) (τ3), который характеризует положение второго фенильного кольца Ph2 относительно NH-группы (табл. 3). Кроме этих параметров в [1] введен угол между двумя фенильными кольцами Ph1 и Ph2 (острый угол между плоскостями двух фенильных колец) и суммарный угол (Στi = τ1 + τ2 + τ3), который описывает интегральную гибкость моста, соединяющего фенильные кольца. Поскольку конформация молекулы в кристаллической решетке зависит от разных факторов, трудно выделить только один, который определял бы ее конформационное состояние. Из данных табл. 3 следует, что на конформационное строение 4-амино-N-(4-нитрофенил)бензолсульфонамида можно влиять, вводя в кристаллическую решетку различные молекулы растворителя (например, диметилсульфоксид и N,N-диметилацетамид). Так, в соединении 1 наблюдаются самые высокие значения углов τ1 и τ2, самое низкое значение угла τ3 и меньший по сравнению с соединениями 2 и 3 угол между фенильными кольцами. Введение молекул растворителя (диметилсульфоксида или N,N-диметилацетамида) больше всего отразилось на величине угла τ3, который характеризует положение фенильного кольца Ph2 относительно NH-группы.
Таблица 3.
Некоторые углы (град), описывающие конформационные состояния молекул СА в кристаллических структурах соединений 1–3
| Соединение | ∠C2−C1−S1−N1 (τ1) | ∠C7−N1−S1−С1 (τ2) | ∠C12−C7−N1−S1 (τ3) | ∠Ph1−Ph2 |
|---|---|---|---|---|
| 1 | –87.7 | –73.2 | –6.2 | 78.3 |
| 2 | –73.1 | –61.1 | –17.2 | 88.3 |
| 3 | –72.8(4) | –63.5(4) | –22.3(6) | 89.5(4) |
В кристалле соединения 1 реализуется межмолекулярная водородная связь между амидным атомом водорода H(1) и атомом кислорода O(5) молекулы диметилсульфоксида (рис. 1) с параметрами: H(1)···O(5) = 2.06 Å, N(1)···O(5) = = 2.801 Å, угол N(1)H(1)O(5) = 172.4°. В кристалле соединения 2 реализуется межмолекулярная водородная связь между амидным атомом водорода H(1) и атомом кислорода O(5) молекулы N,N-диметилацетамида (рис. 2) с параметрами: H(1)···O(5) = 1.91 Å, N(1)···O(5) = 2.762 Å, угол N(1)H(1)O(5) = 168.4°. В [1] показано, что увеличение донорно-акцепторных взаимодействий и водородных связей в кристаллах приводит к снижению подвижности моста С(1)–S(1)–N(1)–C(7). В кристалле 3 меньше межмолекулярных водородных связей, Н(1) не участвует в образовании водородных связей в отличие от соединений 1 и 2. Таким образом, введение молекулы растворителя диметилсульфоксида и N,N-диметилацетамида в кристалл СА увеличивает количество межмолекулярных водородных связей, в результате чего снижается подвижность моста С(1)–S(1)–N(1)–C(7) молекулы СА и изменяется ее конформационное строение, что может сопровождаться разрывом межмолекулярных связей.
Работа выполнена при финансовой поддержке Минобрнауки России (соглашение № 02.а03.21.0008).
Список литературы
Perlovich G.L., Ryzhakov A.M., Tkachev V.V., Hansen L.Kr. // Cryst. Grouth Des. 2011. V. 11. P. 1067.
Korolkovas A. // Essentials of Medicinal Chemistry. 2nd Ed. New York: Wiley, 1988. P. 699.
Adsmond D.A., Grant D.J.W. //J. Pharm. Sci. 2001. V. 90(12). P. 2058.
Kelly C.J., Skakle J.M.S., Wardell J.L. et al. // Acta Cryst. B. 2002. V. 58. P. 94.
Sheldrik G.M. SHELX-86, Program for the Crystal Structur Determination. University of Cambridge (England), 1986.
Sheldrik G.M. SHELXTL Vers. 6.14, Structure Determination Software Suite. Brucker AXS, Madison (Wisconsin, USA), 2000.
Parkin A., Collins A., Gilmore C.J., Wilson C.C. // Acta Cryst. B. 2008. V. 64. P. 66.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография