Кристаллография, 2020, T. 65, № 6, стр. 877-885
Прецизионное уточнение атомной структуры минерала натролита с локализацией молекул воды
А. П. Дудка 1, *, З. В. Бедрань 2, М. А. Белянчиков 2, Б. П. Горшунов 2
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
2 Московский физико-технический институт
Долгопрудный, Россия
* E-mail: dudka@crys.ras.ru
Поступила в редакцию 15.04.2020
После доработки 22.05.2020
Принята к публикации 28.05.2020
Аннотация
Кристаллы, содержащие молекулы воды на расстояниях, исключающих их химическое взаимодействие, являются модельными системами для исследования так называемого “водяного сегнетоэлектричества” – явления упорядочения полярных молекул воды, взаимодействующих посредством электродипольной связи. Методом рентгеноструктурного анализа при 93 K исследован кристалл натролита Na2(Al2Si3O10)(H2O)2, содержащий молекулы воды, локализованные в ячейках (изолированных полостях), образованных ионами каркаса (пр. гр. Fdd2, Z = 8, a = 18.24822(6), b = 18.59561(8), c = 6.57868(4) Å, R1(|F|)/wR2(|F|) = 1.149/1.294%, Δρmin/Δρmax = –0.19/0.17 э/Å3 для 11145 независимых рефлексов). Параметры атомов водорода уточнены в анизотропном приближении атомных смещений, что позволило определить ориентацию молекул воды. Изученный минерал является модельным объектом для изучения водяного сегнетоэлектричества спектроскопическими методами.
ВВЕДЕНИЕ
Изучение нановключений (атомов или молекул) в минералах с порами и каналами традиционно представляет интерес для геологов. На практике такие среды могут быть использованы, например, как матрицы для хранения радиоактивных отходов, молекулярные фильтры. В последнее время подобные объекты привлекают внимание с фундаментальной точки зрения, так как между включениями возможно взаимодействие специфического типа. В частности, интерес вызывают системы, включениями в которых являются электрополярные молекулы воды. При отсутствии химического взаимодействия в ближнем порядке возможно взаимное упорядочение дипольных моментов молекул воды из-за дальнодействующих электродипольных сил. Проявляться этот феномен может в различных системах, как неорганических, так и биологических.
Упорядоченное состояние молекул воды недавно было обнаружено спектроскопическими методами в кристалле берилла [1]. Изучение подобных систем невозможно без сведений об атомных параметрах молекул воды и входящих в их состав атомов водорода. Точная и достоверная информация о характеристиках атомов водорода является важной для изучения энергии взаимодействия атомов в технологических, биологических и фармацевтических материалах. В целом роль водорода в химии, биологии и медицине сложно переоценить. Важнейшей задачей материаловедения является создание устройств хранения водорода, что способно помочь в решении многих климатических и экологических проблем.
Несмотря на актуальность темы и внимание исследователей [2, 3], трудность точного определения координат атомов водорода по рентгенодифракционным данным общеизвестна. В рентгеноструктурном анализе необходимо учитывать условие несовпадения максимума в распределении электронной плотности атома водорода с центром водородного ядра из-за химического взаимодействия в молекуле воды. Поэтому неудивительно, что соответствующие расстояния, полученные по данным рентгеновской дифракции в рутинных исследованиях, оказываются существенно короче, чем получаемые в нейтронографических работах, когда центром рассеяния является протон. Еще сложнее определить параметры смещения атомов водорода в анизотропном приближении. Чтобы обойти эту проблему, обычно рекомендуют использовать дифракцию нейтронов, что нельзя признать “бюджетным” решением. Следует подчеркнуть, что длины связей H–O и смещения атомов водорода в анизотропном приближении, полученные из анализа баз нейтронографических данных, не стоит абсолютизировать. Из-за аппаратных ограничений (главное из которых – относительно большая длина волны нейтронов и следующее из этого низкое разрешение по межплоскостному расстоянию) нейтронные данные не всегда являются достоверными. Кроме того, цель исследования чаще всего не ограничивается диагностикой атомов водорода, поэтому нейтронографические методики могут оказаться недостаточно точными для решения ряда задач.
Интересная альтернатива предложена в цикле работ Мадсена, которая реализована на веб-сервере SHADE [4]. В ряде случаев можно считать, что смещения атома водорода имеют две составляющие – следование общим колебаниям окружающих атомов плюс его собственные смещения [5]. Собственные смещения оцениваются по нейтронографической базе данных, а общее движение рассчитывается с помощью TLS-процедуры [6]. Это означает, что метод применим для молекулярных кристаллов, и минимальное условие его применимости – это удовлетворение теста Хиршфельда [7] на жесткость химических связей. Для исследуемого кристалла данный метод не может быть использован по обоим критериям.
Общий подход к решению сложных задач при уточнении параметров структурных моделей по экспериментальным данным с использованием методов минимизации, подобных МНК, заключается в увеличении количества и разнообразия измерений [8]. Физика рассеяния рентгеновского излучения колеблющимся атомом такова, что наиболее информативным для определения атомных смещений является рассеяние на большие углы. Добавляя в уточнение структурной модели вклады от высокоугловых рефлексов, можно значительно повысить достоверность определения параметров атомных смещений, особенно ангармонических.
Следуя подходу [8], в [9] была уточнена модель структуры минерала кордиерита, (Mg1.643Mn0.001 Fe0.137Al0.104Ca0.002)Al3(Al0.921Si5.079)O18 · [(H2O)0.756 Na0.041K0.001)] (упрощенная химическая формула (Mg,Fe,Al)2Al4Si5O18), и были определены координаты чередующихся от ячейки к ячейке молекул воды и углекислоты, расположенных в вертикальных каналах на уровне z = 1/4. Было показано, что наблюдается несколько ориентаций молекулы воды с интенсивными межориентационными переходами. А именно, в интервале температур 91–295 K, вероятно, не существует упорядоченных ориентаций молекул H2O, создающих сетку дальнего порядка. Кроме физико-химических причин локализация молекул воды в кордиерите осложняется их малым количеством: значительная часть элементарных ячеек не содержит молекул H2O и CO2: заселенности позиций молекулами воды и углекислоты равны ∼9 и ∼12% соответственно.
В настоящей работе в качестве объекта исследования выбран кристалл натролита – гидратированного алюмосиликатного цеолита (Na2Al2Si3O10 · · 2H2O, ромбическая пр. гр. Fdd2). Минералы группы цеолита, описываемые общей формулой (M+,$M_{{0.5}}^{{2 + }}$)x[AlxSiyO2(x + y)](H2O)n, являются кристаллическими соединениями, структура которых характеризуется каркасом из связанных тетраэдров, образованных четырьмя атомами кислорода, окружающими катион [10]. В случае натролита основным структурным блоком является фрагмент из двух AlO4- и трех SiO4-тетраэдров. Этот каркас содержит открытые полости в виде каналов и ячеек-кегов (изолированных полостей). Полости заполнены внекаркасными катионами (Na+ в данном случае) и молекулами воды. В природе натролит часто встречается в виде прозрачных столбчатых кристаллов совместно с анальцимом (NaAlSi2O6) · H2O.
Подгруппа натролита группы цеолита содержит несколько членов. Кроме самого натролита интересны паранатролит (Na2Al2Si3O10 · 3H2O, моноклинная пр. гр. Cc) и тетранатролит (или гоннардит, (Na,Ca)16[Al19Si21O80] · nH2O, тетрагональная пр. гр. I$\bar {4}$2d). Взаимосвязь структур в подгруппе натролита широко обсуждалась [11–13]. Паранатролит [14] и тетранатролит [15] были обнаружены в Квебеке, Канада. На территории России паранатролит впервые был обнаружен в Ловозерском и Хибинском массивах [16]. Уточнение структуры паранатролита по рентгенодифракционным данным проведено в [17] в анизотропном приближении смещений атомов водорода. Координатам атомов водорода были приписаны значения, полученные в нейтронографичеcком исследовании [18], и в процессе уточнения они были фиксированы. Причины стабилизации структуры паранатролита обсуждались в [19].
Тетранатролит – продукт дегидратации паранатролита, причем реакция дегидратации является обратимой [20]. Гидратация/дегидратация натролита под воздействием давления вызывает не только перестройку структуры [21], но и формирует хорошо упорядоченные одномерные “цепочки” молекул воды [22]. Кристаллическая структура тетранатролита изучена в [23]. Вариация структуры тетранатролита с температурой проанализирована в [24]. Натролит принадлежит к ромбической сингонии и имеет выделенные направления, что может привести к однозначным выводам об ориентации дипольных моментов молекул воды. В отличие от кордиерита в этом минерале молекулы воды заполняют регулярные ячейки-кеги каркаса, т.е. имеют высокую заселенность; это должно облегчить задачу характеризации молекул воды.
Структура натролита впервые была определена в [25, 26] рентгенодифракционным методом. Ввиду сложности структурного анализа этого минерала исследования проводили неоднократно [27, 28]. С использованием современного оборудования в [29] на разностных синтезах Фурье электронной плотности были определены позиции атомов водорода в структуре натролита и построена сетка водородных связей. В [29] были получены явно заниженные расстояния O–H. Это было сделано на основании 8136 измеренных и 1495 независимых рефлексов при достигнутом согласовании модель–эксперимент R1(|F|) = 2.85% для рефлексов, имеющих статистически значимые интенсивности I > 2σ(I). Такой точности недостаточно для детального анализа ориентации дипольного момента молекулы воды в кристалле натролита. Отметим также работу [30], в которой процесс упорядочения молекул воды в натролите был инициирован приложенным давлением. Процессы гидратации/дегидратации натролита изучены в [31]. Наиболее достоверные сведения о позиционных параметрах атомов водорода получены в нейтронографическом исследовании [32], однако параметры смещения атомов водорода представляются завышенными, вероятно, в силу недостаточно высокого разрешения (sin θ/λ ≤ ≤ 1.05 Å–1, 2176 независимых рефлексов, R1(F2) = = 5.4%). Таким образом, уточнение структуры натролита на прецизионном уровне представляется актуальной задачей.
Цель исследования состояла в определении атомной структуры минерала натролита на уровне точности, достаточном для установления параметров молекул воды рентгенодифракционным методом. В методическом плане цель работы состояла в наработке рекомендаций, облегчающих структурную диагностику молекул воды и атомов водорода в кристаллах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образец натролита был приобретен в сети Интернет, страна происхождения – Индия. Для дифракционного исследования был приготовлен образец в форме эллипсоида с осями 0.30 и 0.38 мм. Дифракционные эксперименты проведены на дифрактометре Xcalibur фирмы Rigaku Oxford Diffraction с CCD-детектором EOS S2. Использовано излучение MoKα с длиной волны λ = 0.71073 Å; измерения сделаны при номинальной температуре 87 K. Для охлаждения образца была использована криосистема Cobra Plus (Oxford Cryosystems) с открытым потоком холодного азота, направленного на образец. При проведении низкотемпературных дифракционных экспериментов с такой аппаратурой необходимо учитывать, что существует градиент температуры между закрепленным в сопле криостриммера датчиком температуры и образцом, находящимся от датчика на расстоянии до 12 мм. Проведенная калибровка [33] показала, что реальная температура образца составила 93 K. В эксперименте получен представительный набор данных: покрытие обратного пространства превысило 99.5% при максимальном угле рассеяния рефлексов θ = 74.4° и избыточности данных более пяти.
Расчет интегральных интенсивностей по дифракционным картинам выполнен по программе CrysAlisPro [34]. Обработка данных включала в себя: учет геометрических особенностей съемки (поправка Лоренца) и коррекцию на поляризацию излучения; калибровку дифрактометра [35, 36]; коррекцию интенсивностей на поглощение излучения для эллипсоидальных образцов [37]; коррекцию на эффект теплового диффузного рассеяния [38] с упругими константами [39]. При усреднении эквивалентных рефлексов использована оценка средней интенсивности методом непараметрической статистики [40], уточнен вклад половинной длины волны [41]. Поправку на экстинкцию не вводили, так как ее учет в отличие от [32] оказывал незначительное влияние на уточнение. Введение всех поправок и уточнение структурных параметров были выполнены по программе ASTRA [42]. Синтезы Фурье электронной плотности построены с использованием программы Jana2006 [43]. Графические построения выполнены в программах Diamond [44] и Vesta [45]. Детали сбора данных и уточнения структуры натролита при 93 К приведены в табл. 1. Координаты атомов, эквивалентные изотропные среднеквадратичные смещения атомов и анизотропия смещений атомов (эллипсоидальность ε [46]) сведены в табл. 2. Информация о структуре депонирована в Кембриджский банк структурных данных (CCDC № 1999308).
Таблица 1.
Кристаллографические характеристики, данные эксперимента и результаты уточнения модели структуры кристалла натролита Na2(Al2Si3O10)(H2O)28
| T, К | 93 |
| a, b, с, Å | 18.24822(6)*, 18.59561(8), 6.57868(2) |
| V, Å3 | 2232.39(1) |
| μ, мм–1 | 0.721 |
| Дифрактометр | Xcalibur EOS S2 CCD |
| Излучение; λ, Å | MoKα; 0.71073 |
| Тип сканирования | ω |
| Пределы h, k, l | –49 ≤ h ≤ 48, –48 ≤ k ≤ 45, –17 ≤ l ≤ 17 |
| θmax, град | 74.4 |
| Число измеренных рефлексов | 57484 |
| Избыточность** | 5.04 |
| 〈σ(F 2)/F 2〉 | 0.0253 |
| R1уср(F 2)/wR2уср(F 2), % | 1.49/1.40 |
| Число рефлексов/параметров в уточнении | 11145/130 |
| R1(|F |)/wR2(|F |), % | 1.149/1.294 |
| S | 1.00 |
| Δρmin/Δρmax, э/Å3 | –0.19/0.17 |
* Точность, декларируемая программным обеспечением дифрактометра, которая приблизительно в 10 раз превышает реальную точность, получаемую, например, в повторных экспериментах.
** Избыточность – отношение числа измеренных рефлексов к числу независимых рефлексов, используемых в уточнении. Критерии точности усреднения: 〈σ(F 2)/F 2〉 = {∑i[σ(F 2)/F2 ]}/N ≈ ≈ {∑i[σ(F 2)]/∑i[F 2]}; R1уср(F 2) = ∑j[∑i|$F_{i}^{2}$ – 〈F2〉|]/∑j[∑i〈F2〉]; wR2уср(F2) = √{∑j[∑iw($F_{i}^{2}$ – 〈F2〉)2]/∑j[∑iw(〈F2〉)2]}. Критерии точности уточнения: R1(|F |) = ∑||Fobs| – |Fcalc||/∑|Fobs|; wR2(|F |) = = √{∑w(|Fobs| – |Fcalc|)2/∑w(Fobs)2}.
Таблица 2.
Координаты, эквивалентные тепловые параметры Ueq и эллипсоидальность смещений атомов ε [46] в кристалле натролита при температуре 93 K
| Атом | Позиция | x/a | y/b | z/c | Ueq, Å2 | ε |
|---|---|---|---|---|---|---|
| Si1 | 8a | 0 | 0 | 0 | 0.003436(14) | 0.0051 |
| Si2 | 16b | 0.152745(3) | 0.211672(3) | 0.622566(11) | 0.003246(9) | 0.0033 |
| Al1 | 16b | 0.036861(4) | 0.094183(4) | 0.615131(13) | 0.003358(11) | 0.0028 |
| Na1 | 16b | 0.220688(6) | 0.030672(6) | 0.617389(19) | 0.006896(19) | 0.0068 |
| O1 | 16b | 0.022139(9) | 0.068983(9) | 0.86666(3) | 0.00634(2) | 0.0191 |
| O2 | 16b | 0.069250(8) | 0.182731(8) | 0.60946(3) | 0.00452(2) | 0.0179 |
| O3 | 16b | 0.098442(9) | 0.035421(9) | 0.50070(3) | 0.00597(2) | 0.0104 |
| O4 | 16b | 0.205712(9) | 0.152434(10) | 0.72476(3) | 0.00585(3) | 0.0186 |
| O5 | 16b | 0.179917(9) | 0.227874(10) | 0.38981(3) | 0.00652(3) | 0.0173 |
| O6 | 16b | 0.05612(2) | 0.18976(2) | 0.11096(6) | 0.00905(7) | 0.0074 |
| H1 | 16b | 0.0513(4) | 0.14340(18) | 0.0433(9) | 0.019(2) | 0.0407 |
| H2 | 16b | 0.10281(18) | 0.1913(4) | 0.1794(9) | 0.015(2) | 0.0484 |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Установление структуры натролита. Определение параметров каркаса, состоящего из AlO4- и SiO4-тетраэдров, не представляло сложностей. Начальная модель структуры была взята из [32]. Отметим, что выбор начала координат в [29, 32] различается. Выявлено, что натролит кристаллизуется в пр. гр. Fdd2 с ячейкой следующих размеров: a = 18.24822(6), b = 18.59561(8), c = 6.57868(4) Å, Z = 8.
В каркасе можно выделить фрагмент из трех SiO4- и двух AlO4-тетраэдров. Два Si2O4-тетраэдра с катионом на уровне z ∼ 0.373 и два Al1O4-тетраэдра на уровне z ∼ 0.615 формируют четырехзвенные кольца. Они связаны между собой пятым Si1O4-тетраэдром, z = 0. Фрагменты располагаются в виде непрерывных цепочек вдоль оси с (рис. 1а). В этом направлении наблюдается удлинение волокон или иголок, которые образуют кристаллы при росте. В перпендикулярных направлениях цепочки связаны атомами кислорода. Каналы внутри структуры содержат два иона натрия и две молекулы воды. Ионы Na+ окружены четырьмя ионами О2– и двумя молекулами Н2О (рис. 1б).
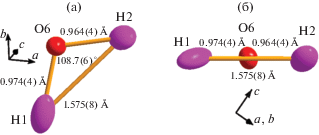
Рис. 1.
Структура минерала натролита: а – общий мотив как каркас из фрагментов, образованных тремя SiО4- (темные) и двумя AlО4-тетраэдрами (светлые), связанными треугольными Na-призмами (показана одна, атомы водорода не показаны); б – два фрагмента, состоящие из SiО4- и AlО4-тетраэдров, в полости между которыми расположены ионы Na+, их кислородное окружение – призмы, молекула воды H1–O6–H2 находится в изолированной ячейке); в – молекулы воды H1–O6–H2 окружают ионы Na+, вытянутые цепочками в направлении оси c ячейки (атом кислорода O6 умеренно связан только с двумя ближайшими атомами натрия). Границы эллипсоидов ADP рассчитаны для вероятности 99 (а) и 90% (б, в).
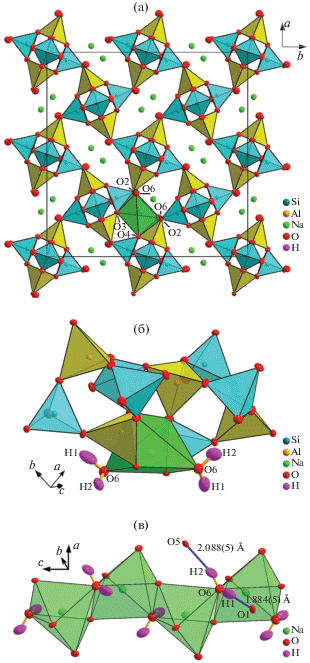
Известно, что цеолиты в целом относятся к группе нестехиометрических кристаллогидратов, для них характерна высокая изменчивость состава. Тем не менее описаны образцы натролита с малой степенью разупорядочения Si–Al [47]. В настоящей работе представлен еще один такой случай. Тетраэдры SiO4 и AlO4 связаны с Na-призмами ребрами O2–O3 и O2–O4 (рис. 1а). В двух оставшихся вершинах Na-призм находятся атомы O6, которые не имеют ближайших соседей-катионов, кроме двух ионов Na+. Более слабые связи атомов O6 с SiO4- и AlO4-тетраэдрами осуществляются через водородную связь O6–H1···O1 длиной 1.884(5) Å и O6–H2···O5 длиной 2.088(5) Å (рис. 1в). Поэтому молекулу воды H1–O6–H2 можно рассматривать как группу, связанную с каркасом не очень жестко.
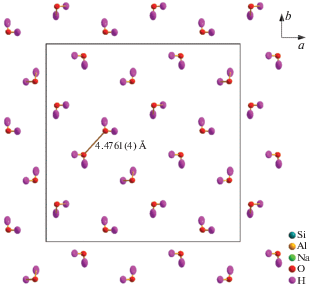
Таким образом, атомная конфигурация в натролите имеет следующие особенности. С одной стороны, молекулы воды связаны с каркасом, в ячейках (нанопорах) которого они содержатся в достаточном количестве, в отличие от ситуации с кристаллом кордиерита [9], когда нужно было локализовать следовое количество свободной воды в каналах. С другой стороны, атомы водорода являются терминальными, и вполне может оказаться, что электродипольного взаимодействия между молекулами воды достаточно для разворота и упорядочения и атомов водорода, и водных молекул целиком. Сетка молекул воды в ячейках каркаса натролита такова (рис. 2), что электродипольные вклады отдельных молекул могут суммироваться.
Рис. 2.
Мотив сетки молекул воды в натролите. Границы эллипсоидов ADP рассчитаны для вероятности 95%.
Получение атомной модели молекул воды в натролите. Достаточна ли чувствительность структурного анализа для уточнения параметров молекулы воды с использованием обычной модели независимых атомов? Как правило, анизотропные параметры смещения атомов (atomic displacement parameters – ADP) водорода определяют в нейтронографических экспериментах, а в рентгеноструктурном исследовании эти параметры фиксируют. Определенную надежду на успех давала публикация [48], в которой сообщается о возможности точной локализации атомов водорода по данным рентгеновской дифракции. Для этого необходимо использовать сложные модели электронной плотности: мультипольную [49] или модель атомов Хиршфельда [50].
Необходимо ответить на вопрос, в какой степени увеличение объема экспериментальных данных способно “заменить” усложнение моделирования. Общее правило увеличения объема данных, необходимое для повышения достоверности результатов [8], следующее: с увеличением числа измеренных высокоугловых рефлексов повышается точность определения параметров атомных смещений. В любой модели уточнение ADP водорода в анизотропном приближении возможно лишь в редких случаях особо точных экспериментальных данных, для получения которых были применены следующие средства: тщательная подготовка образца, охлаждение образца и увеличение числа измеренных интенсивностей рефлексов. Время сбора данных было увеличено до 122 ч при крайне медленном сканировании высокоугловых рефлексов: 260 с/град. Дифракционный эксперимент сочетал в себе редко применяемые параметры: большую длительность, высокое разрешение по межплоскостному расстоянию sin θ/λ ≤ 1.36 Å–1, избыточность более пяти, которая оказалась достаточной, чтобы обеспечить покрытие обратного пространства 99.55% для такого сверхвысокого разрешения. Предпринятые меры позволили измерить большое число интенсивностей отражений, что дало в заключительном уточнении 11 145 независимых рефлексов (усредненных с низким R-фактором R1уср(F 2) = = 1.49%), полученных после редукции интенсивностей – удаления вкладов всех эффектов, сопровождавших упругую когерентную дифракцию. В частности, учет теплового диффузного рассеяния понижает R-факторы уточнения на 0.02–0.03% и улучшает статистические критерии высокоугловых рефлексов.
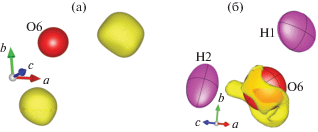
Благодаря аккуратным коррекциям даже неполная модель структуры натролита без учета атомов водорода, содержащая 10 атомов и 87 параметров, была уточнена до критериев R1(|F|)/wR2(|F|) = 1.208/1.470%. На карте разностного синтеза Фурье электронной плотности в окрестности атома O6 на расстоянии 0.859 Å был обнаружен пик H1, а на расстоянии 0.964 Å – пик H2. Максимальная высота этих пиков была Δρmax = = 0.3 э/Å3 (рис. 3а). После уточнения параметров атомов водорода в изотропном приближении (с наложением связи на расстояния O–H) разностная плотность уменьшилась, и R-факторы уточнения статистически значимо понизились на уровне доверия 0.9999 [51]. Атом H2 находится выше горизонтальной плоскости, проходящей через центр атома O6, а атом H1 – ниже этой плоскости. Переход к анизотропным ADP для атомов водорода дополнительно улучшил критерии. Тем не менее наблюдались большие смещения Ueq атома O6 при удивительно малой анизотропии (эллипсоидальности ε [46]) и заметная остаточная плотность в его окрестности. Терминальная природа молекулы H2O не исключает возможности ее ангармонического смещения. Расширение модели для учета ангармонической составляющей смещений атома кислорода O6 до четвертого ранга было связано с попыткой улучшить показатели подгонки модели и чистоту разностных синтезов. Это удалось сделать не полностью: небольшая остаточная плотность в области атома O6 осталась (рис. 3б). Ангармоническая модель была принята по другой (основной) причине – в ней ADP атомов водорода уменьшились в полтора раза (рис. 4а). Тест Гамильтона–Фишера [46] уверенно подтверждает статистическую значимость расширенных моделей: добавление в модель структуры атомов водорода в изотропном приближении, переход к анизотропным атомным смещениям атомов водорода, переход к ангармоническим смещениям атомов кислорода O6. Уточнение структуры завершилось на прецизионном уровне: a = 18.24822(6), b = 18.59561(8), c = = 6.57868(4) Å, пр. гр. Fdd2, Z = 8, sin θ/λ ≤ 1.35 Å–1; R1(|F |)/wR2(|F |) = 1.149/1.294%, Δρmin/Δρmax = = ‒0.19/0.17 э/Å3 для набора из 11 145 независимых рефлексов, включая 1169 рефлексов с F 2 < 2σ(F 2).
Рис. 3.
Трехмерная разностная электронная плотность в области молекулы воды: а – без учета атомов водорода в модели (атом кислорода O6 в анизотропном приближении и изоповерхности атомов водорода с границей 0.2 э/Å3); б – в финальной модели (атомы водорода имеют анизотропные ADP, атом кислорода O6 уточнен в ангармоническом приближении).
Обсудим, насколько достоверными являются параметры водородных связей, полученные при таком уточнении. Для этого сравним результаты трех работ: настоящей работы, [29] и [32] (табл. 3). Уникальная работа [32] выполнена на нейтронном дифрактометре с точечным детектором при 20 K. Работы настоящая и [29] выполнены на рентгеновских CCD-дифрактометрах одного поколения близких годов выпуска. Легко видеть, что результаты настоящей работы и [32] близки, а их точность сопоставима. Результаты [29] заметно хуже по относительной точности и порой ошибочны по абсолютным величинам. Причина – в [29] использованы экспериментальные данные недостаточно высокого разрешения.
Таблица 3.
Сравнение параметров водородных связей в кристалле натролита
| Литература | O6–H···On | O6–H, Å | H···On, Å | O6···On, Å | O6–H···On, град |
|---|---|---|---|---|---|
| [32] | O6–H1···O1 | 0.974(2) | 1.877(2) | 2.830(1) | 165.6(2) |
| [32] | O6–H2···O5 | 0.964(2) | 2.103(2) | 2.999(1) | 153.8(2) |
| [29] | O6–H1···O1 | 0.73(4) | 2.38(4) | 3.009(3) | 144(4) |
| [29] | O6–H2···O5 | 0.66(4) | 2.21(4) | 2.848(3) | 162(5) |
| НР | O6–H1···O1 | 0.974(4) | 1.884(5) | 2.8304(4) | 163.2(6) |
| 0.906(4)* | |||||
| НР | O6–H2···O5 | 0.964(4) | 2.088(5) | 2.9951(4) | 156.2(5) |
| 0.892(4)* |
На приведенном примере можно понять ограниченность некоторых выводов и рекомендаций, касающихся определения характеристик водородных связей в кристаллах по рентгенодифракционным данным. Аналитические материалы, посвященные вопросу оценки параметров атомов водорода в кристаллах, опираются преимущественно на данные об органических кристаллах – в лучших случаях реализуется разрешение до d = = 0.6 Å, а критерий уточнения модели всего лишь R1(|F |) > 2–3%. В настоящей работе разрешение составляет d = 0.36 Å, и критерий относительной точности R1(|F |) = 1.1%. Более того, в случае применения обычного критерия уточнения F > 4σ(F ) получаем R-факторы менее 0.8% для примерно 9000 рефлексов. Данные подобной точности редко попадают в обзоры и проверки и не влияют на статистику, поэтому остается неизвестно, какие возможности уточнения параметров атомов водорода открываются при использовании достоверных данных, подобных полученным в настоящей работе.
В целях структурной диагностики минерала натролита, необходимой для спектроскопии и квантово-механических расчетов, следовало решить две задачи – получить правильные расстояния кислород–водород и описать смещения атомов водорода в анизотропном приближении. Расстояния кислород–водород были уточнены с использованием ограничений, наложенных на них в соответствии с нейтронографическим исследованием [32]. При удалении ограничений и полноматричном уточнении расстояния O–H несколько уменьшаются (табл. 3), но все еще остаются в пределах средних длин связей O–H, равных 0.9–1.0 Å. Эти расстояния соответствуют результатам нейтронографических экспериментов, депонированным в Кембриджскую базу данных [52], а также находятся в пределах значений, характерных для работ по изучению зарядовой плотности, выполненных с использованием мультипольной модели или уточнения модели атомов Хиршфельда [48].
Анизотропные ADP обоих атомов водорода получены в свободном уточнении без ограничений. Таким образом, обе сложные задачи решены с использованием рентгеноструктурных данных, полученных в лаборатории, без проведения нейтронодифракционного эксперимента. Впрочем, определение расстояний O–H еще нуждается в дополнительных методологических исследованиях. Очевидные преимущества будут легко получены при переходе к лабораторному источнику Ag-излучения с более короткой длиной волны и увеличению объема измерений на 30–50%.
Возможно ли обнаружение пьезоэлектрического упорядочения молекул воды в кристалле натролита? Ответ на данный вопрос дадут спектроскопические исследования. В структурной работе можно лишь оценить потенциальную возможность такого явления. Сделать это удобно в сравнении с исследованием похожей проблемы в кристалле кордиерита [9]. В кордиерите молекулы воды располагаются в относительно ажурных каналах. Минимальное расстояние между водными атомами кислорода равно 4.674 Å. Их мало – приблизительно только каждая десятая ячейка содержит молекулу воды. Следовательно, эффективное расстояние “вода–вода” будет значительно больше, и ожидается, что электрическое поле, создаваемое такой системой диполей, будет относительно слабым. Тепловое движение атомов при комнатной температуре и при температуре жидкого азота легко разупорядочивает такую конструкцию. Упорядочение диполей возникает только при температурах ниже 3 K [9]. В натролите, с одной стороны, молекула воды связана с каркасом и поэтому следует ожидать не выстраивания молекул воды друг относительно друга, а их ориентации по направлениям дальнодействующих полей всей решетки. С другой стороны, водные атомы кислорода O6 расположены друг к другу ближе, чем в кордиерите d(O6–O6) = = 4.4761(4) Å, и степень заполнения нанопор молекулами воды выше. Более того, эти атомы обособлены, между ними и катионами Na+ реализуются связи умеренной силы: d(Na–O6) = = 2.3802(4) Å. Эквивалентные изотропные среднеквадратичные смещения атомов O6 необычно велики (0.009 против 0.004–0.006 Å2 для остальных пяти атомов кислорода). Даже ангармоническая модель смещений атомов O6 не “убирает” полностью остаточную электронную плотность в окрестности этого атома. Тест Хиршфельда [7] на жесткость химических связей в структуре натролита не выполняется только для атомов O6, H1 и H2. Кроме того, для связанного с молекулой воды катиона Na+ имеется не совсем жесткая связь Na–O2 (ближайший атом O2, находящийся на расстоянии 2.49723(15) Å). Таким образом, молекулы воды действительно слабо связаны с каркасом, что делает возможным их упорядочение. Направления предпочтительных колебаний атомов водорода и направление дипольного момента хорошо видны (рис. 4б). Молекула воды, по сути, является терминальной группой, и можно ожидать, что она обладает дополнительными степенями свободы по сравнению с чисто каркасными анионами.
Таким образом, данные рентгеноструктурного анализа свидетельствуют о том, что минерал натролит является удобным объектом для изучения водяного сегнетоэлектричества спектроскопическими методами, так как этот минерал содержит “массивную” трехмерную сетку полярных молекул воды, обладающих определенной подвижностью.
ЗАКЛЮЧЕНИЕ
Выполнено прецизионное рентгеноструктурное исследование водосодержащего минерала натролита Na2(Al2Si3O10)(H2O)2, который является перспективным кандидатом для изучения водяного сегнетоэлектричества спектроскопическими методами. Электродипольное упорядочение полярных молекул воды представляется важным звеном многих явлений в живой и неживой природе.
В структурном исследовании получены экспериментальные данные сверхвысокого разрешения, большого объема, полноты и точности: sin θ/λ ≤ 1.36 Å–1; R1(|F|)/wR2(|F|) = 1.149/1.294%, Δρmin/Δρmax = –0.19/0.17 э/Å3. Уточнение параметров атомной структуры проведено по набору данных из 11 145 независимых рефлексов для модели из 130 уточняемых параметров (около 86 измерений/параметр). Использован полный набор данных, без отбраковок слабых и дефектных рефлексов, включающий в себя 1169 рефлексов с F 2 < 2σ(F 2).
Кристаллохимический анализ выявил признаки слабости связи водных молекул с каркасом. Решена сложная задача локализации атомов водорода в молекулах воды в анизотропном приближении атомных смещений. Полученные параметры молекул воды хорошо согласуются с результатами нейтронографических исследований и значительно превосходят по достоверности результаты известных рентгеноструктурных работ.
Успех проведенного исследования достигнут благодаря эффективным оригинальным методикам, основанным на методе межэкспериментального сравнения [8]. Анализ литературы и опыт авторов позволили выдвинуть предположение, что основной причиной неудач в определении корректных параметров водородных связей в кристаллах по данным рентгеновской дифракции является недостаток измерений высокого разрешения, а не объективные ограничения, связанные с физикой рассеяния рентгеновских лучей, как это принято считать.
Полученные данные об ориентации молекул воды, их мотиве и степени свободы колебаний позволили прийти к заключению, что минерал натролит является удобным объектом для изучения водяного сегнетоэлектричества спектроскопическими методами. В настоящей структурной работе собраны необходимые данные для проведения молекулярно-динамических расчетов и планирования спектроскопических исследований.
Работа выполнена с использованием оборудования ЦКП ФНИЦ “Кристаллография и фотоника” при поддержке Минобрнауки РФ (проект RFMEFI62119X0035) в рамках Государственного задания ФНИЦ “Кристаллография и фотоника” РАН.
Список литературы
Gorshunov B.P., Torgashev V.I., Zhukova E.S. et al. // Nature Commun. 2016. V. 7. P. 12842.
Müller P., Herbst-Irmer R., Spek A.L. et al. Hydrogen atoms, in Crystal Structure Refinement: A Crystallographer’s Guide to SHELXL / Ed. Müller P. (International Union of Crystallography Texts on Crystallography) New York: Oxford University Press, 2006. № 8. Ch. 3.
Hoser A.A., Paulina M., Dominiak P.M., Wozniak K. // Acta Cryst. A. 2009. V. 65. P. 300.
Madsen A.O. // J. Appl. Cryst. 2006. V. 39. P. 757.
Munshi P., Madsen A.O., Spackman M.A. et al. // Acta Cryst. A. 2008. V. 64. P. 465.
Schomaker V., Trueblood K.N. // Acta Cryst. B. 1968. V. 24. P. 63.
Hirshfeld F.L. // Acta Cryst. A. 1976. V. 32. P. 239.
Дудка А.П. // Кристаллография. 2002. Т. 47. № 1. С. 156.
Дудка А.П., Белянчиков М.А., Томас В.Г. и др. // Поверхность. Рентген., синхротр. и нейтр. исслед. 2020. Т. 63. № 7. С. 1.
Coombs D.S., Alberti A., Armbruster T. et al. // Can. Mineral. 1997. V. 35. P. 1571.
Artioli G., Galli E. // Am. Mineral. 1999. V. 84. P. 1445.
Evans H.T., Konnert J.A., Ross M. // Am. Mineral. 2000. V. 85. P. 1808.
Lee Y., Hriljac J.A., Parise J.B., Vogt T. // Am. Mineral. 2006. V. 91. P. 247.
Chao G.Y. // Can. Mineral. 1980. V. 18. P. 85.
Chen T.T., Chao G.Y. // Can. Mineral. 1980. V. 18. P. 77.
Хомяков А.П., Черепивская Г.Е., Михеева М.Г. // Докл. АН СССР. 1986. Т. 288. № 1. С. 214.
Pechar F. // Cryst. Res. Technol. 1988. V. 23. № 5. P. 647.
Pechar F., Schafer W., Will G. // Z. Kristallogr. 1983. B. 164. S. 19.
Lee Y., Hriljac J.A., Parise J.B., Vogt T. // Am. Mineral. 2005. V. 90. P. 252.
Seryotkin Yu.V., Bakakin V.V. // Eur. J. Mineral. 2007. V. 19. P. 593.
Lee Y., Vogt T., Hriljac J.A. et al. // J. Am. Chem. Soc. 2002. V. 124. P. 5466.
Lee Y., Martin C.D., Parise J.B. et al. // Nano Lett. 2004. V. 4. № 4. P. 619.
Михеева М.Г., Пущаровский Д.Ю., Хомяков А.П., Ямнова H.A. // Кристаллография. 1986. Т. 31. № 3. С. 434.
Lee Y., Hriljac J.A., Vogt T. // Am. Mineral. 2005. V. 90. P. 247.
Taylor W.H., Meek C.A., Jackson W.W. // Z. Kristallogr. 1933. B. 84. S. 373.
Meier W.M. // Z. Kristallogr. 1960. B. 113. S. 430.
Ghermani N.E., Lecomte C., Dysausoy Y. // Phys. Rev. B. 1996. V. 53. P. 5231.
Baur W.H., Kassner D., Kim C.-H., Sieber N.H. // Eur. J. Mineral. 1990. V. 2. P. 761.
Capitelli F., Derebe M.G. // J. Chem. Crystallogr. 2007. V. 37. P. 583.
Seryotkin Yu.V., Likhacheva A.Yu., Rashchenko S.V. // J. Struct. Chem. 2016. V. 57. № 7. P. 1377.
Wang H.-W., Bish D.L. // Eur. J. Mineral. 2010. V. 22. P. 271.
Artioli G., Smith J.V., Kvick A. // Acta Cryst. C. 1984. V. 40. P. 1658.
Дудка А.П., Верин И.А., Смирнова Е.С. // Кристаллография. 2016. Т. 61. № 4. С. 663.
Rigaku Oxford Diffraction, CrysAlisPro Software System, version 1.171.40.64, Rigaku Corporation, Oxford, UK, 2019.
Dudka A. // J. Appl. Cryst. 2010. V. 43. № 6. P. 1440.
Дудка А.П. // Кристаллография. 2015. Т. 60. № 4. С. 659.
Дудка А.П. // Кристаллография. 2005. Т. 50. № 6. С. 1148.
Дудка А.П., Рабаданов М.Х., Лошманов А.А. // Кристаллография. 1989. Т. 34. Вып. 4. С. 818.
Sanchez-Valle C., Sinogeikin S.V., Lethbridge Z.A.D. et al. // J. Appl. Phys. 2005. V. 98. P. 053508.
Дудка А.П. // Кристаллография. 2018. Т. 63. № 6. С. 1001.
Dudka A. // J. Appl. Cryst. 2010. V. 43. P. 27.
Dudka A. // J. Appl. Cryst. 2007. V. 40. P. 602.
Petricek V., Dusek M., Palatinus L. // Z. Kristallogr. 2014. B. 229 (5). S. 345.
Brandenburg K. Diamond. Ver. 3.1. Crystal Impact GbR, Bonn, Germany. 1999.
Momma K., Izumi F. // J. Appl. Cryst. 2011. V. 44. P. 1272.
Дудка А.П., Милль Б.В. // Кристаллография. 2014. Т. 59. № 5. С. 759.
Neuhoff P.S., Kroeker S., Du L.-S. et al. // Am. Mineral. 2002. V. 87. P. 1307.
Woinska M., Grabowsky S., Dominiak P.M. // Sci. Adv. 2016. V. 2. P. e1600192.
Hansen N.K., Coppens P. // Acta Cryst. A. 1978. V. 34. P. 909.
Capelli S.C., Bürgi H.-B., Dittrich B. et al. // IUCr J. 2014. V. 1. P. 361.
Hamilton W. // Acta Cryst. 1965. V. 18. P. 502.
Allen F.H., Bruno I.J. // Acta Cryst. B. 2010. V. 66. P. 380.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография