Кристаллография, 2020, T. 65, № 6, стр. 914-920
Предварительные структурные исследования инактивированного вируса желтой лихорадки
Е. Б. Пичкур 1, 2, В. Р. Самыгина 1, 2, *, А. Л. Иванова 3, А. Ю. Федотов 3, А. П. Иванов 3, Е. В. Хватов 3, А. А. Ишмухаметов 3, 4, М. Ф. Ворович 3, 4
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Институт кристаллографии им. А.В. Шубникова, ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
3 Федеральный научный центр исследований и разработки иммунобиологических препаратов им. М.П. Чумакова РАН
Москва, Россия
4 Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России (Сеченовский университет)
Москва, Россия
* E-mail: lera@crys.ras.ru
Поступила в редакцию 17.06.2020
После доработки 25.06.2020
Принята к публикации 25.06.2020
Аннотация
Разработана методика выделения и очистки инактивированного вируса желтой лихорадки для определения структуры высокого разрешения методом криоэлектронной микроскопии (криоЭМ). Для получения структуры вируса методом криоЭМ его концентрация в образце должна составлять не менее 1012 частиц/мл. Использовано сочетание нескольких методов оценки концентрации образца, таких как бляшкообразование, спектрофотометрический метод, электрофорез белков в поли-акриламидном геле. Чистота образца подтверждена электрофоретически и просвечивающей электронной микроскопией. Собран набор данных криоЭМ, проведена 2D-классификация частиц.
ВВЕДЕНИЕ
Флавивирусы являются возбудителями ряда тяжелых заболеваний человека, в частности как давно известных инфекций (желтая лихорадка (ЖЛ), лихорадка денге, лихорадка Западного Нила, японский и клещевой энцефалиты (КЭ)), так и вновь возникших (как лихорадка Зика), и способны к быстрому распространению на новых территориях [1]. Ежегодно в мире регистрируется несколько миллионов случаев флавивирусных инфекций и более 150 тысяч случаев ЖЛ, смертность от которой составляет от 20 до 50% [1–3]. Эндемичными по ЖЛ являются 47 стран Африки и Южной Америки [4], существует риск возникновения очагов ЖЛ в Азии [5].
Вирус желтой лихорадки (ВЖЛ) является прототипным вирусом рода Flavivirus. Вирион флавивирусов имеет диаметр около 50 нм, ядро вириона состоит из одноцепочечной молекулы (+) РНК и белка С [1]. Ядро покрыто липидной мембраной, в которую встроены мембранный белок М и поверхностный белок Е, образующий наружную поверхность вириона. Белок Е обеспечивает стабильность вирусной частицы и определяет первые этапы инфекции – связывание вируса с клеточными рецепторами, проникновение в клетку, раздевание вирусной РНК.
Специфических противовирусных препаратов для лечения ЖЛ не существует, вакцинация является единственным эффективным способом предотвращения и контроля заболеваемости [1, 6]. Для вакцинации против ЖЛ применяют живую аттенуированную вакцину ЖЛ на основе штаммов ВЖЛ 17D-214 или 17DD [7]. Однако при использовании живых вакцин ЖЛ возможно развитие серьезных нежелательных явлений, вплоть до смерти вакцинированных [8–10]. Кроме того, живая аттенуированная вакцина не рекомендована для применения у младенцев в возрасте до 9 мес лиц старше 65 лет, иммунокомпрометированных лиц и кормящих женщин [6]. Для вакцинации данных категорий реципиентов разрабатываются другие типы вакцин, в том числе цельновирионные инактивированные вакцины [11], активным компонентом которых являются очищенные вирионы ВЖЛ. При получении данного типа вакцин ЖЛ необходимо обеспечить сохранение структуры основных антигенных эпитопов белка Е, являющегося основным иммуногеном флавивирусов, обеспечивающим защиту от заболевания.
Флавивирусы обладают природной гетерогенностью, связанной с циклами созревания: в получаемых образцах всегда присутствуют зрелые, незрелые, полузрелые и так называемые “сломанные”, т.е. деформированные частицы [12]. Это делает затруднительным получение структур вирионов флавивирусов методом рентгеновской кристаллографии, так как гетерогенность препятствует получению упорядоченных кристаллов. Данный метод был успешно применен лишь при определении структуры индивидуальных белков флавивирусов [13–15]. При этом большинство исследований было посвящено получению структур эктодомена белка Е или его отдельных доменов, в том числе в комплексе с моноклональными антителами [13, 16].
Оптимальным методом получения структуры вирионов флавивирусов является криоэлектронная микроскопия (криоЭМ), переживающая настоящую революцию и позволяющая получать структуры вирусов с высоким разрешением [17]. На ранней стадии развития метода структуры флавивирусов изучались с разрешением 10–20 Å [18], однако в последние годы стало возможным определение структур с разрешением лучше 3.5 Å [17]. С применением криоЭМ были собраны структурные данные для вирионов вируса денге, вируса Зика, вируса КЭ, вируса Западного Нила и др., получены структуры как зрелых, так и незрелых вирионов, а также комплексов флавивирусов с нейтрализующими антителами [19]. С наивысшим разрешением получена структура зрелых вирионов вируса Зика (3.1 Å, код pdb 6СO8) [20]. Для ВЖЛ известна только криоЭМ-структура незрелой формы с низким разрешением, 25 Å [18]), в то время как наибольший интерес представляет структура зрелых вирусных частиц ВЖЛ с высоким разрешением.
Несмотря на значительное сходство между известными структурами вирионов разных флавивирусов и структурами их оболочечного белка Е, существуют значительные различия в детерминируемых белком Е протективных и нейтрализующих свойствах для этих флавивирусов [21]. Соответственно изучение детальной структуры вирионов флавивирусов и индивидуальных вирусных белков является важным для разработки новых высокоспецифичных средств профилактики и лечения флавивирусных заболеваний.
Получение структуры полноразмерного вириона ВЖЛ высокого разрешения является актуальной задачей. Такая структура может служить не только основой для разработки антивирусных препаратов, но и ключом к пониманию механизмов нейтрализации и инактивации вируса.
Структурные исследования вирусов методом криоЭМ предъявляют особые требования к качеству образцов: гомогенность и относительно высокая концентрация при отсутствии агрегатов.
Целью данной работы являлись разработка методики получения образцов инактивированного ВЖЛ с высоким содержанием зрелых вирионов и предварительные структурные исследования методом криоЭМ.
МАТЕРИАЛЫ И МЕТОДЫ
Вирус. В работе использовали штамм 17D ВЖЛ, применяемый для получения российской коммерческой живой аттенуированной вакцины ЖЛ.
Клетки. Репродукцию ВЖЛ проводили в перевиваемой культуре клеток Vero. Рабочий посевной банк клеток был приготовлен на уровне 132 пассажа из ампулы № 0519, полученной из VeroWHO банка клеток (ВОЗ).
Титрование ВЖЛ. Титр вируса определяли методом бляшкообразования и выражали в БОЕ/мл. Готовили трехкратные последовательные разведения анализируемых проб в среде DMEM с 2% фетальной сыворотки (Gibco, США). Пробу анализируемого образца добавляли к монослою клеток Vero, выращенному на планшетах (Corning, ФРГ), инкубировали один час для адсорбции вируса и вносили в лунки агаровое покрытие (1% басто-агара (Difco, США), раствор Эрла, 2% эмбриональной сыворотки коров, 0.015% красителя нейтрального красного). После семи–восьми суток инкубации (37°C/5% CO2) клетки фиксировали 5%-ной трихлоруксусной кислотой и после удаления агарового покрытия окрашивали 4%-ным спиртовым раствором красителя генцианового фиолетового. Подсчитывали количество бляшек в ячейке планшета и рассчитывали титр ВЖЛ по методу Рида–Менча [22].
Накопление вируса. Клетки Vero выращивали в среде DMEM с 10%-ной эмбриональной сывороткой (Gibco, США) в роллерных флаконах TufRol Roller Bottle (Thermo Fisher Scientific, США) в роллерной установке Cell-Production Roller Apparatus (BELLCO Biotechnology, США) при 37°C в течение 48–72 ч. Культуру на уровне не более 150 пассажа заражали ВЖЛ. Множественность заражения составляла 0.03–0.3 БОЕ/кл. Вируссодержащую культуральную жидкость (КЖ) собирали через 48–96 ч.
Инактивация ВЖЛ. Вируссодержащую КЖ инактивировали β-пропиолактоном в конечном разведении 1 : 1000 при 4°C в течение 24 ч или формалином в конечном разведении 1 : 2000 при 25°C в течение 72 ч.
Определение остаточной инфекционности. Остаточную инфекционность инактивированного ВЖЛ определяли двумя методами: бляшкообразованием в культуре клеток Vero (титрование ВЖЛ) и пассажем в культуре клеток Vero (отсутствие цитопатического эффекта). Для нейтрализации воздействия формалина на культуру клеток к пробе инактивированного ВЖЛ добавляли 0.1%-ный раствор метабисульфита натрия. Для выявления цитопатического эффекта при пассировании пробу инактивированного ВЖЛ добавляли к монослою клеток Vero и инкубировали в течение семи суток (37°C/5% CO2). Монослой клеток просматривали под микроскопом, затем фиксировали клетки 70%-ным этанолом и окрашивали красителем генциановым фиолетовым.
Очистка ВЖЛ. Вируссодержащую КЖ осветляли центрифугированием при 12 000 об./мин, 30 минут, 4°С (Beckman J2-21, USA). В ряде экспериментов перед осветлением к КЖ добавляли протамина сульфат до конечной концентрации 50 мг/мл и инкубировали 60 мин, 4°С. После осветления собирали супернатант и центрифугировали при 25 000 об./мин, 4 ч, 4°С (Beckman-Coulter L90K, США). Полученный осадок ресуспендировали в буфере TNE (0.1 М Tris-Cl, 0.13 M NaCl, 1 мM EDTA, pH 7.8). Затем проводили центрифугирование в ступенчатом градиенте плотности сахарозы 10–60% при 35 000 об./мин, 3 ч, 4°С (Beckman-Coulter L90K, США). Собирали целевую фракцию и проводили переосаждение вирусных частиц в буфере TNE/5 (20 мМ Tris-Cl, 25 мМ NaCl, 1 мМ EDTA, рН 7.8) центрифугированием при 35 000 об./мин, 3 ч, 4°С (Beckman-Coulter L90K, США). Полученный осадок растворяли в буфере TNE. Образцы хранили при 4°С не более семи дней или при –70°С. Анализ проб проводили непосредственно после получения или после хранения.
Иммуноферментный анализ (ИФА). При получении образцов для детекции антигена ВЖЛ использовали ИФА [23]. Кратко, планшеты (Costar, ФРГ) сенсибилизировали аффинно-очищенным препаратом иммуноглобулинов Y (IgY) против ВЖЛ (17D) из яичных желтков куриц породы Леггорн. Свободные сайты связывания блокировали 1%-ной сывороткой теленка (Gibco, США) в фосфатно-солевом буферном растворе в течение одного часа при 37°С. Вирус ЖЛ вносили в ячейки планшета и инкубировали 2 ч при 37°С (или 18 ч при 4°С). Затем вносили детекторные антитела – коммерческую референс-сыворотку зеленой мартышки против ВЖЛ (YF, NIBSC, Великобритания), инкубировали 1 ч при 37°С, добавляли коммерческий пероксидазный конъюгат против IgG человека (Sigma, США) и инкубировали 1 ч при 37°С. Далее в ячейки вносили субстрат тетраметилбензидин (Sigma, США), инкубировали 30 мин в темноте при комнатной температуре и останавливали реакцию 2 М раствором серной кислоты. Оптическую плотность измеряли при 450 нм (Thermo Scientific Multiskan FC ELISA reader, Thermo Fisher Scientific, США). Статистическую обработку результатов проводили с использованием программного обеспечения Microsoft Excel.
Определение концентрации вирионов ВЖЛ с использованием спектрофотометрии. Определение концентрации РНК и общего белка проводили на приборе Nanodrop (Thermo Fisher Scientific, США) при 260 и 280 нм соответственно в пробах объема 2.5 мкл, используя встроенные программы прибора. Концентрацию вирусных частиц рассчитывали по измеренной концентрации РНК, исходя из строения флавивирусов, и по концентрации белка Е [24].
Электрофорез и Вестерн-блоттинг. Электрофорез белков проводили в денатурирующих условиях в 10%-ном SDS-ПААГ (Mini-Protein Tetra System, BIO-RAD, США). Для окраски белков в геле использовали краситель кумасси брильянтовый синий R-250. Молекулярную массу (ММ) белков оценивали, используя маркеры ММ 10–200 кДа (Thermo Fisher Scientific, США). Гель сканировали и проводили денситометрию полос (ImageJ). При проведении вестерн-блоттинга после электрофореза в 10%-ном SDS-ПААГ белки переносили на нитроцеллюлозную мембрану (Hybond ECL, Amersham, США), используя модуль Mini Trans-Blot cell (BIO-RAD, США). Мембрану инкубировали с детекторными антителами (коммерческая референс-сыворотка зеленой мартышки против ВЖЛ (YF, NIBSC, Великобритания)), 1 ч, 37°С, промывали и добавляли коммерческий пероксидазный конъюгат против IgG человека (Sigma, США). Инкубировали 1 ч при 37°С, промывали и детектировали образовавшиеся иммунные комплексы, используя хемилюминесцентный реагент ECL (Amersham, USA) и рентгеновскую пленку (FujiFilm, (Япония).
Просвечивающая электронная микроскопия (ПЭМ) (негативное контрастирование). Поддерживающие медные сетки для электронной микроскопии, покрытые пленкой аморфного углерода (01843-F, Ted Pella), были обработаны в тлеющем разряде с помощью установки PELCOeasiGlow™ (Ted Pella). Образец наносили на сетки, проводили контрастирование 1%-ным раствором ацетата уранила и выдерживали сетки не менее 15 мин до полного высыхания. Просмотр приготовленных образцов и получение изображений проводили на микроскопе Titan S\TEM (Thermo-Fisher, США) при помощи CCD-детектора UltraScan 1000XP (Gatan) при ускоряющем напряжении 300 кВ (увеличение от 8.000× до 20.000×).
Криогенная просвечивающая электронная микроскопия. Поддерживающие сетки для электронной микроскопии с периодическими отверстиями в аморфной пленке углерода (Quantifoil R1.2/1.3) были обработаны в тлеющем разряде с помощью установки PELCOeasiGlow™ (Ted Pella) при стандартных условиях. После нанесения образцов на сетки проводили витрификацию образцов в жидком этане в камере установки Vitrobot Mark IV (Thermo Fisher Scientific, США). Операции запрессовки подготовленных сеток в картриджи, перемещения картриджей в кассеты и переноса кассеты в криогенный просвечивающий микроскоп были выполнены при криогенной температуре во избежание кристаллизации аморфного льда на сетках. Исследование проводили на криогенном электронном микроскопе Titan Krios 60–300 (Thermo Fisher Scientific, США), оборудованном высокоэффективным детектором электронов Falcon II, с использованием программного обеспечения EPU (FEI) в режиме малой дозы при ускоряющем напряжении 300 кВ и потоке электронов не более 60 э/(Å2 с). Было получено 600 стеков изображений, после чего при помощи программного пакета Warp [25] проводили коррекцию дрейфа, оценку параметров функции передачи контраста, а также выбор проекций отдельных частиц на изображениях. 2D-классификацию выполняли в программе RELION [26].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для проведения структурных исследований вирусных частиц методом криоЭМ необходимо иметь высокоочищенные препараты с концентрацией частиц не менее 1010–1011 частиц/мл. Подготовка инактивированных образцов ВЖЛ (иВЖЛ) в такой высокой концентрации является сложной задачей.
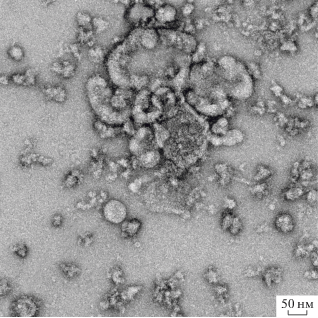
Для получения образцов флавивирусов для биологических исследований, включая иВЖЛ, стандартным подходом является использование методов концентрирования, центрифугирования и хроматографии [6, 27–29]. На начальном этапе работы полученный и очищенный образец иВЖЛ, (множественность заражения 0.1 БОЕ/кл; сбор вируссодержащей КЖ через 96 ч после заражения; инактивация β-пропиолактоном; осветляющее центрифугирование при 12 000 об./мин, 30 мин; центрифугирование полученного супернатанта при 25 000 об./мин, 4 ч) был проанализирован с использованием ПЭМ (методика негативного контрастирования). Анализ продемонстрировал необходимость оптимизации данной методики, поскольку на микрографах идентифицировались только отдельные сферические частицы, соответствующие по размеру целевым вирионам, и большое количество посторонних примесей (рис. 1).
Рис. 1.
Негативное контрастирование ПЭМ образца иВЖЛ, полученного по неоптимизированной методике выделения и очистки.
Для получения образца, соответствующего указанным выше требованиям для проведения криоЭМ, варьировали условия репродукции, инактивации, концентрации и очистки ВЖЛ. Было показано, что для репродукции данного штамма ВЖЛ в клетках Vero оптимальными условиями являлись множественность заражения 0.3 БОЕ/кл и сбор вируссодержащей КЖ через 72 ч после заражения. При этих условиях титр вируса в КЖ составлял 7.2 + 0.3 lg БОЕ/мл. Наиболее качественный образец был получен по следующей методике: инактивация ВЖЛ формалином до осветления; обработка протамина сульфатом и центрифугирование при 12 000 об./мин, 30 мин; центрифугирование полученного супернатанта при 25 000 об./мин, 4 ч; ресуспендирование осадка и центрифугирование в ступенчатом градиенте плотности сахарозы 20/60% при 35 000 об./мин, 3 ч; переосаждение вирусных частиц целевой фракции при 35 000 об./мин, 3 ч. При получении образца иВЖЛ по данной методике фактор концентрации составлял не менее 2000.
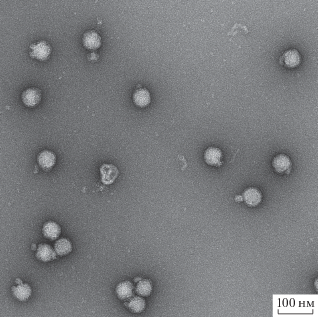
Для оценки чистоты полученного образца использовали электрофорез в 10%-ном SDS-ПААГ (рис. 2). В исходной вируссодержащей КЖ основным определяемым белком был белок с ММ 67 кДа, по-видимому, сывороточный альбумин (дорожка 1). В целевой фракции, полученной при центрифугировании в градиенте плотности сахарозы, детектируется в основном белок с ММ 56 кДа, соответствующий по ММ белку Е ВЖЛ, другие белки практически не детектируются (дорожка 3). Результаты ПЭМ (методика негативного контрастирования) продемонстрировали, что данный образец содержит высокую концентрацию сферических частиц диаметром 50 нм, соответствующих по морфологии зрелым вирионам ВЖЛ (рис. 3). Вместе с тем наблюдалась незначительная гетерогенность вирусной популяции, вероятно, связанная с особенностями репродукции ВЖЛ при культивировании, такими как используемый клеточный субстрат, множественность заражения, длительность культивирования и др. Образец практически не содержал посторонних примесей.
Рис. 2.
Исходный препарат и фракции градиента плотности сахарозы после ультрацентрифугирования. Электрофорез в 10%-ном SDS-ПААГ. Дорожка 1 – инактивированный вирус ЖЛ после центрифугирования 25 000 об./мин; дорожки 2–4 – фракции градиента плотности сахарозы, центрифугирование 35 000 об./мин, 3 – целевая фракция; дорожки 5–8 – бычий сывороточный альбумин: 0.25, 0.5, 1 мкг, 2 мк. М – маркеры молекулярной массы.
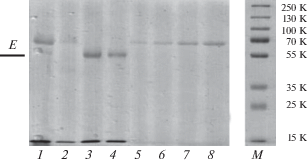
Рис. 3.
Негативное контрастирование ПЭМ образца иВЖЛ, полученного по оптимизированной методике выделения и очистки (разбавление в 4 раза).
Для оценки концентрации вирусных частиц в инактивированном целевом образце ВЖЛ проводили расчеты по спектрометрической концентрации общей РНК, по спектрометрической концентрации общего белка и по концентрации белка Е, определяемой методом электрофореза в ПААГ (табл. 1). Концентрация РНК в целевом образце, рассчитанная на основе спектрофотометрических данных, составила 30 мкг/мл, концентрация общего белка – 550 мкг/мл. Исходя из размера РНК вируса ЖЛ 10.5 кВ, ММ и стехиометрии структурных белков вириона флавивирусов, рассчитанная концентрация вирусных частиц в целевом образце составила 5 × 1012 частиц/мл при расчете по концентрации общей РНК и 1.9 × 1013 частиц/мл при расчете по концентрации общего белка. Для оценки содержания белка Е в образце методом электрофореза в 10%-ном SDS-ПААГ использовали бычий сывороточный альбумин как стандартный белок. Расчетная концентрация белка Е в целевом образце составила 36 мкг/мл, что соответствует 2.3 × 1012 частиц/мл. Таким образом, несколькими методами подтверждена высокая концентрация иВЖЛ в образце. Различия в оценке концентрации вирусных частиц, в частности, могут быть объяснены тем, что при спектрофотометрическом методе оценки плотная упаковка белка на поверхности частицы влияет на оптическую плотность, что наблюдалось и для других вирусов [30], а при электрофоретическом методе оценки измеряется концентрация денатурированного белка. Целесообразным представляется ориентироваться на минимальное значение концентрации из всех, которые были определены.
Таблица 1.
Оценка концентрации вирусных частиц в образце иВЖЛ*
| Препарат | Расчет по концентрации белка Е280 | Расчет по концентрации РНК260 | Расчет по концентрации белка Е (электрофорез) |
|---|---|---|---|
| спектрофотометрия | |||
| иВЖЛ* | 1.9 × 1013** | 5 × 1012 | 2.3 × 1012 |
Сохранение антигенных свойств инактивированных вирионов ВЖЛ, т.е. сохранение структуры основных антигенных эпитопов белка Е, подтверждали методом ИФА и методом вестерн-блоттинга. Референсная сыворотка к вирусу ЖЛ взаимодействовала с вирусными частицами целевого образца в ИФА, белок Е также был детектирован в целевом образце после электрофореза в денатурирующих условиях (рис. 4). Это указывает на сохранение структуры основных антигенных эпитопов белка Е в процессе получения образца, что является существенным для проведения дальнейших структурных исследований.
Рис. 4.
Вестерн-блот. Электрофорез в 10%-ном SDS-ПААГ. Дорожка 1 – инактивированный вирус ЖЛ после центрифугирования 25 000 об./мин; дорожки 2–5 – фракции градиента плотности сахарозы, центрифугирование 35 000 об./мин, 3 – целевая фракция.

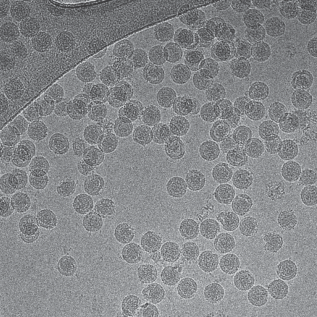
Так как качество целевого образца соответствовало требованиям, предъявляемым к образцам для получения структуры методом криоЭМ, был собран набор данных на криогенном электронном микроскопе. На криоЭМ-изображениях визуализируются сферические частицы, в основном соответствующие зрелым вирионам ВЖЛ (рис. 5). Микрофотографии демонстрируют небольшие области скопления частиц, которые могут свидетельствовать об агрегации, либо наложении частиц, находящихся в разных слоях льда. Качество изображений позволило провести 2D-классификацию частиц (рис. 6), которая показывает, что в образце присутствуют зрелые вирионы, деформированные, полузрелые частицы в различных вариантах и незрелые частицы. Набор данных криоЭМ находится в процессе дальнейшей обработки.
ЗАКЛЮЧЕНИЕ
Проведено предварительное исследование инактивированного вируса желтой лихорадки методом криоЭМ. Для получения очищенных препаратов ВЖЛ может быть использован широкий набор методов. Например, существуют методики получения очищенного препарата ВЖЛ путем выращивания вируса в клетках Vero с последующей ультрафильтрацией или ионно-обменной хроматографией [6, 11]. Методика негативного контрастирования ПЭМ показала необходимость поиска нового подхода для достижения большей гомогенности и более высокой концентрации препарата. В данной работе для получения образца был применен модифицированный протокол, основанный на центрифугировании. При исследовании чистоты целевого образца продемонстрировано, что в очищенных препаратах инактивированного ВЖЛ выявляется только один белок – белок Е оболочки вириона, т.е. полученные препараты являются биохимически чистыми. После инактивации сохраняется структура антигенных эпитопов белка Е, что подтверждается в экспериментах по изучению протективных свойств инактивированных препаратов ВЖЛ [6, 27]. Разработанная методика позволила впервые получить высококонцентрированный монодисперсный образец инактивированного ВЖЛ с высоким содержанием зрелых вирионов и собрать набор данных криоЭМ.
Авторы выражают благодарность К.К. Тучинской за консультации и ценные советы.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (грант № 18-02-40026).
Список литературы
Barrows N.J., Campos R.K., Liao K. et al. // Chem. Rev. 2018. V. 118. P. 4448.
Monath T.P. // Antiviral Res. 2008. V. 78. P.116.
Pugachev K.V., Guirakhoo F., Trent D.W., Monath T.P. // Int. J. Parasitol. 2003. V. 33. P. 567.
CDC. Yellow fever maps; 2018 [accessed on April 17, 2019]. https://www.cdc.gov/yellowfever/maps/index.html.
Paules C., Fauci A.S. // New Engl. J. Med. 2017. V. 376. P. 1397.
Monath T.P., Lee C.K., Julander J.G. et al. // Vaccine. 2010. V. 14. P. 3827.
Barrett A.D., Teuwen D.E. // Curr. Opin. Immunol. 2009. V. 21. P. 308.
Martin M., Tsai T.F., Cropp C.B. et al. // Lancet. 2001. V. 358. P. 98.
Vasconcelos P.F., Luna E.J., Galler R. et al. // Lancet. 2001. V. 358. P. 91.
Chan R.C., Penney D.J., Little D. et al. // Lancet. 2001. V. 358. P. 121.
Pato T.P., Souza M.C.O., Mattos D.A. et al. // Vaccine. 2019. V. 37. P. 3214.
Ruzek D., Avšič Ž.T., Borde J. et al. // Antiviral Res. 2019. V. 164. P. 23.
Zhang X., Jia R., Shen H. et al. // Viruses. 2017. V. 9. P. 338.
Brecher M., Chen H., Liu B. et al. // PloS One. 2015. V. 10. e0130062.
Bollati M., Alvarez K., Assenberg R. et al. // Antiviral Res. 2010. V. 87. P. 125.
Ray F.A., Stiasny K., Vaney M.Ch. et al. // EMBO Reports. 2018. V. 19. P. 206.
Egelman E.H. // Biophys. J. 2016. V. 110. P. 1008.
Zhang Y., Corver J., Chipman P.R. et al. // EMBO J. 2003. V. 22. P. 2604.
Stass R., Ng W.M., Kim Y.Ch. et al. // Adv. Virus Res. 2019. V. 105. P. 35.
Sevvana M., Long F., Miller A.S. et al. // Structure. 2018. V. 26. P. 1169.
Chambers T.J., Diamond M.S. // Adv. Virus Res. 2003. V. 60. P. 273.
Reed L.J., Muench H. //Am. J. Epidemiol. 1938. V. 27. P. 493.
Иванов А.П., Клеблеева Т.Д., Иванова О.Е. // Вопросы вирусологии. 2020. Т. 65. С. 21.
Trauchessec M., Lambert O., Bonnafous P. et al. // Vaccine. 2019. V. 37. P. 3580.
Tegunov D., Cramer P. // Nat. Methods. 2019. V. 16. P. 1146.
Zivanov J., Nakane T., Forsberg B. et al. // eLife., 2018. V.7. P. e42166.
Pereira R.C., Silva A.N.M.R., Souza M.C. et al. // Vaccine. 2015. V. 33. P. 4261.
Coelho Sh.V.A., Neris S.R.L., Papa M.P. et al. // J. Virological Methods. 2017. V. 246. P. 65.
Toriniwa H., Komiya T. // Biologicals. 2007. V. 35. P. 221.
Mittereder N., March K.L., Trapnell B.C. // J. Virology. 1996. V. 70. P. 7498.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография