Кристаллография, 2021, T. 66, № 1, стр. 97-103
KTm[B4O6(OH)4] ⋅ 3H2O – новый представитель семейства боратов со слюдоподобными тетраэдрическими слоями
А. П. Топникова 1, Е. Л. Белоконева 1, О. В. Димитрова 1, А. С. Волков 1, Д. В. Дейнеко 1, Л. В. Зорина 2, *
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Институт физики твердого тела РАН
Черноголовка, Россия
* E-mail: nastya_zorina@rambler.ru
Поступила в редакцию 10.08.2020
После доработки 01.09.2020
Принята к публикации 01.09.2020
Аннотация
Кристаллы нового бората KTm[B4O6(OH)4] ⋅ 3H2O (пр. гр. Р$\bar {3}$1m, a = 4.5472(7), c = 12.151(3) Å) получены в гидротермальных условиях при T = 280°С и Р = 100 атм. В структуре выделяются пакеты из двух полярных слюдоподобных тетраэдрических слоев [B4O6(OH)4]∞∞, соединенных TmO6-октаэдрами. Атомы K и молекулы воды статистически заполняют межпакетное пространство. Аналогичный слой есть в структурах пепроссиита, его синтетических аналогов NdAl2.07[B4O10]O0.6 и KTa[B4O6(OH)4](OH)2 ⋅ 1.33H2O (пр. гр. P$\bar {6}$2m), в которых координация тяжелого атома тригонально-призматическая. Проведено сопоставление с двумя другими структурами семейства – KGd[B6O10(OH)2] и KHo[B6O10(OH)2]. В новом члене семейства реализована комбинация из простых слюдяных слоев и октаэдров в одном пакете, неизвестная ранее. Для всех рассмотренных представителей характерны беспорядок и статистическая заселенность позиций, особенно в межпакетном пространстве. Кристаллы KTm[B4O6(OH)4] ⋅ 3H2O демонстрируют интенсивную эмиссию в синей области видимого света за счет излучательных переходов 4f–4f катиона Tm3+. В спектрах излучения фотолюминесценции наиболее интенсивным является переход 1D2–3F4 при 450 нм.
ВВЕДЕНИЕ
Для боратов характерно большое разнообразие анионных радикалов в связи со способностью бора присутствовать в двоякой координации (треугольной и тетраэдрической), что вызывает интерес к данному классу соединений сточки зрения кристаллохимии и поиска новых фаз. Кристаллы боратов являются интересными объектами для материаловедения, поскольку обладают большим спектром химических и физических свойств, таких как лазерные, магнитные, люминесцентные, нелинейно-оптические, ионопроводящие. Наличие редкоземельных ионов в структурах боратов позволяет надеяться на получение кристаллов с люминесцентными свойствами.
Согласно базам данных [1, 2] среди класса боратов с Tm известны следующие соединения в соответствии с систематикой [3]: TmBO3 [4], TmBa3(BO3)3 [5] и Ca4TmB3O10 [6] с изолированными BO3-треугольниками [∆], TmHB2O5 с диборатными цепочками [T+∆] [7], высокобарический TmB3O6 с гофрированными слоями из тетраэдров, соединенных в гексаборатные блоки 6[6T] [8], высокобарический Tm3B5O12 с тетраэдрическими слоями [9], аналогичными силикатным в структуре синтетического H2NaNd[Si6O15] ⋅ ⋅ nH2O [10].
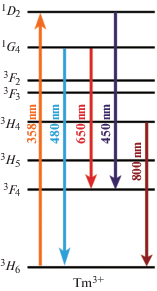
Боратные кристаллические структуры активно используются как матрицы для введения люминесцирующих катионов благодаря высокой стабильности излучения [11, 12]. В ряду редкоземельных элементов (РЗЭ) эмиссия наблюдается за счет внутри конфигурационных 4f–4f и межконфигурационных 5d1–4f переходов и находит широкое применение в системах LED (Light-Emitting Diode) [13]. Катионы Tm3+ демонстрируют излучение в синей области видимого спектра за счет трехфотонного 1G4 → 3H6 (∼480 нм) [14, 15] и четырехфотонного 1D2 → 3F4 (∼450 нм) переходов. Схематическое представление процессов возбуждения и релаксации катионов Tm3+, возникающих при воздействии излучения с длиной волны 358 нм, представлена на рис. 1 [16]. В спектрах излучения также присутствуют переходы 1G4 → 3F4 (∼650 нм) и 3H4 → 3H6 (∼750 нм) [17]. Так как 4f-электроны сильно экранированы 5s- и 5р-электронными оболочками [18], переходы 4f–4f являются узкими полосами в спектрах поглощения и излучения [19]. В зависимости от кристаллического окружения положение полос люминесценции может незначительно изменяться. Кроме того, в зависимости от температуры и давления может наблюдаться перераспределение интенсивностей переходов Tm3+, что используется в методах оптической термометрии [20, 21].
В настоящей работе приведены результаты гидротермального синтеза, исследования кристаллической структуры нового бората KTm[B4O6(OH)4] ⋅ ⋅ 3H2O, ее сравнительного кристаллохимического анализа с родственными структурами, а также исследования люминесцентных свойств кристаллов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез и свойства кристаллов. Кристаллы нового бората KTm[B4O6(OH)4] ⋅ 3H2O получены в гидротермальных условиях при температуре 280°С и давлении ∼100 атм. в стандартных автоклавах объемом 5–6 см3 с тефлоновым вкладышем. Нижний предел температуры был ограничен кинетикой гидротермальных реакций, верхний – возможностями аппаратуры. Коэффициент заполнения автоклава выбран таким образом, чтобы давление оставалось постоянным. Массовое соотношение исходных компонентов Tm2O3 и B2O3, взятых в количестве 1.0 г (0.003 моль) и 1.0 г (0.014 моль) соответственно, составляло 1 : 1. Ионы K+, Cl– и CO$_{3}^{{2 - }}$ были добавлены в раствор в качестве минерализаторов. Отношение твердой и жидкой фаз было 1 : 5. Время взаимодействия составляло 14 сут, что было необходимо для полного завершения реакции, после кристаллы промывали водой. Значение рН, измеренное после реакции, равно 10.
В общей тонкозернистой массе опыта обнаружены прозрачные и полупрозрачные тонкие слюдоподобные кристаллы с перламутровым блеском и их сростки. Выход кристаллов составлял около 10%. Оценочный тест на генерацию второй гармоники (ГВГ), выполненный с помощью импульсного ИАГ : Nd-лазера по схеме “на отражение” [22] для общей массы кристаллов, показал нулевой сигнал относительно кварцевого эталона, что свидетельствовало о центросимметричности кристаллов новой фазы.
Состав кристаллов определен с помощью рентгеноспектрального анализа в лаборатории локальных методов исследования вещества МГУ на микрозондовом комплексе на базе растрового электронного микроскопа Jeol JSM-6480LV и показал присутствие атомов Tm, K и О.
Рентгеноструктурное исследование. Параметры новой фазы определены на дифрактометре Oxford Diffraction Gemini R c CCD-детектором на прозрачном монокристалле в виде маленькой тонкой пластинки размером 0.125 × 0.1 × 0.025 мм. Определялась гексагональная ячейка, для которой не было аналогов в базе данных неорганических соединений ICSD [1]. Параметры элементарных ячеек были близки параметрам решетки структур KTa[B4O6(OH)4](OH)2 ⋅ 1.33H2O [23], KGd[B6O10 (OH)2] и KHo[B6O10(OH)2] [24], что позволило предположить принадлежность новой структуры к данному семейству слоистых боратов. Трехмерный экспериментальный набор интенсивностей получен в полной сфере обратного пространства на дифрактометре Oxford Diffraction Gemini R c CCD-детектором. Обработка данных выполнена по программе CrysAlis [25]. Структура была решена прямыми методами с помощью программы SHELXS [26] комплекса WinGX [27]. В качестве вероятной для расшифровки предложена пр. гр. Р$\bar {6}$2m, однако в силу центросимметричности структуры, выявленной в результате теста на ГВГ, для расшифровки была выбрана пр. гр. Р$\bar {3}$1m. Первыми были найдены позиции Tm, B, K, О1 и О2. Атом K статистически заселял свою позицию с вероятностью 0.5. Из разностного синтеза выявлены позиции атомов O3, О4 молекул воды. Их заселенности (0.28 и 0.22 соответственно) найдены путем пошагового изменения (шаг 0.02, приблизительно равный величине погрешности). При расчете остаточной электронной плотности обнаружены высокие пики вблизи позиции атома Tm, отстоящие от основной позиции на расстояниях ∼0.198–1.428 Å вдоль оси с, что говорило о разупорядочении атомов Tm вдоль данного направления. Добавление дополнительных слабозаселенных позиций Tm1–Tm4 (табл. 2) и пошаговое варьирование заселенностей с уточнением тепловых параметров позволили существенно понизить фактор расходимости до R = 0.0795. Расчет баланса валентных усилий по Полингу для полученной модели с учетом кратностей позиций атомов показал, что атом О1 является атомом кислорода О2–, а атом О2 – гидроксильной группой (ОН)–. Выявить позиции атомов Н было затруднительно из-за высокого разупорядочения структуры. Полученная структурная модель уточнена с использованием метода наименьших квадратов и программы SHELXL [28] комплекса WinGX [27] в анизотропном приближении смещений атомов Tm, B, K, O1 и O2 с уточнением весовой схемы. Заключительная кристаллохимическая формула исследованного бората – KTm[B4O6(OH)4] ⋅ ⋅ 3H2O, Z = 1.
Таблица 1.
Кристаллографические характеристики, данные эксперимента и результаты уточнения структуры KTm[B4O6(OH)4] ⋅ 3H2O
| Химическая формула | KTm[B4O6(OH)4] ⋅ 3H2O |
|---|---|
| М | 469.35 |
| Сингония, пр. гр., Z | Тригональная, Р$\bar {3}$1m,1 |
| а, с, Å | 4.5472(7), 12.151(3) |
| V, Å3 | 217.58(8) |
| Dx, г/см3 | 3.505 |
| Излучение; λ, Å | МоKα; 0.71073 |
| μ, мм–1 | 10.754 |
| Т, K | 293(2) |
| Размер образца, мм | 0.125 × 0.1 × 0.025 |
| Дифрактометр | Oxford Diffraction Gemini R |
| Тип сканирования | Ω |
| θmах, град | 34.596 |
| Пределы h, k, l | –5 ≤ h ≤ 7, –7 ≤ k ≤ 6, –18 ≤ l ≤ 19 |
| Количество рефлексов измеренных/независимых/с I ≥ 1.96σ(I)/Rint | 2142/363/239/0.2417 |
| Метод уточнения | МНК по F2(hkl) |
| Весовая схема | 1/[σ2(Fo)2 + (0.0794P)2], P = [max(Fo)2 + 2(Fc)2]/3 |
| Число параметров | 32 |
| Rall | 0.1225 |
| Rgt, Rwgt | 0.0795, 0.1614 |
| S | 1.009 |
| Δρmin/Δρmax, э/Å3 | –2.329/2.127 |
| Программы | SHELX |
Таблица 2.
Координаты базисных атомов, заселенность позиций (s.o.f.) и эквивалентные изотропные параметры в структуре KTm[B4O6(OH)4] ⋅ 3H2O
| Атом | Позиция Уайкова | s.o.f. | x/a | y/b | z/c | Uэкв, Å2 |
|---|---|---|---|---|---|---|
| Tm | 1a,1m | 0.532 | 0 | 0 | 0 | 0.026(6) |
| Tm1 | 2e, 3m | 0.15 | 0 | 0 | 0.984(4) | 0.011(4)* |
| Tm2 | 2e, 3m | 0.054 | 0 | 0 | 0.926(3) | 0.015(3)* |
| Tm3 | 2e, 3m | 0.018 | 0 | 0 | 0.883(6) | 0.015(10)* |
| Tm4 | 2e, 3m | 0.012 | 0 | 0 | 0.810(7) | 0.029(16)* |
| K | 2e, 3m | 0.5 | 0 | 0 | 0.633(2) | 0.084(6) |
| B | 4h, 3 | 1.0 | 0.6667 | 0.3333 | 0.8401(16) | 0.026(3) |
| O1 | 6k, m | 1.0 | 0.605(2) | 0 | 0.8803(9) | 0.036(2) |
| O2(ОН) | 4h, 3 | 1.0 | 0.6667 | 0.3333 | 0.7171(12) | 0.050(3) |
| O3(Оw) | 6k, m | 0.28 | 0.491(12) | 0 | 0.550(3) | 0.060(12)* |
| О4(Оw) | 6k, m | 0.22 | 0.510(14) | 0 | 0.655(4) | 0.053(13)* |
Кристаллографические данные, характеристики эксперимента и результаты заключительного уточнения структуры приведены в табл. 1, координаты и тепловые параметры атомов – в табл. 2. Информация о структуре находится в базе данных CCDC(ICSD) [1], номер депозита 2022543. Рисунки построены с помощью программы ATOMS [29].
Исследование спектров люминесценции. Спектрально-люминесцентные свойства изучали с помощью спектрофлюориметра Agilent Cary Eclipse. Установка позволяет регистрировать спектры люминесценции и возбуждения люминесценции образцов в диапазоне длин волн от 230–1000 нм. Источником возбуждающего излучения является ксеноновая лампа (75 кВт), управление которой осуществляется с помощью программного обеспечения Agilent Cary Eclipse. Установка оборудована различными щелями шириной от 1 до 10 мм, позволяющими изменять интенсивность пучка, попадающего на регистратор.
Спектр возбуждения фотолюминесценции для KTm[B4O6(OH)4] ⋅ 3H2O представлен на рис. 2а. В спектре присутствуют переходы, относящиеся к переходу 3H6–1D2 и высокоэнергетическим переходам 3H6–3PJ со сравнительно малой интенсивностью. Пониженная симметрия для иона тулия в кристаллической структуре KTm[B4O6(OH)4] ⋅ 3H2O (пр. гр. Р$\bar {3}$1m) приводит к значительному расщеплению люминесцентного перехода 3H6–1D2 (рис. 2a).
Рис. 2.
Фотолюминесценция KTm[B4O6(OH)4] ⋅ 3H2O: а – спектр возбуждения, λem = 450 нм; б – спектр излучения, λex = 350 нм. CTB – Charge Transfer Band (полоса с переносом заряда).
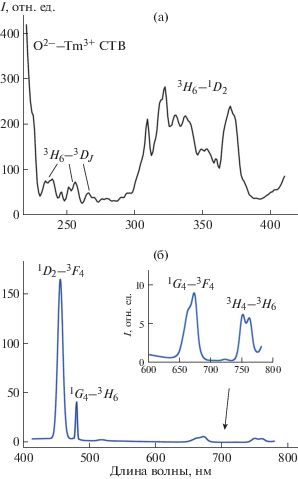
В спектрах фотолюминесценции наблюдается ряд переходов (рис. 2б): на уровень 1D2 за счет возбуждения с последующей излучательной и безызлучательной релаксацией – переходы на уровни 3F4 и 1G4 соответственно. Наблюдается доминирование четырехфотонного перехода 1D2–3F4 (450 нм) по сравнению с 1G4–3H6 (475 нм) (рис. 2б). Распределение интенсивностей спектральных линий нетипично для катиона тулия, так как зачастую самый интенсивный – переход 1G4–3H6 [30], однако ранее оно наблюдалось в фосфатных матрицах [31, 32]. Полоса, отвечающая переходу 1G4–3F4 (645 нм), имеет низкую интенсивность и не вносит существенного вклада в результирующее излучение.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
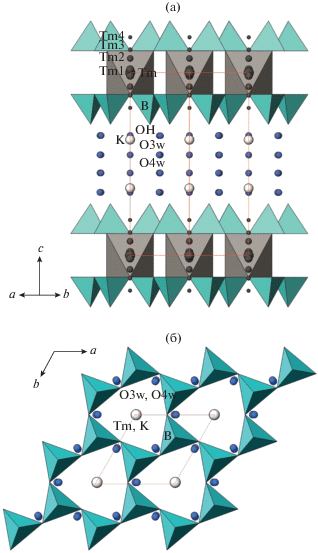
Описание структуры. Структура нового бората KTm[B4O6(OH)4] ⋅ 3H2O состоит из полярных тетраэдрических слюдоподобных слоев [B4O6(OH)4]∞∞, параллельных плоскости ab (рис. 3а, 3б), аналогичных силикатным [T4O10]∞∞. Концевые вершины тетраэдров представлены ОН-группами. BO3(ОН)-тетраэдр характеризуется следующими межатомными расстояниями: B–О1 (×3) 1.480(8), B–O2(OH) 1.50(2) Å, и гидроксильная группа слегка удалена от атома В. Атом Tm в основной позиции окружен шестью атомами кислорода, образующими изолированные TmO6-октаэдры (симметрия $\bar {3}$1m) с расстояниями Tm–О1 (×6) 2.311(10) Å. Два полярных слоя с противоположной ориентацией вершин тетраэдров соединены TmO6-октаэдрами в центросимметричные неполярные пакеты (рис. 3а). Межпакетное пространство статистически заселено атомами K и молекулами воды Н2О3 и Н2О4 (табл. 2). Атомы K координированы 11 атомами кислорода молекул воды, находящихся на расстоянии 2.25–2.52 Å. Кроме беспорядка и статистического заполнения позиций в межпакетном пространстве в структуре наблюдается разупорядочение позиции Tm, которая “размыта” вдоль оси с. По мере удаления от основной позиции Tm в центре октаэдра заселенности дополнительных позиций Tm1–Tm4 уменьшаются (табл. 2, рис. 3а), оставаясь незначительными.
Рис. 3.
Кристаллическая структура KTm[B4O6(OH)4] ⋅ ⋅ 3H2O: а – боковая проекция, показаны TmО6-октаэдры и BO3(OH)-тетраэдры, статистически заселяющие позиции атомы Tm, атомы K и молекулы H2О изображены шарами; б – борокислородный тетраэдрический слой в проекции на плоскость ab.
Аналогичный слой присутствует в структурах KTa[B4O6(OH)4](OH)2 ⋅ 1.33H2O [23] (рис. 4), пепроссиита и его синтетического аналога NdAl2.07[B4O10]O0.6 (табл. 3), где он был обнаружен впервые [33]. В этих структурах слои соединяются в пакеты тригональными призмами(симметрия $\bar {6}$2m), а не октаэдрами. Образование пакетов происходит за счет зеркальной плоскости mz, а не за счет центра инверсии, как в новом представителе, что и приводит к различию в пространственных группах и координационных полиэдрах. В K,Ta-борате межслоевое пространство заполнено атомами K, ОН-группами и молекулами воды, в Nd,Al-борате – атомами Al и O. Данные позиции с вакансиями заселены статистически.
Рис. 4.
Кристаллическая структура KTa[B4O6(OH)4](OH)2 ⋅ ⋅ 1.33H2O в боковой проекции: показаны ТаО6-тригональные призмы и BO3(OH)-тетраэдры, атомы K и молекулы H2О изображены шарами.
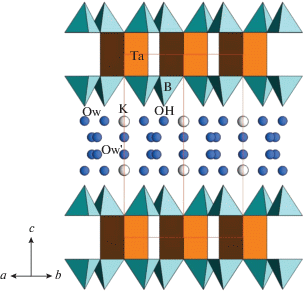
Таблица 3.
Основные кристаллохимические характеристики структур семейства
| Химическая формула, ссылка | а, с, Å | Пр. гр. | КП | Тип слоя и его формула |
|---|---|---|---|---|
| KTm[B4O6(OH)4] ⋅ 3H2O, [настоящая работа] |
4.547, 12.151 | P$\bar {3}$1m | Октаэдр | Тетраэдрический [B4O6(OH)4]∞∞ |
| NdAl2.07[B4O10]O0.6, [18] | 4.588, 9.298 | P$\bar {6}$2m | Тригональная призма | Тетраэдрический [B4O10]∞∞ |
| KTa[B4O6(OH)4](OH)2 ⋅ ⋅ 1.33H2O, [11] | 4.512, 12.057 | P$\bar {6}$2m | Тригональная призма | Тетраэдрический [B4O6(OH)4]∞∞ |
| KHo[B6O10(OH)2], [12] | 4.508, 12.032 | P$\bar {3}$1m | Октаэдр | Тетраэдрический, дополненный треугольниками [B6O10(OH)2]∞∞ |
| KGd[B6O10(OH)2], [12] | 4.524, 12.096 | P$\bar {6}$2m | Тригональная призма | Тетраэдрический, дополненный треугольниками [B6O10(OH)2]∞∞ |
Новое соединение также родственно боратам KHo[B6O10(OH)2] (рис. 5а) и KGd[B6O10(OH)2] (рис. 5б, табл. 3) [24]. Отличие этих структур от нового K,Tm-бората заключается в том, что к полярным тетраэдрическим слоям присоединяются дополнительные BO2(OH)-треугольники, и образуется полиборатный слой [B6O10(OH)2]$_{{\infty \infty }}^{{4 - }}$ (рис. 5а, 5в). Структура KHo[B6O10(OH)2] имеет ту же симметрию и аналогичный координационный полиэдр атома РЗЭ – НоО6-октаэдр (рис. 5а). В структуре KGd[B6O10(OH)2] (рис. 5б) реализуется ацентричный вариант с тригональной призмой, как в K,Tа-борате, синтетическом Al,Nd-борате и пепроссиите (табл. 3). Октаэдрическая координация связана с меньшим ионным радиусом Tm и Ho конца ряда РЗЭ по сравнению с радиусом Gd середины ряда или крупным Та. Пространство между пакетами также заселено статистически крупными атомами K, атомами B2 и ОН-группами (рис. 5а, 5б), в позициях есть вакансии. Были обнаружены нелинейно-оптические свойства кристаллов K,Gd-бората (сигнал ГВГ в 45 раз превышает сигнал в кварцевом образце) [24].
Рис. 5.
Кристаллические структуры KHo[B6O10(OH)2] (а) и KGd[B6O10(OH)2] (б) в боковых проекциях (показаны HoO6-октаэдры и GdО6-тригональные призмы соответственно, ВО4-тетраэдры и BO2(OH)-треугольники, атомы K изображены шарами); борокислородный тетраэдрический слой структур в проекции на плоскость ab (в).
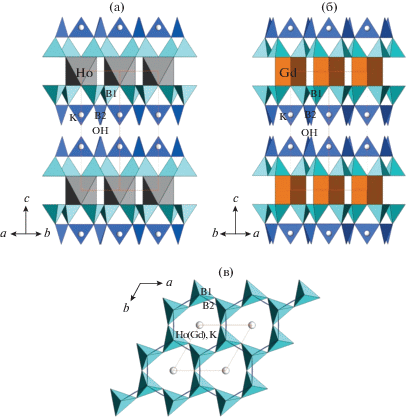
Таким образом, для кристаллов всех рассмотренных боратов характерны совершенная спайность и низкое качество, в структурах наблюдаются беспорядок и статистическое заселение позиций атомов в межпакетном пространстве. Пакет из октаэдров (призм) и двух слоев из В-тетраэдров является самой стабильной частью всех структур. Для нового K,Tm-бората помимо беспорядка в межпакетном пространстве характерно разупорядочение атомов Tm вдоль оси с структуры. Данный структурный вариант новый для семейства, поскольку в нем сочетаются октаэдрический “сердечник”, как в K,Но-борате, и простые слюдяные слои без дополнительных треугольников, как в K,Та-борате и пепроссиите.
ВЫВОДЫ
Кристаллы нового бората KTm[B4O6(OH)4] ⋅ ⋅ 3H2O были получены в гидротермальных условиях при температуре 280°С и давлении 100 атм. Структура состоит из полярных слюдоподобных тетраэдрических слоев [B4O6(OH)4]∞∞, которые объединяются с TmO6-октаэдрами в неполярные пакеты. Межпакетное пространство заполнено атомами K и молекулами воды, заселяющими позиции с вакансиями статистически. Новый борат принадлежит семейству слоистых структур, таких как KTa[B4O6(OH)4](OH)2 ⋅ 1.33H2O, пепроссиита и его синтетического аналога NdAl2.07[B4O10]O0.6, а также синтетических фаз с усложненным слоем KHo[B6O10(OH)2] и KGd[B6O10(OH)2]. В K,Tm-борате реализована новая комбинация простых слюдяных слоев с TmO6-октаэдрами. Самой стабильной частью всех структур является пакет из октаэдров (призм) и слоев из ВO4-тетраэдров. Совершенная спайность и плохое качество кристаллов связаны с их строением и характерным для них беспорядком в структурах, статистическим заселением позиций атомов в межпакетном пространстве. Для структуры K,Tm-бората также характерно разупорядочение атомов Tm в направлении оси с структуры, что объясняет несколько завышенный фактор расходимости при уточнении структуры.
Синтезированный борат демонстрирует интенсивную эмиссию в синей области видимого света за счет излучательных переходов 4f–4f катиона Tm3+. В спектрах излучения фотолюминесценции наиболее интенсивным является переход 1D2–3F4 при 450 нм.
Авторы выражают благодарность С.Ю. Стефановичу за определение сигнала ГВГ и консультации, В.О. Япаскурту за определение состава кристаллов.
Работа выполнена частично в рамках госзадания ИФТТ РАН. Исследование люминесцентных свойств проведено при поддержке Российского научного фонда (грант № 19-77-10013).
Список литературы
The Cambridge Crystallographic Data Centre (CCDC). Inorganic Crystal Structure Data Base – ICSD. https://www.ccdc.cam.ac.uk/http://www.fiz-karlsruhe.de
Crystallography Open Database. crystallography.net/cod
Christ C.L., Clark J.R. // Phys. Chem. Miner. 1977. V. 2. P. 59.
Newnham R.E., Redman M.J., Santoro R.P. // J. Am. Ceram. Soc. 1963. V. 46. P. 253.
Liu Y., Yu F., Wang Zh. et al. // Cryst. Eng. Commun. 2014. V. 16. P. 7141.
Илюхин А.Б., Джуринский Б.Ф. // Журн. неорган. химии. 1993. Т. 38. С. 1625.
Белоконева Е.Л., Зорина А.П., Димитрова О.В. // Кристаллография. 2013. Т. 58. № 2. С. 191.
Moeller M.H., Schleid T., Emme H. et al. // Z. Natur. B. 2004. V. 59. P. 202.
Emme H., Valldor M., Pöttgen R., Huppertz H. // Chem. Mater. 2005 V. 17. P. 2707.
Либау Ф. Структурная химия силикатов. М.: Мир, 1988. 410 с.
Qiao X., Cheng Y., Qin L.et al. // J. Alloys Compd. 2015. V. 617. P. 946.
Du P., Yu J.S. // Mater. Res. Bull. 2016. V. 84. P. 303.
Nikiforov I.V., Deyneko D.V., Spassky D.A. et al. // Mater. Res. Bull. 2020. V. 130. P. 110925.
Xue Z., Yi Z., Li X. et al. // Biomaterials. 2017. V. 115. P. 90.
Zhang H., Li Y., Lin Y. et al. // Nanoscale. 2011. V. 3. P. 963.
Carnall W.T., Fields P.R., Rajak K. // J. Chem. Phys. 1968. V. 49. P. 4424. https://doi.org/10.1063/1.1669893
Tymiński A., Grzyb T. // J. Lumin. 2017. V. 181. P. 411.
GruberJ. B., Conway J.G. // J. Chem. Phys. 1960. V. 32. № 4. P. 1178.
Nadort A., Zhao J., Goldys E.M. // Nanoscale. 2016. V. 8. P. 13099.
Transition Metal and Rare Earth Compounds Excited States, Transitions, Interactions I / Ed. Yersin H. New York: Springer, 2001. 187 p.
Runowski M., Shyichuk A., Tymiński A. et al. // ACS Appl. Mater. Interfaces. 2018. V. 10. № 20. P. 17269.
Stefanovich S.Yu. // Extended Abstracts of Eur. Conf. on Lasers and ElecrtoOptics (CLEO Europe’94). Amsterdam, 1994. P. 249.
Belokoneva E.L., Stefanovich S.Yu., Dimitrova O.V. // J. Solid State Chem. 2002. V. 195. P. 79.
Belokoneva E.L., Topnikova A.P., Stefanovich S.Yu. et al. // Solid State Sci. 2015. V. 46. P. 43.
Agilent (2014). CrysAlis PRO. Agilent Technologies Ltd, Yarnton, Oxfordshire, England.
Sheldrick G.M. // Acta Cryst. A. 2008.V. 64. P. 112.
Farrugia L.J. // J. Appl. Cryst. 2012. V. 45. P. 849.
Sheldrick G.M. // Acta Cryst. C. 2015. V. 71. P. 3.
Dowty E. ATOMS. Shape Software, Kingsport, Tennessee, USA, 2006.
Dominiak-Dzik G., Ryba-Romanowski W., Goł S., Pajaczkowska A. // J. Phys.: Condens. Matter. 2000. V. 12. P. 5495.
Meza-Rocha A.N., Speghini A., Lozada-Morales R., Caldiño U. // Opt. Mater. 2016. V. 58. P. 183.
Que M., Ci Zh., Wang Yu. Et al. // J. Lumin. 2013. V. 144. P. 64.
Пущаровский Д.Ю., Карпов О.Г., Леонюк Н.И., Белов Н.В. // Докл. АНСССР. 1978. Т. 241. С. 91.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография