Кристаллография, 2021, T. 66, № 3, стр. 369-380
Нестехиометрия в неорганических фторидах: 4. Начальная стадия анионной нестехиометрии в RF3 (R – Y, La, Ln)
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
* E-mail: sobolevb@yandex.ru
Поступила в редакцию 14.05.2019
После доработки 06.07.2020
Принята к публикации 08.07.2020
Аннотация
Анионная нестехиометрия в неорганических фторидах – замещение F1– на O2– в анионной подрешетке. Все семейства фторидов имеют начальную стадию анионной нестехиометрии (НСАН), рассмотреную для трифторидов редкоземельных элементов (РЗЭ – RF3). Частичное замещение F1– на O2– в RF3 возникает при реакциях с парами H2O при нагреве (пирогидролиз), обменных реакциях RF3 с R2O3 в расплавах, гидротермальных растворах, твердой фазе, при механохимическом синтезе. Механизм НСАН – образование оксофторидов RF3 – 2xOx, тип которых и сроение структурно обусловлены кристаллическими формами RF3. На основе тисонитовых форм tys-RF3 (R = La–Gd, тип LaF3) образуются конгруэнтно плавящиеся tys-RF3 – 2xOx. Изоструктурные им бертоллидные фазы ~tys-RF3 – 2xOx, плавящиеся инконгруэнтно выше соответствующих RF3, образуются с R = Tb–Ho. Эффект стабилизации tys-RF3 – 2xOx “вверх” по температуре (+ΔTfus) меняется по ряду РЗЭ немонотонно c максимумом ~100°С в районе Gd–Tb. Замещения F1– → O2– нет в формах β-RF3 (R = Er–Lu, Y) типа β-YF3. Фазы α-RF3 – 2xOx типа α-YF3 (α-UO3) плавятся инконгруэнтно и распадаются при высоких температурах. Продукты НСАН в RF3 могут служить источником новых конгруэнтно плавящихся фтор-кислородных материалов.
ОГЛАВЛЕНИЕ
Введение
1. Стадийность анионной нестехиометрии в RF3
2. Бескислородные трифториды РЗЭ
3. Методы изучения начальной стадии анионной нестехиометрии (НСАН) в RF3
4. Механизм НСАН в RF3 и нестехиометрические фазы RF3 – 2xOx
4.1. Термические характеристики RF3 – 2xOx (сравнение с RF3)
4.2. Термическая устойчивость фаз tys-RF3 – 2xOx (изменения по ряду РЗЭ)
Заключение
ВВЕДЕНИЕ
Сообщение продолжает обзоры по нестехиометрии в неорганических фторидах (НФ) [1, 2], дополняя монографии [3, 4] с данными исследований катионной нестехиометрии в Институте кристаллографии РАН (ИК РАН) до 2001 г., а также обзор [5] по анионной нестехиометрии в MF2 (M = Ca, Sr, Ba). Рассмотрена начальная стадия анионной нестехиометрии (НСАН) в трифторидах (RF3) 15 редкоземельных элементов (РЗЭ, R), исключая ScF3 и PmF3. Это обширное химическое семейство соединений РЗЭ сыграло особую роль в изучении катионной нестехиометрии в НФ [3].
Трифториды редкоземельных элементов (RF3) составляют ~60% от 27 MFm, используемых для фторидных многокомпонентых кристаллических материалов [4]. Несмотря на интерес к RF3 как к компонентам систем, кристаллическим матрицам и активаторным ионам фотоники, исследования самих соединений и фазовых диаграмм систем MFm–RF3 (и более сложных) с их участием сдерживались отсутствием данных о фазовых переходах (ФП) в них. К середине 80-х годов прошлого столетия признанной схемы плавления и полиморфизма для 17 RF3 не существовало. С 1966 по 1976 г. предложены четыре несовместимых схемы ФП в RF3. Прием выбора “лучших” температур из противоречивых данных не работал – в надежности каждого определения не сомневались. Причина разногласий была объективна. НСАН в RF3 (кислородное “загрязнение”) оказалось такой причиной.
Основные примеси в соединениях – катионы. От них можно очистить вещество (до какого-то предела), будучи уверенным в сохранении чистоты. В НФ появляется анионная примесь (кислород) – единственная летучая примесь, которая накапливается в кристалле по ходу эксперимента. Концентрация структурно фиксированного (изоморфного) кислорода растет, пока есть внешние источники и не насыщен продукт НСАН – оксофторид. Управляет кислородным “загрязнением” начальная стадия.
Изучение НСАН в RF3 началось в ИК РАН в 70-х годах прошлого столетия для R = Gd, Tb, Ho, Er, Y. Группа в ИК РАН была не единственной в мире, получившей бескислородные RF3. Но она одна продолжила изучение механизма замещения F1– → O2–, показав структурную обусловленность НСАН, т.е. зависимость химической природы и строения фаз RF3 – 2xOx от атомного номера РЗЭ Z и кристаллических структур соответствующих RF3.
Исследования НСАН и фазовых превращений в RF3 [6, 7] основаны на получении бескислородных RF3. Определены истинные температуры плавления и полиморфизма RF3, показано, что механизм начальной стадии замещения F1– → O2– заключается в образовании оксофторидов RF3 – 2xOx во всех пяти изученных системах RF3–R2O3 (была известна одна c Gd), выявлена структурная обусловленость продуктов НСАН исходными RF3.
В те годы исследования фазовых диаграмм систем RF3–R2O3 и их областей вблизи RF3 велись и другими коллективами, изучавшими отдельные RF3. В литературе нет целостной картины НСАН во всем ряду RF3 и, как следствие, понимания ее роли в термическом поведении RF3 и систем с их участием.
Результатом такой ситуации стала недавняя публикация (2008 г.) фазовой диаграммы системы GdF3–LuF3 [8]. Ranieri I.M. и др. вместо GdF3 в качестве компонента ошибочно использовали GdF3 – 2xOx. Они не знали ни работ [6, 7] (в журнале, где опубликована [8]), ни [9] по фазовым диаграммам 34 систем RF3–R’F3, полагая, что изучили систему GdF3–LuF3 впервые. Анализ допущенных в [8] ошибок из-за незнания процессов НСАН в GdF3 проведен в [10].
Пример не единственный, хотя и яркий, показывает, что предпринятое здесь впервые изложение систематических данных о НСАН в RF3 всего ряда остается актуальным для высокотемпературной химии трифторидов РЗЭ, расширяя знания об анионной нестехиометрии в них.
Обзоры по НСАН F1– → O2– в простых MF2 [5] и RF3 (настоящий обзор) являются также первой попыткой объединения катионной нестехиометрии во фторидах [1, 3] с анионной.
Цели настоящей работы: представить обзор данных о НСАН – замещении F1– → O2– в RF3; рассмотреть механизм НСАН по результатам изучения областей систем RF3–R2O3 с R = La, Gd, Ho, Y (представители структурных подгрупп RF3); проследить связь структуры RF3 – 2xOx с формами RF3 (структурную обусловленность НСАН); сравнить температуры полиморфных и морфотропных переходов в RF3 – 2xOx с RF3 по ряду РЗЭ; проанализировать изменения термической стабильности tys-RF3 – 2xOx продуктов НСАН в RF3 по всему ряду РЗЭ.
1. СТАДИЙНОСТЬ АНИОННОЙ НЕСТЕХИОМЕТРИИ В RF3
В системах RF3–R2O3 по содержанию кислорода выделяются три стадии замещения F1– → O2–. Конечная – полное замещение с образованием оксидов (у большинства РЗЭ это R2O3). Промежуточная – образование ROF и близких составов, имеющих малые области гомогенности, склонных к упорядочению, полученых в виде монокристаллов. Стадия проявляется у всех RF3.
За реакцией замещения F1– → O2– в НФ утвердилось название “пирогидролиза”. Это не совсем корректно прежде всего по приставке “пиро”, поскольку, как увидим далее, нагрев для этого не обязателен. Термин охватывает широкий круг различных реакций. Он не определяет принадлежность реакции к собственно гидролизу, требующему воды в определенном состоянии. Он не делает различия между системами с паровой фазой, закрытыми системами, не различает состояний продуктов реакций. Он не учитывает химических различий между газообразными продуктами, определяющими тип реакции (гидролиз или окисление). Механизмы изоморфного вхождения кислорода и его источники различны, часто они не определены. Объединяющими описанные способы замещения F1– → O2– признаками являются продукты, одинаковые во всех случаях – оксофториды разного состава и структуры на промежуточной и оксиды на конечной стадии. Учитывая общепринятость термина “пирогидролиз”, будем использовать его для любой реакции получения оксофторидов.
Конечная стадия пирогидролиза RF3парами воды до R2O3. Систематическое изучение конверсии НФ в оксиды парами воды инициировано Ман-хэттенским проектом (1942–1945). Извлечению урана гидрофторированием урановых руд потребовался быстрый и точный контроль полноты реакции. Реакция фторидов при нагреве с парами воды упрощала аналитику фтора. Методика оказалась применимой и к RF3. Для всех фторидов выбран нагрев при 1000 ± 25°С. Условия и техника анализа на фтор во фторидах металлов (включая РЗЭ) реакцией с парами воды опубликованы в 1954 г. [11]. Статья вышла много позже отчетов по проекту (Manhattan Project CC-1981 Oct. 10, 1944; CC1983-Nov. 10, 1944; CC-2723, June 30, 1945), закрепляющих приоритет. Пирогидролизу подвержены все НФ. Их различает кинетика реакции, изученная в [11] на порошках. Наиболее стабильные 34 фторида разделены на трудно и легко (к ним отнесены RF3) гидролизуемые.
Пирогидролиз RF3 при 975 ± 25°С изучен в [12]. Кинетика реакции делит RF3 на две группы. К легко гидролизующимся (<30 мин) отнесены:
Фториды РЗЭ цериевой подгруппы требуют более высоких температур реакции, чем иттриевой, что коррелирует с температурами плавления RF3. Данные [11, 12] по склонности RF3 к пирогидролизу практически совпадают.
Промежуточная стадия пирогидролиза RF3до ROF парами воды. В системах RF3–ROF образуются оксофториды с разными соотношениями F : O (ROF : RF3 = 3 : 1; 4 : 1; 6 : 1 и др.). Данные об их числе, составах, строении, термическом поведении и изменениях по ряду РЗЭ противоречивы. Во многом это обусловлено трудностями достижения равновесных состояний.
Фазам ROF промежуточной стадии, начиная с 1941 г., посвящено много работ. История синтеза ROF и других оксофторидов из RF3 и R2O3 (до 1971 г.) подробно изложена в обзоре Л.Р. Бацановой [13], чья группа с Химического факультета МГУ внесла большой вклад в исследование этого раздела.
Стадийность анионной нестехиометрии в RF3 наиболее систематически изучена для пирогидролиза в системах “RF3–пары воды”. В них содержание кислорода растет до ROF (катион : анион = = 1 : 2), что выделяет его в стадию:
Пирогидролиз RF3 парами H2O для синтеза ROF первым использовал в 1951 г. В.Х. Захаризен [14], получив LaOF нагревом в течение ~30 ч LaF3 при 920°С в атмосфере воздуха. Медленное протекание реакции позволило получать промежуточные составы с заданными содержаниями кислорода, останавливая процесс. Синтез YOF из YF3 при 500°С потребовал ~50 ч. Работа инициировала серию исследований, обсуждение которых выходит за рамки работы.
Об индивидуальности ROF свидетельствует получение [15] их микрокристаллов (до 1 мм3) c R = Y, Gd, Tb, Dy, Ho, Er из раствора в расплаве R2O3 с флюсом из смесей PbO/PbF2/Al2O3 при охлаждении от 1340°С со скоростью 3 град/ч. Крупные кристаллы LaOF : Nd3+ (диаметром 6 мм) выращены в [16] из расплава методом направленной кристаллизации. Их температура плавления определена как ~2000°С.
Анионная нестехиометрия “глубокой” (промежуточной) стадии стабилизирует “вверх” по температуре структурный тип CaF2 у ROF с 50%-ным замещением F1– → O2–. Это делает флюоритовые ROF доминирующими среди нестехиометрических фаз с анионной нестехиометрией аналогично флюоритовым M1 – xRxF2 + x и Na0.5 – xR0.5 + xF2 + 2x в катионной нестехиометрии.
Краткий обзор химических взаимодействий RF3 с H2O при высоких температурах показывает, что фазовый, химический состав и структура оксофторидных фаз в средней области систем RF3–R2O3, несмотря на многочисленные исследования, нельзя считать хорошо установленными.
Учитывая направленность настоящего обзора на НСАН в RF3 и RF3 – 2xOx с малым содержанием кислорода, закончим рассмотрение ROF – промежуточной “глубокой” стадии пирогидролиза RF3 парами воды, имеющих в первом приближении постоянный состав и структуру типа CaF2.
Основную неопределенность пирогидролиза фторидов парами воды вызывают особенности подвижного компонента – воды. Нагретый (чаще перегретый) водяной пар – это не та вода, от которой происходит “гидролиз”. Говоря о пирогидролизе фторидов, надо учитывать изменения свойств воды с температурой и давлением. Данные о состоянии воды, в принципе хорошо из-ученном, в анализе реакций F1– → OH1– и F1– → → O2– не использовались. Нагретая вода – ионная жидкость, реакция которой с фторидом приводит к замещению F1– → OH1–. Это близко к гидротермальным условиям минералообразования, в которых часто наблюдается изоморфизм OH1– и F1–.
Неопределенность введения кислорода во фторид, возможного в формах гидроксила (F1– → → OH1–) и кислорода (F1– → O2–), связана с водой.
Механогидролиз RF3до ROF. Нагрев не является обязательным условием замещения F1– → O2– во фторидах. Механохимическим синтезом (МХС) из LaF3 и La2O3 получен LaOF [17]. Из монокристаллов CaF2 и LaF3 МХС [18] синтезирована фторпроводящая тисонитовая фаза La1 – yCayF3 – y, с увеличением времени помола частично переходящая в LaOF (тип СaF2). По аналогии с пирогидролизом реакцию образования LaOF назвали “механогидролизом” [18]. Источник воды – атмосферная влага при отборе проб для изучения кинетики МХС. Механогидролиз в [18] относится к системам “фторид–вода”, но с водой не в паровой фазе и не нагретой. МХС используют для получения нанокерамических фторпроводящих твердых электролитов ([19] и др.) с катионной и анионной нестехиометрией.
Замещение F1– → O2– в RF3 открывает начальная стадия, ставшая самой загадочной в химии RF3. В то время как промежуточная стадия открыта в начале, а конечная в середине 50-х, открытие начальной состоялось для отдельных РЗЭ лишь в середине 80-х годов прошлого столетия, а полное исследование для всего ряда РЗЭ не завершено и сейчас.
Для установления влияния небольших содержаний кислорода на ФП в RF3 нужно было получить бескислородные RF3.
2. БЕСКИСЛОРОДНЫЕ ТРИФТОРИДЫ РЗЭ
Номинально бескислородными RF3 для физико-химических исследований резонно считать те, в которых примесь кислорода не меняет температуры ФП в пределах точности дифференциально-термического анализа (ДТА). Этот критерий условен, так как основан на меняющейся величине – точности метода ДТА.
“Загрязнение” фторидов кислородом как проблему мирового масштаба для химии фторидов РЗЭ оценил О. Грейс в обзоре по состоянию химии RF3 в 1982 г. [20]. К началу 90-х только три научных группы в мире работали с минимально гидролизованными RF3, позволявшими изучать их высокотемпературную химию. Они синтезировали номинально чистые по кислороду RF3, подтвердив это анализами. В [20] названы группы F.H. Spedding (Ames Lab, США) и Б.П. Соболева (ИК РАН, Россия), плавившие фториды, и группа О. Грейса (ФРГ), получавшая RF3 в виде порошков. Оценка [20] не учитывала научных коллективов и фирм по росту кристаллов фторидов, получавших чистые по кислороду RF3 без их анализа.
Глубина очистки RF3 от кислорода в Ames Lab [21, 22] и ИК РАН [6, 7] существенно различается. Это вызвано разной длительностью (22 и 4 ч) и эффективностью (динамическая и статическая фторирующие атмосферы) реакций фторирования. В результате в [21, 22] достигнута на порядок более глубокая очистка (в среднем 0.003 мас. % или 30 ppmw), чем в [6, 7] (в среднем 0.040 мас. % или 400 ppmw). Более высокая точность определения температур превращений (±3°С) получена [21, 22] сочетанием ДТА и калориметрии. В [6, 7] эта точность ±10°С, а в [23] – ±8°С (по ДТА).
Температуры ФП RF3 определены группой O. Грейса [23] на стандартной установке ДТА с оксидной керамикой, но каждый образец заваривался в платиновую ампулу. Открыты “размытые” ФП у RF3 c R = La–Eu. О степени очистки от кислорода судили по близости температур ФП к [21, 22] и [6, 7]. В среднем температуры превращений, полученные [23], ближе к [21, 22], чем к [6, 7]. Сравнение позволяет считать цифровые данные трех групп совпадающими. Все группы разными способами достигли очистки RF3 от кислорода до значений, достаточных для использования их в исследованиях по высокотемпературной химии RF3 и получении оптических монокристаллов.
3. МЕТОДЫ ИЗУЧЕНИЯ НСАН В RF3
Степень пирогидролиза RF3 зависит от метода исследования. Работа [24] по рентгенографии порошка RF3 – лучшая иллюстрация разного содержания кислорода в трифторидах РЗЭ, изученных разными методами. Технические особенности методик термического изучения RF3, обсуждаемые ниже, остаются возможными источниками ошибок и сегодня.
Высокотемпературная рентгенография (метод порошка) для изучения полиморфных переходов в RF3in situ была применена в 1966 г. [24]. Впервые установлена принадлежность α-“RF3” к определенным типам структур. Кавычки обозначают, что изученные образцы являются не RF3, как полагали авторы, а RF3 – 2xOx – продуктами НСАН. В [24] дополнили рентгеновские данные по “мнимому” полиморфизму RF3 их температурами плавления по данным ДТА [25]. Содержание кислорода в RF3, полученных [24] от этой группы, достигало 200–750 ppmw. Об этом позже сообщили в [21, 22], получив более чистые по кислороду RF3 и сделав анализы всех RF3, синтезированных в Ames Lab в 1961 и 1971 г. Для RF3 (синтез которых разделен десятилетием и разницей примеси кислорода в среднем более чем на порядок!) температуры плавления совпали в пределах ошибкок ДТА. Таким образом, приводимые в [24] температуры ФП одних и тех же RF3, полученные разными методами, делятся на ошибочные и приемлемые. Цитируемые по [25] температуры плавления RF3 с кислородом (ДТА) приемлемы. При рентгенографических анализах in situ пирогидролиз приводит к дальнейшему росту содержания кислорода и делает результаты неприемлемыми как по температурам полиморфных превращений, так и по образованию некоторых фаз RF3 – 2xOx со структурами, которых нет у RF3.
Рассмотрим, как проявлялся пирогидролиз RF3 в установках для ДТА.
Коммерческие установки для ДТА содержат тепловые и электрические изоляторы из оксидной керамики, способные функционировать в обычной атмосфере. Сильный пирогидролиз в стандартной установке ДТА с керамическими деталями описали в [26], сравнив анализ некоторых RF3 в открытом тигле и запаянной платиновой ампуле. В [3] показано, что измеренные в [26] при последовательных нагревах температуры α ↔ β-“GdF3” в открытом тигле следуют зависимостям температур распада GdF3 – 2хOх от концентрации кислорода и завершаются насыщенным кислородом составом.
Насыщение кислородом происходит для разных РЗЭ при 4–8 мол. % R2O3. Для GdF3 – 2хOх оно отвечает х ~ 0.17 (~5.5 мол. % Gd2O3). Это значительно выше 750 ppmw кислорода [21], которые не влияют в пределах ошибки ДТА на температуры плавления RF3. Керамические детали коммерческих установок ДТА вносят изменения в состав образцов.
Метод ДТА фторидных систем с построением фазовых диаграмм использовался в 50-е годы в Манхэттенском проекте группой R.E. Thoma (ORNL) для поиска низкоплавких смесей фторидов. Поэтому созданная ими установка для ДТА фторидов имела низкий температурный потолок – 1100°С. Анализ велся в открытых графитовых или никелевых тиглях. Влага вымораживалась жидким N2. Главная мера против пирогидролиза – фторирование каждого состава перед анализом расплавом бифторида аммония, помещаемым в тигель на 4 ч при 550°С. Для уточнения температур превращений использован градиентный отжиг в Ni-капиллярах [27]. О том, что анионная нестехиометрия не была подавлена, говорят фазовые диаграммы с ошибочными данными по полиморфизму RF3, плавкости и даже фазовому составу систем: LiF–RF3, NaF–RF3; KF–RF3 [28–35] и др. Фазовые диаграммы систем с частично гидролизованными компонентами “RF3” потребовали серьезной ревизии.
Причины разногласий ДТА и рентгенографических исследований одних и тех же образцов RF3 заключаются в кинетике термообработки при ДТА и высокотемпературной рентгенографии. ДТА требует быстрого нагрева (10–20 град/мин). При рентгенографии нагрев медленный из-за контроля равновесия и фазового состава. Рентгенограмма выше температуры перехода снимается долго (одновременной регистрации рефлексов еще не было). Развитая поверхность и длительность контакта с атмосферой объясняют высокую степень замещения F1– → O2– при более низкой температуре.
Экспресс-установка для ДТА фторидов разработки ИК РАН обеспечила изучение фазовых диаграмм более 200 систем MFm–RFn (m < n ≤ 4) из тугоплавких гидролизующихся фторидов с катионной нестехиометрией [3]. Она оказалась пригодной и для изучения НСАН в RF3 [6, 7].
Установка разработана и изготовлена в ИК РАН автором обзора с коллегами [36]. Главные отличия от коммерческих – контролируемая атмосфера, начинавшаяся с вакуума, и конструкционные материалы теплового узла. Рабочая атмосфера создавалась гелием или аргоном.
Установка отвечала ряду технологических и ситуативных требований. Технологическое – подавление пирогидролиза до допустимого уровня (подтверждено анализами [7]). Он был достигнут ранее в установках для роста кристаллов фторидов из расплава, у которых для установки ДТА заимствованы графитовый нагреватель и тепловой экран из прутков молибдена. Исключение для оксидных электро- и теплоизолирующих материалов состояло в использовании плавленой (метод Вернейля) крупнозернистой керамики из Al2O3. Для W–Re-термопар использовались “бусы” из монокристаллов сапфира. В установке ДТА допустимы фторирующие атмосферы, чем пользовались редко.
Ситуативное требование – высокие темпы изучения фазовых диаграмм из-за жесткой мировой конкуренции при поиске новых кристаллов и решении задач уточнения ФП (разница составов достигала 1 мол. %).
Наиболее времязатратная процедура вакуумной камеры ДТА – изменение составов образцов. После каждого измерения камера со специальной атмосферой открывается, в нее помещается тигель с новым составом и снова создается нужная атмосфера. Для изменения состава сбросом в тигель компонента создан дозатор, позволяющий изучать до 20 составов без разгерметизации камеры. Эффект интенсификации ДТА от дозатора повысил производительность в 5–6 раз (выше стандартной). Экспресс-установка ДТА ИК РАН не имеет мировых аналогов среди коммерческих приборов по производительности, устойчивости к агрессивным расплавам и воспроизводимости при температурном потолке ~1700°С, минимальному пирогидролизу и возможности использования фторирующих атмосфер.
Анионная нестехиометрия и высокотемпературные измерения ионной проводимости кристаллов на основе RF3. Чувствительность ДТА в определении влияния НСАН на температуры плавления RF3 превышает ошибки ДТА при содержаниях кислорода в RF3 – 2xOx на уровне х ≥ 0.01–0.02. Это отвечает ~0.10–0.15 мас. % O2 (1000–1500 ppmw), близкому, по мнению [7, 21, 22, 37], к допустимым содержаниям кислорода в RF3.
Чувствительность ДТА к НСАН нельзя назвать высокой. Есть методы изучения пирогидролиза фторидов, основанные на других свойствах, чем теплоты реакций. Среди них внимания заслуживает ионная проводимость.
4. МЕХАНИЗМ НСАН В RF3 И НЕСТЕХИОМЕТРИЧЕСКИЕ ФАЗЫ RF3 – 2xOx
Вместо глубокой очистки RF3 для исследования НСАН методом ДТА в ИК РАН выбран путь введения в расплав номинально бескислородных RF3 дозированных количеств R2O3 (намного превышающих его примесные содержания в RF3). Обменная реакция дает фазы RF3 – 2xOx, определение температур плавления и распада которых и есть установление механизма влияния анионной нестехиометрии на ФП в RF3 через образование оксофторидов различного химического типа и строения.
Анионная нестехиометрия и температуры плавления фаз RF3 – 2xOx. Качественно влияние кислорода на температуры плавления RF3 замечено в [38, 39]. Рассмотрим области систем RF3–R2O3, относящихся к представителям четырех структурных подгрупп RF3 (R = La, Gd, Ho, Y).
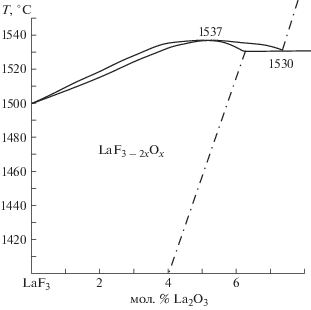
Система LaF3–La2O3 (область вблизи LaF3) изучена ДТА до 1600°С [40]. Часть системы на рис. 1 (полностью не публиковалась) содержит фазу LaF3 – 2xOx, имеющую при температуре эвтектики 1530 ± 5°С область гомогенности ~6 мол. % La2O3 с максимумом на 1537 ± 5°С и распадающуюся при охлаждении.
Распад CeF3 – 2xOx наблюдался в кристаллах CeF3 для позитронно-эмиссионного томографа (ПЭТ) в [41]. Пример брака из-за рассеивающих свет частиц кислородсодержащей фазы в кристалле-сцинтилляторе CeF3 виден на рис. 2а. Фазовый состав частиц установить не удалось. Полное фторирование реактива CeF3 дает прозрачные элементы для ПЭТ (рис. 2б).
Рис. 2.
Кристаллы: а – бракованный элемент кристалла-сцинтиллятора CeF3 для ПЭТ с неоднородным распределением оксидной фазы (направление кристаллизации снизу вверх); б – рабочий элемент из CeF3 для ПЭТ из [41].

Хотя из систем RF3–R2O3 с R = La–Sm изучена одна (R = La), можно полагать (принцип непрерывности), что участки систем с другими RF3 цериевой подгруппы подобны части LaF3–La2O3 на рис. 1 по [40].
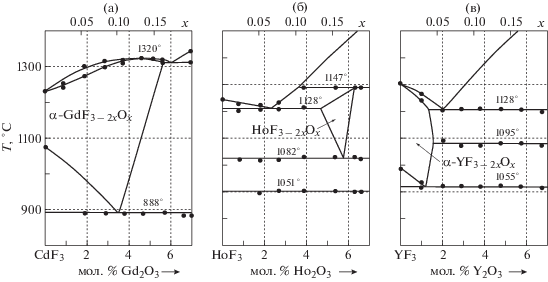
Система GdF3–Gd2O3 (область вблизи GdF3) – первая из RF3–R2O3, для которых ДТА показано существование НСАН в GdF3 [42] в форме образования α-GdF3 - 2хOх – твердого раствора на основе α-GdF3 (тип LaF3). Замещение F1– → O2– сопровождается ростом температуры плавления α-GdF3 – 2хOх до максимума (1325 ± 5°C при 4.5 мол. % Gd2O3). Кислород стабилизирует структуру LaF3 в α-GdF3 – 2хOх “вверх” по температуре (рис. 3а) на величину (92 ± ± 5°C), намного превышающую ошибку ДТА. Полученные в [42] температуры максимума на кривых плавкости α-GdF3 – 2хOх и ее распада (897°С) подтверждены в [6, 7] (1320 и 888°С соответственно, рис. 3а).
Влияние кислорода на термическое поведение RF3 аналогично влиянию примесей алиовалентных катионов. Термическая стабилизация катионной нестехиометрией типа LaF3 особенно эффективна в R1 – yMyF3 – y (М = Ca, Sr, Ba) с образованием анионных вакансий: R3+ + F1–→ M2+ + VF [6, 7, 43–46].
Система HoF3–Ho2O3 (область вблизи HoF3). Фаза HoF3 – 2хOх типа LaF3 топологически отличается от α-GdF3 – 2хOх тем, что отделена от HoF3 двухфазной областью (рис. 3б). Между HoF3 и HoF3 – 2хOх образуется эвтектика. Кислород в HoF3 (в пределах точности ДТА) не растворяется.
Механизм анионной нестехиометрии (образование RF3 – 2xOx) для HoF3 (и III структурной подгруппы RF3 с R = Tb–Ho) отличается от II структурной подгруппы RF3 c R = Sm–Gd. Ромбический HoF3 (тип β-YF3) индифферентен к замещению F1– → O2– во всем интервале температур.
При увеличении содержания Ho2O3 до ~5 мол. % (мольная доля кислорода, x ~ 0.15) тип LaF3 стабилизируется в оксофторидной бертоллидной фазе ~tys-HoF3 – 2хOх, которая плавится инконгруэнтно на 7 ± 5°C выше, чем бескислородный HoF3 [6]. Она распадается при 1082 ± 5°C. Полученные в [6] кристаллы HoF3 содержали 0.005 мас. % кислорода (50 ppmw).
Появление бертоллида ~tys-HoF3 – 2хOх однозначно связано с полиморфизмом RF3. Деление фаз на дальтониды и бертоллиды (предложено Н.С. Курнаковым) в литературе встречается редко, хотя термин berthollides вошел в IUPAC Inorganic Rules (1960), где им присвоен знак тильда (~). Бертоллиды играют особую роль среди нестехиометрических фаз с катионной и анионной нестехиометрией. Понятие о бертоллидах удобно и информативно при описании топологии систем MFm–RFn и RF3–R2O3.
Стабилизация анионной нестехиометрией структуры LaF3 у бертоллидов ~tys-RF3 – 2xOx присуща только RF3 типа β-YF3 из III структурной подгруппы (R = Tb–Ho). Образование фаз ~tys-RF3 – 2xOx не наблюдается для IV структурной подгруппы β-RF3 (R = Er–Lu, Y), имеющих тот же тип β-YF3.
Система YF3–Y2O3 (область вблизи YF3). Фаза α-YF3 – 2хOх со структурой α-YF3 (α-UO3) по [24, 47] является продуктом НСАН на основе высокотемпературных α-RF3. В системе с YF3 (рис. 3в) растворение Y2O3 в α-YF3 понижает температуру эвтектического плавления до 1128 ± 5°C (α-YF3 плавится при 1152 ± 5°C). В пределах точности ДТА фазы β-YF3 – 2хOх нет.
Анионная нестехиометрия и температуры распада фаз RF3 – 2хOх. Расторможенный полиморфизм RF3 середины ряда позволил определить ДТА температуры эвтектоидного распада фаз RF3 – 2xOx (R = Gd, Ho, Y), рис. 3.
Cистема LaF3–La2O3 (область вблизи LaF3). Распад LaF3 – 2xOx происходит в области низких температур и методом ДТА не фиксируется.
Cистема GdF3–Gd2O3 (область вблизи GdF3). Фаза α-GdF3 – 2хOх с ~3.5 мол. % Gd2O3 распадается по эвтектоидной схеме при 888 ± 5°С (рис. 3а), что на 187 ± 5°C ниже температуры α ↔ β-GdF3 (1075 ± 5°C [6]). Кислород в α-GdF3 – 2хOх сильно расширяет устойчивость типа LaF3 “вниз” по температуре. НСАН в GdF3 сопровождается вхождением в α-GdF3 – 2хOх до ~5 мол. % Gd2O3.
Разнонаправленное влияние НСАН на температуры плавления GdF3 (повышение) и полиморфизма (понижение) вызывает максимальный (среди всех RF3) разброс литературных данных по температурам полиморфизма “загрязненного” кислородом “GdF3”. Опубликованные температуры α↔β-“GdF3” группируются около двух значений: 900 и 1070°С. Первое близко к распаду насыщенного кислородом α-GdF3 – 2хOх (888 ± 5°С, рис. 3а), а второе совпадает с полиморфизмом чистого GdF3 (1070 ± 5°С) [6, 7].
Система HoF3–Ho2O3 (область вблизи HoF3). Бертоллид ~tys-HoF3 – 2хOх типа LaF3 (по [24]) отделен от HoF3 двухфазной областью (рис. 3б). Фаза ~tys-HoF3 – 2хOх распадается по эвтектоидной схеме при 1082 ± 5°С.
Система YF3–Y2O3 (область вблизи YF3). В системе (рис. 3в) растворение Y2O3 в α-YF3 (тип α-UO3) немного (на 15 ± 5°C) понижает температуру α ↔ β-YF3 до эвтектоидного распада α-YF3 – 2хOх при 1055 ± 5°C (по сравнению с α ↔ β-YF3 при 1070 ± 5°C).
Выводы. НСАН стабилизирует тип LaF3 у RF3 – 2xOx “вверх” и “вниз” по температуре. Области систем, примыкающих к четырем представителям структурных подгрупп RF3 (R = La, Gd, Ho, Y), показывают, что анионная нестехиометрия влияет на температуры плавления RF3 – 2xOx через два разнонаправленных фактора: уменьшение ионного радиуса R3+ по ряду РЗЭ, требующего замены типа LaF3 на структуру с более низким координационным числом (КЧ) катиона, и образование анионных вакансий 2F1– → O2– + VF. Устойчивость типа LaF3 “продлевается” на R = = Tb–Ho в виде образования бертоллидов ~tys-RF3 – 2xOx.
4.1. Термические характеристики RF3 – 2xOx (сравнение с RF3)
Для понимания механизма НСАН в RF3 через образование фаз RF3 – 2xOx на рис. 1 и 3 рассмотрены участки фазовых диаграмм четырех систем RF3–R2O3 (R = La, Gd, Ho, Y) [6] с представителями всех структурных подгрупп RF3.
На рис. 4 представлены термические характеристики RF3 – 2xOx для всех изученных 10 систем RF3–R2O3 (с La, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu, Y).
Рис. 4.
НСАН в RF3 (R = La–Lu). Температуры фазовых превращений RF3 и RF3 – 2xOx: кривая A – температуры плавления бескислородных RF3; B, C – температуры полиморфных превращений бескислородных RF3 по [7]; D – “диффузные” фазовые превращения по [23]; Е: точки 6 – температуры плавления RF3 – 2xOx по [7]; 7 – температура конгруэнтного плавления tys-GdF3 – 2xOx по [42]; кривая F: точки 4 – температуры распада RF3 – 2xOxin situ по [24]; 5 – температуры распада RF3 – 2xOx по данным ДТА [6]; 7 – температура распада tys-GdF3 – 2xOx по [42]. Горизонтальная штриховка – фазы tys-RF3 – 2xOx типа LaF3 (R = La–Gd), бертоллиды ~tys-RF3 – 2xOx (R = = Tb–Ho) и фазы RF3 – 2xOx (R = Er, Tm) со структурой типа α-YF3 (α-UO3).
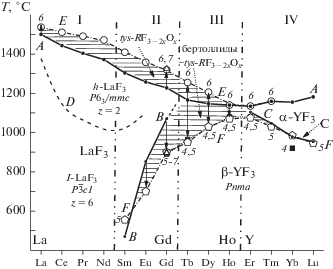
Из областей фазовых диаграмм выбраны особые точки – температуры конгруэнтного плавления и распада насыщенных кислородом RF3 – 2xOx. По оси абсцисс в порядке роста атомного номера Z отложены 14 РЗЭ от La до Lu, по оси ординат – температуры ФП RF3 и RF3 – 2xOx.
Уменьшение (лантаноидное сжатие) ионных радиусов R3+ с ростом Z приводит к cмене у RF3 (без ScF3) трех типов: тисонита (LaF3), β-YF3 и α-YF3 (α-UO3). Структурные поля типов RF3 на рис. 4 даны символами их представителей. Ряд RF3 разбит [7] на четыре структурных подгруппы I–IV, разделенные штрих пунктирными вертикалями (не соответствуют морфотропным превращениям). В порядке роста Z подгруппы включают в себя:
– подгруппа I: RF3 (R = La–Nd) со структурой тисонита (LaF3);
– подгруппа II: диморфные RF3 (R = Sm–Gd) с низкотемпературной β-RF3 типа β-${\text{YF}}_{3}^{{82}}$ и высокотемпературной формой α-RF3 типа LaF3;
– подгруппа III: RF3 (R = Tb–Ho) с одной формой типа β-YF3;
– подгруппа IV: диморфные RF3 (R = Er–Lu, Y) с β-RF3 типа β-YF3 и высокотемпературной α-RF3 типа α-YF3 (α-UO3) [47].
Чтобы не усложнять рисунок, не нанесены данные для YF3, размещающегося между HoF3 и ErF3 с близкими температурами переходов.
На рис. 4 впервые приведено сравнение термических характеристик изученных RF3 – 2xOx с бескислородными RF3. Он получен двумя проецируемыми одна на другую Т–х-плоскостями. На первой плоскости температуры плавления RF3 (кривая A) по [6, 7, 21–23], полиморфных переходов β-RF3 (R = Sm–Gd) в высокотемпературные α-RF3 (кривая B) и температуры полиморфных переходов β-RF3 (R = Er–Lu, Y) в α-RF3 типа α-YF3 (α-UO3) (кривая C). Кривые B и С охватывают температуры полиморфных превращений α ↔ β-RF3 двух структурных подгрупп II и IV, разделенных III подгруппой TbF3, DyF3 и HoF3. Кривая D отражает “диффузные” ФП по [23].
На второй Т–х-плоскости представлены результаты НСАН в RF3.
Повышение температур плавления (Tfus) RF3 – 2xOx. Кривая E – результат образования максимумов на кривых плавкости RF3 – 2xOx. Для R = La, Gd–Tm, Y значения экспериментальные, для остальных – интерполированы по принципу непрерывности. Рост Tfus c ростом Z на участке с изученными R = = Sm–Gd дает сравнение кривых A и E, горизонтальная штриховка между которыми – вклад НАСН в рост Tfus “RF3”. При большом влиянии НСАН важна ее универсальность – рост Tfus наблюдается у всех оксофторидов.
Понижение температур α↔β распада тисонитовых фаз tys-RF3 – 2xOx с R = Sm–Lu по данным ДТА [6] представлено штрих пунктирной кривой F. Понижение Tdisc (стабилизация RF3 – 2xOx “вниз”) немонотонно с ростом Z и распространяется на I–III структурные подгруппы, не охватывая IV.
Сильное понижение Tdisc RF3 – 2xOx c ростом Z на участке R = Sm–Gd отражает сравнение кривых B и F. Расширение термической устойчивости фаз tys-RF3 – 2xOx “вниз” по температуре показано стрелками от кривой B к F. На кривую F хорошо ложится точка 7 – распад фазы tys-GdF3 – 2xOx по [42]. Поле продуктов НСАН – tys-RF3 – 2xOx со структурой типа LaF3 – выделено горизонтальной шириховкой ниже кривой B.
Температуры распада фаз RF3 – 2xOx (R = Tb–Yb) по данным высокотемпературной рентгенографии in situ из работы [24] на частично гидролизованных образцах “RF3” показаны на рис. 4 точками 4 (черные квадраты). Они хорошо ложатся на штрихпунктирную кривую F (точки 5, полученные ДТА на частично гидролизованных “RF3”). Точка 7 (треугольник) – температура распада фазы tys-GdF3 – 2xOx по ДТА [42]. Температуры распада RF3 – 2xOx по данным разных авторов и различных методов (рентгенофазовый анализ и ДТА) совпадают, кроме системы с Yb.
Штрихпунктирная кривая F (пятиугольники на рис. 4) относится к фазам tys-RF3 – 2xOx типа LaF3 с разной химической природой (твердые растворы на основе компонента и бертоллиды). Величина стабилизации “вниз” по температуре отмечена стрелками вниз от точек на кривой A для RF3 (R = Tb–Ho) до точек 5 на кривой F для R1 – xF3 – 2xOx.
Кривая F подтверждает, что в [6, 7, 24] изучались не RF3, а RF3 – 2xOx, образующиеся на НСАН. Из близости значений температур распада RF3 – 2xOx в разных работах можно полагать, что анионная нестехиометрия достигает насыщенных по кислороду составов НСАН, кроме фазы с Yb.
Понижение температур распада фаз RF3 – 2xOx с R = Er–Lu, Y со структурой типа α-YF3 (α-UO3). Точки на правой ветви штрихпунктирной кривой F для R = Er–Lu (Y) соответствуют температурам распада α-RF3 – 2xOx типа α-YF3 (α-UO3). Эта часть кривой F практически сливается с кривой C – полиморфизмом бескислородных α-RF3. Только для систем с R = Er, Tm наблюдаются небольшое понижение температур α ↔ β-RF3 и рост области устойчивости фаз α-RF3 – 2xOx (горизонтальная штриховка).
Таким образом, с ростом Z при нелинейности зависимости термической стабилизации RF3 – 2xOx по ряду РЗЭ налицо ее уменьшение.
Образование на НСАН фаз RF3 – 2xOx, структуры которых не совпадают со структурами соответствующих RF3, нарушает деление RF3 на четыре подгруппы I–IV. Оксифториды расширяют устойчивость структурного типа LaF3 по ряду РЗЭ на три элемента (R = Tb–Ho) и “ликвидируют” III подгруппу RF3 (R = Tb, Dy, Ho), соединив ее с подгруппой II диморфных RF3 с R = Sm–Gd. НСАН в RF3 “переносит” переход между структурными подгруппами гидролизованных “RF3” по ряду РЗЭ (по сравнению с RF3) на три элемента вправо между “HoF3” и “ErF3”.
Структурная обусловленность НСАН. Поскольку продукты НСАН имеют составы, близкие к RF3, можно полагать, что они будут иметь структуры, аналогичные компонентам. Так и происходит с твердыми растворами R1 – xF3 – 2xOx на основе RF3 подгруппы I (R = La–Nd), как и в высокотемпературных α-RF3 подгруппы II (R = = Sm–Gd). Для них справедливо то, что продукты НСАН структурно обусловлены компонентом RF3.
Структурная обусловленность нарушается в RF3 – 2xOx с R = Tb–Ho из III структурной подгруппы без диморфизма. Фазы R1 – xF3 – 2xOx не наследуют формы β-RF3 (β-YF3). Они “отрываются” от RF3, образуя бертоллиды ~tys-RF3 – 2xOx типа LaF3, в стабилизацию которого вносят вклад замещение F1– на “крупный” O2– и вакансии анионов. Все ~tys-RF3 – 2xOx плавятся выше RF3.
На рис. 4 кривые E и F представляют изменения по ряду РЗЭ термической устойчивости фаз tys-RF3 – 2xOx в абсолютных температурах. Сравнение их с бескислородными RF3 (кривые А, В, С) затруднено наложением нелинейных изменений с ростом Z температур плавления Tfus и твердофазного распада Tdisc сравниваемых фаз RF3 – 2xOx и полиморфизма RF3.
4.2. Термическая устойчивость фаз tys-RF3 – 2xOx (изменение по ряду РЗЭ)
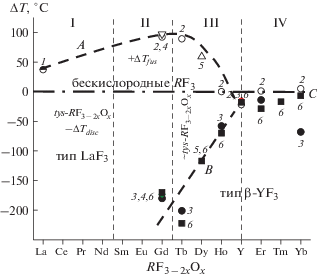
На рис. 5 выделим ΔT стабилизации каждой фазы RF3 – 2xOx, приводя их к температурам соответствующих RF3. Повышение +Tfus = TRF3 – 2xOx – TRF3 фаз tys-RF3 – 2xOx (стабилизация “вверх”) описывает кривая А. Понижение –Tdisc = TRF3 – – TRF3 – 2xOx температуры распада фаз tys-RF3 – 2xOx (стабилизация “вниз”) дает кривую B. Для бескислородных RF3 ΔT = 0, горизонталь C. Температурная шкала ΔT на рис. 5 сжимается от +100 до –200°С (т.е. до 300°С или второе по сравнению со шкалой T на рис. 4).
Появляются два фазовых поля: с положительными +ΔTfus (“вверх”) и отрицательными –ΔTdisc (“вниз”) значениями стабилизации RF3 – 2xOx фаз относительно RF3. Поле +ΔTfus образовано точками 1–5, а поле –ΔTdisc охватывает точки 3–6.
Рост +ΔTfus меняется немонотонно с ростом Z. Максимум +ΔTfus не локализован экспериментом и может располагаться на интервале от Ce до Tb.
Стабилизирующее влияние анионной нестехиометрии на фазы tys-RF3 – 2xOx типа LaF3 (+ΔTfus и –ΔTdisc) заканчивается у RF3 – 2xOx c R = Er, Y, где кривые А и B сходятся к ΔT = 0 (прямая C). Максимальный +ΔTfus (из изученных) у tys-GdF3 – 2xOx ~100°С. Понижение –ΔTdisc фаз tys-RF3 – 2xOx (стабилизация “вниз” по Т) максимально у ~tys-TbF3 – 2xOx (– 201, – 222°С; точки 3, 6 по разным данным, рис. 5). Температуры распада RF3 – 2xOx определены менее точно, чем плавления. Причина выброса на Yb неясна.
Поля +ΔTfus и –ΔTdisc характеризуют устойчивость фаз tys-RF3 – 2xOx со структурой LaF3. Граница между II и III структурными подгруппами RF3 разделяет химические типы изоструктурных (тип LaF3) фаз RF3 – 2xOx: твердые растворы на основе компонента (tys-RF3 – 2xOx) и бертоллиды (~tys-RF3 – 2xOx).
Сильное влияние НСАН на термическое поведение некоторых частично гидролизованных “RF3” при малых содержаниях кислорода (единицы мол. % R2O3) вызвано структурной “чувствительностью” к кислороду ФП RF3 – 2xOx с РЗЭ первой половины ряда. Его примесь “работает” на фоне “кристаллохимической неcтабильности”. Так, в [48] названы области в гомологических рядах соединений РЗЭ, включая фториды, в которых чаще всего происходят морфотропные изменения структуры, связанные с катионным мотивом. Первая область представлена соединениями Pr, Nd и Sm, вторая – Gd, третья – Dy, Ho и Er. Области “кристаллохимической неcтабильности” и морфотропные превращения вызваны понижением КЧ R3+. В RF3 наблюдаются все известные области “кристаллохимической нестабильности” соединений РЗЭ.
В случае НСАН в RF3 “кристаллохимическая нестабильность” структуры тисонитовых tys-RF3 – 2xOx связана с анионной нестехиометрией, “продляющей” этот тип структуры по ряду РЗЭ на три элемента: R = Tb–Ho.
ЗАКЛЮЧЕНИЕ
Нестехиометрия во фторидах делится на катионную и анионную. Анионная (замещение F1– → → O2–) в неорганических фторидах – распространенное явление. В отличие от катионной анионная нестехиометрия – неконтролируемый процесс, вызываемый летучей примесью H2O. По степени замещения F1– → O2– в RF3 анионная нестехиометрия делится на начальную (до 4–8 мол. % R2O3), промежуточную (до 50 мол. % R2O3) и конечную (100 мол. % R2O3). Распространенность анионной нестехиометрии велика, как и катионной.
Температуры плавления и распада RF3 – 2xOx – продуктов НСАН в RF3 – зависят от содержания кислорода. Определение ДТА этих зависимостей и есть установление механизма влияния анионной нестехиометрии на фазовые превращения в RF3. Зависимость температур α ↔ β-RF3 – 2xOx от содержания кислорода у R = Gd, Tb велика и позволяет количественно определять его концентрацию. Оксофториды RF3 – 2xOx на основе tys-RF3 (R = La–Gd) имеют максимумы на кривых плавкости. В RF3 с R = Tb–Ho без тисонитовых форм этот тип стабилизируетcя образованием бертоллидов ~tys-RF3 – 2xOx, плавящихся инконгруэнтно выше RF3. Эффект стабилизации tys-RF3 – 2xOx “вверх” по температуре (+ΔTfus) меняется по ряду РЗЭ немонотонно c максимумом ~100°С в районе Gd–Tb. Замещения F1– → O2– нет в формах β-RF3 (R = Er–Lu, Y) типа β-YF3. Фазы α-RF3 – 2xOx типа α-YF3 (α-UO3) плавятся инконгруэнтно и распадаются при высоких температурах. Продукты НСАН в RF3 могут быть источником новых фтор-кислородных материалов.
Автор выражает благодарность Н.И. Сорокину и Д.Н. Каримову за полезные обсуждения, Е.А. Кривандиной и З.И. Жмуровой за предоставленные кристаллы.
Работа выполнена при финановой поддержке Министерства науки и высшего образования РФ в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН.
Список литературы
Соболев Б.П. // Кристаллография. 2012. Т. 57. № 3. С. 490.
Соболев Б.П., Сорокин Н.И. // Кристаллография. 2014. Т. 59. № 6. С. 889.
Sobolev B.P. The Rare Earth Trifluorides. Part 1. The High Temperature Chemistry of the Rare Earth Trifluorides, Ed.: Institut d’Estudis Catalans. Barcelona, Spain. 2000. 520 p.
Sobolev B.P. The Rare Earth Trifluorides. Part 2. Introduction to Materials Science of Multicomponent Fluoride Crystals, Ed.: Institut d’Estudis Catalans, Barcelona. Spain. 2001. 460 p.
Соболев Б.П. // Кристаллография. 2020. Т. 65. № 5. С. 705.
Sobolev B.P., Fedorov P.P., Steinberg D.V. et al. // J. Solid State Chem. 1976. V. 17. № 2. P. 191.
Sobolev B.P., Fedorov P.P., Seiranian K.B., Tkachenko N.L. // J. Solid State Chem. 1976. V. 17. № 2. P. 201.
Ranieri I.M., Baldochi S.L., Klimm D. // J. Solid State Chem. 2008. V. 181 P. 1070.
Соболев Б.П., Федоров П.П., Галкин А.К. и др. // Рост кристаллов. М.: Наука, 1980. Т. 13. С. 198.
Fedorov P.P. // Mater. Res. Bull. 2012. V. 47. P. 2700.
Warf J.C., Cline W.D., Tevebaugh R.D. // Analyt. Chem. 1954. V. 26. № 2. P. 2342.
Banks C.V., Burke K.E., O’Lauglin J.W. // Analyt. Chim. Acta. 1958. V. 19. № 3. P. 239.
Бацанова Л.Р. // Успехи химии. 1971. Т. 40. № 6. С. 945.
Zachariasen W.H. // Acta Cryst. 1951. V. 4. № 2. P. 231.
Garton G., Wanklyn B.M. // J. Mater. Sci. 1968. V. 3. № 4. P. 395.
Осико В.В., Соболь А.А., Тимошечкин М.И. и др. // Труды ФИАН. М.: Наука, 1972. Т. 60. С. 71.
Lee J., Zhang Q., Saito F. // J. Am. Ceram. Soc. 2001. V. 84. P. 863.
Соболев Б.П., Свиридов И.А., Фадеева В.И. и др. // Кристаллография. 2008. Т. 53. № 5. 919.
Reddy M.A., Fichtner M. // J. Mater. Chem. 2011. V. 21. P. 17059.
Greis O., Haschke J.M. // Handbook on the Physics and Chemistry of Rare Earths / Eds. Gscheidner K.A., Eyring L.R. Amsterdam; N.-Y.; Oxford. 1982. V. 5. Ch. 45. P. 387.
Spedding F.H., Henderson D.C. // J. Chem. Phys. 1971. V. 54. № 6. P. 2476.
Spedding F.H., Beaudry B.J., Henderson D.C., Moorman J. // J. Chem. Phys. 1974. V. 60. № 4. P. 1578.
Greis O., Cader M.S.R. // Thermochim. Acta. 1985. V. 87. № 1. P. 145.
Thoma R.E., Brunton G.D. // Inorg. Chem. 1966. V. 5. № 11. P. 1937.
Carlson O.N., Schmidt F.A. // The Rare Earths / Eds. Spedding F.H., Daane A. H. Wiley, New York. 1961. Ch. 6. P. 77.
Pastor R.C., Robinson M. // Mat. Res. Bull. 1974. V. 9. № 5. P. 569.
Friedman H.A., Hebert G.M., Thoma R.E. ORNL-Report-3373, Contract № W-7405-eng-26, 1963.
Thoma R.E., Weaver C.F., Friedman H.A. et al. // J. Phys. Chem. 1961. V. 65. № 7. P. 1096.
Thoma R.E., Brunton G.D., Penneman R.A. et al. // Inorg. Chem. 1970. V. 9. № 5. P. 1096.
Thoma R.E. // Rev. Chim. Miner. 1973. V. 10. № 1–2. P. 363.
Thoma R.E., Herbert G.M., Insley H. et al. // Inorg. Chem. V. 2. № 5. P. 1005.
Thoma R.E., Insley H., Hebert G.M. // Inorg. Chem. 1966. V. 5. № 7. P. 1222.
Barton C.J., Gilpatrick L.O., Insley H. // J. Inorgan. Nucl. Chem. 1974. V. 36. № 6. P. 1271.
Barton C.J., Gilpatrick L.O., Brunton G.D. et al. // J. Inorgan. Nucl. Chem. 1971. V. 33. № 2. P. 53.
Barton C.J., Bredig M.A., Gilpatric L.O., Fredricksen J.A. // J. Inorgan. Nucl. Chem. 1970. V. 9. № 2. P. 307.
Багдасаров Х.С., Калинин П.Б., Лапскер Я.Э. и др. // Завод. лаб. 1973. Т. 39. С. 494.
Spedding F.H., Sanden B., Beaudry B.J. // J. Less Common Metals. 1973. V. 31. P. 1.
Ипполитов Е.Г., Маклачков А.Г. // Изв. АН СССР. Неорган. материалы. 1970. Т. 6. № 1. С. 146.
Жигарновский Б.В., Ипполитов Е.Г. // Изв. АН СССР. Неорган. материалы. 1970. Т. 6. № 9. С. 1598.
Gorbulev V.A., Fedorov P.P., Sobolev B.P. // J. Less Common Metals. 1980. V. 76. P. 55.
Васильченко В.Г., Коноплянников А.В., Косматов С.Л. и др. // Приборы и техника эксперимента. 1991. № 3. С. 198.
De Kozak A., Samouel M., Chretien A. // Rev. Chim. Miner. 1973. V. 10. № 1. P. 259.
Mansmann M. // Z. Kristallogr. 1965. B. 122. № 5/6. S. 375.
Соболев Б.П., Сейранян К.Б. // Кристаллография. 1975. Т. 20. Вып. 4. С. 763.
Федоров П.П., Соболев Б.П. // Кристаллография. 1975. Т. 20. Вып. 5. С. 949.
Соболев Б.П., Ткаченко Н.Л. // Кристаллография. 1975. Т. 20. Вып. 6. С. 1204.
Соболев Б.П., Федоров П.П. // Кристаллография. 1973. Т. 18. Вып. 3. С. 624.
Бандуркин Г.А., Джуринский Б.Ф., Таннаев И.В. // Докл. АН СССР. 1966. Т. 168. № 6. С. 1315.
De Kozak A., Samouel M., Erb A. // Rev. Chim. Miner. 1980. V. 17. P. 440.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография