Кристаллография, 2021, T. 66, № 3, стр. 482-487
Синтез, рост, структура и свойства кристаллов трис(этилендиамин)никель(II)дихлорида дигидрата [Ni(H2NCH2CH2NH2)3]Cl2 ⋅ 2H2O
О. Б. Зайнуллин 1, *, Н. И. Сорокина 1, В. А. Коморников 1, И. С. Тимаков 1, А. Э. Волошин 1
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
* E-mail: OlegBZainul@yandex.ru
Поступила в редакцию 05.06.2020
После доработки 18.08.2020
Принята к публикации 08.09.2020
Аннотация
Рассмотрены условия получения кристаллов [Ni(H2NCH2CH2NH2)3]Cl2 ⋅ 2H2O ([Ni(en)3]Cl2 ⋅ 2H2O) из водных растворов. Проведено комплексное исследование полученных кристаллов методами порошковой и монокристальной рентгеновской дифракции, дифференциальной сканирующей калориметрии и оптической спектроскопии.
ВВЕДЕНИЕ
Оптические фильтры, предназначенные для выделения определенного спектрального диапазона, находят применение в спектральной измерительной аппаратуре, гиперспектрометрах и приборах “солнечно-слепой технологии” (детекторы ближнего УФ-спектра).
Кристаллы α-NiSO4 ⋅ 6H2O (NSH) и никелевые соли Туттона с общей формулой Me2Ni(SO4)2 ⋅ ⋅ 6H2O (Me = K, NH4, Rb или Cs) являются эффективными оптическими УФ-фильтрами [1]. Полосчатый спектр поглощения данных кристаллов обусловлен наличием в их структурах октаэдрического комплексного гексааквакатиона [Ni(H2O)6]2+ [2, 3]. Полоса поглощения этих кристаллов вблизи 400 нм соответствует энергетическому переходу 3A2g → 3T1g (P) между расщепленными d-орбиталями. Расщепление d-орбиталей в комплексном ионе, в свою очередь, определяется конфигурацией и силой кристаллического поля лиганда, входящего в его состав. Таким образом, величина энергетического перехода и соответствующая ей полоса поглощения могут быть изменены посредством изменения лиганда, координированного к атому Ni.
В [4], как и, например, в [5–8], было показано, что замещение молекул воды в составе гексааквакатиона [Ni(H2O)6]2+ ионами хлора позволяет в некоторой степени изменять спектр пропускания кристалла без изменения набора полос пропускания/поглощения. Помимо изменения силы кристаллического поля координированного лиганда еще одним способом влияния на оптические свойства получаемых кристаллов является изменение дентатности лиганда.
Таким образом, цель настоящего исследования – получение кристаллов трис(этилендиамин)никеля(II)дихлорида дигидрата ([Ni(H2NCH2 CH2NH2)3]Cl2 ⋅ 2H2O) и изучение их свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. Для приготовления трис(этилендиамин)никеля(II)дихлорида дигидрата ([Ni(H2NCH2 CH2NH2)3]Cl2 ⋅ 2H2O или кратко [Ni(en)3]Cl2 ⋅ ⋅ 2H2O) использовали хлорид никеля(II) гексагидрат NiCl2 ⋅ 6H2O марки “Ч”, ГОСТ 4038-79), 1,2-диаминоэтан (этилендиамин) H2NCH2CH2NH2, “Sigma-Aldrich”, ≥99%).
Синтез исследуемого вещества [9] осуществляли в минимальном количестве дистиллированной воды, исходя из уравнения
(1)
$\begin{gathered} {\text{NiC}}{{{\text{l}}}_{2}} \cdot 6{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 3{{{\text{H}}}_{{\text{2}}}}{\text{NC}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{N}}{{{\text{H}}}_{2}} \to \\ \to [{\text{Ni}}{{({{{\text{H}}}_{{\text{2}}}}{\text{NC}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{N}}{{{\text{H}}}_{{\text{2}}}})}_{{\text{3}}}}]{\kern 1pt} {\text{C}}{{{\text{l}}}_{2}} \cdot 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} \cdot 4{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $После завершения реакции кристаллический препарат фильтровали от раствора с обязательной проверкой фазового состава методом порошкового рентгенофазового анализа (РФА). Данный синтезированный препарат применяли в качестве исходного реактива для всех дальнейших этапов исследования (приготовление ростовых растворов, термических измерений и т.д.).
Определение температурной зависимости растворимости проводили методом массового определения содержания соли в одинаковых аликвотах насыщенного раствора. В кристаллизационной установке, обеспечивающей термостатирование и перемешивание раствора, готовили насыщенный раствор таким образом, чтобы температура насыщения незначительно превышала максимальную (40°C) в исследуемом интервале. После чего температуру раствора повышали до 50°C до полного растворения осадка. После этого температуру раствора снижали до значения в 40°С для спонтанного формирования равновесного осадка. После вымешивания раствора при нужной температуре в течение 24 ч проводили отбор 1 мл аликвоты со взвешиванием. Затем аликвоту высушивали до постоянной массы при t ~ 80°C и по разности масс определяли соотношение растворителя и соли в насыщенном растворе.
Рост кристаллов. Монокристалл [Ni(en)3]Cl2 ⋅ ⋅ 2H2O получали из водного раствора в два этапа методами изотермического упаривания и управляемого снижения температуры. На первом этапе в открытом цилиндрическом сосуде проводили упаривание изначально ненасыщенного раствора при комнатной температуре в течение трех суток. Образовавшиеся в результате кристаллы размером до 1 × 1 × 1 мм использовали в качестве затравок. На втором этапе проводили кристаллизацию из насыщенного раствора с использованием затравки на цилиндрическом подвесе в течение недели в соответствии с установленной температурной зависимостью растворимости. Так были получены кристаллы необходимых для оптических исследований размеров.
Рентгеновские дифракционные методы. Рентгенофазовый анализ размолотых в порошок монокристаллических образцов выполнен при комнатной температуре на настольном рентгеновском дифрактометре Rigaku Miniflex 600 (Япония) (рентгеновская трубка с медным анодом, непрерывный режим съемки – 1.5 град/мин, величина шага 0.02° в интервале углов 2θ 5°–70°, без вращения образца) в обычной атмосфере.
Рентгеновский дифракционный экспериментальный материал для монокристаллов [Ni(en)3]Cl2 ⋅ 2H2O был получен при комнатной температуре на рентгеновском дифрактометре Xcalibur Eos S2 (Rigaku Oxford Diffraction), оборудованном двухкоординатным ССD-детектором. Источник рентгеновского излучения Mo-анод (MoKα; λ = 0.71073 нм). Двумерный CCD-детектор Sapphire S3 (2048 × 2048 пикселей, размер пикселя 37 мкм). Гониометр с каппа-геометрией KM-4, точность установки углов 0.005°–0.01°.
Термические измерения. Методами дифференциальной сканирующей калориметрии (ДСК) и термогравиметрического анализа (ТГА) измерены тепловые свойства исследуемых кристаллов.
Эксперименты проводили в потоке сухого азота на приборе синхронного термического анализа STA 449 F1 Jupiter (NETZSCH, Германия) в температурном интервале 275–500 K. Скорость изменения температуры составляла 2 град/мин.
Оптические измерения проводили на автоматическом двулучевом спектрофотометре Cary 300 UV-Vis в диапазоне длин волн 200–800 нм со скоростью 200 нм/мин. При измерении спектров растворов использовали стандартные кварцевые кюветы с длиной хода луча спектрофотометра, равной 10 мм.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
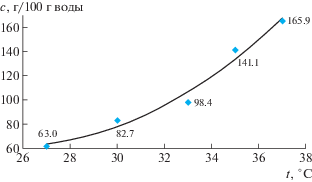
Изученная температурная зависимость растворимости [Ni(en)3]Cl2 ⋅ 2H2O в воде в температурном интервале 27–37°C представлена на рис. 1. Она является прямой, монотонно возрастающей с увеличением температуры, лучше описывается квадратичной, нежели линейной функцией.
Довольно высокие значения растворимости в изученном температурном интервале, с одной стороны, облегчают работу по получению кристаллов, так как это позволяет обходиться малыми объемами растворов для выращивания кристаллов. С другой стороны, высокая растворимость обусловливает очень интенсивную окраску растворов и в значительной мере осложняет визуальный контроль процесса роста кристалла. Эти обстоятельства заставляют прибегать к использованию схемы кристаллизатора с подвешенным затравочным кристаллом для предотвращения сращивания целевого кристалла со спонтанно образовавшимися в процессе роста паразитными кристаллами.
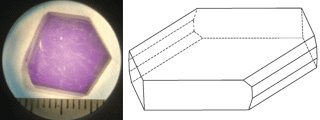
Упомянутым методом двухстадийной кристаллизации были получены образцы монокристалла [Ni(en)3]Cl2 ⋅ 2H2O размером до 7 × 5 × 2 мм в виде плоских псевдогексагональных пластинок, рис. 2.
Естественная огранка кристалла образована набором пинакоидов, характерным для моноклинной сингонии. Низкое качество кристалла (наличие макровключений в объеме кристалла, двойникование) связано с низким качеством исходного затравочного кристалла. Получить более качественный затравочный кристалл можно из сектора более крупного кристалла, что становится возможным на второй и последующих итерациях роста. Вторая сложность выращивания, связанная с высокой интенсивностью окраски насыщенного раствора, может быть скомпенсирована посредством добавки к водному раствору высаливателя, снижающего растворимость вещества в растворе, например спирта или диметилформамида. Установление влияния качества затравочного кристалла и добавок органических растворителей к ростовому раствору на получение кристаллов [Ni(en)3]Cl2 ⋅ 2H2O выходит за рамки данного исследования и будет проведено отдельно.
Для исследования кристаллической структуры отбирали оптически прозрачные монокристаллы после первой стадии кристаллизации размером не более 0.5 мм и подвергали первичному рентгеноструктурному исследованию. Для последующих экспериментов выбрали один образец, для которого профили дифракционных пиков и сходимость интенсивностей эквивалентных по симметрии дифракционных отражений оказались наилучшими. Полный дифракционный эксперимент для монокристалла [Ni(en)3]Cl2 ⋅ 2H2O был проведен при комнатной температуре.
Интегрирование пиков и LP-коррекцию проводили по программе, входящей в пакет математического обеспечения дифрактометра [10]. Все остальные кристаллографические расчеты (ввод поправки на аномальное рассеяние, усреднение эквивалентных по симметрии отражений) осуществляли с использованием комплекса программ Jana2006 [11]. Модель атомной структуры кристаллов [Ni(en)3]Cl2 ⋅ 2H2O, состоящая из атомов никеля, хлора, азота, кислорода и углерода, получена методом charge flipping по программе Superflip [12], входящей в состав комплекса программ Jana2006. Кристаллографические характеристики, условия рентгенодифракционного эксперимента и результаты уточнения структуры приведены в табл. 1. Поиск элементарной ячейки в исследуемом монокристалле завершился выбором моноклинной ячейки с параметрами, указанными в табл. 1.
Таблица 1.
Кристаллографические характеристики, данные эксперимента и уточнения структуры [Ni(en)3]Cl2 ⋅ 2H2O
| [Ni(N2C2H8)3]Cl2 ⋅ 2H2O ([Ni(en)3]Cl2 ⋅ 2H2O) | |
| Т, K | 293 |
| Пр. гр. | C2/c |
| Z | 12 |
| а, Å | 26.1571(8) |
| b, Å | 13.8791(5) |
| c, Å | 12.8839(5) |
| β, град | 93.202(3) |
| V0, Å3 | 4670.0(3) |
| Число отражений: измеренных/независимых/с I > 3σ(I) | 231 876/7064/3404 |
| Nx | 304 |
| R/wR | 0.043/0.040 |
| S | 2.80 |
| Δρmin/Δρmax, э/Å3 | –0.26/0.35 |
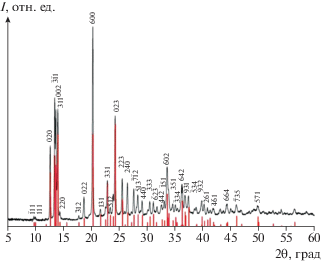
Для монокристалла [Ni(en)3]Cl2 ⋅ 2H2O после уточнения структурных параметров 26 атомов (двух атомов никеля, четырех атомов хлора, девяти атомов азота, девяти атомов углерода и двух атомов кислорода) методом наименьших квадратов в полноматричном варианте по экспериментальным данным, полученным при комнатной температуре, были построены и проанализированы карты разностных синтезов электронной плотности в окрестности атомов азота, углерода и кислорода. Отметим, что на картах разностных синтезов электронной плотности, построенных по экспериментальным данным, выявлены пики остаточной электронной плотности, соответствующие только 22 атомам водорода, недостающие 18 атомов водорода были приписаны согласно их геометрическим параметрам. Тепловые параметры атомов никеля, хлора, азота, кислорода и углерода уточнены в анизотропном приближении атомов смещения, а атомов водорода – в изотропном. Полученные структурные данные позволили проиндицировать имевшиеся порошковые рентгеновские профили размолотых в порошок монокристаллов, рис. 3.
На рис. 4 приведены проекции структуры в пределах одной элементарной ячейки [Ni(en)3]Cl2 ⋅ ⋅ 2H2O при комнатной температуре.
Рис. 4.
Проекции структуры [Ni(en)3]Cl2 ⋅ 2H2O на плоскости (001) (а) и (100) (б), а также координационное окружение атомов никеля (в). Показано искажение октаэдров [Ni(en)3]2+.
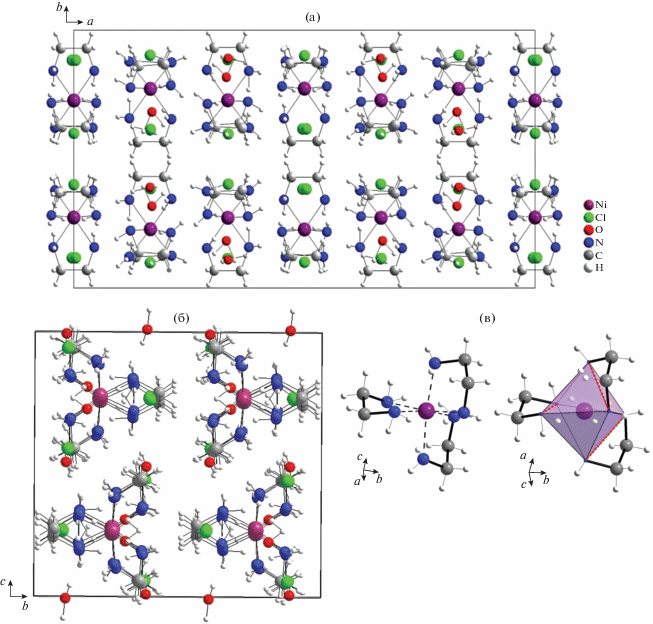
Информация об исследованной структуре (координаты базисных атомов, значения заселенности атомами кристаллографических позиций q и эквивалентные параметры атомных смещений) депонирована в Кембриджский банк данных органических структур CSD (депонент № 610673). Полученные результаты хорошо согласуются с данными [13] и подтверждают искажение октаэдрического окружения атома Ni, образованное тремя бидентатными en-лигандами.
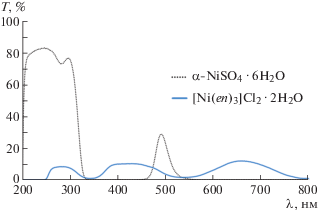
На рис. 4 показан комплексный катион [Ni(en)3]2+ в виде октаэдра, в вершинах которого находятся шесть атомов азота en-лигандов. Такая конфигурация комплексного катиона приводит к тому, что три из 12 ребер октаэдра образованы атомами азота, относящимися к одному и тому же en-лиганду, и имеют меньшую длину относительно оставшихся девяти (отмечены на рисунке пунктирными линиями). Это искажение обусловливает наблюдаемый оптический спектр пропускания кристалла, рис. 5. Данный спектр характеризуется тремя максимумами поглощения при 340, 540 нм и максимумом, лежащим за пределами измерительного диапазона прибора (800 нм).
Данное изменение спектра в сравнении со спектрами кристаллов α-NiSO4 ⋅ 6H2O или NiCl2 ⋅ ⋅ 6H2O связано со снятием вырождения eg- и t2g-уровней, обусловленного деформацией октаэдрического окружения Ni. Более точное отнесение типов электронных переходов наблюдаемым полосам поглощения требует более подробного эксперимента.
Термический анализ, проведенный на монокристаллическом образце, выявил характерную для кристаллогидратов потерю массы и соответствующий этому эндотермический эффект с максимумом при температуре ~ 109°C. Потеря массы составила ~10 мас. %, что соответствует теоретически возможному значению для процесса дегидратации с образованием безводной соли. При этом для образца, размолотого в порошок, изменение массы выражено в меньшей степени, а соответствующий этому эндотермический эффект размывается, проявляя два максимума при ~85 и ~103°C, рис. 6.
Рис. 6.
Результаты ДСК/ТГА соединения [Ni(en)3]Cl2 ⋅ ⋅ 2H2O для монокристалла и размолотого в порошок образца.
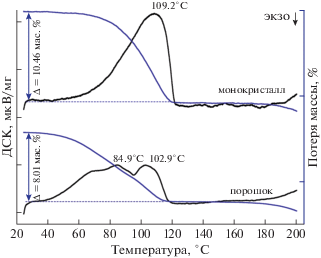
Данные различия в поведении монокристаллического и порошкового образцов могут быть связаны с механоактивацией процесса дегидратации при размоле. Иными словами, в процессе размола начинается потеря воды, и образец, помещенный в тигель, на момент начала эксперимента имеет в своем составе меньшее количество воды в сравнении с монокристаллическим образцом.
Для обоих образцов при температуре выше 170°C наблюдается начало процесса разложения, сопровождающееся потерей массы. Полученные результаты хорошо согласуются с данными [14].
Такое изменение массы образцов кристаллов [Ni(en)3]Cl2 ⋅ 2H2O, а также отсутствие тепловых эффектов и изменения массы при температуре свыше 120°C позволяют предположить, что выше данной температуры образуется соединение состава [Ni(en)3]Cl2.
Такая относительная простота получения безводного соединения [Ni(en)3]Cl2 позволяет предположить возможность получения монокристаллов данного соединения посредством кристаллизации из полярных неводных растворителей.
ВЫВОДЫ
Определена температурная зависимость растворимости соединения [Ni(en)3]Cl2 ⋅ 2H2O в воде в интервале 27–37°C. Подобраны условия кристаллизации соединения из водного раствора, получен монокристалл с размерами, достаточными для исследования оптических свойств.
Проведено исследование кристалла [Ni(en)3]Cl2 ⋅ ⋅ 2H2O методом монокристальной рентгеновской дифракции. Структура моноклинная, параметры элементарной ячейки: а = 26.1571(8), b = 13.8791(5), c = 12.8839(5) Å, β = 93.202(3)°, пр. гр. C2/c, Z = 12. Установлено искажение октаэдрического окружения атома Ni, образованное тремя бидентатными en-лигандами.
Оптический спектр полученного кристалла в интервале длин волн 200–800 нм характеризуется двумя максимумами поглощения (340 и 540 нм), что обусловлено искажением октаэдрического окружения атомов никеля в структуре кристалла.
Исследование термических свойств соединения выявило практически одностадийную потерю двух молекул воды с образованием устойчивого безводного соединения. Причем данная потеря воды довольно слабо зависит от того, монокристаллический или порошковый образец нагревается.
Работа выполнена с использованием оборудования ЦКП ФНИЦ “Кристаллография и фотоника” при поддержке Министерства науки и высшего образования РФ в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН.
Список литературы
Маноменова В.Л., Руднева Е.Б., Волошин А.Э. // Успехи химии. 2016. Т. 85. С. 585.
Grinter R., Harding M., Mason S. // Chem. Soc. A. 1970. P. 667.
Cotton F.A., Wilkinson G. // Advanced Inorganic Chemistry. Part 3. New York: Wiley-Interscience, 1999.
Зайнуллин О.Б., Волошин А.Э., Коморников В.А. и др. // ФТТ. 2019. Т. 61. № 12. С. 2408.
Kleinberg R. // J. Chem. Phys. 1969. V. 50. № 11. P. 4690.
Kleinberg R. // J. Appl. Phys. 1967. V. 38. № 3. P. 1453.
Ptasiewicz-Bak H., Olovsson I., McIntyre G.J. // Acta Cryst. B. 1999. V. 55. P. 830.
Joji Mizuno // J. Phys. Soc. Jpn. 1961. V. 16. № 8. P. 1574.
State H.M. // Inorg. Synth. 1950. V. 6. P. 200.
Rigaku Oxford Diffraction, CrysAlisPro Software System, Version 1.171.39.46. 2018. Rigaku Corporation, Oxford, UK.
Petricek V., Dusek M., Palatinus L. // Z. Kristallogr. 2014. B. 229. № 5. S. 345.
Palatinus L. // Acta Cryst. A. 2004. V. 60. P. 604.
Hai Feng, Bing Tu, Ya Qin Li et al. // Acta Cryst. E. Online. 2006. V. 62. P. 1405.
House J.E. Jr., Tahir F.M. // Thermochim. Acta. 1987. V. 118. P. 191.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография