Кристаллография, 2021, T. 66, № 6, стр. 902-912
Модельная система для изучения транспорта противовирусного препарата
Я. А. Забродская 1, 2, 3, 4, *, **, Ю. Е. Горшкова 5, 6, А.-П. С. Шурыгина 3, А. В. Бродская 3, Д. Е. Бобков 3, 7, А. Н. Горшков 3, А. Б. Бондаренко 3, Д. В. Лебедев 1, 4, В. В. Егоров 1, 4, 8
1 НИЦ “Курчатовский институт” – ПИЯФ
Гатчина, Россия
2 Санкт-Петербургский политехнический университет Петра Великого
Санкт-Петербург, Россия
3 Научно-исследовательский институт гриппа им. А.А. Смородинцева Минздрава России
Санкт-Петербург, Россия
4 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
5 Объединенный институт ядерных исследований
Дубна, Россия
6 Институт физики, Казанский федеральный университет
Казань, Россия
7 Институт цитологии РАН
Санкт-Петербург, Россия
8 Институт экспериментальной медицины
Санкт-Петербург, Россия
* E-mail: yana@zabrodskaya.net
** E-mail: zabrodskaya_ya@pnpi.nrcki.ru
Поступила в редакцию 09.09.2020
После доработки 08.04.2021
Принята к публикации 09.04.2021
Аннотация
Установление механизма действия потенциальных лекарственных субстанций является неотъемлемым этапом разработки новых лекарственных препаратов. Показано взаимодействие противовирусного пептида PB16–14 с липидными мембранами в клеточной и бесклеточной модельных системах. Проникновение флуоресцентно меченого аналога пептида в клетки в течение 15 мин показано методами проточной цитофлуориметрии и конфокальной микроскопии. Особенности взаимодействия исследуемого пептида с клеточными мембранами изучены методами малоуглового рассеяния нейтронов, атомно-силовой микроскопии и динамического светорассеяния. Показано, что в присутствии пептида (в буфере 5% этанола/5% ДМСО/ФСБ) наблюдается увеличение размера модельных липосом (ФХ/ФГ) с одновременным незначительным изменением ζ-потенциала, что может быть интерпретировано как следствие изменения поверхностного заряда и свидетельствовать о способности пептида к взаимодействию с липидным бислоем, в том числе не исключая его проникновение внутрь мембраны. Полученные данные могут быть использованы как при изучении механизма транспорта терапевтического пептида, так и для разработки средств доставки лекарственных препаратов.
ВВЕДЕНИЕ
Воздействие лекарственных препаратов на основе пептидов можно считать наиболее специфичными как при взаимодействии с белками, так и при модулировании белок-белковых взаимодействий. Однако такие препараты могут как нарушать взаимодействия, лежащие в основе возникновения и развития каких-либо патологических состояний, так и приводить к возникновению способности белков к новым взаимодействиям [1], что может быть использовано в терапевтических целях. Белок-белковые взаимодействия лежат в основе большей части биологических процессов, включая комплексы структурных белков, регуляцию транскрипции, трансляции и репликации. В то же время изменение белок-белковых взаимодействий и возникновение способности белков к гомоолигомеризации являются причиной различных заболеваний, в том числе онкологических и нейродегенеративных [2].
Важным этапом при разработке лекарственных препаратов является выяснение их механизма действия [3]. При этом необходимо не только определить мишень и показать достаточную специфичность, но и доказать, что разрабатываемый препарат способен достичь, как минимум, в модельной системе той мишени, на которую он направлен.
В данной работе рассматривается противовирусный пептидный препарат (PB16–14), описанный в [4, 5]. Показано, что пептид PB16–14 способен воздействовать на N-концевой участок субъединицы PB1 полимеразного комплекса вируса гриппа А, вызывая изменение его конформации. Это приводит к нарушению структуры нативного полимеразного комплекса вируса гриппа, что, в свою очередь, делает невозможной репликацию вируса и обусловливает противовирусный эффект пептида [6, 7]. В контексте применения данного пептида в качестве активного компонента потенциального противовирусного препарата необходимо показать, что он способен проникать в клетки, а также установить механизм проникновения, поскольку репликация вируса гриппа и работа полимеразного комплекса происходит внутри инфицированной клетки.
Одним из барьеров, преодолеваемых данным пептидом на пути к белковой мишени, является плазматическая мембрана. Биологическая мембрана (БМ) – структурный элемент клетки, представляющий собой динамичную функциональную оболочку, которая отделяет клетку от внешней среды (а клеточные органеллы от цитоплазмы клетки) и осуществляет важные клеточные процессы. Основными компонентами БМ являются липиды (фосфолипиды, гликолипиды и др.), белки и холестерин, каждый из которых выполняет важную роль в биофизических и биохимических процессах. Поскольку фосфолипидный бислой – это структурная основа биологических мембран, то крайне важно понять не только механизм пептид-липидного взаимодействия, но и создать методические основы для изучения проникновения противовирусного пептида PB16–14 внутрь липидного бислоя.
На первом этапе изучения механизма взаимодействия пептида с липидными мембранами и его проникновения в клетку были использованы модельные однослойные липосомы, состоящие из нейтральных фосфолипидов ДМФХ, а также смеси ДПФХ и ДПФЭ (80/20), которые являются основными компонентами мембран млекопитающих [8]. Поскольку пептид PB16–14 имеет положительный заряд, для установления роли электростатического взаимодействия между пептидом и липидными мембранами использовали отрицательно заряженные фосфолипидные бислои ДМФХ/ДМФГ (70/30) [9].
Цель данного исследования – показать возможность проникновения пептида PB16–14 внутрь клеток, а также изучить механизм проникновения пептида PB16–14 через клеточную мембрану на модельной системе, используя методы проточной цитофлуориметриии, конфокальной микроскопии и малоуглового рассеяния нейтронов (МУРН).
МАТЕРИАЛЫ И МЕТОДЫ
Материалы. Пептиды PB16–14 (Ac-TLLFLKVPA-NH2) и FITC-PB16–14 (FITC-TLLFLKVPA-NH2) были синтезированы в ООО “Пептидные технологии” (Санкт-Петербург, Россия). Чистота составила более 95%.
Клетки A549 (карциномы легкого человека) получены из коллекции ФГБУ “НИИ гриппа им. А.А. Смородинцева” Минздрава России. В экспериментах по проточной цитофлуориметрии использовали однодневный монослой клеток A549, выращенный в лунках шестилуночного планшета, каждая из которых содержала примерно 106 клеток. Перед экспериментом клетки отмывали от бычьей эмбриональной сыворотки фосфатно-солевым буфером (ФСБ, Sigma). В экспериментах по конфокальной микроскопии использовали однодневный монослой клеток A549, выращенный в лунках 24-луночного планшета на круглых покровных стеклах (Menzel).
Для приготовления липосом использовали нейтральные фосфолипиды ДПФЭ (1,2-дипалмитоил-sn-глицеро-3-фосфадилэтаноламин), ДПФХ (1,2-дипалмитоил-sn-глицеро-3-фосфадилхолин), ДМФХ (1,2-димиристоил-sn-глицеро-3-фосфадилхолин) и отрицательно заряженные фосфолипиды ДМФГ (1,2-димиристоил-sn-глицеро-3-фосфоглицерин) производства Sigma-Aldrich (Merck).
Использовали ФСБ, приготовленный на дистиллированной (18.2 MΩ·cм, Merck Millipore) или дейтерированной воде (НИЦ «Курчатовский институт» – ПИЯФ) без или с добавлением дейтерированного этанола (этанол-d6, Fluka AG, Buchs, Switzerland) и дейтерированного диметилсульфоксида (ДМСО-d6, Sigma-Aldrich).
Проточная цитофлуориметрия. Сухой пептид PB16–14 был растворен в буфере 5% этанол/5% ДМСО (недейтерированные), разбавлен в 10 раз средой альфа-MEM (Биолот) без бычьей эмбриональной сыворотки до конечной концентрации 33 мкМ и добавлен к клеткам A549 (по 5 мл в каждую лунку). В контрольные лунки была внесена среда альфа-MEM без сыворотки, содержащая 0.5% этанол/0.5% ДМСО. Таким образом, количество молекул пептида, приходящееся на одну клетку, составило около 1012. Пептид вносили в лунки шестилуночного планшета за 60, 30, 15, 5 и 1 мин до остановки эксперимента, после чего клетки инкубировали в течение соответствующего времени в СО2-инкубаторе (в атмосфере 5%-ного CO2) при температуре 37°С. Клетки A549 в лунках без добавления пептида (контрольные клетки) инкубировали в течение 60 мин. После двукратной отмывки ФСБ к клеткам добавили 300 мкл раствора трипсин-ЭДТА. Отмытые от трипсина клетки ресуспендировали в ФСБ и разделили на три аликвоты (технические повторы) до концентрации 0.5 × 105 клеток/мл для проведения измерений на проточном цитофлуориметре.
Образцы анализировали с использованием проточного цитофлуориметра Navios (Beckman Coulter), оснащенного диодным лазером с длиной волны возбуждения 488 нм, для детектирования клеток, положительных по флуоресценции FITC. По диаграммам прямого и бокового рассеяния была определена популяция клеток А549, имеющих одинаковые размер и форму; в каждом образце проанализировано не менее 105 клеток. Клетки, положительные по флуоресценции FITC, принимали за содержащие пептид. Математическое описание проводили с помощью программного обеспечения Navios Software v.1.2 и Kaluza v.1.2, Beckman Coulter. Данные визуализировали с использованием программного обеспечения Origin2015.
Конфокальная микроскопия. К клеткам A549 добавляли пептид FITC-PB16–14 до конечной концентрации 33 мкМ. После инкубации в течение 1 ч при 37°С, 5% CO2, клетки отмывали ФСБ и фиксировали раствором 4%-ного параформальдегида в ФСБ. Препараты клеток заключали в раствор, препятствующий выгоранию флуоресцентного красителя (Mounting medium, Sigma, США), и исследовали с помощью лазерного сканирующего микроскопа Leica TSC SP8, оснащенного гибридным детектором с повышенной чувствительностью. Флуоресценцию FITC возбуждали при помощи аргонового лазера (488 нм) и регистрировали в области длины волн флуоресценции 510–550 нм. Использовали объектив 63×, получали изображение размером 1024 × 1024 пикселя. Съемку и обработку изображений проводили в программе Leica Application Suite X.
Малоугловое рассеяние нейтронов. Для приготовления липосом использовали фосфолипиды ДМФХ, ДПФХ, ДМФГ и ДМФЭ. Сухой липид ДМФХ (ФХ) или смеси липидов ДМФХ/ДМФГ (ФХ/ФГ) в соотношении 70/30, ДПФХ/ДПФЭ (ФХ/ФЭ) в соотношении 80/20 растворяли в ФСБ, приготовленном на D2O (pD = 7.4). Концентрация липидов в буфере составляла 2 мас. %. Для гомогенизации раствора использовали шейкер. Однородный раствор мультислойных везикул (МСВ) был получен методом замораживания–оттаивания в диапазоне t = ±20°С от температуры главного фазового перехода (tm) используемых липидов. Процедуру повторяли 6 раз. Однослойные везикулы (ОСВ) были приготовлены путем пропускания приготовленного раствора МСВ через поликарбонатные фильтры диаметром 50 нм с помощью экструдера (Hamilton Co., Reno, Nevada, USA) при температуре выше tm. После 25 повторений получался стабильный раствор ОСВ.
Полученные липосомы смешивали в равных объемах с пептидом в концентрации 1 мг/мл, растворенном в смеси этанол-d6/ДМСО-d6/ФСБ. В качестве контроля использовали липосомы, к которым добавляли только растворитель. Конечная концентрация липида составляла 1 мас. %. В работе использовали два различных состава растворителя: конечная концентрация этанол-d6/ДМСО-d6 составляла 5%/5% (обозначены ФХ/ФГ_5-5, ФХ/ФЭ_5-5) либо 2.5%/2.5% (обозначены ФХ/ФГ_2-2). Для оценки влияния растворителя на полученные липосомы зарегистрировали спектры исходных липосом в ФСБ и спектры липосом, к которым был добавлен растворитель ДМСО-d6/ФСБ или этанол-d6/ДМСО-d6/ФСБ.
Измерения проводили на высокопоточном реакторе ИБР-2, спектрометр ЮМО (ОИЯИ, г. Дубна, Россия), с использованием двух детекторов методом времени пролета [10, 11] в диапазоне переданного импульса 0.005–0.5 Å–1. Первичную обработку экспериментальных данных проводили в программе SAS [12], позволяющей нормировать полученный спектр на независимый ванадиевый рассеиватель, вычитать данные фонового образца [13]. Образцы в кварцевых кюветах помещали в термостатический бокс. Измерения проводили 20 мин при 37°С для всех исследуемых систем.
В общем случае рассеяние от монодисперсных центросимметричных частиц имеет вид
где ${{I}_{0}} = n{{V}^{2}}{{(\Delta {{\rho }})}^{2}}$ – интенсивность рассеяния в нулевой угол, q – переданный импульс, n – объемная концентрация частиц c объемом V, ${{\Delta \rho }} = {{{{\rho }}}_{s}} - {{{{\bar {\rho }}}}_{m}}$ – контраст между плотностями длин рассеяния растворителя и липосом, $P(q) \equiv {{F}^{2}}(q)$ – квадрат форм-фактора, S(q) – структурный фактор, описывающий взаимодействие между частицами, bkg – остаточный некогерентный фон, имеющий место в эксперименте по рассеянию нейтронов. Для сильно разбавленных и слабо взаимодействующих между собой частиц, какими являются фосфолипидные ОСВ с массовой долей ≤2 мас. %, S(q) = 1 [14, 15]. В первом приближении ОСВ представляют собой полые сферы с оболочкой (липидный бислой), разделяющей внутреннюю и внешнюю среду. Таким образом, рассеяние на ОСВ будет описываться форм-фактором, нормированным на объем оболочки, сформированной липидным бислоем (Vb) [16]:(2)
$\begin{gathered} P(q) = \frac{\phi }{{{{V}_{b}}}}\left[ {\frac{{3{{V}_{{{\text{in}}}}}({{{{\rho }}}_{s}} - {{{{{\bar {\rho }}}}}_{m}}){{J}_{1}}(q{{R}_{{{\text{in}}}}})}}{{q{{R}_{{{\text{in}}}}}}}} \right. + \\ + \;{{\left. {\frac{{3{{V}_{{v}}}({{{{{\bar {\rho }}}}}_{m}} - {{{{\rho }}}_{s}}){{J}_{1}}(q{{R}_{{v}}})}}{{q{{R}_{{v}}}}}} \right]}^{2}} + bkg, \\ \end{gathered} $Структурные параметры ОСВ получены в результате аппроксимации экспериментальных спектров моделью (2) в программе SasView 4.2.2 [17].
Толщину липидного бислоя T определяли с точностью до 1 Å [18] с использованием приближения Кратки–Порода:
где радиус гирации ${{R}_{t}} = \sqrt { - \operatorname{tg} \alpha } $ при построении зависимости $\ln (I{{q}^{2}}){v}s{{q}^{2}}$, тогдаАтомно-силовая микроскопия (АСМ). Для исследования морфологии методом АСМ образцы готовили по стандартной методике [20]. Раствор исходного образца (50 мкл), приготовленного по процедуре, описанной в разделе МУРН, был разбавлен 3 мл ФСБ для уменьшения концентрации липосом в растворе. 50 мкл приготовленного образца помещали на свежерасщепленную подложку из слюды, инкубировали 3 мин для адсорбции везикул из раствора на поверхности слюды, после чего осторожно отмывали дистиллированной водой без воздействия на образец воздуха для удаления свободных липосом. Образцы высушивали при комнатной температуре в течение 1 ч. Измерения топографии поверхности образца и фазы проводили в полуконтактном режиме с использованием зонда NSG01 на атомно-силовом микроскопе NTEGRA PRIMA (NT-MDT Spectrum Instruments, Зеленоград, Россия). Обработку изображений и получение распределения частиц по размерам осуществляли в программе Image Analysis P9, версия 3.5 (NT-MDT Spectrum Instruments).
Измерение дзета-потенциала. Для определения стабильности исследуемых систем проводили измерение дзета-потенциала (ζ) на приборе Photocor (Фотокор, Россия). В кювету помещали 3 мл раствора, приготовленного, как описано для АСМ. Измерения проводили, как и в МУРН-эксперименте, при t = 37°С.
Метод определения ζ-потенциала основан на исследовании динамического рассеяния света в режиме измерения скорости потока. Скорость движения частиц в поле, рассчитанная из фазовой функции, позволяет определить электрофоретическую подвижность частиц, ${{{{\mu }}}_{E}} = {{\nu /}}E$, где ν – скорость движения заряженных частиц в электрическом поле с напряженностью E. Электрофоретическую подвижность частиц пересчитывали в ζ-потенциал, ζ, с использованием теории Смолуховского и применением поправок для различной толщины двойного электрического слоя по формуле
где ε – диэлектрическая проницаемость, η – вязкость среды.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Проникновение пептида PB16–14 в клетки. Перспектива применения пептидов, как и любого другого соединения-кандидата, в качестве лекарственного препарата определяется, в том числе, его способностью к проникновению в клетки, а также временными параметрами этого процесса. В качестве модельной системы для изучения транспорта пептида использовали клетки A549 (карциномы легкого человека) как наиболее адекватную модель для изучения функционирования вируса гриппа, поражающего именно эпителиальные клетки дыхательных путей [19]. Клетки инкубировали с FITC-меченым пептидом в условиях, описанных выше. Возможность использования FITC-меченого пептида как аналога не модифицированного была показана в [4] на клетках MDCK для малых концентраций пептида. Поскольку обе изучаемые формы пептида обладают сходной противовирусной активностью, то предполагается, что эффективность и механизм проникновения в клетки у них также аналогичны.
Временные и количественные параметры проникновения (относительное число клеток A549, положительно флуоресцирующих при длине волны возбуждения 488 нм, соответствующей FITC, через разные промежутки времени) оценивали методом проточной цитофлуориметрии. Динамика проникновения пептида в клетки представлена на рис. 1а.
Рис. 1.
Зависимость относительного числа клеток, флуоресцирующих на длине волны, соответствующей меченому FITC-пептиду, от продолжительности инкубации клеток A549 в присутствии данного пептида (а). Конфокальное изображение – оптический срез, проходящий через ядро клетки A549, инкубировавшейся с пептидом, растворенным в 5% этанол/5% ДМСО и разбавленным средой альфа-MEM в 20 раз до концентрации 33 мкМ. Представлено совмещенное изображение флуоресценции при длине волны возбуждения 488 нм и оптического изображения в проходящем свете. Стрелками отмечены области клеток, в которых наблюдается флуоресценция FITC-меченого пептида. Длина масштабного отрезка составляет 20 мкм. Стрелка 1 – пептид в виде гранул, стрелки 2, 3 – пептид, диффузно распределенный по цитоплазме клеток (пояснения в тексте) (б).
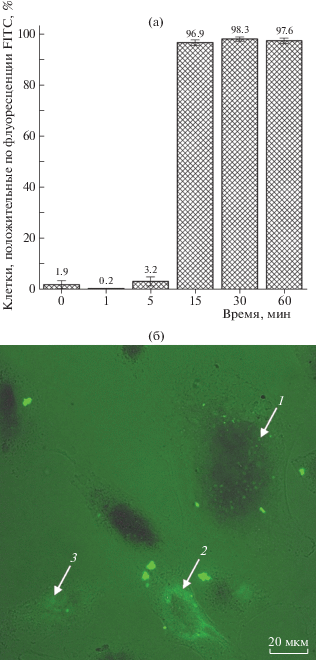
По полученным данным можно сделать вывод, что пептид проникает в клетки между 5-й и 15-й минутами инкубации. Данный временной интервал является приемлемым для использования исследуемого пептида в дальнейшем в качестве лекарственно препарата.
Основываясь на результатах, полученных методом цитофлуориметрии, нельзя однозначно определить, проник ли пептид внутрь клеток или сорбировался на клеточных мембранах. В связи с этим проникновение пептида внутрь клеток подтверждали методом конфокальной микроскопии, регистрируя флуоресценцию FITC-меченого пептида на оптическом срезе, проходящем через ядро клетки. На рис. 1б представлены конфокальные изображения клеток A549, инкубировавшихся с пептидом в присутствии ДМСО и этанола.
Результаты эксперимента показали, что пептид, растворенный в оптимальной смеси 5% ДМСО и 5% этанола [5] и разбавленный до необходимой концентрации клеточной средой, способен не только проникать внутрь клеток в виде гранул (отмечено стрелкой 1 на рис. 1б), но и диффузно распределяться по их цитоплазме (отмечено стрелками 2, 3 на рис. 1б). Отметим, что клетки имеют форму, характерную для живых и нормально функционирующих клеток A549.
Таким образом показано, что пептид PB16–14 проникает в клетки A549 в присутствии ДМСО к 15-й минуте инкубации по данным проточной цитофлуориметрии и конфокальной микроскопии. При использовании растворителя 5% этанол/5% ДМСО клетки сохраняют характерную для живых нормально функционирующих клеток форму, что подтверждается данными конфокальной микроскопии.
Взаимодействие пептида PB16–14 с моделями клеточных мембран. Особенности механизма проникновения пептида PB16–14 через клеточную мембрану изучали с использованием модельной системы – однослойных мембранных везикул.
Взаимодействие пептида с мембраной включает три основных этапа [21]:
– в водном растворе амфифильные пептиды образуют спиральные структуры, чтобы “спрятать” свои гидрофобные сегменты внутрь и “столкнуться” с мембранами посредством диффузии, а также электростатического притяжения;
– после накопления вокруг мембран происходят конформационные изменения, вызванные гидрофобными взаимодействиями. Пептиды претерпевают конформационные изменения, экспонируют гидрофобные сегменты, за счет чего встраиваются в поверхность раздела двух липидных слоев;
– связанные пептиды выполняют свои биологические функции за счет кооперативного взаимодействия друг с другом и с мембранами. Следовательно, функции, индуцированные пептидами, существенным образом зависят от концентрации и физико-химических свойств пептида (структура, заряд, гидрофобность и др.), а также от липидного состава и свойств мембраны (заряда, модуля изгиба, модуля растяжения и др.).
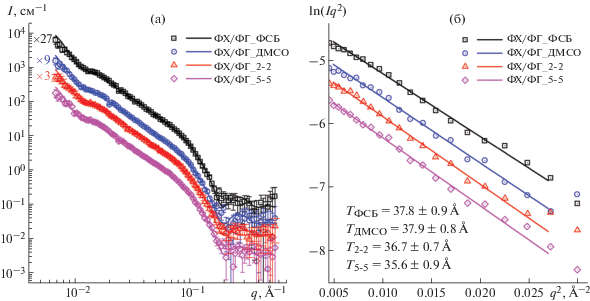
На первом этапе работы было оценено влияние растворителя (2.5% этанол-d6/2.5% ДМСО-d6/ФСБ) на структуру модельных липосом ФХ/ФГ. Сначала к приготовленным липосомам добавляли только ДМСО-d6 до конечной концентрации 2.5% и регистрировали спектр МУРН. Затем был получен спектр липосом в 2.5% этанол-d6/2.5% ДМСО-d6/ФСБ и в 5% этанол-d6/5% ДМСО-d6/ФСБ (рис. 2а). Изменение толщины липидного бислоя T (Å) оценивали из построения Кратки–Порода в координатах $\ln (I{{q}^{2}})\;{v}s\;{{q}^{2}}$ (рис. 2б). Толщина бислоя составила 36–38 Å и не зависела (в пределах погрешности) от растворителя, однако наблюдалась тенденция к уменьшению толщины везикул в растворах, содержащих одновременно этанол и ДМСО. При этом добавление только ДМСО не влияло на структурные параметры модельных мембран. Подобный результат был ожидаем, поскольку незначительное содержание ДМСО (до 20 мас. %) в растворе ДМСО/вода приводит лишь к изменению структуры свободной воды и частичной дегидратации липидного бислоя ФХ-липосом, и только при концентрации ДМСО более 40 мас. % молекулы ДМСО взаимодействуют непосредственно с поверхностью липидной мембраны [22], приводя к слипанию ОСВ с дальнейшим образованием МСВ [23, 24].
Рис. 2.
Кривые МУРН для ОСВ ФХ/ФГ (2 мас. %) в ФСБ (квадраты), в 2.5% ДМСО-d6/ФСБ (круги), в 2.5% этанол-d6/2.5% ДМСО-d6/ФСБ (треугольники) и в 5% этанол-d6/5% ДМСО-d6/ФСБ (ромбы); значения интенсивности спектра ФХ/ФГ_ФСБ, ФХ/ФГ_ДМСО и ФХ/ФГ_2-2 умножены
на 27, 9 и 3 соответственно для лучшей визуализации данных (а). Построение Кратки–Порода
($\ln (I{{q}^{2}})\;{v}s\;{{q}^{2}}$) спектров из (а) для определения толщины липидного бислоя  $T = \sqrt {12} {{R}_{t}}$, где
$T = \sqrt {12} {{R}_{t}}$, где  ${{R}_{t}} = \sqrt { - \operatorname{tg} \alpha } $ (б).
${{R}_{t}} = \sqrt { - \operatorname{tg} \alpha } $ (б).
Влияние пептида PB16–14 на структуру липосом ФХ/ФГ изучали методом МУРН в двух растворителях: 2.5% этанол-d6/2.5% ДМСО-d6/ФСБ и 5% этанол-d6/5% ДМСО-d6/ФСБ (рис. 3а). Анализ толщины липидного бислоя проводили по построению Кратки–Порода (рис. 3б). Для ОСВ ДМФХ/ДМФГ в ФСБ Т* = 37.8 ± 0.9 Å, что с учетом коэффициента 1.15 (для липосом ДМФХ в воде в жидкокристаллической (ЖК) фазе) [25] составляет 43.47 Å. Это значение близко к 44.20 Å для ДМФХ-d54 в воде в ЖК-фазе [26] и отлично согласуется с толщиной липидного бислоя 44.60 Å, полученной для ДМФХ-d54/ДМФГ в отсутствие пептида в [27]. Отметим, что если в случае растворения пептида PB16–14 в 2.5% этанол-d6/2.5% ДМСО-d6/ФСБ, а также при добавлении буфера 5% этанол-d6/5% ДМСО-d6/ФСБ наблюдалась небольшая тенденция к уменьшению толщины липидного бислоя до ∼35.5 Å (табл. 1), то при добавлении пептида, растворенного в 5% этанол-d6/5% ДМСО-d6/ФСБ, наблюдалось значительное уменьшение толщины липидного бислоя (до 32.1 ± 0.7 Å). Данный эффект может быть связан как с увеличением растворимой реакционноспособной формы пептида (в растворителе, содержащем большую концентрацию этанола и ДМСО), так и со стабилизацией конформации пептида, способной к взаимодействию с мембраной.
Рис. 3.
Спектры МУРН липосом ФХ/ФГ в присутствии и в отсутствие пептида PB16–14; точки – экспериментальные кривые, линии – теоретические спектры, полученные в программе SasView по рассчитанным параметрам липосом. Спектр ФХ/ФГ_5-5_пеп (круги) представлен без изменений; интенсивности спектров ФХ/ФГ_5-5 (квадраты), ФХ/ФГ_2-2_пеп (ромбы) и ФХ/ФГ_2-2 (треугольники) умножены на 3, 9 и 27 соответственно (а). Построение Кратки–Порода спектров из а для определения толщины липидного бислоя T (б).

Таблица 1.
Параметры липосом ФХ/ФГ (70/30), приготовленных в ФСБ; в ФСБ с 2.5%ДМСО; в ФСБ с 2.5% этанол-d6/2.5%ДМСО-d6 (2-2) или 5% этанол-d6/5%ДМСО-d6 (5-5); с пептидом PB16–14, растворенным в 2.5% этанол-d6/2.5%ДМСО-d6/ФСБ (2-2_пеп) или 5% этанол-d6/5% ДМСО-d6 /ФСБ (5-5_пеп)
| ФСБ | 2.5% ДМСО | 2-2 | 2-2_пеп | 5-5 | 5-5_пеп | |
|---|---|---|---|---|---|---|
| T*, Å | 37.8 ± 0.9 | 37.9 ± 0.8 | 36.7 ± 0.7 | 35.3 ± 0.6 | 35.6 ± 0.9 | 32.1 ± 0.7 |
| T, Å | 32.0 ± 0.2 | 31.9 ± 0.2 | 31.2 ± 0.2 | 30.7 ± 0.2 | 30.7 ± 0.2 | 28.7 ± 0.2 |
| R, Å | 248.0 ± 2.6 | 251.4 ± 4.6 | 252.0 ± 4.5 | 255.8 ± 2.0 | 258.5 ± 4.6 | 285.1 ± 2.3 |
Аналогичные данные относительно уменьшения толщины липидного бислоя модельных липосом ФХ/ФГ в присутствии пептида PB16–14, растворенного в 5% этанол-d6/5% ДМСО-d6/ФСБ, получены в результате аппроксимации спектров МУРН в программе SasView моделью “ядро–оболочка” (рис. 3а, сплошные линии). Заведомо заниженные значения толщин Т не анализировали, поскольку для корректного извлечения информации из нейтронного эксперимента необходимо использовать смесь ДМФХ-d54/ДМФГ совместно с частичной заменой D2O на H2O и применять модель, в которой гидрофобные и гидрофильные участки (головы и углеводородные хвосты) би-слоя рассматриваются как отдельные слои [27].
Тем не менее полученный результат свидетельствует об уменьшении толщины липидного бислоя в присутствии пептида, как и данные, извлеченные из построения Кратки–Порода. Кроме того, для данной системы (ФХ/ФГ_5-5_пеп) наблюдалось значительное увеличение радиуса липосомы с 250 до 285 Å (табл. 1, рис. 4). Отметим, что интенсивность рассеяния от чистого пептида PB16–14, растворенного в 5% этанол-d6/5% ДМСО-d6/ФСБ (рис. 5а), меньше на 2 порядка, чем интенсивность рассеяния от липосом, в связи с чем оно не может оказывать значительного влияния на итоговый спектр рассеяния. Таким образом, наблюдаемые увеличение радиуса и уменьшение толщины ОСВ ФХ/ФГ обусловлены влиянием пептида на структуру липосом.
Рис. 4.
Параметры липосом, рассчитанные в программе SasView. Расшифровка параметров указана в подписи к табл. 1.

Рис. 5.
Спектр МУРН раствора пептида PB16–14 в 5% этанол-d6/5% ДМСО-d6/ФСБ (а); спектры МУРН липосом ФХ/ФЭ в присутствии (круги) и в отсутствие (квадраты) пептида PB16–14 (б). Точки – экспериментальные кривые, сплошные линии – аппроксимация в программе SasView. На врезке построение кривых в координатах Кратки–Порода для вычисления толщины бислоя T, Å.
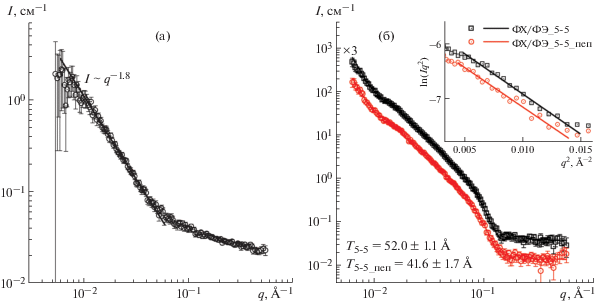
Одним из возможных объяснений наблюдаемых структурных изменений ОСВ ФХ/ФГ могло бы быть предположение о встраивании пептида PB16–14 в липидный бислой, поскольку увеличение количества вещества в мембране приводит к увеличению внутреннего радиуса липосом. Однако высказанное предположение не может объяснить уменьшения толщины бислоя и требует более детального изучения.
Интересным является тот факт, что при добавлении пептида PB16–14 не наблюдалось изменений в спектрах МУРН модельных липосом ФХ/ФЭ и, следовательно, детектируемых изменений структуры липосом (рис. 5б): толщина бислоя, вычисленная по построению Кратки–Порода (врезка на рис. 5б), составила ∼42 Å для обеих систем. При аппроксимации кривых в программе SasView моделью “ядро–оболочка” параметры обеих систем также не различались в пределах погрешности: толщина бислоя составила 41.7 ± 0.3 и 41.6 ± 0.4 Å для липосом без пептида и с пептидом соответственно, а размер липосом составил 288.7 ± 4.5 и 282.3 ± 8.1 Å. Это указывает на различный характер пептид-липидного взаимодействия положительно заряженного пептида с липидными бислоями в зависимости от их состава, в частности от заряда мембранной поверхности и/или фазового состояния липидного бислоя. Следует предположить, что электростатические взаимодействия играют существенную роль в процессах адсорбции в случае взаимодействия пептида PB16–14 с нейтральными (ФХ/ФЭ) липосомами или встраивания пептида в липидный бислой в случае взаимодействия пептида PB16–14 с анионными (ФХ/ФГ) липосомами. Кроме того, при t = 37°С система ФХ/ФЭ (80/20) находится в гелевой $L_{{{\beta }}}^{'}$-фазе [28]. При этом углеводородные цепи менее подвижны, чем в случае системы ФХ/ФГ при той же температуре, что может создавать дополнительный “барьер” для проникновения пептида внутрь липосом.
Контроль возможных морфологических изменений при взаимодействии пептида с ОСВ ФХ/ФГ осуществлялся методом АСМ. Профили высот, представленные на рис. 6 для ОСВ ФХ/ФГ в ФСБ (а), в 5% этанол/5% ДМСО/ФСБ (б) и ОСВ ФХ/ФГ-PB16–14 в 5% этанол/5% ДМСО/ФСБ (в), явно свидетельствуют о сферической форме исследуемых объектов. Кроме того, полученные значения средних размеров наблюдаемых объектов, DA, (табл. 2) из распределения числа частиц по размерам указывают на увеличение диаметра ОСВ при добавлении пептида, что хорошо согласуется с данными, полученными из аппроксимации кривых МУРН. Диаметры липосом, $D = 2(R + T)$, в ФСБ и 5% этанол/5% ДМСО/ФСБ равны 56.0 ± 0.6 и 57.3 ± 1.0 нм соответственно. Добавление пептида, растворенного в 5% этанол/5% ДМСО/ФСБ, к ОСВ ФХ/ФГ в ФСБ приводит к росту диаметра до 62.8 ± 0.5 нм.
Рис. 6.
Топография поверхности и распределение по размерам для ОСВ ФХ/ФГ: а, г – в ФСБ; б, д – в 5% этанол/5% ДМСО/ФСБ; в, е – ОСВ ФХ/ФГ-PB16–14 в 5% этанол/5% ДМСО/ ФСБ.

Таблица 2.
Размерность и ζ-потенциал (ζ) для ОСВ ФХ/ФГ в ФСБ, ОСВ ФХ/ФГ и ОСВ ФХ/ФГ-PB16–14 в 5% этанол/5% ДМСО/ ФСБ
| ФСБ | 5-5 | 5-5_пеп | |
|---|---|---|---|
| D, нм | 56.0 ± 0.6 | 57.3 ± 1.0 | 62.8 ± 0.5 |
| DА, нм | 57.7 ± 3.1 | 53.5 ± 5.2 | 65.9 ± 7.1 |
| ζ, мВ | –33.08 ± 0.27 | –30.29 ± 0.34 | –24.74 ± 0.18 |
Для выяснения роли электростатического взаимодействия в системе пептид–липид провели измерения ζ-потенциала для ОСВ, сформированных из нейтральных липидов ДМФХ, ДПФХ/ДПФЭ (80/20) и смеси нейтральных (ФХ) и отрицательно заряженных (ФГ) липидов ДМФХ/ДМФГ (70/30) при температуре 37°С, pH = 7.4. При добавлении положительно заряженного пептида к ОСВ, состоящего только из молекул ФХ, значение ζ изменялось незначительно: от –11.21(0.04) мВ для чистых липосом до –5.38(0.09) мВ, что может свидетельствовать о слабом пептид-липидном взаимодействии. В случае смешанной системы ФХ/ФЭ можно констатировать адсорбцию пептида на мембранной поверхности: ζ-потенциал меняет знак с отрицательного на положительный (ζ = –33.47(0.31) мВ для ФХ/ФЭ, ζ = +13.38(0.07) мВ для ФХ/ФЭ-PB16–14). ОСВ, состоящие из ФХ/ФГ, являются достаточно стабильной системой (ζ > ±30 мВ), как и в случае ФХ/ФЭ (табл. 3). Поскольку ζ-потенциал изменяется не существенно (табл. 2), то очевидно, что при взаимодействии пептида с мембранной поверхностью лишь небольшая часть пептида адсорбируется на поверхности мембран ФХ/ФГ, а большая часть встраивается в липидный бислой, как предполагали при анализе данных МУРН.
Таблица 3.
ζ-потенциал (мВ) для ОСВ ФХ, ОСВ ФХ/ФЭ и ОСВ ФХ/ФГ в присутствии и в отсутствие пептида PB16–14 в 5% этанол/5% ДМСО/ ФСБ
| ФХ | ФХ/ФЭ | ФХ/ФГ | |
|---|---|---|---|
| Без пептида | –11.21 ± 0.04 | –33.47 ± 0.31 | –33.08 ± 0.27 |
| С пептидом | –5.38 ± 0.09 | +13.38 ± 0.07 | –24.74 ± 0.18 |
Наблюдаемый характер взаимодействия пептида с модельными липосомами может быть об-условлен сочетанием положительно заряженных аминокислотных остатков с гидрофобными, которые, с одной стороны, способны взаимодействовать с отрицательно заряженными головками фосфолипидов, а с другой – с гидрофобными хвостами.
ЗАКЛЮЧЕНИЕ
Данные проточной цитофлуориметрии и конфокальной микроскопии указывают на то, что FITC-меченый аналог пептида проникает внутрь клеток. Ранее на основании только сходной противовирусной активности [4] было сделано предположение [6], что немеченый пептид PB16–14 проникает внутрь клеток аналогичным образом. В настоящей работе на модельной системе при помощи малоуглового рассеяния нейтронов показали, что немеченый пептид способен взаимодействовать с мембранами клеток и, вероятно, проходить через липидный бислой. Важным является тот факт, что проникновение пептида PB16–14 в мембрану определяется исключительно свойствами мембраны и растворителя, поскольку происходит в модельной системе без участия каких-либо клеточных факторов.
Наиболее перспективной для дальнейшего изучения является модельная система липосом ФХ/ФГ (70/30) в буфере 5% этанол-d6/5% ДМСО-d6, поскольку наблюдаемые изменения под действием пептида PB16–14 в этом случае наиболее значительные и приводят, в том числе, к существенному увеличению размера липосом. Для более комплексной характеристики транспорта пептида через мембрану следует использовать комбинацию методов МУРН, АСМ (для описания крупномасштабных перестроек, как, например, изменения размера липосом) и рефлектометрии (для получения информации о параметрах взаимодействия на более мелких масштабах, например, в каком конкретно участке липидного бислоя располагается пептид, какие надмолекулярные структуры образует и т.д.).
Использованная модельная система может быть также применена в качестве системы доставки лекарственных препаратов с возможностью контроля содержания препарата в носителе.
Работа частично поддержана государственным контрактом № 14.N08.11.0080: ФЦП “Развитие фармацевтической и медицинской промышленности Российской Федерации на период до 2020 года и дальнейшую перспективу” (эксперименты по проточной цитофлуориметрии и конфокальной микроскопии). Эксперименты по малоугловому рассеянию нейтронов выполнены на спектрометре ЮМО, реактор ИБР-2, ОИЯИ, г. Дубна (№ 2017-10-14-16-55-35, 2018-04-14-23-49-44). Измерения ζ-потенциала и АСМ проведены при финансовой поддержке гранта Полномочного представителя Румынии в ОИЯИ (приказ № 267, п. 17 от 20.05.2020).
Список литературы
Fosgerau K., Hoffmann T. // Drug Discov. Today. 2015. V. 20. № 1. P. 122. https://doi.org/10.1016/J.DRUDIS.2014.10.003
Protein-Protein Interactions: Methods and Applications. Second ed. / Eds. Meyerkord C.L., Fu H. New York: Springer New York, 2015. V. 1278. 635 p. https://doi.org/10.1007/978-1-4939-2425-7
Миронов А.Н., Бунатян Н.Д. Руководство по проведению доклинических исследований лекарственных средств. М.: Гриф и К, 2012. 944 с.
Matusevich O.V., Egorov V.V., Gluzdikov I.A. et al. // Antiviral Res. 2015. V. 113. P. 4. https://doi.org/10.1016/j.antiviral.2014.10.015
Егоров В.В., Забродская Я.А., Шалджян А.А. и др. Пат: RU 2695336 C1. Российская Федерация: Федеральная служба по интеллектуальной собственности. 2019. № 21. С. 1–18.
Zabrodskaya Y.A., Lebedev D.V., Egorova M.A. et al. // Biophys. Chem. 2018. V. 234. P. 16. https://doi.org/10.1016/j.bpc.2018.01.001
Egorov V.V., Matusevich O.V., Shaldzhyan A.A. et al. // Int. J. Pep. 2013. V. 2013. P. 370832. https://doi.org/10.1155/2013/370832
Li Z., Agellon L.B., Allen T.M. et al. // Cell Metab. 2006. V. 3. № 5. P. 321. https://doi.org/10.1016/j.cmet.2006.03.007
Sun S., Zhao G., Huang Y. et al. // Sci. Rep. 2016. V. 6. № 1. P. 29145. https://doi.org/10.1038/srep29145
Kuklin A.I., Islamov A.K., Gordeliy V.I. // Neutron News. 2005. V. 16. № 3. P. 16. https://doi.org/10.1080/10448630500454361
Kuklin A.I., Soloviov D.V., Rogachev A.V. et al. // J. Phys. Conf. Ser. 2011. V. 291. № 1. P. 012013. https://doi.org/10.1088/1742-6596/291/1/012013
Soloviev A.G., Murugova T.N., Islamov A.H., Kuklin A.I. // J. Phys. Conf. Ser. 2012. V. 351. № 1. P. 012027. https://doi.org/10.1088/1742-6596/351/1/012027
Ostanevich Y.M. // Makromol. Chem. Macromol. Symp. 1988. V. 15. № 1. P. 91. https://doi.org/10.1002/masy.19880150107
Knoll W., Haas J., Stuhrmann H.B. et al. // J. Appl. Cryst. 1981. V. 14. № 3. P. 191. https://doi.org/10.1107/S0021889881009102
Nawroth T., Conrad H., Dose K. // Phys. B. Phys. Condens. Matter. 1989. V. 156–157. P. 477. https://doi.org/10.1016/0921-4526(89)90708-4
Guinier A., Fournet G. Small-angle scattering of X-rays / Eds. Mayer M.G. New York: John Wiley & Sons, Inc.,1955. 268 p.
SasView – Small Angle Scattering Analysis. http://www.sasview.org/
Feigin L.A., Svergun D.I. Structure Analysis by Small-Angle X-Ray and Neutron Scattering. New York: Springer US, 1987. 335 p. https://doi.org/10.1007/978-1-4757-6624-0
Ujie M., Takada K., Kiso M. et al. // J. Gen. Virol. 2019. V. 100. № 10. P. 1345. https://doi.org/10.1099/jgv.0.001314
Benne N., Leboux R.J.T., Glandrup M. et al. // J. Control. Release. 2020. V. 318. P. 246. https://doi.org/10.1016/j.jconrel.2019.12.003
Lee M.-T. // Adv. Phys. X. 2018. V. 3. № 1. P. 1408428. https://doi.org/10.1080/23746149.2017.1408428
Bonora S., Markarian S.A., Trinchero A., Grigorian K.R. // Thermochim. Acta. 2005. V. 433. № 1–2. P. 19. https://doi.org/10.1016/j.tca.2005.02.011
Горшкова Ю.Е. // Поверхность. Рентген., синхротр. и нейтр. исследования. 2018. Т. 7. С. 34. https://doi.org/10.7868/S0207352818070053
Gorshkova Y.E. // J. Optoelectron. Adv. Mater. 2015. V. 17. P. 1532.
Gordeliy V.I., Cherezov V., Teixeira J. // Phys. Rev. E. Stat. Nonlinear, Soft Matter Phys. 2005. V. 72. № 6. P. 061913. https://doi.org/10.1103/PhysRevE.72.061913
Горшкова Ю.Е., Горделий В.И. // Кристаллография. 2007. Т. 52. № 3. С. 560.
Qian S., Heller W.T. // J. Phys. Chem. B. 2011. V. 115. № 32. P. 9831. https://doi.org/10.1021/jp204045t
Kamal M.A., Pal A., Raghunathan V.A., Rao M. // Phys. Rev. E. State Nonlin Soft Matter. Phys. 2012. V. 85. № 5. Pt. 1. P. 051701. https://doi.org/10.1103/PhysRevE.85.051701
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография



