Кристаллография, 2021, T. 66, № 6, стр. 894-898
Моделирование липидного бислоя, имитирующего внутреннюю мембрану митохондрий
А. А. Юрченко 1, *, П. Д. Короткова 2, А. Р. Гусельникова 1, А. Б. Шумм 2, 3, В. И. Тимофеев 4, 5, **, Ю. А. Владимиров 1, 2, 4, 6
1 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
Министерства здравоохранения РФ
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 Физический институт им. П.Н. Лебедева РАН
Москва, Россия
4 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
5 КК НБИКС-природоподобных технологий, Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
6 Институт регенеративной медицины,
Первый Московский государственный медицинский университет им. И.М. Сеченова
Министерства здравоохранения РФ (Сеченовский университет)
Москва, Россия
* E-mail: nastyaurchenkooo@gmail.com
** E-mail: tostars@mail.ru
Поступила в редакцию 10.10.2020
После доработки 27.11.2020
Принята к публикации 27.11.2020
Аннотация
Построена модель липидного бислоя, имитирующего внутреннюю мембрану митохондрий. Полученная модель состоит из 51 молекулы дилинолеил фосфатидилэтаноламина, 36 молекул дилинолеил фосфатидилхолина, 35 молекул тетраолеил кардиолипина и 6 молекул дилинолеил фосфатидилинозитола в каждом из двух слоев липидов. Промоделирована молекулярная динамика полученной модели (20 000 пс). Описана подвижность различных липидов и групп атомов в их составе. Полученная модель может быть использована для изучения липидной компоненты внутренней митохондриальной мембраны.
ВВЕДЕНИЕ
Одними из важнейших клеточных органелл являются митохондрии. Митохондрии – это клеточные органеллы, встречающиеся в большинстве эукариотических клеток, имеющие внешнюю и внутреннюю мембраны, каждая из которых представляет собой липидный бислой с мембранно-ассоциированными белками [1]. Основной составляющей липидной компоненты мембран являются фосфолипиды (амфифильные молекулы, имеющие гидрофильную и гидрофобную части). Наиболее распространенные представители этого класса в биологических мембранах – это фосфатидилэтаноламин, фосфатидилхолин, фосфатидилинозитол и фосфатидилсерин [2].
Второй важный класс липидов, входящий в состав биологических мембран, – это гликолипиды, представляющие собой липиды со связанными с ними углеводами. Основным классом гликолипидов, встречающихся в мембранах, являются гликосфинголипиды, состоящие из церамида (включает в себя сфингозин и жирную кислоту), одного или нескольких углеводных остатков, а также сиаловой кислоты [3]. Они преимущественно находятся на внешней стороне мембраны и отвечают прежде всего за клеточное распознавание и проведение сигналов [3]. Кроме того, в состав мембран входит холестерол, регулирующий их вязкость [4]. Известно, что изменение вязкости мембран приводит к различным заболеваниям, таким как атеросклероз [5], диабет [6] и другие.
Белковую компоненту мембраны составляют различные классы белков, находящиеся на ее поверхности, или пронизывающие ее, например, различные ионные каналы, обеспечивающие избирательную проницаемость мембраны для различных ионов в зависимости от условий [7].
Основной функцией митохондрий являются окисление органических соединений и использование полученной при этом энергии для синтеза аденозинтрифосфата [1]. Кроме того, один из сигнальных путей апоптоза (регулируемого процесса запрограммированной гибели клеток) связан с митохондриями, причем у позвоночных именно такой путь является основным [8]. Отметим, что нарушение апоптоза приводит к различным заболеваниям. Для таких заболеваний, как удушье новорожденных [9] и церебральная ишемия у пожилых людей [10], так же как и для болезни Альцгеймера [11] и некоторых других нейродегенеративных заболеваний, дегенерации сетчатки [12] и отторжения трансплантата [13], характерен чрезмерный апоптоз. При злокачественных опухолях, наоборот, апоптоз в раковых клетках подавлен [14, 15]. Митохондриальный сигнальный путь апоптоза реализуется путем выхода из межмембранного пространства митохондрии в цитоплазму клетки апоптогенных белков путем разрушения мембраны или открытия водопроницаемых каналов на внутренней мембране митохондрии (ВММ) [16]. Один из механизмов активации апоптоза – запуск перекисного окисления липидов ВММ, в первую очередь кардиолипина (CL), катализируемого цитохромом С (Cyt c) [17]. Хотя данный процесс изучался посредством ряда биофизических методов [18, 19], до сих пор остается неизвестной структура комплекса Cyt c и ВММ на молекулярном уровне. Для изучения свойств ВММ построена модель бислоя, имитирующего по составу ВММ (на 37.0% состоит из фосфатидилэтаноламина, на 26.5% – из фосфатидилхолина, на 25.4% – из кардиолипина и на 4.5% – из фосфатидилинозитола) [20], и изучена молекулярная динамика (МД) полученной модели.
МАТЕРИАЛЫ И МЕТОДЫ
Исходная модель системы была построена с использованием сервиса CHARMM-GUI [21], она содержала липидный бислой, состоящий из 51 молекулы дилинолеил фосфатидилэтаноламина (DLiPE), 36 молекул дилинолеил фосфатидилхолина (DLiPC), 35 молекул тетраолеил кардиолипина (TOCL) и 6 молекул дилинолеил фосфатидилинозитола (DLiPI), равномерно распределенных в каждом из двух слоев липидов, 15 Å водного слоя с каждой стороны, а также 0.15 M KCl. Размер ячейки, в которой проводилось моделирование МД, составлял 109.47 × 109.47 × 70.00 Å, ячейка имела кубическую форму. Моделирование МД проводили с использованием программного пакета AMBER [22] c CUDA-версией pmemd [23]. В процессе моделирования МД использовали силовое поле CHARMM36 [24]. В качестве модели воды использовали модель TIP3P. Для релаксации структуры и во избежание стерических клэшей провели минимизацию энергии системы. Затем система была уравновешена в шесть стадий по 25–50 пс каждая при температуре 310 K и давлении 1 атм в NVT- и NPT-ансамблях с ограничениями на подвижность атомов. После этого ограничения на подвижность были сняты, и система уравновешивалась еще 2 нс. Температуру и давление в системе контролировали с помощью термостата Ланжевина [25] и полуизотропного баростата Монте-Карло [26] с двумя интерфейсами. В результате продуктивной МД было промоделировано 20000 пс с шагом 2 фс.
РЕЗУЛЬТАТЫ
Полученная модель бислоя, имитирующего ВММ, изображена на рис. 1. Ширина модели мембраны после уравновешивания системы составляет в среднем 39.08 Å. Видно, что модель бислоя не содержит пор и является непроницаемой для растворителя. Как было показано ранее в ленгмюровских экспериментах [27], существует возможность оценить плотность упаковки липидов в монослое экспериментальными методами, причем высказано предположение, что монослой CL меняет свою плотность при взаимодействии с Cyt c. Учитывая возможность менять плотность упаковки липидов в полученной модели, использованный метод молекулярного моделирования позволяет построить молекулярные модели взаимодействия Cyt c и липидного бислоя ВММ.
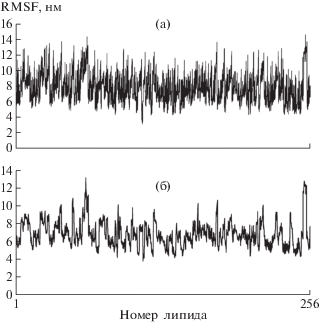
В результате МД-эксперимента показано, что полученная модель липидного бислоя является стабильной структурой и может быть использована как модель липидной компоненты ВММ. Полученная модель состоит из четырех различных по химическому строению липидов – DLiPE, DLiPC, TOCL и DLiPI (рис. 2), однако принадлежащих к одному классу, т.е. являются фосфолипидами и имеют гидрофильную фосфатную головку и гидрофобный углеродный хвост. Для анализа разницы в подвижности различных частей липидов был рассчитан RMSF (root-mean-square fluctuation) – наиболее часто используемый показатель для оценки динамического изменения координат частиц – как для гидрофобной, так и для гидрофильной частей липидных молекул (для атомов углерода и атомов кислорода). Анализ данных показал, что молекулы липидов по подвижности значительно отличаются друг от друга, однако зависимости степени подвижности липида от его класса не выявлено. С другой стороны, каких-либо тенденций в разнице подвижности атомов кислорода и атомов углерода, входящих в состав липидных молекул, не выявлено (рис. 3).
Рис. 2.
Химические формулы фосфолипидов, использовавшихся для построения модели внутренней мембраны митохондрий: 1 – дилинолеил фосфатидилэтаноламин, 2 – дилинолеил фосфатидилхолин, 3 – дилинолеил фосфатидалинозитол, 4 – тетраолеоил кардиолипин.
Рис. 3.
RMSF для атомов, входящих в состав липидных молекул. Представлены RMSF для атомов углерода (а) и кислорода (б).
Таким образом, в результате моделирования получена модель липидного бислоя, имитирующая липидную компоненту ВММ. Полученная модель будет использована в дальнейшем для изучения процессов апоптоза, ассоциированных с Cyt c и ВММ.
Работа выполнена при поддержке Российского научного фонда (грант № 19-14-00244) в части моделирования МД и при поддержке Министерства науки и высшего образования в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН в части анализа результатов молекулярного моделирования.
Список литературы
Alberts B., Johnson A., Lewis J. et al. Molecular biology of the cell. New York: Garland Science, 2002. 1462 p. https://doi.org/10.1093/aob/mcg023
Gennis R.B. Biomembranes: molecular structure and function. New York: Springer, 1989. 533 p. https://doi.org/10.1007/978-1-4757-2065-5
Hakomori S.-i., Igarashi Y. // J. Biochem. 1995. V. 118. № 6. P. 1091. https://doi.org/10.1093/oxfordjournals.jbchem.a124992
Khatibzadeh N., Gupta S., Farrell B. et al. // Soft Matter. 2012. V. 8. № 32. P. 8350. https://doi.org/10.1039/C2SM25263E
Koike T., Ishida G., Taniguchi M. et al. // Biochim. Biophys. Acta. Molecular Basis of Disease. 1998. V. 1406. № 3. P. 327. https://doi.org/10.1016/S0925-4439(98)00019-2
Nadiv O., Shinitzky M., Manu H. et al. // Biochem. J. 1994. V. 298. № 2. P. 443. https://doi.org/10.1042/bj2980443
Alexander S.P.H., Mathie A., Peters J. A. // British J. Pharmacol. 2011. V. 164. Special Issue: Guide to Receptors and Channels, 5th Edition P. S137. https://doi.org/10.1111/j.1476-5381.2011.01649_1.x
Siekevitz P. // Scientific American. 1957. V. 197. № 1. P. 131. https://doi.org/10.1038/scientificamerican0757-131
Waters K.A., Meehan B., Huang J. et al. // Pediatric Res. 1999. V. 45. № 2. P. 166. https://doi.org/10.1203/00006450-199902000-00002
Namura S., Zhu J., Fink K. et al. // J. Neurosci. 1998. V. 18. № 10. P. 3659. https://doi.org/10.1523/JNEUROSCI.18-10-03659.1998
Takuma K., Yan S.S., Stern D.M. et al. // J. Pharmacol. Sci. 2005. V. 97. № 3. P. 312. https://doi.org/10.1254/jphs.cpj04006x
Wenzel A., Grimm C., Samardzija M. et al. // Prog. Retin. Eye Res. 2005. V. 24. № 2. P. 275. https://doi.org/10.1016/j.preteyeres.2004.08.002
Krams S.M., Egawa H., Quinn M.B. et al. // Transplantation. 1995. V. 59. № 4. P. 621.
Lane D.P., Benchimol S. // Genes Dev. 1990. V. 4. № 1. P. 1. https://doi.org/10.1101/gad.4.1.1
Hollstein M., Sidransky D., Vogelstein B. et al. // Science. 1991. V. 253. № 5015. P. 49. https://doi.org/10.1126/science.1905840
Gonzalez D., Bejarano I., Barriga C. et al. // Current Signal Transduction Therapy. 2010. V. 5. № 2. P. 181. https://doi.org/10.2174/157436210791112172
Vladimirov Y.A., Proskurnina E., Alekseev A. // Biochemistry (Moscow). 2013. V. 78. № 10. P. 1086. https://doi.org/10.1134/S0006297913100027
Vladimirov G., Vikulina A., Volodkin D. et al. // Chem. Phys. Lipids. 2018. V. 214. P. 35. https://doi.org/10.1016/j.chemphyslip.2018.05.007
Vladimirov Y.A., Sarisozen C., Vladimirov G.K. et al. // Pharm. Res. 2017. V. 34. № 6. P. 1264. https://doi.org/10.1007/s11095-017-2143-1
Comte J., Maǐsterrena B., Gautheron D.C. // Biochim. Biophys. Acta. Biomembranes. 1976. V. 419. № 2. P. 271. https://doi.org/10.1016/0005-2736(76)90353-9
Jo S., Kim T., Iyer V.G. et al. // J. Comput. Chem. 2008. V. 29. № 11. P. 1859. https://doi.org/10.1002/jcc.20945
Case D.A., Cheatham III T.E., Darden T. et al. // J. Comput. Chem. 2005. V. 26. № 16. P. 1668. https://doi.org/10.1002/jcc.20290
Salomon-Ferrer R., Götz A.W., Poole D. et al. // J. Chemical Theory Computation. 2013. V. 9. № 9. P. 3878. https://doi.org/10.1021/ct400314y
Klauda J.B., Venable R.M., Freites J.A. et al. // J. Phys. Chem. B. 2010. V. 114. № 23. P. 7830. https://doi.org/10.1021/jp101759q
Allen M.P., Tildesley D.J. Computer simulation of liquids. New York: Oxford university press, 1991. 385 p. https://doi.org/10.2307/2938686
Steinbach P.J. // Proteins: Structure, Function, and Bioinformatics. 2004. V. 57. № 4. P. 665. https://doi.org/10.1002/prot.20247
Marchenkova M.A., Dyakova Y.A., Tereschenko E.Y. et al. // Langmuir. 2015. V. 31. № 45. P. 12426. https://doi.org/10.1021/acs.langmuir.5b03155
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография



