Кристаллография, 2022, T. 67, № 2, стр. 254-261
Кристаллическая структура потенциально мезоморфных алкилокси производных 4-нитрофенила (Alk–O–C6H4–NO2, Alk = С4Н9, С10Н21, С12Н25)
Л. Г. Кузьмина 1, *, С. И. Беззубов 1, М. А. Навасардян 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: kuzmina@igic.ras.ru
Поступила в редакцию 02.09.2020
После доработки 02.09.2020
Принята к публикации 04.02.2021
- EDN: FXRRQE
- DOI: 10.31857/S0023476121060205
Аннотация
По данным рентгеноструктурного анализа и дифференциальной сканирующей калориметрии (ДСК) исследованы три 4-алкилокси производных нитрофенила с Alk = С4Н9 (I), С10Н21 (II), С12Н25 (III). Для соединения II рентгеновский эксперимент проведен при разных температурах: 150, 303, 308 и 310 K. Согласно данным ДСК все три соединения не проявляют мезоморфизм, как энантиотропный, так и монотропный. Кристаллическая упаковка I не соответствует типичной упаковке мезоморфных соединений. В кристаллических упаковках II и III отсутствуют слабые направленные взаимодействия между функциональными группами молекул, которые могли бы создать элементы структурированности расплава.
ВВЕДЕНИЕ
Настоящая работа является частью систематического исследования потенциально мезоморфных дихотомных органических соединений с целью установления причин, обусловливающих возникновение или отсутствие у них мезоморфизма разного типа – энантиотропного или монотропного. Дихотомными являются соединения, состоящие по меньшей мере из двух контрастирующих по свойствам и строению частей, например включают подвижную алифатическую цепь и жесткий ароматический фрагмент.
Согласно исследованиям [1–16] кристаллы мезоморфных соединений характеризуются двумя основными особенностями. Во-первых, в их молекулярных упаковках наблюдается чередование рыхлых алифатических и плотных ароматических слоев. Во-вторых, в плотно упакованных слоях существуют слабые направленные взаимодействия (вторичные связи) между функциональными группами ароматических фрагментов. К таким взаимодействиям относятся водородные связи, слабые водородные связи С–Н⋅⋅⋅O/N и C–H⋅⋅⋅π, стэкинг-взаимодействия и прочие. Эти взаимодействия наряду с дисперсионными обусловливают плотную упаковку слоев, а рыхлая структура алифатических областей является следствием высокой конформационной подвижности алифатических цепей, увеличивающей их эффективные размеры.
В [6, 16] показано, что тепловые колебания атомов алифатической цепи совершаются с большей амплитудой, чем атомов жесткого ядра, и это различие усиливается по мере повышения температуры. Это позволяет заключить, что плавление кристаллов должно происходить аномально. Повышение температуры приводит вначале к разрушению упорядоченности алифатических слоев при сохранении структурированности плотных ароматических областей, а затем к появлению вязкой структурированной жидкости – мезофазы. Структурированность мезофазы обусловлена сохранением в ней вторичных связей кристалла.
Согласно наблюдениям появление мезоморфных свойств у соединений гомологического ряда (например, алкилоксизамещенных фенилбензоатов) зависит от температуры плавления: чем она ниже, тем с большей вероятностью соединение проявляет мезоморфизм. Мезофаза устойчива до температур разрушения формирующих ее вторичных связей. Если плавление кристалла происходит при достаточно высоких температурах, то слабые взаимодействия могут разрушиться еще до достижения точки плавления. В таком случае мезофаза не может образоваться из-за отсутствия элементов структурированности в образующемся расплаве.
Алкилокси производные бензола обычно являются низкоплавкими соединениями, что делает их привлекательными объектами для изучения явления мезоморфизма и уточнения модели мезофазы.
В настоящей работе обсуждаются результаты исследований трех 4-алкилокси производных нитробензола с Alk = С4Н9 (I), С10Н21 (II), С12Н25 (III) методами рентгеноструктурного анализа (РСА) монокристаллов (причем для II при разных температурах: 150, 303, 308 и 310 K) и дифференциальной сканирующей калориметрии (ДСК). Молекулярная структура двух из них (II и III) была изучена в [17, 18] при температуре 291 K. Эти соединения исследованы повторно для получения сведений не только о геометрии, но и о характере тепловых колебаний атомов алифатического и ароматического фрагмента и о влиянии на них температуры.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ДСК-исследование. Соединения I, II и III куплены в фирме Sigma-Aldrich. Образец из нескольких монокристаллов соединений I, II и III, выращенных из смеси бензол-ацетонитрил, помещали в оптическую ДСК-систему Linkam DSC600, снабженную микроскопом Olympus BX43, где измеряли термограмму соединения при скорости сканирования 5 град/мин. Согласно ДСК-исследованиям все три соединения не образуют мезофазы как при плавлении, так и охлаждении изотропного расплава. Температура (энтальпия) плавления I, II и III равна 33.9°С (21 кДж/мол), 44.3°С (51 кДж/мол) и 50.4°С (57 кДж/мол) соответственно. Охлаждение изотропного расплава сопровождается кристаллизацией при температуре (энтальпии) 20.4°С (20 кДж/мол), 25.7°С (48 кДж/мол) и 38.8°С (58 кДж/мол) для I, II и III соответственно, т.е. ниже температуры плавления.
Рентгеноструктурный анализ. Мезоморфные соединения часто проявляют полиморфизм. Поэтому, чтобы убедится в идентичности образцов I, II и III, исследуемых двумя разными методами (РСА и ДСК), для РСА отбирали монокристаллы, предварительно изученные методом ДСК.
Монокристалл помещали на дифрактометр Bruker SMART APEX-II, где проводили измерения параметров решетки и интенсивностей рентгеновских отражений (MoKα-излучение, графитовый монохроматор, ω-сканирование). Структура соединения I исследована при температуре 210 K, а соединения III – при комнатной температуре (296 K). Рентгеноструктурное исследование соединения II проводили при температурах 150, 303, 308 и 310 K.
Первичную обработку экспериментальных данных осуществляли по программе SAINT [19]. Структуры расшифрованы прямыми методами и уточнены методом наименьших квадратов по F2 в анизотропном приближении смещений всех атомов, кроме водорода. Хотя атомы водорода можно локализовать в результате разностного синтеза Фурье, их положения были рассчитаны геометрически и включены в дальнейшее уточнение структуры по модели наездника. Основные кристаллографические параметры, данные эксперимента и результаты уточнения структур приведены в табл. 1.
Таблица 1.
Кристаллографические характеристики, данные эксперимента и результаты уточнения структур I, II и III
| Соединение | I | II | III | |
|---|---|---|---|---|
| Формула | C10H13NO3 | C16H25NO3 | C18H29NO3 | |
| М | 195.21 | 279.37 | 307.42 | |
| Пр. гр., Z | P21/n, 8 | P$\bar {1}$, 4 | ||
| T, K | 210 | 120 | 303 | 296 |
| a, b, с, Å | 7.604(3), 13.817(5), 19.384(7) | 5.5780(2), 15.6741(6), 19.0310(9) | 5.6423(5), 16.0786(16), 19.1202(16) | 5.6213(4), 16.0480(12), 21.4074(15) |
| α, β, γ, град | 90, 92.229(10), 90 | 107.923(4), 90.114(4), 99.868(3) | 107.401(3), 90.560(3), 99.783(3) | 72.127(3), 87.263(3), 80.255(3) |
| V, Å3 | 2034.9(12) | 1557.05(12) | 1627.7(3) | 1811.4(2) |
| Dx, г/см3 | 1.274 | 1.192 | 1.140 | 1.127 |
| μ, см–1 | 0.094 | 0.081 | 0.078 | 0.076 |
| Размеры кристалла, мм | 0.28 × 0.18 × 0.04 | 0.46 × 0.31 × 0.23 | 0.42 × 0.36 × 0.24 | |
| F(000) | 832.0 | 608.0 | 672.0 | |
| Число отражений: измеренных (N1), Rуср/независимых с I > 2σ(I) N2) | 16 388, 0.1104/3986 | 32 074, 0.0204/9054 | 33 557, 0.0491/8666 | |
| Число параметров | 255 | 363 | 399 | |
| S | 1.002 | 1.024 | 1.053 | |
| R1/wR2 по N1 | 0.1930/0.3236 | 0.0680/0.1191 | 0.1332/0.1768 | |
| R1/wR2 по N2 | 0.0941/0.2549 | 0.0452/0.1053 | 0.0805/0.1565 | |
| Δρmin/Δρmax, э Å–3 | –0.22/0.39 | –0.25/0.33 | –0.26/0.18 | |
| Программы | Olex-2 [20], ShelXT [21], XH [22] | |||
Все расчеты проведены по программам Olex-2 [20], ShelXT [21] и XH [22]. Данные о структурах депонированы в Кембриджскую базу данных: CCDC 2019429 (I), 2019430 (II 150 K), 2019431 (II 303 К), 2109432 (III), deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ДСК-исследование. Согласно калориметрическому исследованию все три соединения не образуют мезофазы как при нагревании кристаллов, так и при охлаждении изотропного расплава. Для исследованных соединений характерно образование переохлажденных расплавов, т.е. их температура плавления оказывается существенно выше температуры кристаллизации. Соотношение температур плавления и кристаллизации составляет 33.9/20.4, 44.3/25.7 и 50.4/38.8°С для соединений I, II и III соответственно. Это, по-видимому, обусловлено следующими обстоятельствами. Тепловым колебаниям в большей степени подвержены атомы алифатической группы, чем атомы ароматического фрагмента, что значительно влияет на общее очертание (размеры и форму) молекул. Повышение температуры может привести к существенным различиям амплитуд колебаний ароматического и алифатического фрагментов. Тогда “эффективные очертания” молекул при температуре кристаллизации из раствора и из расплава могут значительно различаться. По-видимому, охлаждение расплава может даже приводить к формированию иной кристаллической модификации. Поскольку изменение формы молекул при повышенных температурах происходит в сторону увеличения ее размеров, то полученный из расплава кристалл будет иметь меньшую плотность, а следовательно, более низкую температуру плавления. Это наиболее разумное предположение, объясняющее различия температур плавления и кристаллизации.
Исследование РСА
Молекулярная структура. Кристаллы всех трех соединений содержат по две независимые молекулы с очень близкими геометрическими параметрами. Структура молекул I и тепловые эллипсоиды атомов при температуре эксперимента 210 K показаны на рис. 1. Заметно небольшое усиление тепловых колебаний концевых атомов алкильной цепи по сравнению с остальными атомами.
Рис. 1.
Две независимые молекулы в кристалле I: а – строение, среднеквадратичные температурные смещения атомов приведены на уровне вероятности 50%; б – взаимное наложение.
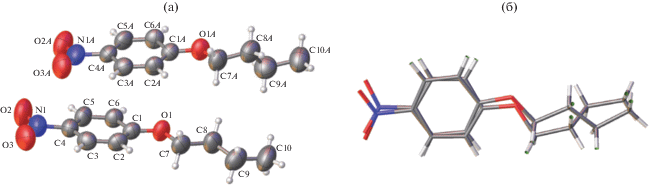
Независимые молекулы имеют различные конформации (рис. 1б). В обеих молекулах торсионные углы С2–С1–О1–С7 (С2А–С1А–О1А–С7А) практически совпадают (4.47° и 4.64°) вследствие сопряжения одной из электронных пар атома кислорода с π-системой бензольного кольца. Бутильный фрагмент в обеих молекулах почти плоский, и эта плоскость наклонена к плоскости бензольного кольца. Двугранный угол между этими плоскостями в одной молекуле составляет 5.18° (поворотная и наклонная компоненты этого угла равны 4.8° и 7.8°), а в другой – 109.5° (109.6° и 40.7° соответственно).
Структура независимых молекул II и эллипсоиды тепловых колебаний атомов при температурах 303, 308, 310 K, которые ненамного меньше температуры плавления (317.3 K), показаны на рис. 2. В табл. 2 приведены изотропные эквивалентные температурные параметры трех концевых атомов алифатической цепи С14, С15, С16 и для сравнения первого атома этой цепи С7, связанного с атомом кислорода, при температурах 303, 308 и 310 К. Из таблицы видно, что повышение температуры мало влияет на характер теплового движения атомов в молекуле в отличие от ранее исследованного при температурах 120, 295, 320 и 333 K мезоморфного 4-(децилоксибензилиден)-4'-толуидина [6]. Для него установлено не просто усиление тепловых колебаний терминальных фрагментов (пропильного, а затем бутильного) алифатической цепи с ростом температуры, но и их неупорядоченность, что подтвердило предположение о том, что плавление мезоморфных соединений начинается по алифатическим цепям молекул.
Рис. 2.
Структура молекул II при температурах 303, 308 и 310 K; среднеквадратичные температурные смещения атомов приведены на уровне вероятности 70%.
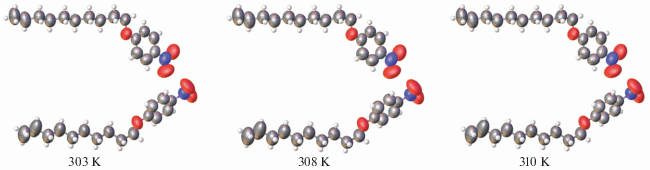
Таблица 2.
Значения эквивалентных изотропных температурных параметров (Å2) некоторых атомов алифатической цепи в двух независимых молекулах II при температурах 303, 308 и 310 K
| Атом | Т, K | ||
|---|---|---|---|
| 303 | 308 | 310 | |
| С7/C7A | 60.3(3)/57.5(3) | 61.3(4)/63.8(4) | 60.3(4)/62.6(4) |
| С14/C14A | 56.3(3)/70.5(4) | 76.0(4)/61.0(3) | 74.9(4)/59.6(3) |
| С15/C15A | 72.8(4)/104.4(7) | 110.6(8)/77.7(5) | 109.6(8)/76.6(5) |
| С16/C16A | 82.2(5)/92.2(6) | 97.6(6)/87.2(5) | 96.3(6)/86.21(5) |
Эффект усиления тепловых колебаний концевых фрагментов алифатической цепи выражен отчетливо, хотя он слаб по сравнению с наблюдавшимся в 4-(децилоксибензилиден)-4'-толуидине, который в отличие от II является мезоморфным. Эффект усиления тепловых колебаний алифатических атомов по мере их удаления от начального атома С7 также наблюдается в соединении III, независимые молекулы которого (рис. 3) близки по строению к молекулам II.
Рис. 3.
Строение молекулы и нумерация атомов в соединении III; среднеквадратичные температурные отклонения атомов приведены на уровне вероятности 50%.
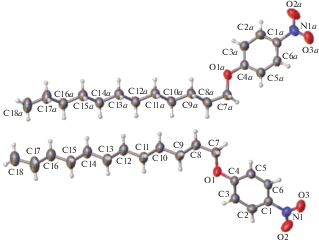
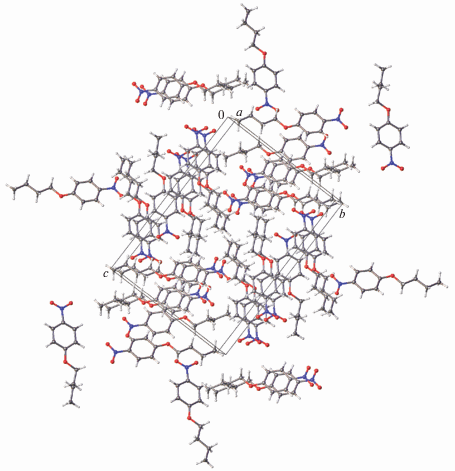
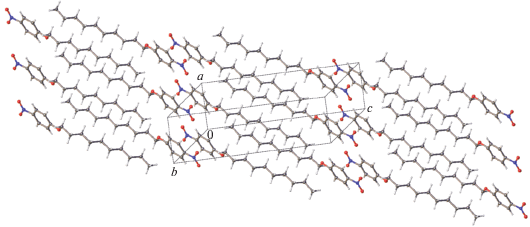
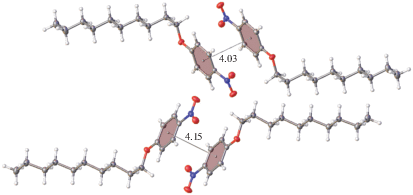
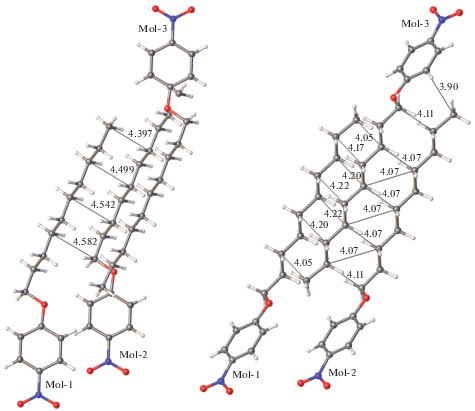
Кристаллическая упаковка. Кристаллическая упаковка I не характерна для мезоморфного кристалла (рис. 4); в ней ароматические и алифатические области не разделены. Кристаллические упаковки изоструктурных соединений II и III качественно схожи. Фрагмент упаковки одного из них, а именно II, показан на рис. 5. В данной упаковке наблюдается типичное для мезоморфных кристаллов чередование алифатических и ароматических слоев. Кратчайшие межмолекулярные расстояния между атомами соседних алифатических цепей в II превосходят суммы ван-дер-ваальсовых радиусов атомов (рис. 6). Аналогичная картина наблюдается в случае кристаллов III – различаются лишь соответствующие расстояния, но они также увеличены по сравнению со стандартными расстояниями ∼3.6, 2.4, 3.2 Å для контактов С⋅⋅⋅С, Н⋅⋅⋅Н, С⋅⋅⋅Н соответственно. Таким образом, одно из условий мезоморфизма в этих кристаллических структурах выполняется.
Рис. 6.
Кратчайшие расстояния (Å) между атомами соседних алифатических фрагментов (данные для эксперимента при 120 K).
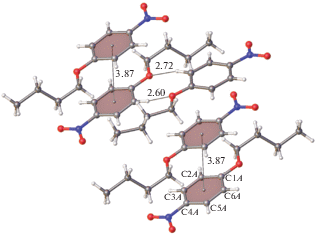
Иначе обстоит дело с выполнением второго условия – необходимости существования слабых направленных взаимодействий между функциональными группами ароматических фрагментов. Во всех трех соединениях прослеживается тенденция к формированию стэкингового димера. В структуре I в таком димере (рис. 7) расстояние между центроидами бензольных колец составляет 3.87 Å в обеих независимых молекулах, что вполне может соответствовать слабому стэкинг-взаимодействию. Но поскольку в этой структуре отсутствует первая особенность кристаллической упаковки мезоморфа, это соединение интересно только тем, что указывает на возможность образования в гомологах этого ряда слабых направленных взаимодействий между функциональными группами ароматического фрагмента. Кроме того, в этом соединении также возможно существование слабой водородной связи типа С–Н⋅⋅⋅О (расстояния Н⋅⋅⋅О 2.60 и 2.72 Å); соответствующие атомы Н являются “кислыми”, поскольку расположены в бензольном кольце в орто-позиции относительно электронакцепторного заместителя AlkO.
В кристаллической упаковке III (рис. 8) можно отметить тенденцию к образованию стэкингового димера с центросимметричным антипараллельным расположением бензольных колец, хотя расстояние между их π-системами (4.12 и 4.19 Å) слишком велико, чтобы такое взаимодействие могло бы как-то влиять на термическое поведение вещества. В этой структуре отсутствуют отмеченные в I слабые водородные связи типа С–Н⋅⋅⋅О.
Рис. 8.
Фрагмент кристаллической упаковки соединения III с возможными π-стэкинг-взаимодействиями; расстояния приведены в Å.
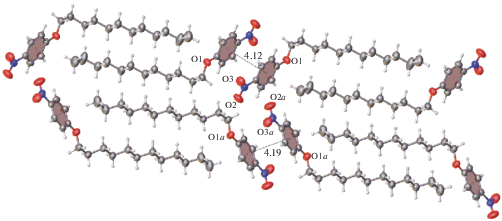
Аналогичные структурные единицы характеризуют и кристаллическую упаковку II (рис. 9). Хотя в этой структуре расстояния между π-системами бензольных колец короче, чем в III, они слишком большие, чтобы можно было рассуждать об их влиянии на сохранение структурированности расплава. Кроме того, на термограммах соединений II и III не обнаружены термические эффекты в кристаллической фазе. Это свидетельствует о том, что рассматриваемые межмолекулярные контакты не являются специфическими взаимодействиями. Поэтому отсутствие мезоморфизма у этих соединений обусловлено невыполнением условия существования в кристалле слабых направленных взаимодействий. Причина отсутствия таких взаимодействий, по-видимому, заключается в недостаточной конформационной подвижности молекул. Действительно, как свойственно алкилоксизамещенным бензолам, в каждой из молекул II и III плоскость алифатического фрагмента практически копланарна плоскости бензольного кольца вследствие сопряжения одной из неподеленных пар атома кислорода с π-системой кольца. В противоположность алкилокси производным бензола алкилзамещенные бензолы не являются плоскими. В них ориентация алкильного заместителя с такой же плоской структурой углеродного каркаса не фиксирована жестко по отношению к плоскости бензольного кольца, т.е. он более склонен к взаимной подстройке молекул для формирования стэкингового димера.
ВЫВОДЫ
Исследование AlkO–C6H4–NO2, Alk = C4H9 (I), C10H21 (II), C12H25 (III) методами РСА и ДСК показало, что соединение не проявляет мезоморфных свойств. В кристаллах II и III отсутствуют слабые направленные взаимодействия, способные обеспечить структурированность расплава. Кристаллическая упаковка I отлична от той, которая типична для мезоморфных соединений.
Рентгеноструктурный анализ проведен в ЦКП ИОНХ РАН. Работа выполнена при поддержке Российского научного фонда (грант № 16-13-10273).
Список литературы
Кузьмина Л.Г., Кучерепа Н.С. // Кристаллография. 2011. Т. 56. № 2. С. 267.
Кузьмина Л.Г., Кучерепа Н.С., Чураков А.В. // Кристаллография. 2012. Т. 57. № 2. С. 261. https://doi.org/10.1134/51063774512020137
Константинов И.И., Чураков А.В., Кузьмина Л.Г. // Кристаллография. 2013. Т. 58. № 1. С. 89. https://doi.org/10.7868/S0023476113010098
Kuzmina L.G., Konstantinov I.I., Lermontova E.Kh. // Mol. Cryst. Liq. Cryst. 2014. V. 588. P. 1. https://doi.org/10.1080/15421406.2013.822289
Кузьмина Л.Г., Константинов И.И., Беззубов С.И. // Химия высоких энергий. 2016. Т. 50. № 6. С. 478. https://doi.org/10.7868/S0023119316060115
Kuz’mina L.G., Navasardyan M.A., Churakov A.V., Howard J.A.K. // Mol. Cryst. Liq. Cryst. 2016. V. 638. P. 60. https://doi.org/10.1080/15421406.2016.1221953
Kuz’mina L.G., Konstantinov I.I., Churakov A.V., Navasardyan M.A. // Acta Cryst. E. 2017. V. 73. P. 1052. https://doi.org/10.1107/S2056989017008568
Kuz'mina L.G., Konstantinov I.I., Medvedev A.G. // Mol. Cryst. Liq. Cryst. 2017. V. 652. P. 76. https://doi.org/10.1080/15421406.2017.1357429
Кузьмина Л.Г., Навасардян М.А., Михайлов А. // Кристаллография. 2017. Т. 62. № 6. С. 889. https://doi.org/10.1134/S1063774517060153
Kuz’mina L.G., Konstantinov I.I., Churakov A.V. // Mol. Cryst. Liq. Cryst. 2018. V. 664. P. 95. https://doi.org/10.1080/15421406.2018.1470134
Кузьмина Л.Г., Навасардян М.А., Константинов И.И. // Кристаллография. 2019. Т. 64. № 1. С. 77. https://doi.org/10.1134/S002347611901017X
Кузьмина Л.Г., Навасардян М.А., Беззубов С.И. // Кристаллография. 2019. Т. 64. № 1. С. 72. https://doi.org/10.1134/S0023476119010168
Кузьмина Л.Г., Калле П., Константинов И.И., Лермонтова Э.Х. // Кристаллография. 2020. Т. 65. № 4. С. 588. https://doi.org/10.31857/S0023476120040141
Кузьмина Л.Г., Константинов И.И., Калле П., Навасардян М.А. // Криталлография. 2020. Т. 65. № 3. С. 457. https://doi.org/10.31857/S0023476120030194
Кузьмина Л.Г., Константинов И.И., Навасардян М.А. // Кристаллография. 2020. Т. 65. № 3. С. 449. https://doi.org/10.31857/S0023476120030182
Кузьмина Л.Г., Калле П., Чураков А.В. // Изв. РАН. Сер. хим. 2020. № 6. С. 1054.
Xi-Gui Yue // Acta Cryst. E. 2009. V. 65 P. o2627. https://doi.org/10.1107/S1600536810035683
Xi-Gui Yue // Acta Cryst. E. 2009. V. 65. P. o3034. https://doi.org/10.1107/S1600536809045966
Saint. Version 6.02A, Bruker AXS: Madison, W1. 2001.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Sheldrick G.M. // Acta Cryst. A. 2015. V. 71. P. 3.
Sheldrick G.M. // Acta Cryst. A. 2008. V. 64. P. 112. https://doi.org/10.1107/S010876730704393
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография