Кристаллография, 2022, T. 67, № 2, стр. 262-265
Начальная стадия изменений структуры и молекулярной динамики цитохрома с в водном растворе, происходящих при добавлении метанола
П. Д. Короткова 1, *, А. А. Юрченко 2, В. И. Тимофеев 3, 4, А. Р. Гусельникова 2, Г. К. Владимиров 6, А. Б. Шумм 1, 5, Ю. А. Владимиров 1, 2, 3, 6
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
Министерства здравоохранения Российской Федерации
Москва, Россия
3 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
4 КК НБИКС-природоподобных технологий, Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
5 Физический институт им. П.Н. Лебедева РАН
Москва, Россия
6 Институт регенеративной медицины, Первый Московский государственный медицинский университет
им. И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский университет)
Москва, Россия
* E-mail: korotkovapol@gmail.com
Поступила в редакцию 02.12.2020
После доработки 11.12.2020
Принята к публикации 11.12.2020
- EDN: WKIJJK
- DOI: 10.31857/S0023476122020096
Аннотация
Промоделирована молекулярная динамика молекулы цитохрома С из сердца лошади в водном растворе и в 50%-ном водно-метанольном растворе. Для каждой из систем проводили три независимых расчета по 100 нс. Показано, что добавление метанола существенно влияет на подвижность атомов молекулы цитохрома С на участке от валина в 20-м положении до пролина в 30-м положении, который относится к одному из известных сайтов связывания кардиолипина. При этом за 100 нс не происходит разрыва и существенного изменения длины координационной связи между железом гема и серой близлежащего метионина, а также изменения расстояний от гема до аминокислотных остатков, обеспечивающих флуоресценцию, что наблюдалось в других работах при добавлении метанола к цитохрому С.
ВВЕДЕНИЕ
Цитохром С (Цит c) – это гемсодержащий белок, имеющий в своем составе гем типа С, ковалентно связанный с белком при помощи двух расположенных аксиально по отношению к нему аминокислотных остатков. Цит с является важным участником дыхательной цепи митохондрий, выполняющим роль переносчика электронов между элементами дыхательной цепи [1]. Кроме того, при определенных условиях Цит c участвует в запрограммированной клеточной гибели по пути апоптоза [2].
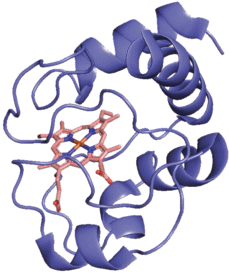
Наиболее изученным вариантом этого белка с точки зрения пространственной структуры является Цит c из сердца лошади, содержащий 105 аминокислотных остатков. Пространственная структура и аминокислотная последовательность Цит c из сердца лошади (PDB ID: 1HRC, [3]) представлены на рис. 1. Молекула Цит c содержит α-спирали, а также множество подвижных петель. Отметим, что атом железа, содержащийся в составе гема С, координирован двумя аминокислотными остатками – His-18 и Met-80.
Известно, что в определенных условиях Цит c может менять конформацию, переходя в состояние, близкое по свойствам к так называемой “moltenglobule” (расплавленная глобула), что может быть связано с изменением полярности среды [4]. Показано, что добавление кардиолипина также меняет конформацию Цит c [5]. Данный факт, учитывая участие Цит c и кардиолипина в процессе апоптоза, может быть интересен с точки зрения изучения молекулярного механизма Цит c-опосредованного апоптоза.
Получено несколько кристаллических структур, в которых Цит c из сердца лошади значительно менял конформацию [6, 7]. В [6] были получены димеры и тримеры Цит c за счет того, что координационная связь между железом гема и Met-80 разрушалась, а подвижная петля, на которой расположен Met-80, значительно меняла свою конформацию. Этого удалось достичь в растворе Цит c в калий-фосфатном буфере при объемной доле этанола, равной 60%. В [8] изучалось поведение Цит c в зависимости от типа и концентрации соли в растворе.
В настоящей работе для изучения динамики начальной стадии перехода Цит c из сердца лошади из обычной формы в состояние расплавленной глобулы промоделирована молекулярная динамика Цит c в водном растворе и в 50%-ном водно-метанольном растворе. Изучалось влияние именно метанола, так как известно, что наличие метанола способствует переходу в состояние, схожее по свойствам с расплавленной глобулой [9–11], а также в связи с тем, что при изучении взаимодействия Цит c с кардиолипином последний чаще всего присутствует в испытуемой пробе в виде метанольного раствора. Кроме того, добавление метанола в раствор может моделировать изменение полярности микроокружения Цит c в клетке. Рассмотрено влияние метанола на подвижность молекулы Цит c, а также на некоторые межатомные расстояния в глобуле Цит c.
МАТЕРИАЛЫ И МЕТОДЫ
Для расчета молекулярной динамики Цит c в водном растворе использовали структуру Цит c из сердца лошади, полученную методом рентгеноструктурного анализа (PDBID: 1HRC). Топология системы построена с использованием программного пакета AmberTools19 [12], после чего преобразована в формат GROMACS [13] с помощью программы ACPYPE [14]. Для построения топологии гема применяли параметры, полученные в [15]. Расчет молекулярной динамики проводили с использованием программного пакета GROMACS 2019.1 [13]. В качестве силового поля применяли поле amber14sb [16]. В качестве модели воды использовали TIP3P. В систему было добавлено 0.15 М KCl, а также ионы для нейтрализации суммарного заряда системы. Для релаксации структуры и во избежание стерических клэшей в дальнейших расчетах проводили минимизацию потенциальной энергии с шагом в 1 фс до максимальной силы 1000 кДж/моль/нм. Система была уравновешена в NVT- и NPT-ансамблях (100 пс каждый) при температуре 300 К и давлении 1 атм. Температуру и давление контролировали с использованием модифицированного термостата Берендсена [17] и баростата Паринелло–Рахмана [18] с временными константами tau_t = 0.1 пс и tau_p = 2 пс соответственно. Продуктивную молекулярную динамику проводили в изотермо-изобарическом ансамбле с шагом в 2 фс. Молекулярную динамику Цит с в 50%-ном водно-метанольном растворе проводили аналогичным образом, за исключением того, что в систему были добавлены молекулы метанола.
Для получения статистически достоверных результатов расчеты молекулярной динамики проведены в трех независимых повторностях для каждой из систем. Результаты представлены в виде усредненных значений (n = 3).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследована динамика молекулы Цит c в водном растворе и в 50%-ном водно-метанольном растворе.
Ранее было показано, что в присутствии метанола в Цит c происходит разрыв железо-серной связи >Fe∙S(Met80) между железом гема и серой в составе Met80. Для оценки влияния метанола на координационную связь между железом гема и серой в составе Met80 рассмотрено изменение длины этой связи во времени (рис. 2а и 2б). Из графиков видно, что за 100 нс не происходит ни разрыва данной связи, ни существенного изменения ее длины ни в водном, ни в 50%-ном водно-метанольном растворе.
Рис. 2.
Кинетика изменения межатомных расстояний в молекуле Цит c: а, б – между атомом железа в составе гема и атомом серы в составе метионина в 80-м положении, в, г – между атомом железа в составе гема и атомом азота в составе триптофана; а, в – 50%-ном водно-метанольном растворе, б, г – в водном растворе.
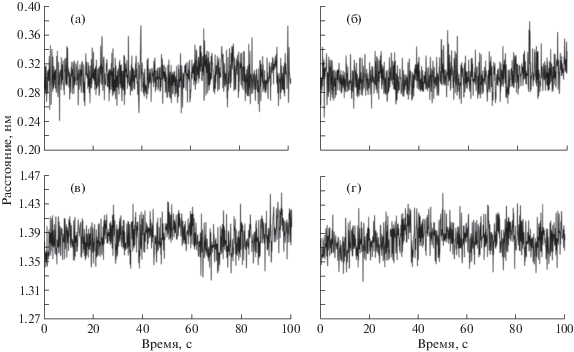
В [19] показано, что при наличии в растворе метанола Цит c приобретает флюоресценцию, характерную для остатков тирозина и триптофана. Для оценки влияния метанола на расстояния от гема до флуоресцирующих в метанольном растворе Цит c аминокислотных остатков тирозина и триптофана в настоящей работе рассмотрено изменение во времени расстояния от железа в составе гема до атомов азота в составе остатков тирозина в положениях 48, 67, 74 и 97 (данные не представлены) и остатка триптофана в положении 59 (рис. 2в, 2г). Из рисунка видно, что за 100 нс не происходит существенного изменения расстояний от гема до остатка триптофана ни в водном, ни в 50%-ном водно-метанольном растворе. Также не наблюдалось изменений расстояния от гема до остатков тирозина в обеих системах.
Полученные результаты по межатомным расстояниям можно объяснить по меньшей мере двумя причинами. Первой и наиболее простой причиной может быть то, что процесс разрыва рассматриваемой железо-серной связи и увеличения расстояния от гема до флуорофоров под действием метанола происходит за временной период, продолжительность которого больше рассмотренных 100 нс. Другая причина может заключаться в том, что условия, приводившие к разрыву железо-серной связи и увеличению расстояния от гема до флуорофоров, наблюдаемым в присутствии метанола в реальных экспериментах, вероятнее всего были также обеспечены определенными значениями pH и ионной силы в исследуемых растворах. В эксперименте по моделированию молекулярной динамики в раствор помещали ионы калия и хлора в концентрации 0.15 М, имитируя тем самым физиологические условия. Кроме того, исследуемая система была уравновешена ионами, чтобы нейтрализовать ее суммарный заряд, что необходимо для проведения расчетов. Таким образом, построенная реакционная система не в полной мере повторяет условия каждого из экспериментов, в которых показаны те изменения структуры Цит c, которые не удалось увидеть в результате расчетов молекулярной динамики.
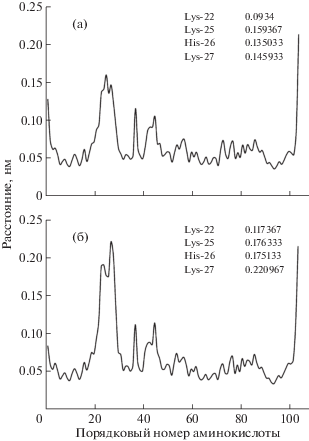
Изучено различие подвижности молекулы Цит c и отдельных ее участков в водном растворе и в 50%-ном водно-метанольном растворе. Для этого рассчитаны RMSF (root-mean-square fluctuation) Сα-атомов молекулы Цит c в обоих растворах (рис. 3). Из рисунка видно, что подвижность Сα-атомов в водном и 50%-ном водно-метанольном растворах существенно различается для аминокислотных остатков в промежутке от Val-20 до Pro-30: в присутствии метанола на этом участке происходит уменьшение значений RMSF. Примечательно, что в этой области находятся аминокислотные остатки, относящиеся к так называемому L-сайту связывания кардиолипина [20]. Таким образом, снижение RMSF в этой области указывает на то, что в присутствии метанола происходит стабилизация той части полипептидной цепочки Цит c, которая отвечает за взаимодействие с кардиолипином. На рис. 3 также видно, что за период в 100 нс изменений подвижности в других участках Цит c не происходит.
Рис. 3.
RMSF (root-mean-square fluctuation) Сα-атомов аминокислотных остатков в составе Цит c: а – в 50%-ном водно-метанольном растворе, б – в водном растворе. В текстовом виде приведены значения RMSF для атомов в составе указанных аминокислотных остатков.
Работа выполнена при поддержке Российского научного фонда (грант № 19-14-00244) в части моделирования молекулярной динамики и при поддержке Министерства науки и высшего образования в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН в части анализа результатов молекулярного моделирования.
Список литературы
Zhang Z., Huang L., Shulmeister V.M. et al. // Nature. 1998. V. 392. № 6677. P. 677. https://doi.org/10.1038/33612
Goldstein J.C., Waterhouse N.J., Juin P. et al. // Nat. Cell. Biol. 2000. V. 2. № 3. P. 156. https://doi.org/10.1038/35004029
Bushnell G.W., Louie G.V., Brayer G.D. // J. Mol. Biol. 1990. V. 214. № 2. P. 585. https://doi.org/10.1016/0022-2836(90)90200-6
Hirota S., Ueda M., Hayashi Y. et al. // J. Biochem. 2012. V. 152. № 6. P. 521. https://doi.org/10.1093/jb/mvs098
Muenzner J., Pletneva E.V. // Chem. Phys. Lipids. 2014. V. 179. P. 57. https://doi.org/10.1016/j.chemphyslip.2013.11.002
Hirota S., Hattori Y., Nagao S. et al. // PNAS. 2010. V. 107. № 29. P. 12854. https://doi.org/10.1073/pnas.1001839107
Parui P.P., Deshpande M.S., Nagao S. et al. // Biochemistry. 2013. V. 52. № 48. P. 8732. https://doi.org/10.1021/bi400986g
Deshpande M.S., Parui P.P., Kamikubo H. et al. // Biochemistry. 2014. V. 53. № 28. P. 4696. https://doi.org/10.1021/bi500497s
Bychkova V.E., Dujsekina A.E., Klenin S.I. et al. // Biochemistry. 1996. V. 35. № 19. P. 6058. https://doi.org/10.1021/bi9522460
Grandori R. // Protein Sci. 2002. V. 11. № 3. P. 453.
Kamatari Y.O., Konno T., Kataoka M. et al. // J. Mol. Biol. 1996. V. 259. № 3. P. 512. https://doi.org/10.1006/jmbi.1996.0336
Case D.A., Cheatham III T.E., Darden T. et al. // J. Comput. Chem. 2005. V. 26. № 16. P. 1668. https://doi.org/10.1002/jcc.20290
Abraham M.J., Murtola T., Schulz R. et al. // Softwarex. 2015. V. 1. P. 19. https://doi.org/10.1016/j.softx.2015.06.001
Da Silva A.W.S., Vranken W.F. // BMC Res. Notes. 2012. V. 5. № 1. P. 367. https://doi.org/10.1186/1756-0500-5-367
Giammona D.A. “An examination of conformational flexibility in porphyrins and bulky-ligand binding in myoglobin”. Ph.D. thesis, USA, Davis, University of California, 1984.
Maier J.A., Martinez C., Kasavajhala K. et al. // J. Chem. Theory Comput. 2015. V. 11. № 8. P. 3696. https://doi.org/10.1021/acs.jctc.5b00255
Berendsen H.J., Postma J.V., van Gunsteren W.F. et al. // J. Chem. Phys. 1984. V. 81. № 8. P. 3684. https://doi.org/10.1063/1.448118
Parrinello M., Rahman A. // J. Chem. Phys. 1982. V. 76. № 5. P. 2662. https://doi.org/10.1063/1.448118
Владимиров Г.К. “Структура и пероксидазная функция комплекса цитохрома С с кардиолипином в водной среде и в неполярном окружении” Дис. … канд. биол. наук. М.: РНИМУ, 2018.
Kagan V.E., Bayır H.A., Belikova N.A. et al. // Free Radic. Biol. Med. 2009. V. 46. № 11. P. 1439. https://doi.org/10.1016/j.freeradbiomed.2009.03.004
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография