Кристаллография, 2022, T. 67, № 2, стр. 239-248
Кристаллизация комплексов нитрилотриуксусной кислоты с органическими аминами: молекулярная структура нитрилотриацетата гексаметилен-1,6-диаминия
В. В. Семенов 1, *, О. В. Новикова 1, Р. В. Румянцев 1, Б. И. Петров 1, Е. Н. Разов 2, 3
1 Институт металлоорганической химии им. Г.А. Разуваева РАН
Нижний Новгород, Россия
2 Институт проблем машиностроения РАН
Нижний Новгород, Россия
3 Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
* E-mail: vvsemenov@iomc.ras.ru
Поступила в редакцию 12.11.2020
После доработки 29.01.2021
Принята к публикации 29.01.2021
- EDN: MZWCQD
- DOI: 10.31857/S0023476122020175
Аннотация
Представлены способы получения и очистки методом перекристаллизации солей аминов нитрилотриуксусной кислоты N(CH2COOH)3: нитрилотриацетата бис(2-аминий пропионовой кислоты) [HN(CH2COO)3]2–[H3NCH2CH2COOH]$_{2}^{ + }$, нитрилотриацетата трет-бутиламиния [HN(CH2COOH) (CH2COO)2]–[H3NC(CH3)3]+, нитрилотриацетата гексаметилендиаминия [HN(CH2COOH)(CH2COO)2]$_{2}^{ - }$ [H3N(CH2)6NH3]2+, нитрилотриацетата триэтаноламиния [HN(CH2COOH)(CH2 COO)2]–[HN(CH2CH2OH)3]+ ⋅ ⋅ Н2О, нитрилотриацетата бис(триэтаноламиния) [HN(CH2COO)3]2–[HN(CH2CH2OH)3]$_{2}^{ + }$, нитрилотриацетата тетраметилэтилендиаминия [HN(CH2COOH)(CH2 COO)2]$_{2}^{ - }$[HMe2NCH2CH2NMe2H]2+, нитрилотриацетата 1,4-диазабицикло[2,2,2]октана [HN(CH2 COOH)(CH2COO)2]$_{2}^{ - }$[HN(CH2CH2)3NH]2+ ⋅ ⋅ Н2О. 2-Аминопропионовая кислота, трет-бутиламин, триэтаноламин и 1,4-диазабицикло[2,2,2]октан образуют в реакции с нитрилотриуксусной кислотой игольчатые или нитевидные кристаллы, тетраметилэтилендиамин дает пластинчатые кристаллы, гексаметилендиамин – смесь игольчатых и пластинчатых кристаллов. Соединения исследованы методами ИК-спектроскопии, оптической и растровой электронной микроскопии, масс-спектрометрии, дифференциальной сканирующей калориметрии. Представлена молекулярная структура нитрилотриацетата гексаметилен-1,6-диаминия.
ВВЕДЕНИЕ
Соли аминов представляют собой важный класс органических производных, используемых в качестве фармацевтических препаратов [1], в процессах глубокой очистки как индивидуальных соединений, так и смеси углеводородов, выделяемых из нефти. Переведение аминов в водорастворимое состояние достигается посредством реакций с протонными кислотами. N-карбоксиметил-трис(гидроксиметил)аминометан (трицин) (HOCH2)3C–NH$_{2}^{ + }$–CH2–COO–) известен как буфер в биохимических исследованиях и комплексообразователь для многих катионов [2], а также как эффективная ловушка гидроксильных радикалов [3]. Его аналог – N-карбоксиэтил-трис(гидроксиметил)аминометан (гомотрицин) (HOCH2)3C–NH$_{2}^{ + }$–CH2CH2–COO–) – используется для связывания ионов TcO42– c целью последующего введения в живой организм в качестве радиоактивной метки [2]. Аминиевые производные триэтаноламина и 2-метилфеноксиуксусной кислоты [HN(CH2CH2OH)3]+[CH3–C6H4–CH2 COO]– – “крезацин” и “трекрезан” – применяются в медицине и сельском хозяйстве [4–6]. Известны несколько примеров приложений солей аминов в синтезе [7–14]. Синтезированы и изучены кристаллическая и молекулярная структура хлорида 1-(3-аминийпропил)силатрана [N(CH2 CH2O)3SiCH2CH2CH2NH3]+Cl– [15], сульфата трис(гидроксиметил)аминийметана [(HOCH2)3 C–NH3]$_{2}^{ + }$[SO4]2– [16], моногидрата сульфита N-(гидроксиэтил)этилендиаминия [HOCH2CH2NH2CH2CH2NH3]2+[SO3]2– [17], трис(2-гидроксиэтил)аминиевой соли янтарной кислоты [HN (CH2CH2OH)3]$_{2}^{ + }$[O(О)С–CH2CH2–C(O)O]2– [18].
Хлористый аммоний при нагревании диссоциирует до летучих продуктов (аммиака и хлористого водорода), которые в холодной части прибора конденсируются, превращаясь в исходное соединение [19]. Аналогичным превращениям могут подвергаться соли органических аминов. Физико-химия такого рода реакций представляет интерес для процесса очистки нефти [20]. Содержащиеся в ее составе кислотные примеси вызывают коррозию металлов при транспортировке и переработке. Добавки органических аминов позволяют связать кислоты нефти в нелетучие нейтральные производные и уменьшить их коррозионное действие. Одним из эффективных рафинирующих реагентов является моноэтаноламин (2-аминоэтанол). Данный реагент используется также в технологии выделения СО2 из отходящих газов [21].
Методы получения и свойства аминопроизводных простых протонных кислот хорошо изучены. Получение высокочистых препаратов особенно актуально для фармации. Очистка возможна методами вакуумной сублимации и перекристаллизации из водной или органической сред. В настоящей работе представлены способы получения и очистки методом перекристаллизации солей аминов нитрилотриуксусной кислоты N(CH2COOH)3 (НТА) – доступного и широко используемого комплексообразующего реагента, называемого также комплексоном-1 [22]. В работе были использованы следующие амины: 2-аминопропионовая кислота (бэта-аланин (Ала)) H2N–CH2CH2C(O)OH, трет-бутиламин (ТБА) H2N–C(CH3)3, гексаметилен-1,6-диамин (ГМДА) H2N(CH2)6NH2, триэтаноламин (ТЭА) N(CH2CH2OH)3, тетраметилэтилендиамин (ТМЕДА) (CH3)2N–CH2CH2–N(CH3)2, 1,4-диазабицикло [2,2,2 ]октан (ДАБКО) N(CH2CH2)3N ⋅ Н2О.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методы анализа
ИК-спектроскопия. ИК-спектры соединений в виде суспензии в вазелиновом (область 1400–400 см–1) и фторированном (4000–1400 см–1) маслах между пластинами KBr регистрировали на ИК-фурье-спектрометре ФСМ 1201.
Элементный анализ и микроскопия. Элементный анализ выполнен на автоматическом элементном анализаторе Vario EL cube (Elementar Analysensysteme GmbH) в конфигурации CHNS, газ-носитель – гелий марки 6.0. Для оптической микроскопии применяли микроскоп Микромед 3 производства “Нингбо Шепт Хенг Оптикс энд Электроникс Ко., ЛТД” с цифровой камерой ToupCam14MP, КНР (ООО “Наблюдательные приборы”, Санкт-Петербург), электронная микроскопия выполнена с помощью растрового электронного микроскопа Tescan VEGA II. Микрорельеф исследовали при увеличениях от 500× до 50 000× при ускоряющем напряжении 20 кВ и рабочем расстоянии 2–8 мм. Использовали детекторы вторичных и обратно рассеянных электронов. Фотографии нитевидных кристаллов получены с помощью фотокамеры NEX-5 HD VCHD с объективом SEL-1855 (Sony).
Масс-спектроскопия. Масс-спектры измерены на хромато-масс-спектрометре Polaris Q с хроматографом Trace GC Ultra.
Дифференциально-сканирующая калориметрия. Термический анализ выполнен на дифференциальном сканирующем калориметре (ДСК) DSC 204 F1 Phoenix фирмы Netzsch. Скорость нагрева составляла 5 град/мин, скорость подачи аргона – 20 мл/мин. Измерения проводили в температурном интервале 25–300°С.
Рентгеноструктурный анализ. Структурные данные для соединения {[HN(CH2COOH)(CH2 COO)2]–}2[H3N(CH2)6NH3]2+ получены на дифрактометре Bruker D8 Quest (графитовый монохроматор, МоKα-излучение, ω-сканирование, λ = = 0.71073 Å) при 100(2) К. Интегрирование экспериментального набора интенсивностей проведено при помощи программы SAINT [23]. Программа SADABS [24] использована для учета поглощения кристалла. Структура решена с использованием программы SHELXT [25] и уточнена полноматричным МНК по $F_{{hkl}}^{2}$ в анизотропном приближении тепловых смещений всех атомов, кроме водорода, с помощью программы SHELXL [26]. Атомы водорода H(1)–H(10) локализованы из разностного фурье-синтеза и уточнены в изотропном приближении смещений. Остальные атомы водорода помещены в геометрически рассчитанные положения и уточнены в изотропном приближении с использованием модели “наездника” (Uiso(H) = 1.2Ueq(C)). Основные кристаллографические характеристики соединения {[HN(CH2COOH)(CH2COO)2]–}2[H3N(CH2)6NH3]2+ (C18H34N4O12) приведены в табл. 1. Структура депонирована в Кембриджскую базу структурных данных (CCDC 2036303).
Таблица 1.
Кристаллографические характеристики, данные эксперимента и результаты уточнения структуры {[HN(CH2COOH)(CH2COO)2]–}2[H3N(CH2)6NH3]2+
| Химическая формула | C18H34N4O12 |
|---|---|
| М, г/моль | 498.49 |
| Пр. гр., Z | P21/c, 4 |
| a, b, c, Å | 13.3502(11), 17.4665(13), 9.8193(8) |
| β, град | 90.083(3) |
| V, Å3 | 2289.7(3) |
| Dx, г/см3 | 1.446 |
| μ, см–1 | 0.122 |
| Т, К | 100 |
| Размеры кристалла, мм | 0.28 × 0.12 × 0.04 |
| F(000) | 1064 |
| Пределы h, k, l | –15 ≤ h ≤ 14, –20 ≤ k ≤ 20, –11 ≤ l ≤ 11 |
| (sin θ/λ)max | 0.595 |
| Число отражений: измеренных/независимых, Rint | 17 056/4038, 0.0686 |
| Число параметров | 338 |
| S | 1.011 |
| R1/wR2 (все отражения) | 0.0462/0.0950 |
| R1/wR2 (I > 2σ(I)) | 0.0810/0.1082 |
| Δρmin/Δρmax, э/Å3 | –0.255/0.263 |
Синтез
Реактивы. В работе использовали нитрилотриуксусную кислоту квалификации Ч, ЛАБХИМ (Санкт-Петербург), ТУ 10329-74; триэтаноламин квалификации Ч производства ООО “Синтез ОКА”, г. Дзержинск, ТУ 2423-005-78722668-2010, АО “ЭКОС-1”; бэта-аланин, Ч, ТУ 6-09-08-1451-80, трет-бутиламин ТУ 6-09-06-490-75 и гексаметилен-1,6-диамин, Ч, ТУ 6-09-36-73 Ереванский завод химреактивов; 2,2'(этилендиокси)бис(этиламин) Fluka; тетраметилэтилендиамин и 1,4-диазабицикло [2, 2, 2 ]октан, Sigma-Aldrich Chemie GmbH.
Нитрилотриацетат бис(2-аминий пропионовой кислоты). Растирали в ступке совместно 2.00 г (1.05 × 10–2 моль) НТА и 1.90 г (2.13 × 10–2 моль) Ала. Полученную смесь присыпали порциями при перемешивании к 60 мл метанола. Через 15 мин суспензия загустела, через 45 мин потеряла текучесть. После добавления 10 мл метанола смесь размешивали, фильтровали через фильтр Шотта, осадок промывали метанолом, сушили в вакууме при нагревании до 100°С. Получили 3.30 г (8.94 × × 10–2 моль, 85%) нитрилотриацетата бис(2-аминий пропионовой кислоты) [HN(CH2 COO)3]2–[H3NCH2CH2COOH]$_{2}^{ + }$ в виде мягкого белого порошка, плохо растворимого в метиловом, этиловом, изопропиловом спиртах, не растворимого в ацетоне, ацетонитриле, бутилацетате, набухающего в этилцеллозольве и растворимого в этиленгликоле. Из кипящего метанола после охлаждения получили кристаллы в виде толстых длинных игл. ИК-спектр: 3202 плечо (пл), 3074 пл, 2746, 2606, 2520, 2109, 1954, 1724, 1692, 1653 пл, 1620, 1557, 1531, 1417, 1393, 1316, 1239, 1215 пл, 1158, 1122, 1075, 1042, 970, 923, 905, 792, 702, 678, 613, 592, 550, 529, 488 см–1. Масс-спектр (m/e): 67, 79, 81, 88, 95, 97, 102, 118, 121, 146, 149, 161, 171, 185, 213, 221, 255, 299, 313(5), 353, 368(32). Элементный анализ: найдено: С 39.54, Н 6.28 мас. %, C12H23N3O10. Вычислено: С 39.02, Н 6.28 мас. %.
Нитрилотриацетат трет-бутиламиния. К суспензии 2.20 г (1.05 × 10–2 моль) НТА в 30 мл ацетона при перемешивании добавили раствор 1.68 г (2.30 × 10–2 моль) ТБА в 20 мл ацетона. Визуально установили отсутствие протекания реакции в течение 4 ч, после чего добавили 10 мл метанола и наблюдали медленное образование объемистого осадка. Через 12 ч смесь фильтровали, осадок промывали ацетоном, сушили в вакууме при 100°С. Получили 2.75 г (1.04 × 10–2 моль, 90%) мелкого белого порошка, растворимого в метиловом, этиловом спиртах, этиленгликоле, плохо растворимого в изопропиловом спирте, диоксане, ацетонитриле, не растворимого в бутилацетате. Перекристаллизацией из горячего раствора диоксан:метанол 10:1 получили мелкие игольчатые кристаллы нитрилотриацетата трет-бутиламиния [HN(CH2COOH)(CH2COO)2]–[H3NC(CH3)3]+ в виде мягкого белого порошка. ИК-спектр: 3589, 3425, 3053 пл, 2749, 2630, 2535, 2132, 1721 пл, 1656, 1602, 1539, 1459, 1396, 1376, 1352, 1313, 1218, 1122, 1081, 1048, 976, 911, 872, 702, 613, 532, 458 см–1. Масс-спектр (m/e): 74, 88, 95, 97, 121, 146, 161, 185, 213, 247, 255, 260, 285, 313(15), 326, 353, 368(43), 395, 409. Элементный анализ: найдено: С 45.24, Н 8.09, N 11.20 мас. %, C10H20N2O6. Вычислено: С 45.45, Н 7.63, N 10.60 мас. %.
Нитрилотриацетат гексаметилен-1,6-диаминия. К суспензии 2.46 г (1.29 × 10–2 моль) НТА в 30 мл Н2О при перемешивании добавили раствор 1.50 г (1.29 × 10–2 моль) ГМДА в 10 мл Н2О. Образовавшийся прозрачный раствор фильтровали, помещали в широкий бюкс и оставляли открытым. Выпавшие через 8 сут из концентрированного раствора влажные нитевидные кристаллы заливали этиловым спиртом, размешивали, фильтровали, спирт удаляли в вакууме. Получили 2.70 г (8.30 × 10–3 моль, 64%) нитрилотриацетата гексаметилендиаминия {[HN(CH2COOH)(CH2COO)2]–}2[H3N(CH2)6NH3]2+ в виде белого порошка. Медленным охлаждением горячего насыщенного спиртового раствора получали смесь игольчатых и пластинчатых кристаллов. Для рентгеноструктурного анализа были отобраны кристаллы в виде пластинок. ИК-спектр: 3425, 3151 пл, 3074 пл, 2767 пл, 2722, 2666, 2600, 2558, 2487, 2135, 1665, 1605, 1513, 1396, 1376, 1352, 1313, 1250, 1200, 1158, 1051, 1003, 967, 953, 908, 744, 699, 532, 476 см–1. Масс-спектр (m/e): 67, 79, 81, 95, 97, 121, 135, 148, 163, 178, 185, 199, 227, 255, 299, 313(55), 339, 353, 368(62), 395, 423, 452, 495. Элементный анализ: найдено: С 44.01, Н 7.48, N 11.90 мас. %, C18H34N4O12. Вычислено: С 43.35, Н 6.88, N 11.24 мас. %.
Нитрилотриацетат триэтаноламиния. К суспензии 2.00 г (1.05 × 10–2 моль) НТА в 30 мл метанола при перемешивании добавили раствор 3.12 г (2.09 × 10–2 моль) ТЭА в 20 мл метанола. Через 24 ч плотный осадок на дне колбы размешали, фильтровали, промывали метанолом, сушили на воздухе, нагревали в вакууме до 110°С. Получили 3.00 г (8.38 × 10–3 моль, 80%) нитрилотриацетата триэтаноламиния [HN(CH2COOH)(CH2COO)2]–[HN(CH2CH2OH)3]+ ⋅ Н2О в виде мягкого белого, сильно электризующегося порошка. Длинные игольчатые кристаллы в виде мягкой ваты выделили перекристаллизацией из горячего водного раствора. ИК-спектр: 3315, 3145, 3008, 2731, 2442, 1992 пл, 1924 пл, 1733, 1694, 1456, 1399, 1376, 1361 пл, 1334, 1253, 1206, 1101, 1075, 1030, 1006, 961, 920, 905, 881, 711, 595, 524, 488 см–1. Масс-спектр (m/e): 81, 88, 118, 147, 186, 206, 227, 254, 285, 313(100), 339, 368(48), 395, 423, 452, 495, 509, 523, 537, 565, 577. Элементный анализ: найдено: С 40.94, Н 6.24, N 7.97 мас. %, C19H26N2O10. Вычислено: С 40.21, Н 7.32, N 7.82 мас. %.
Нитрилотриацетат бис(триэтаноламиния). К суспензии 4.00 г (2.10 × 10–2 моль) НТА в 70 мл Н2О при перемешивании добавили раствор 6.20 г (4.18 × 10–2 моль) ТЭА в 20 мл Н2О. Через 5 мин суспензия НТА растворилась. Прозрачный раствор оставили в открытом стакане. Через 8 сут выпавшие кристаллы фильтровали, сушили на воздухе. Получили 0.87 г (1.78 × 10–3 моль, 9%) нитрилотриацетата бис(триэтаноламиния) [HN(CH2COO)3]2–[HN(CH2CH2OH)3]$_{2}^{ + }$ в виде длинных игл. ИК-спектр: 3566, 3147, 3001, 2985, 2880, 2687, 2563, 1634, 1474, 1438, 1424, 1384, 1317, 1270, 1239, 1142, 1128, 1092, 1054, 1019, 946, 915, 870, 711, 606, 573, 532, 493 см–1. Элементный анализ: найдено: С 43.76, Н 7.77, N 8.58 мас. %, C18H39N3O12. Вычислено: С 44.15, Н 8.03, N 8.59 мас. %.
Нитрилотриацетат тетраметилэтилендиаминия. К суспензии 2.00 г (1.05 × 10–2 моль) НТА в 50 мл метанола при перемешивании добавили раствор 2.43 г (2.09 × 10–2 моль) ТМЕДА в 20 мл метанола. Через 20 мин суспензия НТА растворилась. Метанол отогнали, к жидкому вязкому остатку добавили 20 мл ацетона. Выпавший осадок фильтровали, промывали метанолом, сушили на воздухе. Получили 2.30 г (4.62 × 10–3 моль, 22%) сырого продукта в виде белого мягкого порошка. Пластинчатые кристаллы нитрилотриацетата тетраметилэтилендиаминия [HN(CH2COOH) (CH2COO)2]$_{2}^{ - }$ [HMe2NCH2CH2NMe2H]2+ выделили из горячего метанола. ИК-спектр: 3637, 3425, 3354 пл, 3074, 2725, 2669, 2624, 2389, 1730 пл, 1688, 1629, 1396 пл, 1355, 1307, 1268, 1245 пл, 1158, 1087, 1042, 1024, 1012, 985, 961, 926, 893, 848, 723, 687, 610, 544, 470 см–1. Масс-спектр (m/e): 79, 81, 95, 121, 147, 161, 185, 236, 285, 313(100), 339, 368(44), 395, 423, 451, 495, 509, 523, 551, 565. Элементный анализ: найдено: С 42.72, Н 7.08, N 10.84 мас. %, C18H34N4O12. Вычислено: С 43.55, Н 6.88; N 11.24 мас. %.
Нитрилотриацетат 1,4-диазабицикло [2,2,2 ]октана (нитрилотриацетат триэтилендиаминия). К суспензии 2.00 г (1.05 × 10–2 моль) НТА в 25 мл ацетона при перемешивании добавили раствор 2.72 г (2.09 × 10–2 моль) ДАБКО в 30 мл ацетона. Образовавшийся осадок фильтровали, промывали ацетоном, нагревали в вакууме до 100°С. Получили 2.2 г (4.29 × 10–3 моль, 41%) нитрилотриацетата 1,4-диазабицикло [2,2,2 ]октана [HN(CH2COOH)(CH2COO)2]$_{2}^{ - }$[HN(CH2CH2)3NH]2+ ⋅ ⋅ Н2О в виде белого порошка. Игольчатые кристаллы выделили из горячего этилового спирта. ИК-спектр: 3425, 3175, 3095, 3065, 3005, 2722, 2669, 2618, 1733 пл, 1688, 1623 пл, 1364, 1340, 1310, 1051, 1003, 967, 905, 836, 777, 714, 616, 583, 529 см–1. Масс-спектр (m/e): 81, 112, 149, 161, 193, 203, 238, 244, 285, 298, 313(11), 356, 358, 412. Элементный анализ: найдено: С 41.84, Н 5.94, N 10.87 мас. %, C18H32N4O13. Вычислено: С 42.17, Н 6.29, N 10.93 мас. %.
Реакция нитрилотриацетата 1,4-диазабицикло [2,2,2 ]октана с трет-бутиламином. К суспензии 0.75 г (1.46 × 10–3 моль) нитрилотриацетата 1,4-диазабицикло [2,2,2 ]октана в 25 мл ацетона прибавили 0.21 г (2.92 × 10–3 моль) трет-бутиламина в 5 мл метанола. Смесь перемешивали при нагревании в течение двух часов, фильтровали, сушили на воздухе. Получили 0.95 г (2.68 × 10–3 моль, 92%) мягкого белого порошка, ИК-спектр которого оказался полностью идентичным спектру нитрилотриацетата трет-бутиламиния.
Нитрилотриацетат трис(гидроксиметил)аминийметана [HN(CH2COO)3]2–[H3NC(CH2OH)3]$_{2}^{ + }$. Масс-спектр (m/e): 81, 121, 147, 161, 213, 227, 255, 285, 313(65), 339, 368(100) 395, 423, 480, 509, 523, 551, 577. Элементный анализ: найдено: С 38.55, H 7.25 мас. %, C14H31N3O12. Вычислено: С 38.80, H 7.16 мас. %.
Нитрилотриацетат 2,2´-(этилендиокси)бис(этиламиния) [NH(CH2COO)3]2–[H3NCH2CH2OCH2CH2 OCH2CH2NH3]2+. Масс-спектр (m/e): 67, 79, 81, 95, 97, 121, 146, 185, 199, 213, 255, 260, 299, 313(54), 339, 353, 368(72), 395, 423, 452, 480.
НТА. Масс-спектр (m/e): 60, 74, 88, 102, 118, 146, 173, 192, 213, 228, 313(4), 368(3).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
НТА представляет собой трехосновную кислоту [22] с постепенно убывающей кислотностью: ${\text{р}}K_{{\text{a}}}^{1}$ = 1.8, ${\text{р}}K_{{\text{a}}}^{2}$ = 2.48, ${\text{р}}K_{{\text{a}}}^{3}$ = 9.71. Две свободные кислотные группировки в ее бетаиновой структуре +HN(CH2COO─)(CH2COOH)2 позволяют надеяться на максимальное присоединение только двух молекул амина. В связи с этим реакции проводили в молярном соотношении НТА : амин = = 1 : 2. Проведенные исследования показали, что стехиометрия 1 : 2 в получающихся комплексах реализуется для Ала, 1 : 1 – для ТБА. НТА присоединяла одну молекулу ТЭА, если реакцию проводили в среде метанола, и две молекулы, если в водной среде. ГМДА, ТМЕДА и ДАБКО, имеющие два атома азота, присоединили по две молекулы НТА, т.е. реализовалась стехиометрия 2 : 1.
НТА плохо растворяется в воде, спиртах и полярных органических растворителях. Прибавление к ее водной суспензии раствора амина вызывало достаточно быстрое растворение вследствие образования соли. Медленное испарение воды приводило к выпадению хорошо структурированного осадка, налипающего на стенки и дно сосуда. Аминиевая соль обычно кристаллизовалась на дне в виде длинных игл или нитей, выходящих из нескольких центров, как это показано на рис. 1 для нитрилотриацетата бис(2-аминийпропионовой кислоты). Аналогичная картина наблюдалась при медленном испарении воды из раствора нитрилотриацетата аминийуксусной кислоты.
Рис. 1.
Выросшие в водном растворе из трех центров, радиально расположенные нитевидные кристаллы нитрилотриацетата бис(2-аминийпропионовой кислоты) [HN(CH2COO)3]2–[H3NCH2CH2COOH]$_{2}^{ + }$.

Иглы (или нити) прочно связаны образующимся в ходе реакции олигомером, имеющим по данным ИК-спектроскопии такой же химический состав. Кристаллы и олигомер растворялись только в воде, в связи с чем разделить их с помощью каких-либо органических растворителей не удалось. Проведение реакции в среде метанола позволило получить легко отделяющиеся друг от друга (не склеенные олигомером) игольчатые кристаллы. Прибавление раствора амина к суспензии НТА в метаноле в конечном итоге вызывало образование осадка, который можно было отфильтровать и промыть метанолом. В случае ТМЕДА наблюдалось только растворение суспензии НТА. Образование осадка достигали отгонкой основного количества метанола и добавлением к получающемуся вязкому остаткку ацетона. Синтез производного ТБА проводили в среде ацетона. Кристаллы выпадали в виде тонких игл, не пригодных для проведения рентгеноструктурного анализа.
Ранее [27] были представлены структуры комплексов НТА с моноэтаноламином и трис(гидроксиметил)аминометаном. В реакции ГМДА с НТА удалось получить достаточно крупные кристаллы, необходимые для выполнения рентгеноструктурного анализа. В независимой области ячейки на один дикатион [H3N(CH2)6NH3]2+ приходится димерная частица {[HN(CH2COOH)(CH2COO)2]–}2 с общим зарядом –2 (рис. 2а). Расстояния O(1)–H(4) и H(4)–O(11) составляют 1.11(4) и 1.34(3) Å соответственно. Димерные частицы в кристалле формируют бесконечные цепочки за счет водородных связей O(5)–H(3)⋅⋅⋅O(9A). Расстояние H(3)⋅⋅⋅O(9A) составляет 1.75(3) Å, что свидетельствует о наличии специфического взаимодействия между соседними димерными частицами НТА [28]. Атомы водорода двух оставшихся карбоксильных групп нитрилотриуксусной кислоты, которые не участвуют в образовании цепи, мигрируют к атому азота молекулы НТА и атому азота ГМДА. Основные расстояния приведены в табл. 2. Отметим, что все длины связей в структуре находятся в хорошем согласии с длинами связей ранее опубликованных родственных соединений [29–31]. В кристалле молекулы ГМДА образуют взаимодействия H⋅⋅⋅O с димерными частицами HTA, формируя бесконечные 3D-сети (рис. 2б). Каждый из шести атомов водорода NH3-групп взаимодействует с атомом кислорода карбоксильной группы нитрилотриуксусной кислоты. Соответствующие расстояния H⋅⋅⋅O варьируются в интервале 1.82(4)–1.95(4) Å.
Рис. 2.
Молекулярная структура нитрилотриацетата гексаметилен-1,6-диаминия (a), тепловые эллипсоиды приведены с 30%-ной вероятностью. Две проекции кристаллической упаковки нитрилотриацетата гексаметилен-1,6-диаминия (б), пунктирными линиями обозначены межмолекулярные взаимодействия O⋅⋅⋅H.
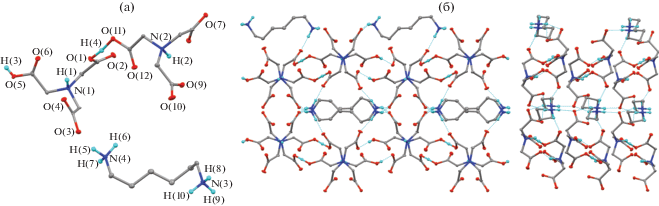
Таблица 2.
Основные расстояния в нитрилотриацетате гексаметилен-1,6-диаминия {[HN(CH2COOH)(CH2COO)2]–}2 [H3N(CH2)6NH3]2+
| Связь | Расстояние, Å | Связь | Расстояние, Å |
|---|---|---|---|
| N(1)–C(1) | 1.497(4) | N(2)–C(7) | 1.492(4) |
| N(1)–C(3) | 1.496(4) | N(2)–C(9) | 1.496(4) |
| N(1)–C(5) | 1.489(4) | N(2)–C(11) | 1.489(4) |
| O(1)–C(2) | 1.276(4) | O(7)–C(8) | 1.257(4) |
| O(2)–C(2) | 1.238(4) | O(8)–C(8) | 1.241(4) |
| O(3)–C(4) | 1.279(4) | O(9)–C(10) | 1.267(4) |
| O(4)–C(4) | 1.233(4) | O(10)–C(10) | 1.226(4) |
| O(5)–C(6) | 1.294(4) | O(11)–C(12) | 1.306(4) |
| O(6)–C(6) | 1.210(4) | O(12)–C(12) | 1.221(4) |
| N(3)–C(13) | 1.478(3) | N(4)–C(18) | 1.486(3) |
Игольчатые кристаллы НТА ⋅ 2Ала и НТА ⋅ ТБА (рис. 3) наиболее типичны, обычно получаются после перекристаллизации из чистого метанола или из метанола с добавками диоксана или тетрагидрофурана. Они представляют собой набор длинных игл разной толщины. При большом увеличении можно заметить продольное сращивание.
Рис. 3.
Игольчатые кристаллы нитрилотриацетата бис(2-аминий пропионовой кислоты) [HN(CH2COO)3]2–[H3NCH2CH2COOH]$_{2}^{ + }$ (а, б) и нитрилотриацетата трет-бутиламиния [HN(CH2COOH)(CH2COO)2]–[H3NC(CH3)3]+ (в). Фотографии получены с увеличением 40× (а, в) и 200× (б).

Толщина игольчатых кристаллов, полученных в реакции НТА с ТЭА в среде метанола и перекристаллизованных из воды (рис. 4), составляет от 1 до 20 мкм, длина – до 1 мм. Наличие коротких игл объясняется их малой прочностью. Разломы могут происходить не только в поперечном, но и в продольном направлении. Удачно расположенный торцевой частью короткий обломок на рис. 4б свидетельствует о том, что кристалл имеет полую структуру. Канал в основном повторяет фигуру наружной оболочки – симметричного шестиугольника. Продольный разлом на рис. 4в показывает внутреннюю ребристую структуру канала. Наличие каналов ранее наблюдали в нитевидных кристаллах парааминобензойной кислоты [32]. Чтобы их надежно зафиксировать, необходимо было провести металлизацию поверхности с помощью октакарбонила дикобальта. Органические микрокристаллы не обладают высокой термической и лучевой устойчивостью. Растровая электронная микроскопия (РЭМ) позволила наблюдать возможность плавления и “сварки” микрокристаллов под действием электронного луча. При нарастании мощности в определенный момент происходит (рис. 4г) плавление и срастание с находящимся рядом микрокристаллом.
Рис. 4.
РЭМ-изображения игольчатых кристаллов нитрилотриацетата триэтаноламиния [HN(CH2COOH)(CH2COO)2]–[HN(CH2CH2OH)3]+ ⋅ ⋅ Н2О (а–в), полученные с разным увеличением; плавление и “сварка” микрокристаллов (г).

Если реакцию НТА с ТЭА проводили в дистиллированной воде и затем выпавший осадок перекристаллизовывали из воды, то получали другой тип кристаллов (рис. 5), представляющих собой смесь тонких иголок и еще более тонких волокон. Параллельно упакованные волокна заполняют пространство между иглами. Ориентация волокон относительно иголок изменяется от почти ортогональной до почти параллельной.
Рис. 5.
Оптическое изображение игольчато-волокнистой структуры кристаллов нитрилотриацетата бис(триэтаноламиния) [HN(CH2COO)3]2–[HN(CH2CH2OH)3]$_{2}^{ + }$, полученное при разном увеличении: а – 40×, б – 100×, в – 200×.

В реакции НТА с ТМЕДА получены пластинчатые кристаллы (рис. 6). Большие пластины достигают величины 200 × 400 мкм и имеют края в виде трапеций. Толщина пластин составляет 5–10 мкм. Большая часть разломов происходит в ортогональных направлениях. Под действием пучка электронов поверхность кристалла подплавляется и вспучивается из-за выделяющихся газов. На рис. 6в показано действие электронного луча на небольшие участки квадратной формы. При большой мощности в месте падения луча происходит плавление, выброс вещества и застывание в виде рыхлой пены. Сканирование пучком электронов меньшей мощности вызывает образование квадратов с разной степенью плавления и вспучивания. При минимальном воздействии возможно получение фигур с относительно ровной поверхностью. Внешне полученная картина скорее напоминает квадратики, приклеенные на ровный лист бумаги.
Рис. 6.
Оптическое (а) и РЭМ-изображение (б, в) пластинчатых кристаллов нитрилотриацетата тетраметилэтилендиаминия [HN(CH2COOH)(CH2COO)2]$_{2}^{ - }$ [HMe2NCH2CH2NMe2H]2+. Трансформация кристалла под действием пучка электронов (в). Увеличение 40× (а).

Из семи полученных аминиевых солей в молекулах пяти производных имеются свободные одна или две кислотные группы –СООН. Представлялось интересным выяснить, способны ли они присоединить еще одну (или две) молекулы амина. Проверка этого предположения была сделана на примере реакции нитрилотриацетата 1,4-диазабицикло [2, 2, 2 ]октана с трет-бутиламином. Вместо присоединения произошло переаминирование, т.е. нитрилотриацетат 1,4-диазабицикло [2, 2, 2 ]октана превратился в нитрилотриацетат трет-бутиламиния:
ИК-спектры. ИК-спектр Ала свидетельствует о его бетаиновой структуре. Двойная полоса валентных колебаний первичной аминной группы в области 3500–3400 см–1 отсутствует, но есть интенсивная полоса поглощения четвертичной аминной группы при 3105 см–1, характерной для аминокислот. Три сильных полосы в диапазоне 1750–1420 см–1 свидетельствуют о наличии карбоксилатного аниона. Взаимодействие с более сильной НТА должно привести к образованию более прочного комплекса кислота–амин и высвобождению карбоксильной группы бэта-аланина:
ИК-спектр производного трет-бутиламина содержит все ожидаемые полосы поглощения для структуры HO(O)C–CH$_{2}^{ + }$NH–CH2–C(O)O–+H3N–C(CH3)3: сильную полосу 3053 см–1 и серию менее интенсивных полос четвертичных аминных групп С–NH$_{3}^{ + }$ и C3NH+ в диапазоне 3000–2000 см–1. Карбоксилатный анион характеризуется сильной полосой 1602 см–1 и более слабой 1459 см–1, группа С=О в –С(О)ОН – полосой 1659 см–1. ИК-спектр комплекса НТА с ТЭА, полученного в среде метанола и перекристаллизованного из воды, содержит все ожидаемые полосы поглощения, соответствующие группам О–Н (3315 см–1), NH+ (серия полос в области 3100–2000 см–1), СОО– (1694, 1456 см–1), СООН (1733 см–1). Очень сильная и широкая полоса поглощения гидроксильных групп в ТЭА становится после присоединения к НТА менее интенсивной и более узкой. Ее положение практически не изменяется. ИК-спектр комплекса НТА с ТЭА, полученного в водной среде и содержащего две молекулы ТЭА, существенно отличается от спектра соединения, синтезированного в среде метанола. Очень сильная и широкая полоса колебаний О–Н триэтаноламина 3650–3030 см–1 сливается с серией составных полос колебаний N–H заряженной аминной группы в области 3000–2000 см–1. Поглощение, соответствующее карбоксилатным, карбоксильным группам и деформационным колебаниям N–H аминиевых групп, имеет высокую интенсивность, но не разрешено и сдвинуто в низкочастотную область.
Присоединение двух молекул НТА к ТМЕДА сопровождается появлением полос поглощения связей N–H в аминиевых группах +HN(CH3)2CH2– и –CH2–NH+(CH2COO–)(CH2COOH) в области 3100–2000 см–1. Тройная полоса 1730, 1688, 1629 см–1 происходит от четырех карбоксилатных и двух кислотных групп.
Масс-спектры. Общим структурным фрагментом всех исследованных соединений является положительно заряженная молекула НТА, принявшая один [HN+(CH2COOH)(CH2COO–)2] или два HN+(CH2COO–)3 протона от амина. Молекулярная масса m/e НТА 191, а также массы 192, 190 (М+1, М–1) не встречались ни в одном из измеренных спектров. В то же время масс-спектры всех исследованных соединений (за исключением производного ДАБКО) содержали два пика с m/e 313 и 368, большими, чем масса НТА (в экспериментальной части выделены скобками). Их интенсивность варьировалась от 5 до 100% в зависимости от соединения. Логично было отнести их к вторичным продуктам фрагментации, получающимся при распаде НТА. В масс-спектре НТА эти два пика имеют очень малую интенсивность. Следовательно, связывание ее в комплекс с амином направляет распад в сторону образования масс 313 и 368. Масс-спектр комплекса НТА с бэта-аланином содержал пики молекулярного иона 368 (М–1, 30%) и бэта-аланина 88 (М–1, 100%). В спектре производного трет-бутиламина пик молекулярного иона 337 отсутствовал, но интенсивность пика ТБА 74 (М+1) составила 100%. Масс-спектр комплекса НТА с дифункциональным амином H2NCH2CH2OCH2CH2OCH2CH2NH показал и молекулярный ион m/e 339 (24%), и амин m/e 146 (М–2, 80%). Аналогичные пики в комплексе с ТЭА составили 339 (М–1, 40%) и 147 (М–2, 28%). Значение 339 представляет собой молекулярную массу комплекса М–1 без молекулы кристаллизационно связанной воды. Разложение этого соединения происходит в четыре стадии с потерей фрагментов с m/e 28 (СО, СН2СН2) и 30 (СН2О, СН2NН2). В масс-спектре комплекса ТМЕДА с двумя молекулами НТА пик молекулярного иона m/e 498 отсутствовал, а интенсивность пика ТМЕДА 117 (М+1) составила 40%.
ДСК. Методом ДСК исследованы шесть соединений, два из которых (НТА ⋅ МЭА и НТА ⋅ ТГМА) (МЭА – моноэтаноламин, ТГМА – трис(гидроксиметил)аминометан) были синтезированы ранее [27]. Полученные результаты представлены в табл. 3. На кривых ДСК наблюдаются два эндотермических пика. Первый из них может быть связан с началом частичной диссоциации комплекса до амина и НТА. Наиболее легко, начиная с 85°С (Тmax = 100°С), теряет летучий амин соединение НТА ⋅ ТБА. Результаты масс-спектрометрии находятся в согласии с данными ДСК. В масс-спектре НТА ⋅ ТБА интенсивность пика молекулярного иона ТБА m/e 74 (М+1) составила 100%. Для остальных комплексов начало диссоциации наблюдается в узком интервале температур от 152 до 161°С (Т1max = 171–175°С). Диссоциация протекает до сравнительно небольшой глубины. Второй пик на кривой ДСК обусловлен плавлением и более глубоким термическим разложением соединений, которое протекает при 180–197°С (Т2max = 195–232°С). Термограмма комплекса НТА ⋅ ТЭА содержит только один эндотерм в области высоких температур (Т2 = = 208°С, Т2max = 230°С).
Таблица 3.
ДСК соединений
| Соединение | Т1 | Т1max | Т2 | Т2max |
|---|---|---|---|---|
| НТА ⋅ 2Aлa | 156 | 175 | 180 | 217 |
| НТА ⋅ ТБА | 85 | 100 | 171 | 195 |
| НТА ⋅ ТЭА | – | – | 208 | 230 |
| 2НТА ⋅ ТМЕДА | 152 | 175 | 197 | 232 |
| НТА ⋅ МЭА | 161 | 175 | 181 | 196 |
| НТА ⋅ 2ТГМА | 157 | 171 | 180 | 215 |
Исследования выполнены в рамках госзадания (Тема № 45.8 “Химия функциональных материалов”, рег. № 0094-2016-0012) с использованием оборудования центра коллективного пользования “Аналитический центр ИМХ РАН” в Институте металлоорганической химии им. Г.А. Разуваева РАН в рамках федеральной целевой программы “Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014–2020 годы” (уникальный идентификатор проекта RFMEFI62120X0040). Работа поддержана Президиумом РАН (Программа № 35 “Научные основы создания новых функциональных материалов”). Монокристальные рентгеноструктурные исследования соединений проведены в рамках госзадания (Тема № 44.2, рег. № АААА-А16-116122110053-1). При выполнении работы использовались приборы Центра коллективного пользования ННГУ Научно-образовательного центра “Физика твердотельных наноструктур”.
Список литературы
Граник В.Г. Основы медицинской химии. М.: Вузовская книга, 2006. 383 с.
Пестов А.В., Вировец А.В., Подберезская Н.В., Ятлук Ю.Г. // Координац. химия. 2008. Т. 34. С. 3.
Silva M.R., Paixao J.A., Beja A.M., da Veiga L.A. // Acta Cryst. С. 2001. V. 57. P. 42. https://doi.org/10.1107/S0108270100020266/bj1011sup1.cif
Адамович С.Н., Оборина Е.Н., Ушаков И.А., Мирскова А.Н. // Журн. общ. химии. 2018. Т. 88. С. 1743.
Адамович С.А., Албанов А.И., Мирскова А.Н. и др. // Журн. общ. химии. 2009. Т. 79. С. 1043.
Воронков М.Г., Расулов М.М. // Хим.-фарм. журн. 2007. Т. 41. С. 1. https://doi.org/10.1007/s11094-007-0001-x
Адамович С.Н., Мирсков Р.Г., Воронков М.Г. // Изв. РАН. Сер. хим. 2010. № 10. С. 1993.
Кондратенко Ю.А., Кочина Т.А., Фундаменский В.С. // Физика и химия стекла. 2016. Т. 42. С. 807.
Кондратенко Ю.А., Няникова Г.Г., Молчанова К.В., Кочина Т.А. // Физика и химия стекла. 2017. Т. 43. С. 496.
Кондратенко Ю.А., Никанорова А.А., Кочина Т.А. // Физика и химия стекла. 2018. Т. 44. С. S49.
Захаров М.А., Филатова Ю.В., Быков М.А. и др. // Координац. химия. 2020. Т. 46. С. 249. https://doi.org/10.31857/S0132344X20040076
Воронков М.Г., Кузнецова Г.А., Барышок В.П. // Журн. общ. химии. 2010. Т. 80. С. 1615.
Воронков М.Г., Кочина Т.А., Вражнов Д.В., Литвинов М.Ю. // Журн. общ. химии. 2008. Т. 78. С. 1924.
Ghammamy Sh., Haskemzadeh A., Mazareey M. // Журн. орган. химии. 2005. Т. 41. С. 1790.
Воронков М.Г., Зельбст Э.А., Фундаменский В.С. и др. // Журн. структур. химии. 2014. Т. 55. С. 392.
Хома Р.Е., Гельмбольт В.О., Шишкин О.В. и др. // Журн. неорган. химии. 2014. Т. 59. С. 60. https://doi.org/10.7868/S0044457X14010061
Хома Р.Е., Гельмбольт В.О., Шишкин О.В. и др. // Журн. неорган. химии. 2014. Т. 59. С. 716.
Логинов С.В., Даин И.А., Рыбаков В.Б. и др. // Кристаллография. 2018. Т. 63. С. 65.
Неницеску К. Общая химия. М.: Мир, 1968. 406 с.
Фахриев А.М., Фахриев Р.А., Белкина М.М. Способ транспортировки нефти // Патент РФ № 2099631. 1995. ГУП РТ ВНИИУС. БИ. 1997. № 35. С. 534.
Баженов С.Д., Новицкий Э.Г., Василевский В.П. и др. // Журн. прикл. химии. 2019. Т. 92. С. 957.
Дятлова Н.М., Темкина В.Я., Попов К.И. Комплексоны и комплексонаты металлов. М.: Химия, 1988. 544 с.
SAINT. Data Reduction and Correction Program. Bruker AXS. Madison. Wisconsin. USA. 2014.
Krause L., Herbst-Irmer R., Sheldrick G.M., Stalke D. // J. Appl. Cryst. 2015. V. 48. P. 3. https://doi.org/10.1107/S1600576714022985
Sheldrick G.M. // Acta Cryst. A. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053273314026370
Sheldrick G.M. // Acta Cryst. C. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053273314026370
Румянцев Р.В., Золотарева Н.В., Новикова О.В. и др. // Кристаллография. 2020. Т. 66. С. 448. https://doi.org/10.31857/S002347612103022X
Зефиров Ю.В., Зоркий П.М. // Успехи химии. 1995. Т. 64. С. 446.
Hoxha K., Prior T.J. // Acta Cryst. E. 2013. V. 69. P. o1674. https://doi.org/10.1107/S1600536813028250
Shan N., Bond A.D., Jones W. // Acta Cryst. E. 2001. V. 57. P. o811. https://doi.org/10.1107/S1600536801012612
Christer B.A., Nieuwenhuyzen M. // Chem. Mater. 1996. V. 8. P. 1229. https://doi.org/10.1021/cm950524b
Семенов В.В., Логинова В.В., Золотарева Н.В. и др. // Кристаллография. 2016. Т. 61. С. 573. https://doi.org/10.1134/S1063774516030238
Беллами Л. Инфракрасные спектры сложных молекул. М.: Изд-во иностр. лит., 1963. 590 с.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


