Кристаллография, 2022, T. 67, № 2, стр. 201-208
Особенности строения смешанных анионов (Мо7 – хWхO24)6– и их упаковки в кристаллической структуре [Pd(NH3)4]3(Мо7 – хWxO24) ⋅ 6H2O
А. С. Сухих 1, С. П. Храненко 1, А. В. Задесенец 1, С. А. Громилов 1, *
1 Институт неорганической химии им. А.В. Николаева СО РАН
Новосибирск, Россия
* E-mail: grom@niic.nsc.ru
Поступила в редакцию 18.03.2021
После доработки 30.03.2021
Принята к публикации 05.04.2021
- EDN: CZEXOC
- DOI: 10.31857/S0023476122020230
Аннотация
При кристаллизации смеси водных растворов Na6W7O24, Na6Мо7O24 и [Pd(NH3)4](NO3)2 образуются кристаллы [Pd(NH3)4]3(Мо7 – хWxO24) ⋅ 6H2O с разными соотношениями Мо/W. Изучены 10 кристаллов с 0.8 ≤ х ≤ 3.4. Атомы Мо и W располагаются в полианионе не статистически, а в предпочтительных позициях. Кристаллографические характеристики [Pd(NH3)4]3(Мо3.6W3.4O24) ⋅ 6H2O: а = = 17.4294(2), b = 28.9215(4), с = 30.4435(4) Å, пр. гр. Ibca, V = 15346.1(3) Å3, Z = 16. Проведен анализ упаковки анионов в структуре, показан псевдогексагональный мотив их расположения. Изучены продукты термического разложения в атмосфере Н2, показано, что при 800°С образуется смесь твердых растворов замещения на основе решеток Pd и Мо(W).
ВВЕДЕНИЕ
Молибдаты и вольфраматы металлов достаточно интенсивно изучаются и находят самое широкое применение. Для улучшения функциональных характеристик постоянно ведутся работы по модификации составов, среди последних публикаций можно отметить [1, 2]. Менее изучены и востребованы соединения с паравольфрамат(молибдат)-анионами, одна из причин связана с определенными трудностями их синтеза. Настоящая работа посвящена изучению солей, содержащих гептамолибдат- и гептавольфрамат-анионы. Анализ современных баз рентгеноструктурных данных [3, 4] показывает достаточно большое (около 60) число структур с указанными анионами и органическими катионами и относительно небольшое число неорганических структур (7).
Гептаполианионы могут быть получены несколькими способами, например при подкислении водных растворов нормальных молибдатов (вольфраматов) щелочных металлов. Введение в раствор комплексных катионов позволяет получать комплексные соли (КС). Основная особенность получения их монокристаллов заключается в длительности процесса: обычно время роста кристаллов, пригодных для проведения рентгеноструктурного анализа (РСА), достигает нескольких месяцев. Такая ситуация наблюдалась в [5–7] при синтезе Na2[Pd(NH3)4]5(W7O24)2 ⋅ 16H2O, Na[Pd(NH3)4]2HW7O24 ⋅ 7H2O, [Pd(NH3)4]3W7O24 ⋅ ⋅ 4.4H2O и [CoEn3]2W7О24 ⋅ 6Н2О (En – этилендиамин). Указанные КС нашли применение в качестве однокомпонентных предшественников ряда практически важных материалов. Так, в [7] соль [CoEn3]2(W7О24) ⋅ 6Н2О использовали для получения сверхтвердых покрытий методом кумулятивного напыления. В [8] термическое разложение [Pd(NH3)4]3W7O24 ⋅ 4.4H2O позволило при относительно низкой температуре 1000°С получить сплав W0.7Pd0.3. Образование сплавов из КС при температурах значительно меньше температур плавления индивидуальных металлов обычно сопровождается образованием наночастиц [9]. Очевидное преимущество биметаллических КС заключается в их исходной гомогенности: атомы металлов перемешаны на атомном уровне и находятся на достаточно коротких расстояниях (в данном случае до 7 Å). Такой ситуации трудно достичь при использовании смесей соединений. Например, в [10] при синтезе одностенных углеродных нанотрубок в качестве катализатора использовали интерметаллид W6Co7, который получали достаточно сложным способом из смеси (NH4)6(W7O24) ⋅ 6Н2О и Co(CH3COO) ⋅ 4Н2О.
Цель настоящей работы – выяснение возможности образования КС с одновременным участием гептамолибдат- и гептавольфрамат-анионов. Предполагаемый состав такого однокомпонентного предшественника – [Pd(NH3)4]3(Мо7O24)0.5(W7O24)0.5 – позволяет рассчитывать на получение сплавов системы Pd–Mo–W.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
При синтезе КС использовали [Pd(NH3)4] (NO3)2, полученный кипячением Pd(NO3)2 ⋅ 2H2O в концентрированном аммиачном растворе в течение 30 мин с последующей кристаллизацией продукта при охлаждении реакционной смеси до комнатной температуры.
Водный раствор Na6Мо7O24 был приготовлен по методике [11] нейтрализацией смеси растворов Na2МоO4 и Na2CO3 (объемное отношение 3: 1) до рН ~ 5.5. Раствор Na6W7O24 получен аналогично из Na2WO4. В эквимолярную смесь указанных свежеприготовленных растворов вносили водный раствор [Pd(NH3)4](NO3)2. Стакан с реакционной смесью закрыли пленкой, сделали в ней небольшое отверстие и оставили на кристаллизацию. За два месяца сформировался мелкокристаллический продукт белого цвета, его отфильтровали, промыли ацетоном и высушили на воздухе. Рентгенографическое исследование (Shimadzu 7000, CuKα-излучение, Ni-фильтр) выделенного продукта показало, что целевая фаза [Pd(NH3)4]3(Мо7O24)0.5(W7O24)0.5 ⋅ 6H2O образуется в смеси с Na2[Pd(NH3)4]5W7O24 ⋅ 16H2O [5]. Несколько дополнительных попыток синтеза однофазного продукта к успеху не привели.
Рентгеноструктурный анализ 10 монокристаллов (линейные размеры не превышали 0.1 мм) проведен на дифрактометре Bruker DUO (MoKα-излучение, графитовый монохроматор, CCD-детектор) при 150 К. Структуры решены с использованием программы SHELXT-2014/5 [12] и уточнены в анизотропном (изотропном – для атомов водорода) приближении. Атомы Н заданы геометрически. Уточнение структур выполнено с использованием программы SHELXL-2018/3 [13]. Во всех случаях значение R1 не превышало 4%, a R1 [I > 2σ(I)] – 3%. Установлено, что соотношение атомов Мо и W в изученных кристаллах меняется от 6.2/0.8 до 3.6/3.4, а сами атомы занимают предпочтительные позиции. Координаты и тепловые параметры атомов для 10 изученных кристаллов [Pd(NH3)4]3(Мо7 – хWxO24) ⋅ 6H2O депонированы в банк структурных данных CCDC [3] и могут быть получены по адресу www.ccdc.cam. ac.uk/structures/. Кристаллографические данные, условия проведения экспериментов и характеристики уточнения трех кристаллических структур приведены в табл. 1.
Таблица 1.
Результаты уточнения кристаллических структур [Pd(NH3)4]3(Мо7 – хWxO24) ⋅ 6H2O*
| Структура | 3 | 6 | 4 |
|---|---|---|---|
| Размер образца, мкм | 60 × 50 × 40 | 50 × 50 × 40 | 50 × 50 × 40 |
| Мо/W | 6.2/0.8 | 4.1/2.9 | 3.6/3.4 |
| a, Å | 17.4028(2) | 17.4229(2) | 17.4294(2) |
| Δa, Å | 0 | 0.0201 | 0.0266 |
| b, Å | 28.9332(3) | 28.9315(4) | 28.9215(4) |
| Δb, Å | 0 | –0.0017 | –0.0117 |
| c, Å | 30.3221(4) | 30.4122(4) | 30.4435(4) |
| Δc, Å | 0 | 0.0901 | 0.1214 |
| V, Å3 | 15 267.7(3) | 15 329.9(3) | 15 346.1(3) |
| ΔV, Å3 | 0 | 62.2 | 78.4 |
| dвыч, г/см3 | 3.051 | 3.347 | 3.428 |
| μ, мм–1 | 5.794 | 11.340 | 12.742 |
| Диапазон θ, град | 3.83–66.29 | 3.82–66.28 | 3.82–66.29 |
| Nнезав | 129 647 | 130 910 | 129 692 |
| Nнезав [I > 2σ(I)] | 14 564 | 14 606 | 14 630 |
| Rинтегр | 0.0528 | 0.0627 | 0.0604 |
| Полнота сбора данных (2θ = 50°), % | 100 | 99.9 | 100 |
| Число уточняемых параметров | 530 | 531 | 530 |
| S-фактор по F2 | 1.041 | 1.108 | 1.162 |
| R1 [I > 2σ(I)] | 0.0266 | 0.0281 | 0.0256 |
| wR2 [I > 2σ(I)] | 0.0539 | 0.0521 | 0.0542 |
| R1 (все данные) | 0.0371 | 0.0387 | 0.0301 |
| wR2 (все данные) | 0.0567 | 0.0543 | 0.0553 |
| CCDC №** | 2 040 613 | 2 040 614 | 2 040 615 |
** Для других структур, депонированных в CCDC [3]: 1 – 2 064 925, 2 – 2 064 926, 5 – 2 064 927, 7 – 2 064 928, 8 – 2 064 929, 9 – 2 064 930, 10 – 2 064 931.
Для проведения термического разложения были отобраны два монокристалла [Pd(NH3)4]3 (Мо7 – хWxO24) ⋅ ⋅ 6H2O с x ≈ 3.6/3.4 (по данным РСА). В обоих случаях линейные размеры монокристаллов не превышали 200 мкм. Для нагрева использовали трубчатую печь SNOL, которую продували водородом. Первый кристалл (кристалл 4) нагревали до 800°С (другие характеристики даны в табл. 2). Далее кварцевый реактор извлекали из печи и проводили продувку гелием до комнатной температуры. Во втором опыте (кристалл 7) температуру повысили до 1000°С, а время выдерживания до 1 ч. В обоих случаях после нагревания частицы демонстрировали ярко выраженный псевдоморфизм, т.е. наследовали форму исходных монокристаллов (вставка на рис. 1б).
Таблица 2.
Результаты рентгенофазового анализа продуктов термического разложения
| Соотношение Pd/Мо/W |
Т, °С; атмосфера; t, мин |
Тип решетки | а, Å | V, Å3 Vатом, Å3 * |
Оценка Pd/Mo/W, %; Vатом, Å3 |
|---|---|---|---|---|---|
| 3/3.6/3.4 кристалл 4 |
800 Н2 10 |
ГЦК | 3.920(3) | 60.236 15.059 |
71/0/29 15.059 |
| ОЦК | 3.162(3) | 31.614 15.807 |
2/42/56 15.714 |
||
| 3/3.6/3.4 кристалл 7 |
1000 Н2 60 |
ГЦК | 3.906(3) | 59.593 14.898 |
78/22/0 14.900 |
| ОЦК | 3.156(3) | 31.434 15.717 |
2/43/55 15.714 |
Рис. 1.
Дифрактограммы продуктов термического разложения монокристаллов в атмосфере H2: a – [Pd(NH3)4]3(Мо3.6W3.4O24) ⋅ 6H2O при 800°C; б – [Pd(NH3)4]3(Мо3.6W3.4O24) ⋅ 6H2O – 1000°C. Рефлексы ГЦК-фазы отмечены – F, ОЦК – I. На вставках показаны дебаеграммы и фотография псевдоморфной частицы.
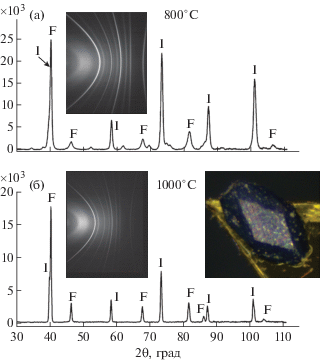
Рентгенографическое исследование продуктов термического разложения проведено в схеме Дебая–Шеррера на дифрактометре Bruker D8 Venture (микрофокусная трубка Incoteac IμS 3.0, CuKα-излучение, трехкружный гониометр, детектор PHOTON 3, разрешение 768 × 1024, размер пикселя 135 мкм, D = 39 мм, 2θD = – 60°). Полученные дебаеграммы показаны на вставках рис. 1. Рентгенофазовый анализ (РФА) проведен с использованием базы данных PDF [14]. Для введения поправок на внешний эталон (Si, a = 5.4309 Å) и перехода к стандартному виду I(2θ) (рис. 1) использовали программу DIOPTAS [15].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
По данным проведенного РФА термическое разложение (атмосфера Н2, 800°С) кристалла 4 привело к образованию смеси двух твердых растворов на основе ГЦК-решетки Pd и ОЦК-решетки Мо(W) (кристаллографические характеристики приведены в табл. 2) и следовых количеств Мо2С. Последняя фаза образовалась, по-видимому, из остатка не отмытой эпоксидной смолы, использованной для крепления кристалла при проведении РСА. Более тщательная промывка кристалла 7 позволила избежать образования этой фазы при термическом разложении в атмосфере Н2 при 1000°С, в результате получена смесь только металлических фаз. В табл. 2 даны оценки составов этих фаз (твердых растворов замещения) исходя из сходного вида фазовых диаграмм Pd–Мо [16] и Pd–W [17] (в обоих случаях при 1000°С в решетке Pd может быть замещено не более ~25% атомов, а в решетке Мо(W) ~3%) и атомных объемов (Vатом). Количественный фазовый анализ продукта термического разложения кристалла 7 привел к соотношению ГЦК- и ОЦК-фаз 45/55 мас. %. Итоговое соотношение металлов Pd/Мо/W 36/34/30 удовлетворительно коррелирует с данными РСА для кристалла 7 (табл. 4). Подчеркнем, что сплавы получены при температурах, заметно меньших температур плавления чистых металлов (Pd – 1555, Mo – 2623, W – 3422°С).
Таблица 3.
Геометрические характеристики анионов М7О24 (М = Мо, W)
| Формула; литература |
М–Oконц., Å; М–Oмост2, Å |
М–Oмост3, Å; М–Oмост4, Å |
∠М–М–М(□), град; ∠М5–М6–М7, град; VМ, Å3 |
|---|---|---|---|
| (NH4)6Мо7O24 ⋅ 4Н2О [4; № 4153] |
1.707–1.770 1.731–2.557 |
1.887–2.252 2.156–2.251 |
89.83–90.22 163.96 18.46 |
| Na6Mo7O24 ⋅ 14Н2О [4; № 174349] |
1.707–1.742 1.716–2.612 |
1.880–2.282 2.118–2.298 |
89.50–90.35 164.13 18.80 |
| Кристалл 3 Мо/W = 6.2/0.8 Наст. работа |
1.712–1.738 1.740–2.502 |
1.902–2.245 2.150–2.263 |
87.70–94.42 164.56 18.35 |
| Кристалл 6 Мо/W = 4.1/2.9 Наст. работа |
1.718–1.746 1.751–2.481 |
1.905–2.245 2.146–2.240 |
87.87–92.29 165.55 18.32 |
| Кристалл 4 Мо/W = 3.6/3.4 Наст. работа |
1.719–1.747 1.752–2.475 |
1.904–2.249 2.116–2.238 |
87.90–92.26 165.69 18.59 |
| (C5H12N)6 W7O24 [3; PIPHWO] | 1.523–1.884 1.759–2.046 |
2.012–2.323 2.094–2.244 |
89.12–90.93 168.29 19.03 |
| [CoEn3]2W7O24 ⋅ 6H2O [7] | 1.714–1.755 1.770–2.398 |
1.947–2.246 2.165–2.235 |
89.96, 90.04 167.90 18.70 |
| Na6W7O24 ⋅ 14Н2О [4; № 417338] | 1.681–1.740 1.902–2.545 |
1.908–2.299 2.110–2.260 |
89.50–90.35 166.73 18.63 |
| [Pd(NH3)4]3W7O24 ⋅ 4.4H2O [6] | 1.731–1.745 1.930–2.406 |
1.882–2.234 2.192–2.220 |
89.85, 90.15 168.70 18.55 |
| Na2[Pd(NH3)4]5(W7O24)2 ⋅ 16H2O [5] | 1.68–1.75 1.76–2.55 |
2.23–2.30 2.17–2.26 |
88.64–91.19 168.95 18.79 |
Таблица 4.
Характеристики анионов, связанные с предпочтительной занятостью позиции в вершине треугольника
| Структура | Общее соотношение Mo и W в анионе | Соотношение Mo и W в позиции 6 | ∠М5–М6–М7, ° | М6…М6, Å | ||||
|---|---|---|---|---|---|---|---|---|
| Мо | W | W, % | Мо | W | W, % | |||
| 3 | 6.22 | 0.78 | 11.1 | 0.78 | 0.22 | 22.0 | 164.56 | 5.351 |
| 6 | 4.13 | 2.87 | 41.0 | 0.33 | 0.67 | 66.9 | 165.55 | 5.404 |
| 2 | 3.76 | 3.24 | 46.3 | 0.25 | 0.75 | 74.7 | 165.65 | 5.410 |
| 1 | 3.74 | 3.26 | 46.6 | 0.26 | 0.74 | 74.02 | 165.67 | 5.410 |
| 10 | 3.70 | 3.30 | 47.1 | 0.26 | 0.75 | 74.5 | 165.67 | 5.411 |
| 8 | 3.69 | 3.31 | 47.3 | 0.25 | 0.75 | 74.8 | 165.69 | 5.411 |
| 9 | 3.69 | 3.31 | 47.3 | 0.26 | 0.74 | 74.3 | 165.66 | 5.410 |
| 5 | 3.67 | 3.33 | 47.6 | 0.25 | 0.75 | 74.8 | 165.70 | 5.412 |
| 7 | 3.62 | 3.38 | 48.3 | 0.24 | 0.76 | 76.1 | 165.72 | 5.415 |
| 4 | 3.61 | 3.39 | 48.4 | 0.24 | 0.76 | 76.4 | 165.69 | 5.410 |
Рентгеноструктурный анализ 10 монокристаллов показал, что общее соотношение Мо/W в них варьируется от 6.2/0.8 до 3.6/3.4. Таким образом, в маточном водном растворе анионы (Мо7O24)6– и (W7O24)6– за время кристаллизации обменивались своими фрагментами. Увеличение доли W приводит к закономерному увеличению объема элементарной ячейки, хотя параметры элементарной ромбической ячейки ведут себя по-разному: значения а и с увеличиваются, а b – уменьшается (табл. 1).
На рис. 2 показано взаимное расположение атомов М (Мо или W) в анионах. Четыре нижние позиции образуют немного искаженный прямоугольник М1М2М3М4 ~ 3.2 × 4.3 Å с углами ∠М – М – М ($\square $) от 87.7 до 94.4° (табл. 3). В большинстве случаев указанный прямоугольник имеет перегиб по диагонали. Взаимное расположение трех верхних позиций представляет собой немного искаженный равнобедренный треугольник М5М6М7 с углом при вершине ~165°. В целом полиэдр можно разбить на четыре неправильные треугольные пирамиды и провести вычисление общего объема VМ (значения даны в последнем столбце табл. 3). Значения VМ для гептавольфрамат-анионов больше, чем для гептамолибдат-анионов всего на ~ 0.3 Å3.
Рис. 2.
Взаимное расположение атомов металла в анионах в кристаллических структурах [Pd(NH3)4]3(Мо7 – хWxO24) ⋅ 6H2O. Даны значения расстояний между атомами металлов, а также соотношение Мо/W в каждой позиции (черным показана доля W).
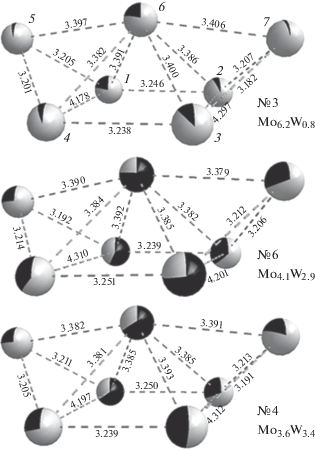
Атомы Мо и W занимают вершины полиэдра не статистически, а в предпочтительных позициях. На рис. 2 показана заселенность позиций М для трех структур. Хорошо видно, что атомы W предпочитают занимать позиции 1 и 3 по одной из диагоналей прямоугольника (т.е. в транс-положении), а также в вершине треугольника М5М6М7. В табл. 4 проведено сравнение общего соотношения Мо/W в изученных структурах и заселенности позиции 6. В этой позиции превышение доли W в структурах 2–10 составляет 26–28%: в структуре 1 (с наибольшим содержанием Мо) – 11%.
Выявленная тенденция заселения вершины треугольника атомами W приводит к изменению геометрии аниона. В табл. 4 даны значения углов ∠М5–М6–М7. В изученных структурах 1–10 по мере увеличения содержания W этот угол увеличивается от 164.6° до 165.7°. Действительно, это общая тенденция: в структурах с гептамолибдат-анионами ((NH4)6Мо7O24 ⋅ 4Н2О и Na6Mo7O24 ⋅ ⋅ 14Н2О) его значения ~164°, а в структурах с гептавольфрамат-анионами значения увеличиваются до 169°.
Значения расстояний М–O в структурах 3, 6 и 4 даны в табл. 3 в сравнении с литературными данными. Сравнивая полученные расстояния, следует учитывать, что в структурах с такими “тяжелыми” атомами, как Мо и особенно W, локализация атомов О имеет ограничения.
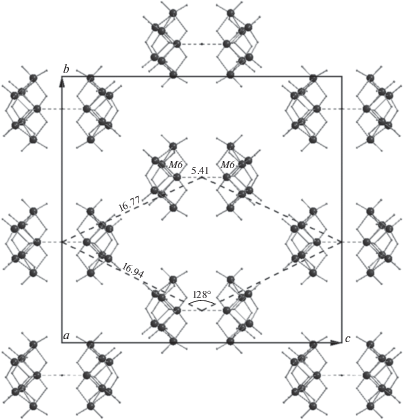
Так как анионы значительно крупнее комплексных катионов, в первую очередь рассмотрим именно их взаимное расположение. Анализ проведен по методике [18, 19]. Для выделения преимущественного вклада атомов, принадлежащих анионам, была вычислена теоретическая дифрактограмма только по атомам Мо(W) и О. Согласно методике, был проведен анализ индексов троек наиболее интенсивных дифракционных отражений, что свидетельствует об их заселенности тяжелыми атомами. Такой подход был использован, например, при анализе упаковки [CoEn3]2W7O24 ⋅ 6H2O [7] и [Pd(NH3)4]3W7O24 ⋅ ⋅ 4.4H2O [6]. В данном случае использование индексов hkl троек сильнейших отражений (с учетом симметрично-связанных) привело с использованием программы [20] к детерминанту 8, что в 2 раза меньше числа анионов в элементарной ячейке. Это указывает на заметное попарное сближение анионов (ряд таких примеров рассмотрен в [19]). Наиболее симметричная подрешетка образована пересечением семейств плоскостей {121}, {12$\bar {1}$} и {200}. Она построена на векторах: aт = b/4 – с/2, bт = b/4 + + с/2, cт = a/2 – b/4. Метрики подъячейки – aт = = bт = 16.85, cт = 11.32 Å, αт = βт = 105.9°, γт = 129.2° (для структуры 4) – позволяют рассматривать структуру как повторение псевдогексагональных слоев в направлении a через половину трансляции. Подчеркнем, что узлам найденной подрешетки должны следовать (т.е. располагаться вблизи) сдвоенные анионы. Рассмотрим их реальное расположение в слое aтbт или bc.
На рис. 3 показано реальное расположение полианионов М7О24 в слое bc. Хорошо видно, что полианионы действительно располагаются парами, расстояния М6…М6 на уровне 5.4 Å (значения даны в табл. 4) значительно меньше параметров элементарной ячейки. Отметим, что расстояние М6…М6 увеличивается от 5.35 до 5.41 Å при увеличении доли W. Центры псевдодимеров образуют сетку 16.78 × 16.94 Å с углом 128.0°. Эти характеристики хорошо коррелируют с метриками подъячейки: aт = bт = 16.85 Å, γт = 129.2°.
Рис. 3.
Фрагмент кристаллической структуры [Pd(NH3)4]3(Мо7 – хWxO24) ⋅ H2O. Комплексные катионы [Pd(NH3)4]2+ и молекулы кристаллизационной воды не показаны.
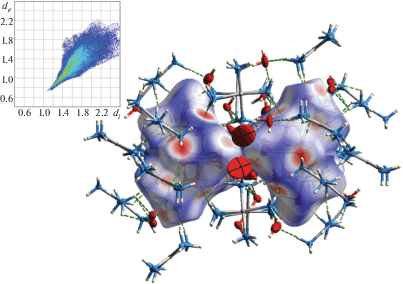
В пустотах анионной подрешетки располагаются комплексные катионы [Pd(NH3)4]2+ и молекулы кристаллизационной воды. Анализ окружения анионов проведен путем построения поверхности Хиршвельда (ПХ). На рис. 4 контраст ПХ соответствует параметру dnorm (нормализованное контактное расстояние) в диапазоне от –0.63 до 1.66 Å. Расчет выполнен по программе CrystalExplorer 17.5 [21] с использованием библиотеки квантово-химических расчетов Tonto [22]. Пунктиром показаны контакты О⋅⋅⋅Н, большинство из которых принадлежит комплексным катионам. Нижняя граница диапазона dnorm равна –0.63, это означает, что минимальное расстояние между парой атомов внутри и снаружи данной ПХ меньше суммы их ван-дер-ваальсовых радиусов на 0.63 Å. Таким образом, можно говорить о серии сильных водородных связей между концевыми атомами анионов, комплексных катионов и молекул кристаллизационной воды. Вставка на рис. 4 отображает все близкие контакты между отдельными парами атомов в виде точек на 2D-графике. Положение каждой точки по оси абсцисс (di, Å) соответствует расстоянию от атома, находящегося внутри ПХ, до ее границы. Аналогично положение точки по оси ординат (de, Å) соответствует расстоянию от атома, находящегося снаружи ПХ. Контакты между атомами О аниона и атомами Н занимают 87.1% ПХ. Основная часть контактов O⋅⋅⋅H лежит в области с di < 1.4 Å и de < 1 Å, минимальное расстояние от атомов О до ПХ составляет ~1.1 Å, а минимальное расстояние от внешнего атома Н до ПХ – 0.73 Å.
Рис. 4.
Поверхность Хиршвельда двух соседних анионов. На вставке отображены контакты O⋅⋅⋅H, где di (Å) – расстояние от внутреннего атома кислорода до ПХ, de (Å) – расстояние от внешнего атома водорода до ПХ.
Таким образом, в настоящей работе показано, что при кристаллизации из смеси водных растворов Na6W7O24, Na6Мо7O24 и [Pd(NH3)4](NO3)2 образуются кристаллы со смешанной анионной частью – [Pd(NH3)4]3(Мо7 – хWxO24) ⋅ 6H2O. Проведенный РСА 10 кристаллов показал, что они имеют разный состав: соотношение Мо/W варьируется от 6.2/0.8 до 3.6/3.4, а атомы Мо и W располагаются в предпочтительных позициях.
Список литературы
Stenzel D., Issac I., Wang K. et al. // Inorg. Chem. 2021. V. 60. P. 115.
Wang W.S., Zhe L., Xu C.Y. et al. // Cryst. Growth Des. 2009. V. 9. P. 1558.
Allen F.H. //Acta Cryst. B. 2002. V. 58. P. 380.
Inorganic Crystal Structure Database. ICSD. Release 2020, Fashinformationszentrum Karlsruhe, D – 1754 Eggenstein – Leopoldshafen, Germany. 2020.
Khranenko S.P., Sukhikh A.S., Gromilov S.A. // J. Struct. Chem. 2020. V. 61. P. 293.
Khranenko S.P., Sukhikh A.S., Komarov V.Yu. et al. // J. Struct. Chem. 2020. V. 61. P. 449.
Kuratieva N.V., Tereshkin I.O., Khranenko S.P. et al. // J. Struct. Chem. 2013. V. 54. P. 1133.
Gromilov S.A., Khranenko S.P., Semitut E.Yu. et al. // Combust. Explos. Shock Waves. 2013. V. 49. P. 238.
Korenev S.V., Venediktov A.B., Shubi Y.V. et al. // J. Struct. Chem. 2003. V. 44. P. 46.
Zhao X., Yang F., Chen J. et al. // Nanoscale. 2018. V. 10. P. 6922.
Бурцева К.Г., Кочубей Л.А., Воропанова Л.А., Горбаткова Б.Х. // Журн. неорган. химии. 1981. Т. 26. № 8. С. 2121.
Sheldrick G.M. // Acta Cryst. A. 2015. V. 71. P. 3.
Sheldrick G.M. // Acta Cryst. C. 2015. V. 71. P. 3.
Powder Diffraction File. PDF-2. International Centre for Diffraction Data. USA.
Prescher C., Prakapenka V.B. // High Press. Res. 2015. V. 35. № 3. P. 223.
Savitskii T.M., Tylkina M.A., Khamidov O.Kh. // Rus. J. Inorg. Chem. 1964. V. 9. P. 2738.
Shunk F.A. Constitution of Binary Alloys. Second Supplement. McGraw-Hill Book Company, 1969. 720 p.
Borisov S.V. // J. Struct. Chem. 1986. V. 27. P. 164.
Gromilov S.A., Borisov S.V. // J. Struct. Chem. 2003. V. 44. P. 680.
Gromilov S.A., Bykova E.A., Borisov S.V. // Crystallography Reports. 2011. V. 56. P. 947.
Turner M.J., McKinnon J.J., Wolff S.K. et al. CrystalExplorer17. 2017. University of Western Australia.
Jayatilaka D., Grimwood D.J. // Computational Science. ICCS. 2003. № 4. P. 142.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


