Кристаллография, 2022, T. 67, № 3, стр. 419-426
Результаты рентгеноструктурного анализа бактериальной наноцеллюлозы, синтезированной продуцентами Komagataeibacter xylinus В-12429 и В-12431 на ферментативных гидролизатах мискантуса и шелухи овса
Л. А. Алешина 1, *, Е. К. Гладышева 2, В. В. Будаева 2, **, Г. Ф. Миронова 2, Е. А. Скиба 2, Г. В. Сакович 2
1 Петрозаводский государственный университет
Петрозаводск, Россия
2 Институт проблем химико-энергетических технологий СО РАН
Бийск, Россия
* E-mail: alkftt@mail.ru
** E-mail: budaeva@ipcet.ru
Поступила в редакцию 06.10.2021
После доработки 06.10.2021
Принята к публикации 17.11.2021
- EDN: YVVPWA
- DOI: 10.31857/S002347612203002X
Аннотация
Представлены результаты рентгеноструктурного анализа бактериальной наноцеллюлозы (БНЦ), синтезированной продуцентами Komagataeibacter xylinus В-12429 и Komagataeibacter xylinus В-12431 на ферментативных гидролизатах мискантуса, шелухи овса и синтетической питательной среды. Методом полнопрофильного анализа установлено, что во всех исследованных образцах БНЦ независимо от продуцента и питательной среды преобладает алломорф Іα, содержание которого колеблется в интервале от 96 до 100%. Определены характеристики надмолекулярной структуры образцов: степень кристалличности, размеры и форма поперечного сечения элементарных фибрилл, а также размер области когерентности (длина) элементарных фибрилл вдоль оси фибриллы.
ВВЕДЕНИЕ
Бактериальная наноцеллюлоза (БНЦ) синтезируется различными бактериями и отличается от растительной целлюлозы структурными характеристиками, в частности преимущественным содержанием алломорфа Іα и высокой степенью кристалличности [1, 2].
Именно преимущественное содержание алломорфа Іα позволяет идентифицировать микробиальное происхождение целлюлозы. Согласно данным [1, 3, 4] этот показатель для БНЦ может варьироваться в одних случаях от 70 до 100%, в других – алломорфы Іα и Iβ присутствуют в равных пропорциях. Но изменение условий культивирования БНЦ может повлиять на содержание алломорфа Іα, например переход от статического к динамическому режиму биосинтеза, введение в питательные среды особых веществ и обработка ультрафиолетом понижают содержание алломорфа Іα [4]. При культивировании продуцента Komagataeibacter medellinensis на питательных средах из отходов сельского хозяйства содержание алломорфа Iα в образцах БНЦ снижается от 86 до 71% [5], а использование виноградного жмыха приводит к снижению этого показателя от 72 до 56% [6].
Степень кристалличности (СК) является одним из наиболее важных параметров для описания структуры БНЦ, поскольку определяет физические, химические и механические свойства целлюлозы, конкретизируя области ее применения. Превосходные механические характеристики БНЦ даже во влажном состоянии связывают в первую очередь с высокой СК [1]. Но под действием различных факторов в процессе биосинтеза СК может изменяться. К одному из таких факторов можно отнести состав питательной среды. Например, при культивировании продуцента Komagataeibacter hansenii GA2016 на гидролизных средах с различными источниками углерода показатель СК варьируется от 80 до 92% [7]. Незначительное изменение в питательной среде содержания сырной сыворотки от 54 до 56%, финикового сиропа от 44 до 46%, витамина С от 0 до 0.4% приводит к снижению СК от 56 до 39% [8]. Использование в качестве питательной среды яблочного сока, кешью и гидролизата мелассы для получения БНЦ привело к снижению СК от 87 до 79% по сравнению с синтетической питательной средой [9].
Таким образом, крайне важным является анализ структурных характеристик БНЦ. Это позволит установить условия культивирования БНЦ, необходимые для обеспечения заданного качества целевого продукта.
Для определения структурных характеристик БНЦ в настоящее время используются следующие методы: рентгеноструктурный анализ, твердофазная 13C-ЯМР [4, 10] и ИК-фурье-спектроскопия [10–14]. Все три указанных метода дают согласующиеся между собой результаты при условии, что расчеты СК на основе данных РСА выполняются модифицированным методом Ритвельда с оценкой степени совпадения контуров рассчитанной и экспериментальной рентгенограмм [15], как это было сделано в [16, 17].
Цель настоящей работы – рентгенографические исследования образцов БНЦ, синтезированных двумя разными продуцентами на ферментативных гидролизатах мискантуса и шелухи овса и синтетической питательной среде.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для биосинтеза БНЦ использовали два продуцента из Всероссийской коллекции промышленных микроорганизмов: Komagataeibacter xylinus В-12429 и Komagataeibacter xylinus В-12431 (Scientific Center “Kurchatov Institute” – Research Institute for Genetics and Selection of Industrial Microorganisms, Россия). Для культивирования данных штаммов использовали питательные среды следующих составов:
– синтетическая среда Хестрина–Шрамма (ХШ): глюкоза – 2.0%, пептон – 0.5%, дрожжевой экстракт – 0.5%, Na2НРO4 – 0.27%, лимонная кислота – 0.115% [18];
– ферментативный гидролизат технической целлюлозы мискантуса (М), полученной азотнокислым способом: массовая доля (м.д.) α-целлюлозы – 79.2%, м.д. пентозанов – 2.5%, м.д. кислотонерастворимого лигнина – 1.5%, м.д. золы – 0.2% [19];
– ферментативный гидролизат технической целлюлозы плодовых оболочек овса (ПОО), полученной азотнокислым способом: м.д. α-целлюлозы – 94.2%, м.д. пентозанов – 0.8%, м.д. кислотонерастворимого лигнина – 1.2%, м.д. золы – 3.8% [19].
Биосинтез БНЦ на данных питательных средах проводили в следующих условиях: температура – 30°С, продолжительность – 14 сут, статический способ культивирования в климатической камере (Binder-400, Germany).
Промывку образцов БНЦ от компонентов питательной среды и клеток осуществляли поэтапной обработкой раствором 2.0%-ного гидроксида натрия и 0.25%-ным раствором разбавленной соляной кислоты с последующей промывкой дистиллированной водой. Гель-пленки БНЦ высушивали в развернутом состоянии при комнатной температуре.
Синтезированы шесть типов образцов БНЦ, которые приведены в табл. 1. Их дифракционные картины получены с помощью CuKα-излучения в интервале углов рассеяния 2θCu от 3° до 145° на дифрактометрах ДРОН-3м и ДРОН-6 (Буревестник, Россия). Шаг по углу рассеяния 2θCu составлял 0.1°. Регистрацию рентгенограмм проводили в двух геометриях: на отражение и прохождение (просвет).
Таблица 1.
Образцы БНЦ, культивированные двумя продуцентами на трех питательных средах
| Образец | Продуцент | Питательная среда |
|---|---|---|
| 1 | Komagataeibacter xylinus В-12429 | Синтетическая среда ХШ |
| 2 | Komagataeibacter xylinus В-12429 | Ферментативный гидролизат технической целлюлозы М |
| 3 | Komagataeibacter xylinus В-12429 | Ферментативный гидролизат технической целлюлозы ПОО |
| 4 | Komagataeibacter xylinus В-12431 | Синтетическая среда ХШ |
| 5 | Komagataeibacter xylinus В-12431 | Ферментативный гидролизат технической целлюлозы М |
| 6 | Komagataeibacter xylinus В-12431 | Ферментативный гидролизат технической целлюлозы ПОО |
Подробно методика расчета СК, размеров областей кристалличности (блоков мозаики, область когерентного рассеяния (ОКР)) и методика полнопрофильного анализа описаны в [16, 17].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1 представлены рентгенограммы исследованных образцов БНЦ, зарегистрированные на отражение и просвет. Для всех шести образцов рентгенограммы, полученные в геометрии на отражение, типичны для БНЦ: на них присутствуют два наиболее интенсивных максимума с индексами (100) и (110) и более слабая линия с индексами (010) [1, 2, 20, 21].
Рис. 1.
Область 2θCu от 3° до 50° рентгенограмм образцов БНЦ 1–6, отснятых на отражение и просвет. Указаны индексы отражений для алломорфа Iα.
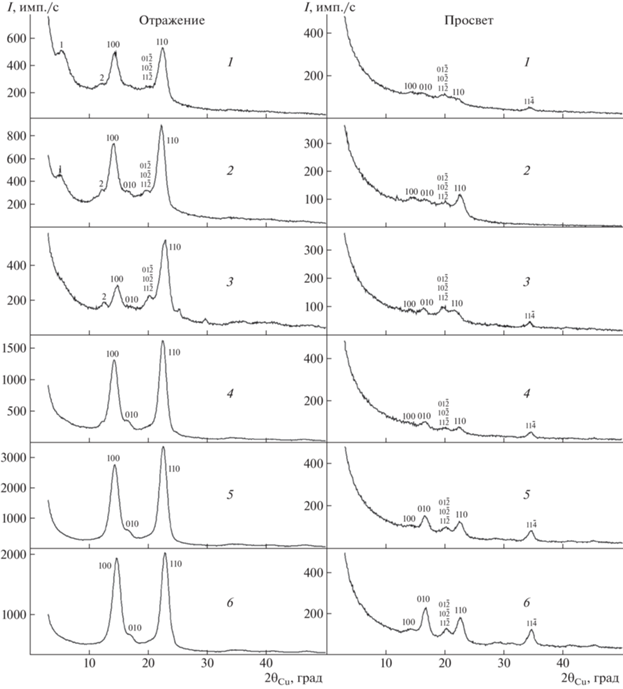
На рентгенограммах, отснятых на прохождение, самой слабой из этих трех отражений является линия (100). Такое перераспределение интенсивности обусловлено преимущественной ориентацией кристаллитов (текстурой) в образцах [15–17, 22].
Отметим, что на рентгенограммах образцов БНЦ 1–3 в геометрии на отражение наблюдаются слабые линии, обозначенные на рисунке как 1 (2θCu = 5.45° и 5.13° для образцов 1 и 2 соответственно) и 2 (2θCu ~ 12°–12.5° для всех трех образцов). На рентгенограмме образца 3 отражение, обозначенное цифрой 1 для образцов 1 и 2, размывается, практически сливаясь с фоном. Фазовый анализ, выполненный методом Ритвельда, показал, что эти отражения не относятся ни к одной из известных модификаций целлюлозы.
Известно, что максимум под углом рассеяния 2θCu ∼ 5.45° наблюдался на рентгенограммах образцов БНЦ, синтезированных продуцентом Gluconacetobacter xylinus (PTCC 1734) [23] и образца БНЦ, синтезированного на питательной среде, содержащей карбоксиметилцеллюлозу [24]. В первом случае все дополнительные максимумы, наблюдающиеся на рентгенограммах, в [23] отнесены к рассеянию на компонентах питающих сред. Во втором случае [24] природа данного максимума не обсуждалась.
Результаты расчета методом полнопрофильного анализа рентгенограмм, полученных в геометрии на отражение, показали, что структура всех исследованных образцов преимущественно соответствует алломорфу Iα с периодами элементарной ячейки, представленными в табл. 2. Отметим, что большие значения факторов недостоверности для образцов 4–6 обусловлены тем, что преимущественная ориентация зерен в них соответствует двум осям текстуры: {100}и {110} (рис. 2), причем обе текстуры аксиальные. В образцах 1–3 имеет место только аксиальная текстура {100}. В результате при уточнении контуров рентгенограмм методом Ритвельда с учетом текстуры {100} на рассчитанных и экспериментальных рентгенограммах образцов 1–3 практически нет расхождения интенсивностей в области отражений (100) и (110) (рис. 2а). При тех же условиях на рассчитанных и экспериментальных рентгенограммах образцов 4–6 наблюдается заметное различие в интенсивностях линий (110) (рис. 2б), что и приводит к росту значений факторов недостоверности. Имеющиеся в настоящее время программы в этой ситуации не позволяют одновременно учитывать оба варианта текстуры.
Таблица 2.
Параметры элементарной ячейки и факторы недостоверности Rwp (весовой профильный) и Rp (профильный), достигнутые в результате расчета методом полнопрофильного анализа по отснятым на отражение рентгенограммам
| Образец | С, % | a, Å | b, Å | c, Å | α° | β° | γ° | Rwp, % | Rp, % | S | Т | {uvw} | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | α | 100 | 6.78(1) | 5.92(1) | 10.49(3) | 117.5(2) | 114.4(1) | 80.4(5) | 9.8 | 7.7 | 1.2 | 0.5 | 100 |
| 2 | α | 100 | 6.78(2) | 5.92(1) | 10.49(3) | 117.5(2) | 114.4(1) | 80.4(4) | 9.7 | 7.1 | 0.4 | 0.5 | 100 |
| 3 | α | 100 | 6.74(1) | 5.93(6) | 10.36(1) | 117.0(1) | 113.0(1) | 81.3(1) | 7.1 | 5.4 | 0.4 | 0.8 | 100 |
| 4 | α | 94 | 6.74(4) | 5.90(1) | 10.36(7) | 117.0(2) | 113.0(5) | 81.0(1) | 17.8 | 13.4 | 1.7 | 0.4 | 100 |
| β | 6 | 7.84(1) | 8.17(3) | 10.30(1) | 90 | 90 | 96.4(1) | 1 | |||||
| 5 | α | 93 | 6.74(4) | 5.90(1) | 10.36(7) | 117.0(2) | 113.0(5) | 81.1(1) | 22.6 | 15.6 | 4.0 | 0.4 | 100 |
| β | 7 | 7.84(1) | 8.17(3) | 10.30(1) | 90 | 90 | 96.4(1) | 1 | |||||
| 6 | α | 94 | 6.74(4) | 5.90(1) | 10.36(7) | 117.0(2) | 113.0(5) | 81.1(1) | 17.5 | 12.1 | 2.9 | 0.3 | 100 |
| β | 6 | 7.84(1) | 8.17(3) | 10.30(1) | 90 | 90 | 96.4(1) | 1 |
Рис. 2.
Результаты уточнения профилей рентгенограмм образцов 3 (а) и 5 (б). Неучет текстуры с осью {110} приводит к расхождению в интенсивностях линии (110) рассчитанной и экспериментальной рентгенограмм образца 5 (б).

Данные табл. 2 показывают, что в образцах, синтезированных продуцентом Komagataeibacter xylinus В-12429, содержание алломорфа Iα составляет 100% (без учета вклада компонента, дающего слабые линии 1 и 2). В образцах, синтезированных продуцентом Komagataeibacter xylinus В-12431, наряду с алломорфом Iα появляется алломорф Iβ в количестве ∼6%. В обоих случаях содержание алломорфа Iα не зависит от состава питательной среды. Известно, что алломорф Iα, как правило, является основной фазой БНЦ [1, 2, 25–27].
Таким образом, исследованные образцы, синтезированные продуцентами В-12429 и В-12431, характеризуются отсутствием зависимости содержания в БНЦ алломорфа Iα от состава питательной среды. Этот результат отличается от опубликованных в [5, 6] данных для других продуцентов, что позволяет рекомендовать продуценты В-12429 и В-12431 для биосинтеза БНЦ на альтернативных питательных средах с обеспечением высокого качества метаболитов.
Значения СК и линейные размеры ОКР в направлениях нормалей к отражающим плоскостям приведены в табл. 3. Индексы отражений указаны для целлюлозы Iα, размеры ОКР соответствуют средним значениям, рассчитанным в приближениях Коши и Гаусса.
Таблица 3.
Результаты расчета степени кристалличности (СК) и размеров областей когерентного рассеяния
| Образец | 1 | 2 | 3 | 4 | 5 | 6 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Геометрия съемки | o | pr | o | pr | o | pr | o | pr | o | pr | o | pr |
| СК, % | 76 | 88 | 74 | 75 | 87 | 90 | 94 | 100 | 90 | 100 | 91 | 89 |
| (hkl) Iα | Dhkl, Å | |||||||||||
| 100 | 62 | 88 | 63 | 66 | 63 | 121 | 52 | 101 | 54 | 110 | 52 | 60 |
| 010 | * | 51 | 55 | 58 | 88 | 112 | 64 | 106 | 58 | 78 | 78 | 78 |
| 110 | 62 | 58 | 64 | 64 | 54 | 56 | 62 | 82 | 62 | 64 | 62 | 64 |
| 11$\bar {4}$ | * | 90 | * | * | * | 163 | * | 161 | * | 81 | * | 106 |
Различие в значениях СК, определенной из рентгенограмм, отснятых на отражение и просвет, находится на пределе погрешности (±5%) для образца 1 и не выходит за пределы погрешности для всех остальных образцов. Это позволяет анализировать средние значения СК по данным геометрии на отражение (о) и прохождение (pr).
Из образцов БНЦ 1–3, синтезированных продуцентом В-12429, наибольшую СК (88 ± 2%) имеет образец 3, синтезированный на ферментативном гидролизате технической целлюлозы ПОО, а наименьшую – (74 ± 2%) образец 2, синтезированный на ферментативном гидролизате технической целлюлозы М.
Из образцов БНЦ 4–6, синтезированных продуцентом В-12431, наибольшую СК (97 ± 3%) имеет образец 4, синтезированный на синтетической среде ХШ. У образцов БНЦ, синтезированных на ферментативных гидролизатах технической целлюлозы М и ПОО, СК на 2 и 7% ниже соответственно.
Таким образом, в отличие от опубликованных данных: 28% [29], 50% [28], 54% [23], 60% [30], 62% [20], оба использованные в данной работе продуцента обеспечивают очень высокие значения СК: СК образцов БНЦ 1–3 (продуцент В-12429) – 74–88%, СК образцов БНЦ 4–6 (продуцент В-12431) – 90–97%. Отсутствие зависимости СК от состава питательной среды дополнительно обосновывает успешное использование данных продуцентов для синтеза БНЦ высокого качества при удешевлении углеродного источника.
Известно [16, 31, 32], что рассчитанные по ширинам отражений размеры кристаллитов (ОКР) определяются в направлении нормалей к отражающим плоскостям. Следовательно, если плоскость с индексами (hkl) параллельна поверхности образца, то Dhkl – это размер кристаллита в направлении, перпендикулярном поверхности образца. Плоскостям триклинной структуры алломорфа Iα (табл. 2) в моноклинной решетке алломорфа Iβ ставятся в соответствие следующие направления:
Первым двум направлениям (осям a и b элементарной ячейки алломорфа Iα) соответствуют диагонали основания элементарной ячейки алломорфа Iβ, а третьему (диагонали основания элементарной ячейки алломорфа Iα) – ось a элементарной ячейки алломорфа Iβ. Рассчитанные по ширинам соответствующих отражений величины Dhkl определяют размеры и форму поперечного сечения элементарных фибрилл. Направление [11$\bar {4}$]α (триклинная структура) и соответствующее ему [001]β (моноклинная структура) параллельны оси фибриллы, и рассчитанные по ширине соответствующих им отражений величины Dhkl определяют длину элементарной фибриллы вдоль оси фибрилл (ось с элементарной ячейки алломорфа Iβ). Подробно связь между элементарными ячейками алломорфов Iα и Iβ рассмотрена в [16, 31, 32].
На рис. 3 представлены схемы поперечного сечения элементарных фибрилл, построенные на основе данных табл. 3. Проекции структуры алломорфа Iα на плоскость ab построены по программе Mercury.
Рис. 3.
Схемы поперечного сечения элементарных фибрилл образцов: 1 (а, г), 2 (б, д), 3 (в, е), 4 (ж, к), 5 (з, л), 6 (и, м), исследованных в геометрии на отражение (а–в, ж–и) и просвет (г–е, к–м). Масштаб в ангстремах соответствует данным табл. 3. В центрах всех схем показана базисная плоскость ab элементарной ячейки целлюлозы Iα.
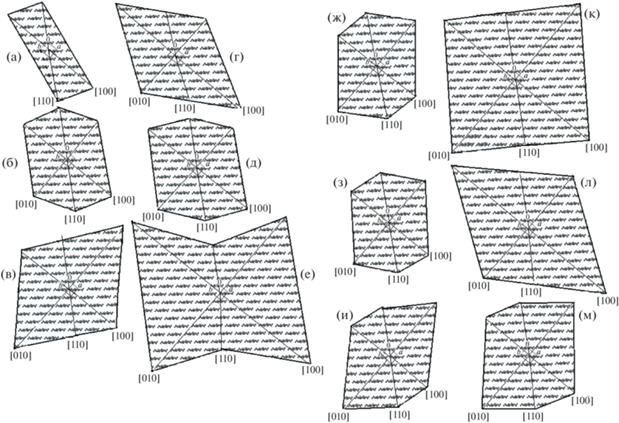
Поперечные размеры элементарных фибрилл, лежащих в плоскости пленки, заметно больше, чем размеры фибрилл, перпендикулярных поверхности, для всех образцов, кроме образца 2 (продуцент В-12429, питательная синтетическая среда ХШ) и образца 6 (продуцент В-12431, питательная среда М) (рис. 3б, 3д и 3и, 3м соответственно).
У образцов БНЦ 1–3, синтезированных продуцентом В-12429, размеры и форма поперечного сечения элементарных фибрилл, как параллельных, так и перпендикулярных поверхности образца, зависят от питательной среды.
Минимальное поперечное сечение имеют элементарные фибриллы, синтезированные на синтетической питательной среде ХШ (образец 1, рис. 3а). При этом размер упорядоченных областей (ОКР) в направлении [010] настолько мал (не больше одного–двух периодов b элементарной ячейки алломорфа Iα), что соответствующее отражение на рентгенограмме сливается с фоном.
Необычная форма поперечного сечения для параллельных поверхностей образца 3 элементарных фибрилл (рис. 3е), по всей вероятности, обусловлена в данном случае разбросом как их размеров, так и формы.
У образцов БНЦ 4–6, синтезированных продуцентом В-12431, размеры и форма поперечного сечения элементарных фибрилл, перпендикулярных поверхности образцов (рис. 3ж–3и), практически не зависят от питательной среды. Размеры поперечного сечения элементарных фибрилл, параллельных поверхности образцов (рис. 3к–3м), максимальны для образца, синтезированного на питательной среде ХШ, и минимальны для образца, синтезированного на питательной среде ПОО.
Таким образом, только для образцов 2 и 6 поперечные размеры элементарных фибрилл практически не зависят от направления в решетке алломорфа Iα и от ориентации кристаллитов относительно поверхности образцов.
Длина элементарных фибрилл, т.е. длина упорядоченной области (ОКР) элементарных фибрилл оценивается по ширине отражения ($11\bar {4}$). Для кристаллитов, направление которых перпендикулярно поверхности образцов, размеры ОКР вдоль оси фибриллы (длина элементарных фибрилл) практически невозможно определить, так как при регистрации рентгенограммы в геометрии на отражение линия ($11\bar {4}$) перекрывается с более интенсивными по сравнению с ней отражениями.
Длина элементарных фибрилл (направление $[11\bar {4}]$, параллельное поверхности) образцов 1 и 3, синтезированных продуцентом В-12429 на питательных средах ХШ и ПОО, составляет 90 и 163 Å соответственно.
Образец 2 выпадает из общей картины: размер ОКР в направлении $[11\bar {4}]$, параллельном поверхности образцов, оказывается предельно мал, т.е. не превышает периода элементарной ячейки алломорфа Iα.
Длина элементарных фибрилл в направлении $[11\bar {4}]$, параллельном поверхности образцов 4–6, максимальна для образца 4, синтезированного продуцентом В-12431 на питательной среде ХШ (163 Å), и минимальна для образца 5, синтезированного на питательной среде для ферментативного гидролизата М (81 Å).
ЗАКЛЮЧЕНИЕ
Установлено, что в образцах, синтезированных продуцентом В-12429, независимо от питательной среды содержание алломорфа Іα практически 100%, а в образцах, синтезированных продуцентом В-12431, содержание алломорфа Іα на 6–7% меньше за счет появления алломорфа Іβ. СК образцов БНЦ, синтезированных продуцентом В-12431, выше, чем для образцов БНЦ, синтезированных продуцентом В-12429 (90–97 и 74–88% соответственно). В целом, несмотря на обнаруженные различия между образцами, синтезированная в работе БНЦ характеризуется высокими значениями содержания алломорфа Іα (от 93 до 100%) и степени кристалличности (от 74 до 100%). Наиболее однородными по размерам и форме поперечного сечения элементарных фибрилл оказались образцы, синтезированные продуцентом В-12429 на ферментативном гидролизате М и продуцентом В-12431 на питательной среде ПОО. Длина элементарных фибрилл для образцов, синтезированных обоими продуцентами, зависит от питательной среды.
Исследование выполнено при поддержке Российского научного фонда (проект № 17-19-01054). Работа по биосинтезу БНЦ выполнена на оборудовании Бийского регионального центра коллективного пользования СО РАН (ИПХЭТ СО РАН, г. Бийск, Россия).
Список литературы
Urbina L., Corcuera M.A., Gabilondo N. et al. // Cellulose. 2021. V. 28. P. 8229. https://doi.org/10.1007/s10570-021-04020-4
Gregory D.A., Tripathi L., Fricker A.T.R. et al. // Mater. Sci. Eng. R. 2021. V. 145. P. 100623. https://doi.org/10.1016/j.mser.2021.100623
Campano C., Balea A., Blanco A., Negro C. // Cellulose. 2016. V. 23. P. 57. https://doi.org/10.1007/s10570-015-0802-0
Meza-Contreras J.C., Manriquez-Gonzalez R., Gutierrez-Ortega J.A., Gonzalez-Garcia Y. // Carbohyd. Res. 2018. V. 461. P. 51. https://doi.org/10.1016/j.carres.2018.03.005
Molina-Ramírez C., Castro C., Zuluaga R., Gañán P. // J. Polym. Environ. 2018. V. 26. P. 830. https://doi.org/10.1007/s10924-017-0993-6
Velásquez-Riaño M., Bojacá V. // Cellulose. 2017. V. 24. P. 2677. https://doi.org/10.1007/s10570-017-1309-7
Güzel M., Akpınar Ö. // Int. J. Biol. Macromol. 2020. V. 162. P. 1597. https://doi.org/10.1016/j.ijbiomac.2020.08.049
Raiszadeh-Jahromi Y., Rezazadeh-Bari M., Almasi H., Amiri S. // J. Food Sci. Technol. 2020. V. 57. P. 2524. https://doi.org/10.1007/s13197-020-04289-6
Souza E.F., Furtado M.R., Carvalho C.W.P. et al. // Int. J. Biol. Macromol. 2020. V. 146. P. 285. https://doi.org/10.1016/j.ijbiomac.2019.12.180
Kljun A., Benians T.A.S., Goubet F. et al. // Biomacromolecules. 2011. V. 12. № 11. P. 4121. https://doi.org/10.1021/bm201176m
Atykyan N., Revin V., Shutova V. // AMB Expr. 2020. V. 10. P. 84. https://doi.org/10.1186/s13568-020-01020-8
Park S., Baker J.O., Himmel M.E. et al. // Biotechnol. Biofuels. 2010. V. 3. P. 10. https://doi.org/10.1186/1754-6834-3-10
Kruer-Zerhusen N., Cantero-Tubilla B., Wilson D.B. // Cellulose. 2018. V. 25. P. 37. https://doi.org/10.1007/s10570-017-1542-0
Revin V.V., Dolganov A.V., Liyaskina E.V. et al. // Polym. 2021. V. 13. № 9. P. 1422. https://doi.org/10.3390/polym13091422
French A.D. // Cellulose. 2014. V. 21. P. 885. https://doi.org/10.1007/s10570-013-0030-4
Aleshina L.A., Gladysheva E.K., Budaeva V.V. et al. // Crystallography Reports. 2018. V. 63. № 6. P. 955. https://doi.org/10.1134/S1063774518050024
Torlopov M.A., Mikhaylov V.I., Udoratina E.V. et al. // Cellulose. 2018. V. 25. P. 1031. https://doi.org/10.1007/s10570-017-1624-z
Hestrin S., Schramm M. // Biochem. J. 1954. V. 58. P. 345.
Kashcheyeva E.I., Gismatulina Y.A., Budaeva V.V. // Polym. 2019. V. 11. № 10. P. 1645. https://doi.org/10.3390/polym11101645
Lopes T.D., Riegel-Vidott I.C., Grein A. et al. // Int. J. Biol. Macromol. 2014. V. 67. P. 401. https://doi.org/10.1016/j.ijbiomac.2014.03.047
Lee C.M., Gu J., Kafle K. et al. // Carbohyd. Polym. 2015. V. 133. P. 270. https://doi.org/10.1016/j.carbpol.2015.06.091
Bohn A., Fink H.P., Ganster J., Pinnow M. // Macromol. Chem. Phys. 2000. V. 201 (15). P. 1913. https://doi.org/10.1002/1521-3935(20001001)201: 15<1913::AID-MACP1913>3.0.CO;2-U
Monammadkazemi F., Doodthoseinik K., Azin M. // Cell. Chem. Technol. 2015. V. 49 (5–6). P. 455.
Huang H.-Ch., Chen L.-Ch., Lin Sh.-B. et al. // Bioresource Technol. 2010. V. 101. № 15. P. 6084. https://doi.org/10.1016/j.biortech.2010.03.031
Huang Y., Zhu C., Yang J. et al. // Cellulose. 2014. V. 21. P. 1. https://doi.org/10.1007/s10570-013-0088-z
Vanderhart D.l., Atalla R.H. // Macromolecules. 1984. V. 17. P. 1465.
Wang J., Tavakoli J., Tang Y. // Carbohyd. Polim. 2019. V. 219. P. 63. https://doi.org/10.1016/j.carbpol.2019.05.008
Revin V., Liyaskina E., Nazarkina M. et al. // Braz. J. Microbiol. 2018. V. 49. P. 151. https://doi.org/10.1016/J.BJM.2017.12.012
Goelzer F.D.E., Faria-Tischer P.C.S., Vitorino J.C. // Mater. Sci. Eng. C – Bio S. 2009. V. 29. № 2. P. 546. https://doi.org/10.1016/j.msec.2008.10.013
Cavka A., Guo X., Tang S.J. // Biotechnol. Biofuels. 2013. V. 6. P. 25. https://doi.org/10.1186/1754-6834-6-25
Khandelwal M. Structure and processing of fibrous cellulose: bacterial and ascidian material (doctoral thesis). University of Cambridge, 2013.
Cheng K., Catchmark J., Demirci A. // J. Biol. Eng. 2009. V. 3. № 12. P. 1. https://doi.org/10.1186/1754-1611-3-12
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


