Кристаллография, 2022, T. 67, № 3, стр. 384-391
Кристаллическая структура анион-радикальных солей 7,7,8,8-тетрацианохинодиметана с катионами N-ксилил-пиридиния и N-ксилил-изохинолиния
Т. Н. Стародуб 1, *, Д. Фенске 2, 3, 4, О. Фур 2, 3, В. О. Ярошенко 5, 6, Д. Степень 1
1 Институт химии университета Яна Кохановского
Кельце, Польша
2 Институт неорганической химии Технологического института
Карлсруэ, Германия
3 Институт нанотехнологии и Карлсруэ наномикроотделение Технологического института Карлсруэ
Еггеншттайн–Деопольдсгафен, Германия
4 Лен-институт функциональных материалов Института химии и химической инженерии
Университета Сень-Ят-Сена
Гуанчжоу, Китай
5 Институт химии университета в Хельсинки
Хельсинки, Финляндия
6 Кафедра химии, факультет естественных наук, университет Матея Беля
Ба́нска-Би́стрица, Словакия
* E-mail: tstarodub@ujk.edu.pl
Поступила в редакцию 02.09.2021
После доработки 30.09.2021
Принята к публикации 05.10.2021
- EDN: LCHDHI
- DOI: 10.31857/S0023476122030201
Аннотация
Синтезированы новые анион-радикальные соли 7,7,8,8-тетрацианохинодиметана (TCNQ) с катионами N-ксилил-пиридиния и N-ксилил-изохинолиния сложного состава: (N-Xy-Py)(TCNQ)2(CH3CN) (1) и (N-Xy-iQn)(TCNQ)2 (2). Методом рентгеноструктурного анализа определены кристаллическая и молекулярная структура 1 и 2. Соли кристаллизуются в разных сингониях: структура (N-Xy-Py)(TCNQ)2(CH3CN) относится к ромбической системе, структура (N-Xy-iQn)(TCNQ)2 – к триклинной. В кристаллах соли 1 наблюдаются димеризованные стопки анион-радикалов типа ABAB, в структуре 2 стопки тетрамеризованы. Подобное структурное искажение не способствует высокой электропроводности, что подтверждается данными ИК-спектров: спектры солей 1 и 2 не содержат особенностей, присущих высокопроводящим солям TCNQ, отсутствуют непрерывное поглощение и аномальное уширение линий. Причиной этого может быть неустойчивость Пайерлса, в результате которой происходит димеризация стопок в кристаллах соли 1 и тетрамеризация стопок в кристаллах соли 2.
ВВЕДЕНИЕ
Анион-радикальные соли (АРС) 7,7,8,8-тетрацианохинодиметана (TCNQ) представляют большой интерес вследствие их необычных физических свойств [1, 2]. Эти АРС находят применение как проводящие материалы, способные плавиться без разложения [1, 3], магнитно-упорядоченные структуры (включая спиновые лестницы) [1, 4], материалы для производства полевых транзисторов [1, 5], фотодиодов и других устройств микро- и наноэлектроники [1, 2]. Структура и природа катиона существенно влияют на физические свойства АРС TCNQ, поэтому изучение этого влияния представляется очень важным.
В работе представлены результаты исследования структурных и оптических свойств АРС TCNQ с катионами на основе пиридина и изохинолина, которые становятся существенно неплоскими при введении соответствующих радикалов. Для синтеза новых АРС TCNQ были использованы катионы N-ксилил-пиридиния и N-ксилил-изохинолиния:
Данный выбор обусловлен тем, что катионы на основе пиридина и изохинолина кроме применения в качестве материалов современной электроники и спинтроники [2] имеют очень большое биологическое значение. Органические комплексы с катионами на основе пиридина характеризуются антиоксидантными, антигрибковыми и антибактерицидными свойствами [6]. Катионы на основе изохинолина могут найти применение в медицине, например при количественном определении антибиотиков, замедляющих развитие грамположительных и грамотрицательных бактерий, отвечающих за кожные заболевания [7], а также в био- и нанотехнологии, например при количественном определении алифатических и ароматических аминов в воде, которое важно, поскольку амины – очень токсические соединения [8, 9].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали TCNQ фирмы Aldrich, который дополнительно был очищен при перекристаллизации. Соли (N-Xy-Py)+Br– и (N-Xy-iQn)+Br– синтезировали по реакции
Соответствующий алкил-бромид (0.2 моль) добавляли по каплям к раствору соответствующего амина (0.1 моль) в ацетоне (200 мл). Смесь перемешивали в атмосфере аргона в течение двух–трех дней (полноту кватернизации контролировали методом бумажной хроматографии). По завершении реакции образовавшийся осадок отфильтровывали, промывали ацетоном и сушили в вакууме при комнатной температуре (нагревание приводит к разложению). Полученные соли использовали без дальнейшей очистки.
АРС 1 и 2 синтезировали согласно реакции
Состав образовавшихся АРС определяли спектрофотометрически [10] с использованием спектрометра Merck Spectroquant Pharo 300. Использовали растворы АРС в ацетонитриле в кюветах толщиной 1 см. Для подтверждения полученных результатов проводили также элементный анализ на углерод, водород и азот с использованием прибора VarioMICRO Superuse. Согласно полученным данным АРС имеют состав: (N-Xy-Py) (TCNQ)2(CH3CN) (1) и (N-Xy-iQn)(TCNQ)2 (2).
Для 1 найдено: C 73.78, H 4.03, N 22.17 мас. %. Для C39H25N10 вычислено: C 73.92, H 3.98, N 22.10 мас. %. Для 2 найдено: C 76.53, H 3.85, N 19.68 мас. %. Для C41H24N9 вычислено: C 76.62, H 3.76, N 19.61 мас. %.
Рентгеноструктурное исследование АРС 1 и 2 проведено на монокристальном дифрактометре Stoe StadiVari Eulerian при 180 K с детектором Dectris Pilatus 300K с использованием монохроматического излучения MoKα (λ = 0.71073 Å) для АРС 1 и с детектором Dectris EIGER4M с GaKα (λ = 1.34143 Å) для АРС 2. Кристаллическая структура решена методом внутреннего фазирования с использованием пакета программ ShelXT [11] и уточнена полноматричным методом наименьших квадратов с использованием программ SHELXL [12] и OLEX2 [13]. Все атомы, кроме водорода, уточнены в анизотропном приближении параметров смещений. Атомы водорода были локализованы из карты Фурье и в случае АРС 2 уточнены независимо от остальных атомов с использованием изотропных параметров смещения, а для АРС 1 использовали модель “наездника” (Uiso = 1.5Ueq для метильных групп, Uiso = 1.2Ueq для прочих).
Основные кристаллографические и экспериментальные данные представлены в табл. 1. Для визуализации структурных данных использована программа Diamond 3.2k [14]. Молекулярные структуры изученных соединений представлены на рис. 1. Экспериментальные длины связей и углы представлены в ESI (табл. S1–S4 ).
Таблица 1.
Кристаллографические характеристики, данные эксперимента и результаты уточнения структур АРС (N-Xy-Py)(TCNQ)2(CH3CN) (1) и (N-Xy-iQn)(TCNQ)2 (2)
| Соединение | 1 | 2 |
|---|---|---|
| Брутто-формула | C39H25N10 | C41H24N9 |
| Система, пр. гр., Z | Ромбическая, P212121, 4 | Триклинная, P$\bar {1}$, 2 |
| Т, K | 180(1) | 180(1) |
| a, b, c, Å | 7.8195(2), 12.6842(5), 32.2214(12) | 7.6614(2), 14.5310(4), 15.9062(4) |
| α, β, γ, град | 90, 90, 90 | 112.300(2), 91.603(2), 91.492(2) |
| V, Å3 | 3195.85(19) | 1636.43(8) |
| Dвыч, г/см3 | 1.317 | 1.304 |
| λ, мм–1 | 0.083 | 0.413 |
| Излучение; λ, Å | MoKα; 0.71073 | GaKα; 1.34143 |
| Дифрактометр | Stoe StadiVari Eulerian | |
| Размер кристаллов, мм | 0.38 × 0.1 × 0.03 | 0.36 × 0.34 × 0.05 |
| Tmin, Tmax | 0.326, 0.995 | 0.078, 0.924 |
| Число отражений: измеренных/независимых, Rint/с I > 2σ(I) | 16428/7860, 0.019/6325 | 22109/7749, 0.016/6479 |
| Число параметров | 444 | 547 |
| R(F 2)/wR(F 2) | 0.040/0.104 | 0.035/0.110 |
| S | 1.030 | 1.100 |
| Δρmin/Δρmax, э·Å–3 | –0.154/0.230 | –0.203/0.221 |
| Программы | SHELXL [12], OLEX2 [13] | |
Рис. 1.
Структуры молекул и схема нумерации в: a – АРС (N-Xy-Py)(TCNQ)2(CH3CN), б – АРС (N-Xy-iQn)(TCNQ)2.

CCDC № 2016745 (АРС 1) и 1983621 (АРС 2) cодержат дополнительные кристаллографические данные. Их можно получить в Кембриджском банке структурных данных через www.ccdc.cam.ac.uk/structures.
Спектры ИК-поглощения порошкообразных образцов 1 и 2 регистрировали на приборе Nicoletis 10 instrument (Thermo Scientific) с приставкой Smart MIRacle в диапазоне частот от 500 до 4000 см–1 при комнатной температуре.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Асимметричная часть элементарной ячейки обеих АРС содержит органический катион и два независимых анион-радикала TCNQ (A и B) (рис. 1). Кроме того, в структуре АРС 1 содержится одна молекула ацетонитрила. На основе формул АРС 1 и 2 средний заряд на частицах TCNQq– должен быть равен –0.5 (или –1 на две частицы TCNQ). Известно, однако, что степень окисления TCNQ хорошо отражается на длинах связей в нем. Учитывая наличие в структуре двух кристаллографически неэквивалентных анион-радикалов, использовали соотношение Кистенмахера
для нахождения распределения зарядов в стопках TCNQ [15, 16] (табл. 2). По данным табл. S1 и S3 найдены неодинаковые заряды частиц типа A и B. Отметим, что диспропорционирование зарядов должно привести к увеличению сопротивления по сравнению со стопками с одинаковыми зарядами –0.5 на частицах TCNQ.Таблица 2.
Анализ длин связей в TCNQ и корреляция между длинами связей и зарядом частиц TCNQ

| a | b | c | d | b – c | c – d | c/(b + d) | Q | |
|---|---|---|---|---|---|---|---|---|
| TCNQ0 | 1.345 | 1.448 | 1.374 | 1.441 | 0.074 | –0.067 | 0.476 | –0.001 |
| TCNQ–0.5 | 1.354 | 1.434 | 1.396 | 1.428 | 0.040 | –0.032 | 0.488 | –0.500 |
| TCNQ– | 1.374 | 1.423 | 1.420 | 1.416 | 0.003 | 0.004 | 0.500 | –0.999 |
| (1) | ||||||||
| TCNQ A | 1.356 | 1.431 | 1.404 | 1.425 | 0.027 | –0.021 | 0.492 | –0.660 |
| TCNQ B | 1.351 | 1.441 | 1.387 | 1.431 | 0.054 | –0.044 | 0.483 | –0.290 |
| (2) | ||||||||
| TCNQ A | 1.365 | 1.426 | 1.412 | 1.421 | 0.014 | –0.009 | 0.496 | –0.830 |
| TCNQ B | 1.354 | 1.442 | 1.388 | 1.431 | 0.054 | –0.044 | 0.483 | –0.300 |
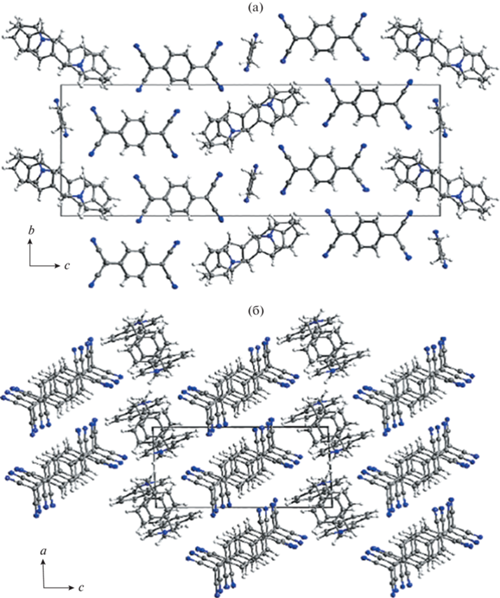
Структуры обеих АРС образованы стопками анион-радикалов TCNQ, между которыми расположены катионы и молекулы растворителя (рис. 2). Подобный тип упаковки характерен для АРС TCNQ, что связано с сильным взаимодействием π-систем анион-радикалов, что обычно способствует высокой электропроводности вследствие делокализации π-электронов.
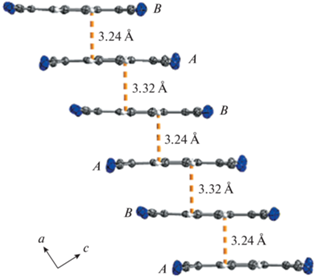
Стопки анион-радикалов в кристаллах АРС 1 и 2 представлены на рис. 3, 4. Вследствие пайерлсовской и спин-пайерлсовской неустойчивости должна происходить n-меризация стопок (здесь 1/n – степень заполнения зоны, в данном случае n = 4) [1, 2]. В кристаллах АРС 1 стопки анион-радикалов слегка димеризованы по типу ABAB с межплоскостными расстояниями между соседними частицами TCNQ 3.24 и 3.32 Å. В кристаллах АРС 2 анион-радикалы упакованы по типу ABBA и проявляют тенденцию к тетрамеризации; соответствующие расстояния A⋅⋅⋅B, A⋅⋅⋅A и B⋅⋅⋅B равны соответственно 3.19, 3.32 и 3.36 Å.
В обеих кристаллических структурах имеются очень слабые водородные связи C–H⋅⋅⋅N (расстояния N⋅⋅⋅H находятся в пределах 2.47–2.70 Å). Можно предположить, что это скорее эффекты упаковки, и структурные элементы в кристалле связаны в основном за счет электростатических взаимодействий между катионами и анионами, а также упомянутых выше взаимодействий в стопках TCNQ. Следует также отметить наличие интересного взаимодействия C–H⋅⋅⋅π: C6–H6A…C7–12i (i: 0.5 + x, 1.5 – y, 1 – z) в структуре 1 и C5–H5…C11–16ii (ii: 2 – x, 1 – y, –z) в структуре 2 (рис. 5).
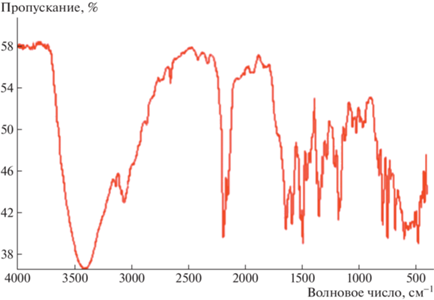
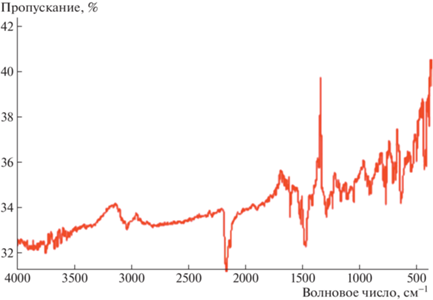
ИК-спектры АРС 1 и 2 не содержат особенностей, присущих высокопроводящим АРС TCNQ (рис. 6, 7). Отсутствует непрерывное поглощение, соответствующее возбуждению электронов проводимости, а также нет линий внутримолекулярных колебаний, аномально уширенных вследствие электрон-фононного взаимодействия [1, 2]. Причиной этого может быть неустойчивость Пайерлса, в результате которой происходит димеризация стопок в кристаллах АРС 1 и тетрамеризация стопок в кристаллах АРС 2. В ИК-спектре АРС 1 в области 3000–3600 см–1 наблюдается широкая полоса с максимумом при 3409 см–1 (рис. 6). Эту полосу, согласно [17], можно отнести к полосе с переносом заряда в стопках TCNQ. Как следует из табл. 2, это соответствует переходу
Из ИК-спектров можно получить оценку ширины щели в результате перехода Пайерлса: 0.42 эВ. Это соответствует выигрышу энергии в результате перехода от гомогенных стопок TCNQ к димеризованным стопкам.
ЗАКЛЮЧЕНИЕ
Синтезированы две новые АРС TCNQ с катионами, содержащими пара-ксилильные радикалы. Обе соли относятся к солям сложного состава: (N-Xy-Py)(TCNQ)2(CH3CN) и (N-Xy-iQn)(TCNQ)2. Несмотря на слабое различие в строении катионов, структуры новых АРС различаются. АРС (N-Xy-Py)(TCNQ)2(CH3CN) кристаллизуется в ромбической кристаллической системе, АРС (N-Xy-iQn)(TCNQ)2 – в триклинной.
В структуре АРС 1 стопки TCNQ димеризованы, в структуре АРС 2 – тетрамеризованы. Согласно данным ИК-спектроскопии обе АРС низкопроводящие: в спектрах отсутствует непрерывное поглощение, обусловленное возбуждением электронов проводимости, и отсутствуют линии, аномально уширенные вследствие электрон-фононного взаимодействия.
В ИК-спектре АРС (N-Xy-Py)(TCNQ)2 (CH3CN) наблюдается одна интенсивная широкая полоса в области 3000–3600 см–1, которая соответствует возбуждению с переносом заряда в стопках TCNQ. Энергетический выигрыш вследствие перехода Пайерлса равен 0.42 эВ.
Полученные результаты способствуют расширению данных в области химии TCNQ и АРС на его основе, а также могут послужить стимулом для дальнейших исследований солей 7,7,8,8-тетрацианохинодиметана с катионами на основе производных пиридина и изохинолина, что, в свою очередь, может привести к появлению новых органических проводников на основе АРС TCNQ.
Вклад доктора В.О. Ярошенко в эту исследовательскую программу поддержан Национальным научным центром “СОНАТА 10” (грант № 2015/19/D/ST5/02774).
Список литературы
Starodub V.A., Starodub T.N. // Russ. Chem. Rev. 2014. V. 83. P. 391. https://doi.org/10.1070/RC2014v083n05ABEH004299
Стародуб В.А., Стародуб Т.Н., Кажева О.Н., Брегадзе В.И. // Материалы современной электроники и спинтроники. М.: Физматлит, 2018. С. 424.
Saito G., Murata T. // Philos. Trans. R. Soc. A 2008. V. 366. P. 139. https://doi.org/10.1098/rsta.2007.2146
Ueda K., Sugimoto T., Endo S. et al. // Chem. Phys. Lett. 1966. V. 261. P. 295. https://doi.org/10.1016/0009-2614(96)00982-7
Menard E., Podzorov V., Hur S.-H. et al. // Adv. Mater. 2004. V. 16. P. 2097. https://doi.org/10.1002/adma.200401017
Piotrowska A., Drzeżdżon J., Jacewicz D., Chmurzyński L. // Wiadomości Chemiczne. 2017. V. 71. P. 220.
Martindale, The Extra Pharmacopoeia V. 33. London: Royal Pharmaceutical Society, 2020.
Al-Sabha T.N., Al-Karemy N.M. // J. Anal. Methods Chem. 2013. V. 2013. P. 1.
Wang Ch., Wu Na, Jacobs Daniel L. et al. // Chem. Commun. 2017. V. 53. P. 1132.
Starodub V.A., Gluzman E.M., Kaftanova Yu.A. // J. Olejniczak. Theor. Experim. Chem. 1997. V. 33. P. 95. https://doi.org/10.1007/BF02765953
Sheldrick G.M. // Acta Cryst. A. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053273314026370
Sheldrick G.M. // Acta Cryst. C. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053229614024218
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Brandenburg K. Diamond 3.2k. Crystal Impact GbR, Bonn, Germany (1999).
Üngor Ö., Phan H., Choi E. Sang et al. // J. Magn. Magn. Mater. 2020. V. 497. P. 165984. https://doi.org/10.1016/j.jmmm.2019.165984
Kistenmacher Th.J., Emge Th.J., Bloch A.N., Cowan D.O. // Acta Cryst. B. 1982. V. 38. P. 1193. https://doi.org/10.1107/S0567740882005275
Shirotani I., Sakai N. // J. Solid State Chem. 1976. V. 18. P. 17. https://doi.org/10.1016/0022-4596(76)90074-8
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография