Кристаллография, 2022, T. 67, № 6, стр. 977-981
Влияние структуры замещенных нафталоцианинов на их оптические свойства в тонких пленках
А. В. Казак 1, 2, 3, М. А. Марченкова 2, *, Б. В. Набатов 2, И. В. Рыков 4, Т. В. Дубинина 4, 5, Д. Н. Чаусов 3, 6
1 Научно-исследовательский институт наноматериалов “Ивановский государственный университет”
Иваново, Россия
2 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
3 Московский государственный областной университет
Москва, Россия
4 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
5 Институт физиологически активных веществ РАН
Черноголовка, Россия
6 Институт общей физики им. А.М. Прохорова РАН
Москва, Россия
* E-mail: marchenkova@crys.ras.ru
Поступила в редакцию 18.02.2022
После доработки 06.03.2022
Принята к публикации 10.03.2022
- EDN: GJQBTT
- DOI: 10.31857/S0023476122040105
Аннотация
Представлено исследование оптических свойств 3,4,12,13,21,22,30,31-Окта-(2-нафтил)-2,3-нафталоцианината цинка и 3,4,12,13,21,22,30,31-Окта-(2-нафтокси)-2,3-нафталоцианината цинка в растворах хлороформа и тонкопленочных образцах. Сформированы плавающие слои и пленки Ленгмюра–Шеффера этих соединений. Получены спектры поглощения и флуоресценции как для растворов соединений, так и для многослойных пленок Ленгмюра–Шеффера. Показано, что в спектрах поглощения многослойных пленок положение Q-полосы, ответственной за окраску соединения, батохромно смещено на 12–13 нм по сравнению со спектрами растворов. Это можно объяснить наличием межмолекулярных дипольных взаимодействий между ориентированными в виде цепочки молекулами нафталоцианина, характерных для J-агрегатов – одного из известных типов структурно упорядоченных образований молекул красителей. Из-за образования плотно упакованного пограничного слоя в тонкопленочных образцах происходит тушение флуоресценции.
ВВЕДЕНИЕ
В последние десятилетия стремительно растет интерес к науке о нанообъектах, а именно о материалах со сложной молекулярной структурой [1–6]. В связи с этим фталоцианины продолжают привлекать внимание исследователей своими уникальными линейными и нелинейно-оптическими свойствами [7–9], благодаря которым эти красители широко используются в различных областях науки и техники [10–14]. Актуальность производных фталоцианина определяется острой необходимостью создания новых дешевых и высокоэффективных материалов для наноэлектронных устройств, в том числе элементов фотоэлектрических устройств на основе тонкопленочных органических наноматериалов [15–17]. Они демонстрируют сочетание свойств, необходимых для их эффективного применения в фотоэлектрических, светодиодных и других органических электронных устройствах [18–20]. Среди производных фталоцианина наиболее интересными соединениями являются нафталоцианины благодаря их способности поглощать свет в ближней ИК-области [21, 22]. Такое поглощение должно помочь повысить эффективность преобразования солнечной энергии в электрическую. Важной фундаментальной проблемой, имеющей большое практическое значение, являются контроль и управление структурой таких материалов для создания тонкопленочных наноматериалов с оптимальными физико-химическими свойствами [23–29]. Структура и свойства получаемых тонкопленочных материалов обычно зависят от надмолекулярной организации плавающих слоев [30, 31]. Морфология монослоев Ленгмюра 3,4,12,13,21,22, 30,31-Окта-(2-нафтил)-2,3-нафталоцианината цинка (I) и 3,4,12,13,21,22,30,31-Окта-(2-нафтокси)-2,3-нафталоцианината цинка (II) (рис. 1) была изучена в [32]. Чтобы продолжить это направление, в настоящей работе получены тонкие пленки упомянутых веществ и изучены их оптические свойства.
МАТЕРИАЛЫ И МЕТОДЫ
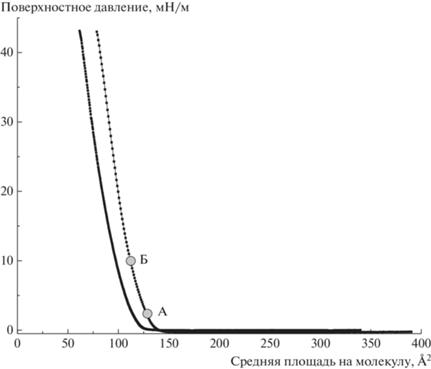
Синтез замещенных 2,3-нафталоцианинов проводили по методу, описанному в [33, 34]. Слои Ленгмюра были сформированы из растворов исследуемых соединений в хлороформе (C = = 0.013 мас. %, C – массовая доля растворенного вещества) с использованием ванны KSV 5000 (Финляндия). В качестве субфазы использовали сверхчистую воду ρ = 18.2 МОм · см (Millipore Elix 3, Millipore Simplicity 185). Температуру субфазы и окружающей среды поддерживали постоянной (18.0 ± 0.5°С). Начальная степень покрытия водной поверхности молекулами нафталоцианина рассчитана в соответствии с методом [14]. Сформированные монослои были перенесены методом Ленгмюра–Шеффера (ЛШ) на кварцевые подложки (КУ-1) при поверхностном давлении (SP) 2 и 10 мН/м (условия переноса показаны точками на рис. 2). Количество переносов равно 20.
Рис. 2.
π–A-изотермы плавающего слоя соединения I (слева) и соединения II (справа), точками А и Б обозначены поверхностные давления 2 и 10 мН/м соответственно.
Электронные спектры поглощения получены с помощью двухлучевого спектрофотометра Cary 5000 (Varian) в диапазоне длин волн 250–1000 нм. Спектры флуоресценции регистрировали на спектрофлуориметре Cary Eclipse (Varian) в диапазоне длин волн 450–900 нм. Спектры растворов соединений в хлороформе (с концентрацией (3.7–4.2) × 10–5 моль/л) регистрировали в стандартных кварцевых кюветах с длиной оптического пути 1 см. Анализ спектральных данных всех растворов проводили после вычитания вклада растворителя.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Супермолекулярная организация плавающих слоев. На рис. 2 показаны π–A-изотермы, полученные во время образования монослоя соединений I и II.
π–A-изотермы аналогичны изотермам 3,4,12,13,21,22,30,31-окта-фенил-2,3-нафталоцианината цинка [22]. Начальная площадь на молекулу в описанном эксперименте составляла Aмол = = 340 и Aмол = 390 Å2 для соединений I и II соответственно. Изотермы исследуемых соединений характеризуются непрерывным повышением поверхностного давления во время сжатия пленки. Многослойные пленки ЛШ переносили в жидком и жидкокристаллическом фазовых состояниях, указанных на рис. 2 в качестве точек А и Б (2 и 10 мН/м соответственно).
Оптические характеристики пленок Ленгмюра–Шеффера. На рис. 3 показаны спектры поглощения и флуоресценции растворов в хлороформе и многослойных тонкопленочных образцов соединений I и II. В спектрах поглощения всех образцов в ближней УФ-области имеется характерная В-полоса (Соре). В красной области спектра, приграничной с ближней ИК-областью (~800 нм), наблюдается достаточно интенсивная характерная Q-полоса, ответственная за окраску соединения. Так, для растворов соединений I и II ее максимумы находятся на длине волны 777 нм (рис. 3а, кривая 1) и 793 нм (рис. 3а, кривая 2) соответственно. В спектрах поглощения образцов многослойных пленок положение Q-полосы батохромно смещено на 12–13 нм относительно максимума Q-полосы соответствующих растворов (положение максимума Q-полосы для пленок соединения I составляет 790 нм (рис. 3а, кривые 3, 4), для пленок соединения II – 805 нм (рис. 3а, кривые 5–7). Условия (поверхностное давление) переноса пленок на подложки для обоих соединений не влияют на положение максимума Q-полосы в спектрах поглощения. Это указывает на схожую надмолекулярную организацию соединений при различных условиях переноса. В точке А (рис. 2) перенос осуществлялся из edge-on-монослоя, а в точке Б (рис. 2) из edge-on-бислоя [32]. Данное изменение спектров поглощения тонкопленочных образцов можно объяснить наличием межмолекулярных взаимодействий в тонких пленках нафталоцианина, которые характерны для J-агрегатов. Агрегаты, образующиеся при спонтанной сборке молекул (самоорганизация), классифицируют по J- и H-типу в зависимости от относительной ориентации индуцированных диполей переходов каждой молекулы – “голова-к-хвосту” или “голова-к-голове” соответственно [35]. Состояние J-агрегатов обусловлено сильным межмолекулярным дипольным взаимодействием между ориентированными в виде цепочки мономерами, для них в электронных спектрах поглощения характерно смещение максимума поглощения в длинноволновую (красную) область относительно мономолекулярной формы [35].
Рис. 3.
Спектры поглощения (а) и флуоресценции (б) растворов соединений в хлороформе I (кривые 1) и II (а, кривая 2; б, кривые 2, 3) и многослойных пленок (14 и 20 слоев) (а, кривые 3–7). Для наглядности кривые 2–7 на рис. а представлены в увеличенном виде: 2 – ×8; 3 – 20 слоев, SP 2 мН/м, ×10; 4 – 20 слоев, SP 10 мН/м, ×10; 5 – 14 слоев, SP 2 мН/м, ×20; 6 – 20 слоев, SP 2 мН/м, ×30; 7 – 20 слоев, SP 10 мН/м, ×10.
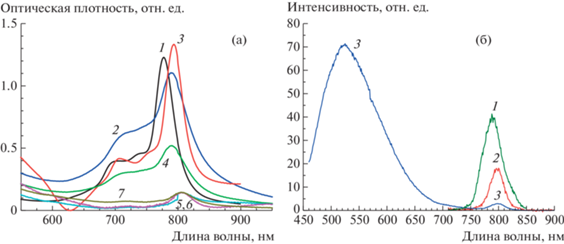
Возбуждение молекул нафталоцианинов в растворах в область поглощения Q-полосы (возбуждение светом 700–750 нм) приводит к возникновению зеркально-симметричной полосы излучения с небольшим батохромным сдвигом 5–9 нм.
В спектрах флуоресценции для соединения I максимум полосы наблюдается на длине волны 786 нм (рис. 3б, кривая 1), для соединения II – 798 нм (рис. 3б, кривая 2). Кроме этого, в области 450–650 нм наблюдается уширенная полоса люминесценции с максимумом 525 нм, соответствующая В-полосе поглощения (рис. 3б, кривая 3). Тонкопленочные образцы в отличие от растворов не демонстрируют какой-либо заметной флуоресценции независимо от длины волны возбуждения. Тушение флуоресценции в тонких пленках можно объяснить тем фактом, что молекулы образуют плотноупакованный пограничный слой.
ЗАКЛЮЧЕНИЕ
Сформированы плавающие слои и пленки Ленгмюра–Шеффера из 3,4,12,13,21,22,30,31-Окта-(2-нафтил)-2,3-нафталоцианината цинка (I) и 3,4,12,13,21,22,30,31-Окта-(2-нафтокси)-2,3-нафталоцианината цинка (II). Изучены спектральные и флуоресцентные свойства растворов и тонкопленочных материалов соединений I и II. Установлено, что спектральные характеристики исследованных соединений в ЛШ-пленках отличаются от таковых в растворе хлороформа. В ЛШ-пленках максимум Q-полосы смещен на 12–13 нм в длинноволновую область относительно соответствующих растворов, что объясняется наличием межмолекулярных взаимодействий в тонких пленках нафталоцианина, характерных для J-агрегатов. В тонкопленочных образцах в отличие от растворов наблюдалось практически полное тушение флуоресценции независимо от длины волны возбуждения. Такое тушение в тонких пленках данных соединений происходит из-за того, что их молекулы образуют плотноупакованный пограничный слой.
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации в рамках государственного задания Ивановскому государственному университету (№ FZZM-2020-0006), выполнения работ по Государственному заданию Федеральному научно-исследовательскому центру “Кристаллография и фотоника” РАН с использованием оборудования Центра коллективного пользования “Структурная диагностика материалов” ФНИЦ “Кристаллография и фотоника” РАН и частично при поддержке Российского фонда фундаментальных исследований (грант № 20-07-00181a), РФФИ и Ивановской области (грант № 20-47-370002). Работа по синтезу и характеризации нафталоцианиновых комплексов выполнена при поддержке Российского научного фонда (грант № 19-73-00099).
Список литературы
Gorbachev I.A., Smirnov A.V., Glukhovskoy E.G. et al. // Langmuir. 2021. V. 37. P. 14105. https://doi.org/10.1021/acs.langmuir.1c02345
Yablonskii S.V., Bodnarchuk V.V., Yudin S.G. // J. Exp. Theor. Phys. 2020. V. 130. P. 446. https://doi.org/10.1134/S1063776120010203
Bottari G., De la Torre G., Guldi D.M., Torres T. // Chem. Rev. 2010. V. 110. P. 6768. https://doi.org/10.1021/cr900254z
Chausov D.N. // Liq. Cryst. Their Appl. 2018. V. 18. № 3. P. 45. https://doi.org/10.18083/LCAppl.2018.3.45
Antina L.A., Ksenofontov A.A., Kalyagin A.A. et al. // J. Mol. Liq. 2020. V. 304. P. 112717. https://doi.org/10.1016/j.molliq.2020.112717
Antina L.A., Ksenofontov A.A., Kazak A.V. et al. // Colloids Surf., A 2021. V. 618. P. 126449. https://doi.org/10.1016/j.colsurfa.2021.126449
Wöhrle D., Schnurpfeil G., Makarov S.G. et al. // Macroheterocycles. 2012. V. 5. № 3. P. 191. https://doi.org/10.6060/mhc2012.120990w
Kazak A.V., Marchenkova M.A., Khorkov K.S. et al. // Appl. Surf. Sci. 2021. V. 545. P. 148993. https://doi.org/10.1016/j.apsusc.2021.148993
Paczesny J., Binkiewicz I., Janczuk M. et al. // J. Phys. Chem. C. 2015. V. 119. P. 27007. https://doi.org/10.1021/acs.jpcc.5b08090
Kazak A.V., Marchenkova M.A., Smirnova A.I. et al. // Mendeleev Commun. 2020. V. 30. P. 52. https://doi.org/10.1016/j.mencom.2020.01.017
Klyamer D., Sukhikh A., Nikolaeva N. et al. // Sensors. 2020. V. 20 P. 1893. https://doi.org/10.3390/s20071893
Squeo B.M., Ganzer L., Virgili T., Pasini M. // Molecules. 2021. V. 26. P. 153. https://doi.org/10.3390/molecules26010153
Kuznetsova R.T., Aksenova I.V., Prokopenko A.A. et al. // J. Mol. Liq. 2019. V. 278. P. 5. https://doi.org/10.1016/j.molliq.2019.01.049
Kazak A.V., Marchenkova M.A., Smirnova A.I. et al. // Thin Solid Films. 2020. V. 704. P. 137952. https://doi.org/10.1016/j.tsf.2020.137952
Bottari G., De la Torre G., Guldi D.M., Torres T. // Chem. Rev. 2010. V. 110. P. 6768. https://doi.org/10.1021/cr900254z
Kazak A.V., Usol’tseva N.V., Smirnova A.I. et al. // Crystallography Reports. 2016. V. 61. № 3. P. 493. https://doi.org/10.1134/S1063774516030159
Maklakov S.S., Dubinina T.V., Osipova M.M. et al. // J. Porphyrins Phthalocyanines. 2016. V. 20. P. 1134. https://doi.org/10.1142/S1088424616500759
Friederich P., Fediai A., Kaiser S. et al. // Adv. Mater. 2019. V. 31. P. 1808256. https://doi.org/10.1002/adma.201808256
Boileau N.T., Cranston R., Mirka B. et al. // RSC Adv. 2019. V. 9. P. 21478. https://doi.org/10.1039/C9RA03648B
Kazak A.V., Dubinina T.V., Kholodkov I.V. // Liq. Cryst. Their Appl. 2019. V. 19. № 4. P. 88. https://doi.org/10.18083/LCAppl.2019.4.88
Hirao A., Akiyama T., Okujima T. et al. // Chem. Commun. 2008. V. 39. P. 4714. https://doi.org/10.1039/B811674A
Kazak A.V., Marchenkova M.A., Dubinina T.V. et al. // New J. Chem. 2020. V. 44. P. 3833. https://doi.org/10.1039/C9NJ06041C
Tolbin A.Yu., Dzuban A.V., Shestov V.I. et al. // RSC Adv. 2015. V. 5. P. 8239. https://doi.org/10.1039/C4RA15239E
Park J.H., Ravavar L., Kwak I. et al. // J. Phys. Chem. C. 2017. V. 121. P. 6721. https://doi.org/10.1021/acs.jpcc.6b13096
Nikitin K.S., Polenov Yu.V., Kazak A.V. et al. // Crystallography Reports. 2020. V. 65. P. 779. https://doi.org/10.1134/S1063774520050156
Fuhrhop J.-H. // Langmuir. 2014. V. 30. P. 1. https://doi.org/10.1021/la402228g
Marfin Y.S., Usoltsev S.D., Kazak A.V. et al. // New J. Chem. 2020. V. 44. P. 19046. https://doi.org/10.1039/d0nj02855j
Kazak A.V., Dubinina T.V., Chausov D.N. et al. // Liq. Cryst. Their Appl. 2021. V. 21. № 1. P. 62. https://doi.org/10.18983/LCAppl.2021.1.62
Marfin Y.S., Vodyanova O.S., Usoltsev S.D. et al. // Crystallography Reports. 2019. V. 64. P. 644. https://doi.org/10.1134/S1063774519040138
Kolker A.M., Erokhin V., Borovkov N.Yu. // J. Phys. Chem. C. 2016. V. 120. P. 12706. https://doi.org/10.1021/acs.jpcc.6b04180
Hussain S.A., Dey B., Bhattacharjee D., Mehta N. // Heliyon. 2018. V. 4. https://doi.org/10.1016/j.heliyon.2018.e01038
Kazak A.V., Marchenkova M.A., Dubinina T.V., Chausov D.N. // J. Phys.: Conf. Ser. 2020. V. 1560. № 012034. https://doi.org/10.1088/1742-6596/1560/1/012034
Dubinina T.V., Paramonova K.V., Trashin S.A. et al. // Dalton Trans. 2014. V. 43. P. 2799. https://doi.org/10.1039/C3DT52726C
Dubinina T.V., Piskovoi R.A., Tolbin A.Y. et al. // Russ. Chem. Bull. 2008. V. 57. P. 1912. https://doi.org/10.1007/s11172-008-0258-6
Blinov L.M., Lazarev V.V., Palto S.P., Yudin S.G. // J. Exp. Theor. Phys. 2012. P. 691. https://doi.org/10.1134/ S1063776112030016
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография