Кристаллография, 2022, T. 67, № 6, стр. 924-929
Рентгеноструктурное исследование моноклинной кристаллической модификации церулоплазмина человека
А. В. Соколов 1, В. Б. Васильев 1, В. Р. Самыгина 2, 3, *
1 Институт экспериментальной медицины
Санкт-Петербург, Россия
2 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
3 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: lera@crys.ras.ru
Поступила в редакцию 01.06.2022
После доработки 01.06.2022
Принята к публикации 03.06.2022
- EDN: QKFRGG
- DOI: 10.31857/S0023476122060236
Аннотация
Впервые получены кристаллы церулоплазмина (ЦП) человека, принадлежащие пр. гр. I2. Новая кристаллическая упаковка позволила впервые определить конформацию лабильной функциональной петли 884–890 между пятым и шестым доменом. Проведено сравнение моноклинной и тригональной кристаллических упаковок ЦП. Полученная в работе структура подтверждает эффективность метода очистки белка, позволяющего получить непротеолизованный ЦП, а также высказанное ранее предположение о значении целостности петли 884–892 для ингибирования миелопероксидазы нейтрофилов при образовании комплекса с ЦП.
ВВЕДЕНИЕ
Церулоплазмин (ЦП, ферро:O2-оксидоредуктаза, КФ 1.16.3.1) является полифункциональной медьсодержащей оксидазой. Важное физиологическое значение имеет ферроксидазная активность ЦП. Фермент катализирует окисление иона Fe2+ до Fe3+ и обеспечивает встраивание Fe3+ в апо-трансферрины, участвуя таким образом в метаболизме железа [1]. ЦП окисляет четыре иона Fe2+ и осуществляет четырехэлектронный перенос на кислород с образованием воды, препятствуя неферментативной реакции окисления железа, ведущей к появлению свободных радикалов, что делает его природным антиоксидантом. ЦП обладает также активностью супероксиддисмутазы [2] и глутатион-зависимой пероксидазы [3]. ЦП образует комплексы с белками лейкоцитов: пероксидазой эозинофилов, лактоферрином, прооксидантным ферментом нейтрофилов и моноцитов – миелоперксидазой (МПО). ЦП относят к физиологическим ингибиторам МПО [4]. ЦП также подавляет активность фактора ингибирования миграции макрофагов благодаря контактам вблизи активного центра при их взаимодействии [5].
Кристаллическая структура ЦП впервые была решена в 1996 г. с разрешением 3.1 Å [6]. ЦП представляет собой мономер, а при повышенной концентрации ионов меди ЦП может образовывать димеры [7]. Мономер состоит из шести доменов, с которыми неравномерно, но прочно связаны шесть ионов меди. Во втором, четвертом и шестом доменах расположены гомологичные одноядерные центры связывания меди, трехъядерный центр расположен между первым и шестым доменами. Кроме этого, были обнаружены еще два лабильных сайта связывания металлов, из которых в нативном ЦП заселена лишь половина [8]. По гипотезе, высказанной в [9], эти сайты играют важную роль в окислении железа. Банк белковых данных (Protein Data Bank, PDB) содержит три структуры ЦП человека, относящиеся к тригональной сингонии (P3221) с разрешением от 3.1 до 2.6 Å [6, 9, 10]. В 2008 г. была получена орторомбическая пространственная группа в условиях кристаллизации, аналогичных тем, что позволяли получить кристаллы тригональной сингонии [11]. Влияние на кристаллическую упаковку, вероятно, оказали ионы Ni2+, использовавшиеся при выделении белка и связавшиеся в лабильных центрах связывания ионов меди. Позднее была продемонстрирована зависимость кристаллической упаковки ЦП крысы (имеющего высокую гомологию с ЦП человека) от кристаллизационных условий [12].
Чувствительность ЦП к протеолитической деградации затрудняет получение кристаллов высокого дифракционного качества. В известных кристаллических структурах ЦП человека отсутствует электронная плотность для двух из трех междоменных петель, содержащих консервативные сайты протеолиза, одна из которых соответствует участку а.о. 885–890. Выделение недеградированного и стабильного ЦП остается непростой задачей. В препаратах ЦП присутствуют примеси протеиназ [13–15], что делает необходимым использование смеси протеиназных ингибиторов на всех стадиях выделения ЦП [16].
Существуют три консервативных сайта протеолиза ЦП: R481/S482, R701/Q702, K887/V888 [13] (рис. 1). Согласно [17] замена этих аминокислотных остатков в рекомбинантном ЦП с помощью сайт-направленного мутагенеза позволяет получить белок, устойчивый к протеолизу. Отсутствие протеолитической деградации по K887 важно для ингибирования церулоплазмином белка нейтрофилов МПО при образовании комплекса [10].
Рис. 1.
Общая структура ЦП. Аминокислотные остатки, относящиеся к консервативным сайтам протеолиза, показаны стиками (верхняя панель – петля, содержащая R481, смоделирована) и обозначены стрелками на схеме доменной структуры ЦП.

В настоящей работе получена новая, моноклинная кристаллической модификации ЦП и описаны ее особенности. Обсуждается конформация функциональной петли 885–890 между пятым и шестым доменами, пространственная структура которой установлена впервые благодаря использованию для кристаллизации недеградированного ЦП.
МАТЕРИАЛЫ И МЕТОДЫ
Выделение и очистка ЦП. Для получения препарата мономерного ЦП с A610/A280 > 0.049 плазму крови с добавлением 1 мМ этилендиаминтетрауксусной кислоты и 0.1 мМ фенилметилсульфонилфторида подвергали анионообменной хроматографии на UNOsphere Q и неомицин-агарозе [18]. Для гарантированного удаления следов тромбина препарат ЦП фильтровали через колонку с бензамидин-агарозой. ЦП концентрировали до 80 мг/мл с помощью центрифужной ячейки Vivaspin 20 (для M > 100 кДа), трижды заменяя буферный раствор (0.1 M Hepes-NaOH, рН 7.5).
Кристаллизация и сбор дифракционных данных. Кристаллы ЦП получали при 4°C методом диффузии паров. Кристаллизационный раствор содержал 3–7% PEG 3350, 20 мМ MgCl2 и 50 мМ Tris-буфера, рН 7.5. Кристаллы голубого цвета в виде тонких пластин размером 0.08–0.2 мм появлялись через 3–5 дней. В качестве криопротектора использовали 20% глицерина. Сбор дифракционных данных проводили на станции синхротронного излучения BL41XU, SPring-8 (Япония) при температуре 100 К с использованием детектора PILATUS 6M. Для обработки данных использовали программы DENZO, SCALEPACK [19]. Характеристики дифракционного набора приведены в табл. 1.
Таблица 1.
Характеристики экспериментального набора дифракционных данных и уточнения структуры церулоплазмина
| Параметры экспериментального набора дифракционных данных | |
| Длина волны, Å | 1.0000 |
| Пространственная группа | I2 |
| a, b, c, Å | 128.35, 76.22, 148.0 |
| α = γ, β, град | 90.00, 108.98 |
| Диапазон разрешения при сборе данных, Å | 50.0–3.5 (3.83–3.5)* |
| Полное число отражений | 80 067 (12 395)* |
| Число независимых отражений | 27 923 (4456)* |
| Полнота набора, % | 95.6 (96.1)* |
| Повторяемость | 2.9 (2.9)* |
| Среднее значение 〈I/σ(I)〉 | 3.3 (1.2)* |
| Общий температурный фактор Вильсона, Å2 | 86.9 |
| Rmerge | 5.56 (82.41)* |
| Rpim | 3.16 (46.72)* |
| $CC_{{1/2}}^{{*{\kern 1pt} *}}$, % | 91.4 (67.2)* |
| Параметры уточнения структуры | |
| Число рефлексов в рабочем наборе | 15452 (1134) |
| Число рефлексов в тестовом наборе | 789 |
| Rwork/Rfree, % | 21.49/32.26 |
| Cruickshank DPI, Å | 0.73 |
| Число уточняемых неводородных атомов | |
| Белка | 8359 |
| Лигандов | 54 |
| Воды | – |
| R.m.s.d. от “идеальной” геометрии | |
| По длинам валентных связей, Å | 0.014 |
| По валентным углам, град | 2.715 |
| Среднее значение B-фактора для всех атомов, Å2 | 69.74 |
| Статистика Рамачандрана | |
| Число а. о. в наиболее благоприятных областях, % | 98.79 |
| Число а. о. в разрешенных областях, % | 0.81 |
| Число а. о. в неблагоприятных областях, % | 0.4 |
| Число редко встречающихся ротамеров, % | 0.73 |
Решение и уточнение структуры. Структура решена методом молекулярного замещения с использованием программы MOLREP [20]. В качестве начальной модели использовали структуру ЦП (ID PDB: 4ENZ), решенную с разрешением 2.6 Å [10]. Уточнение выполнено с использованием программы REFMAC [21] и графической программы СOOT [22]. Финальный R‑фактор/Rfree-фактор составил 21.49/32.6%. Согласно карте Рамачандрана в наиболее благоприятных областях находятся 86.6/87.1% аминокислотных остатков (а.о.), в дополнительно разрешенных – 12.8/12.2%, в основных – 0.5/0.6%, в запрещенных – лишь 0.1/0.1% а.о. Характеристики решенной и уточненной пространственной структуры приведены в табл. 1.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Найдены новые кристаллизационные условия для ЦП, в которых белок впервые был закристаллизован в пр. гр. I2. Коэффициент Мэтьюса для моноклинной кристаллической упаковки составляет 2.59 Å3/Да, что соответствует содержанию растворителя 52.57%. Для сравнения содержание растворителя для тригональной упаковке составляет ∼70% при коэффициенте Мэтьюса 4.23 [11].
Обычно меньшее содержание растворителя в кристаллической ячейке позволяет получить лучшее разрешение дифракционных данных от кристалла белка [23]. Наиболее высокое пространственное разрешение было получено для орторомбической формы ЦП крысы с содержанием растворителя в кристаллической ячейке 51.71% (коэффициент Мэтьюса 2.55 Å3/Да). Несмотря на сходное значение коэффициента Мэтьюса разрешение структуры моноклинной формы ЦП человека значительно хуже. Однако в данном случае, вероятно, сыграли роль меньший размер кристалла и его форма в виде тонкой пластины. Также кристалл обладал высокой мозаичностью, составлявшей 1.54°.
В кристалле имеются каналы вдоль короткой оси диаметром ∼30 Å и извилистые каналы с полостями диаметром ∼40 Å вдоль оси а. Они уже каналов тригональной кристаллической упаковки, которые по форме напоминают треугольник и имеют сечение ∼110 × 110 × 110 Å (рис. 2).
Благодаря упаковке молекул в кристалле подвижная петля между пятым и шестым доменами, содержащая сайт протеолиза, находится вблизи симметричной молекулы (рис. 3). Впервые в истории структурных исследований ЦП, несмотря на невысокое разрешение, для этой петли присутствует электронная плотность, позволяющая определить позиции Сα-атомов участка 884–892. Несмотря на отсутствие близких контактов с симметричной молекулой, атом О Lys 887 находится на расстоянии 2.94 Å от атома O 721 Gly симметричной молекулы, что может указывать на то, что эти атомы образуют водородную связь. Учитывая, что именно пептидная связь 887 лизина является сайтом протеолиза, это взаимодействие имеет, по-видимому, важное значение для стабилизации конформации петли. Также это еще раз подтверждает, что протокол, разработанный в [18], позволяет получать недеградированный ЦП. Исследования комплекса ЦП с МПО показали, что протеолизованный ЦП образует комплекс, но не ингибирует хлорирующую активность МПО [10]. Структура комплекса ЦП с МПО определена методами малоуглового рентгеновского рассеяния в растворе и рентгеноструктурного анализа с низким разрешением, не позволяющим увидеть тонкие детали структуры. В структуре также не наблюдалось электронной плотности для атомов а. о. петли 884–892, ее конформация была смоделирована [10]. Пространственное совмещение структуры молекулы ЦП, полученной в настоящей работе, и ЦП в кристаллической структуре комплекса ЦП с МПО показало, что позиция симметричной молекулы ЦП в моноклинной сингонии сходна с позицией мономера МПО (рис. 4). Конформация петли в моноклинном ЦП естественно не может точно соответствовать конформации этой петли в комплексе. Однако она расположена близко от входа в гемовый карман МПО. Можно с осторожностью предположить, что боковая цепь Tyr885, обращенная в сторону гемового кармана МПО, может участвовать в контакте ЦП с МПО и ингибировании миелопероксидазы церулоплазмином.
Рис. 3.
Фрагмент карты электронной плотности 2Fo-Fc для петли 884–892. Уровень срезки 1σ. Светлым показана структура симметричной молекулы.
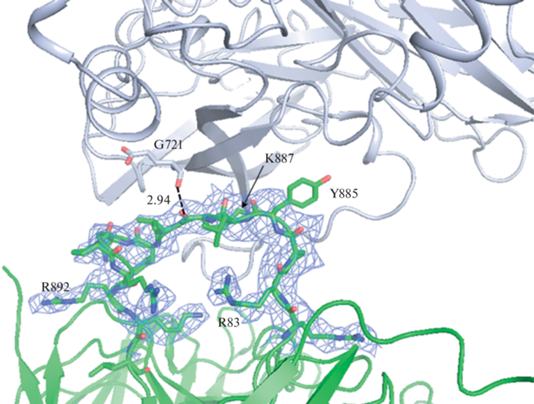
Рис. 4.
Сравнение конформаций петли 882–894 в ЦП (пр. гр. I2) (показана стиками: атомы углерода показаны зеленым, кислорода – красным, азота – синим) и в комплексе ЦП–МПО (красный). Структуры наложены по Сα-атомам ЦП. Для наглядности ЦП моноклинной формы не показан, за исключением петли 882–894. Y885 показан темно-голубым, ЦП комплекса ЦП–МПО – синим. Тяжелая цепь МПО изображена желтым, легкая – розовым. Симметричная молекула ЦП моноклинной кристаллической упаковки показана темно-зеленым (ход полипептидной цепи). Гем МПО показан темно-оранжевым.

Работа выполнена в рамках Федеральной космической программы 2016–2025 гг. (ОКР “МКС (Наука)”) в части сбора набора дифракционных данных и программы деятельности НИЦ Курчатовский Институт (приказ № 2756 от 28.10.2021 г.) в части кристаллизации, решения, уточнения и анализа структуры белка.
Список литературы
Hellaman N.E., Gitlin J.D. // Annu Rev. Nutr. 2002. V. 22. P. 439.
Plonka A., Metodiewa D., Zgirski A. et al. // Biochem. Biophys. Res. Commun. 1980. V. 95. P. 978.
Kim I.G., Park S.Y. // FEBS Lett. 1998. V. 437. P. 293.
Segelmark M., Persson B., Hellmark T., Wieslander J. // Clin. Exp. Immunol. 1997. V. 108. P. 167.
Соколов А.В., Дадинова Л.А., Петухов М.В. и др. // Биохимия. 2018. Т. 83. № 6. С. 895.
Zaitseva I., Zaitsev V., Card G. et al. // J. Biol. Inorg. Chem. 1996. V. 1. P. 15.
Petoukhov M.V., Sokolov A.V., Kostevich V.A., Samygina V.R. // Cryst. Rep. 2021. V. 5. P. 828. https://doi.org/10.1134/S1063774521050175
Lindley P.F., Card G., Zaitseva I. et al. // J. Biol. Inorg. Chem. 1997. V. 2. P. 454.
Bento I., Peixoto C., Zaitsev V.N., Lindley P.F. // Acta Cryst. D. 2007. V. 63. P. 240. https://doi.org/10.1107/S090744490604947X
Samygina V.R., Sokolov A.V., Bourenkov G. et al. // PlosOne. 2013. V. 8. e67145.
Самыгина В.Р., Соколов А.В., Пулина М.О. и др. // Кристаллография. 2008. Т. 53. С. 690.
Samygina V.R., Sokolov A.V., Bourenkov G. et al. // Metallomics. 2017. V. 9. P. 1828. https://doi.org/10.1039/C7MT00157F
Noyer M., Dwulet F.E., Hao Y.L., Putnam F.W. // Anal. Biochem. 1980. V. 102. P. 450.
Bianchini A., Musci G., Calabrese L. // J. Biol. Chem. 1999. V. 274. P. 20265.
Ehrenwald E., Fox P.L. // Arch. Biochem. Biophys. 1994. V. 309. P. 392.
Соколов А.В., Захарова Е.Т., Шавловский М.М., Васильев В.Б. // Биоорган. химия. 2005. Т. 31. С. 269.
Bielli P., Bellenchi G.C., Calabrese L. // J. Biol. Chem. 2001. V. 276. P. 2678.
Соколов А.В., Костевич В.А., Романико Д.Н. и др. // Биохимия. 2012. Т. 77. С. 775.
Otwinowski Z., Minor W. // Methods Enzymol. 1997. V. 276. P. 307.
Vagin A., Teplyakov A. // J. Appl. Cryst. 1997. V. 30. P. 1022.
Murshudov G.N., Vagin A.A., Lebedev A. et al. // Acta Cryst. D. 1999. V. 55. P. 247.
Emsley P., Cowtan K. // Acta Cryst. D. 2004. V. 60. P. 2126.
Weichenberger Ch.X., Afonine P.V., Kantardjieff K., Rupp B. // Acta Cryst. D. 2015. V. 71. P. 1023.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография



