Кристаллография, 2023, T. 68, № 1, стр. 32-37
Синтез и кристаллическая структура нового комплекса нитрата никеля(II) и этоксикарбонил-замещенного (γ-пиперидоно)аза-14-краун-4-эфира
В. Б. Кварталов 1, *, А. М. Антипин 1, В. М. Каневский 1
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
* E-mail: kvartalov@gmail.com
Поступила в редакцию 21.09.2022
После доработки 21.09.2022
Принята к публикации 22.09.2022
- EDN: DPPHHN
- DOI: 10.31857/S0023476123010150
Аннотация
Впервые в виде монокристаллов получено новое координационное соединение – производное аза-14-краун-4-эфира, содержащего этоксикарбонильную субъединицу, с нитратом никеля(II) состава [Ni3(NO3)4L4]2(NO3). Присутствие атомов никеля в комплексе подтверждено методом рентгенофлуоресцентного анализа, структура комплекса изучена методом прецизионного рентгеноструктурного анализа на лабораторном рентгеновском источнике. Показано, что молекула комплекса имеет сложную геометрию и состоит из четырех попарно симметричных молекул лиганда, координированных тремя атомами никеля. Стабилизация молекулы комплекса обеспечивается наличием прочных внутримолекулярных водородных связей, в которых участвует краун-эфирный фрагмент.
ВВЕДЕНИЕ
Комплексные соединения на основе азакраун-эфиров представляют собой важные объекты исследования современной координационной и супрамолекулярной химии благодаря свойству селективно координировать катионы металлов. Такие соединения используются в светочувствительных системах в качестве молекулярных и ионных переключателей (молекулярных машин), в том числе для мониторинга окружающей среды [1, 2], при создании контрастных реагентов для магнитно-резонансной томографии [3, 4], для синтеза молекулярных устройств, в медицине и экологии. Потребность в подобных соединениях возрастает, в связи с этим синтез монокристаллов новых комплексных соединений на основе бензоазакраун-эфиров с последовательным введением различных функциональных групп и их детальные рентгеноструктурные исследования представляют не только значительный фундаментальный, но и практический интерес.
В [5–9] были синтезированы и изучены координационные соединения биспидин-замещенного аза-14-краун-4-эфира L* (23,25-бис(2-пиридил)-8,11,14-триокса‑24,27-диазапентацикло-[19.5.1.122,26.02,7.015,20]-октакоза‑2,4,6,15(20),16,18-гексаен‑28-он) с катионами Co2+, Cu2+, Hg2+, Zn2+ и Ni2+. Показано, что L* проявляет достаточно высокую координационную активность благодаря симметричной структуре молекулы, а также содержащемуся в составе лиганда дипиридил-замещенному 3,7-диазабизикло[3.3.1]нонаноновому фрагменту, представляющему достаточно жесткий молекулярный каркас. В отличие от L* этоксикарбонилсодержащий азакраун-эфир L (23-оксо-8,11,14-триокса-25-азатетрацикло[19.3.1.02,7.015,20]пентакоcа-4,6,15(20),16,18-гексаен-22-карбоновой кислоты) является несимметричным, не обладает достаточной пространственной предорганизованностью для окружения и “захвата” катиона металла, а также содержит меньшее количество центров координации. Тем не менее наличие в молекуле L нескольких атомов с неподеленной электронной парой, данные о комплексообразовании L в растворах, а также теоретические расчеты позволили предположить достаточную комплексообразовательную активность этого аза-14-акраун-4-эфира.
Целью настоящей работы стали синтез и изучение структуры нового координационного соединения никеля(II) на основе несимметричного этоксикарбонил-замещенного аза-14краун-4-эфира [Ni3(NO3)4L4]2(NO3).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез лиганда L. Исходный лиганд L (этиловый эфир 23-оксо-8,11,14-триокса-25-азатетрацикло[19.3.1.02,7.015,20]пентакоcа-,4,6,15(20),16,18-гексаен-22-карбоновой кислоты) синтезирован трехкомпонентной конденсацией диальдегида с ацетоуксусным эфиром в присутствии ацетата аммония (ион аммония обеспечивает темплатную координацию молекулы диальдегида) по методике, описанной в [10].
Синтез комплекса [Ni3(NO3)4L4]2(NO3). Горячие растворы 0.05 г (0.13 ммоль) L и 0.038 г (0.13 ммоль) Ni(NO3)2 в 4 мл ацетона каждый сливали при перемешивании, остужали до комнатной температуры и оставляли на сутки при комнатной температуре, а затем при температуре 8°С на 3 сут. Выпавшие кристаллы отфильтровывали, промывали минимальным количеством растворителя и затем высушивали при пониженном давлении до постоянной массы. Масса полученного мелкокристаллического порошка составила 0.012 г (выход 17%). С помощью оптического микроскопа Nikon SMZ1270 удалось выделить отдельные монокристаллические образцы высокого качества, необходимые для структурной диагностики.
Рентгенофуоресцентный анализ. Исследования монокристаллов никелевого комплекса методом рентгенофлуоресцентного анализа проведены лабораторном спектрометре Orbis Micro-XRF Analyzer. Для возбуждения выхода вторичного излучения атомов никеля в составе образцов использовали монохроматическое излучение (ускоряющее напряжение 30 кВ, ток 300 мА). Для записи спектров флуоресцентного излучения применяли кремниевый энергодисперсионный детектор. Исследуемый образец был закреплен на подвижную платформу и загружен в вакуумную камеру (0.5 торр). Обработка полученных спектров проведена с помощью лицензионного пакета программ EDAX Orbis Vision [11].
Рентгеноструктурный анализ. Рентгеноструктурные исследования проведены на лабораторном дифрактометре XtaLAB Synergy-DW (MoKα, λ = 0.71073 Å) при температуре 100 К. Для проведения рентгенодифракционного эксперимента были отобраны монокристаллы, линейные размеры которых не превышали 0.07 мм. Образцы подвергались первичному рентгеноструктурному исследованию, в результате которого был выбран кристалл с наилучшими профилями дифракционных пиков и сходимостью интенсивностей эквивалентных по симметрии дифракционных отражений. По результатам предварительных экспериментов составлено задание для проведения полного дифракционного эксперимента. Обработка экспериментальных данных, поиск и интегрирование пиков, введение поправок на поглощение, фактор Лоренца и поляризация излучения проведены с помощью пакета программ CrysAlisPro [12]. Модель кристаллической структуры определена и уточнена с применением метода charge flipping (переброски заряда) [13] с помощью программного комплекса Jana2006 [14]. Данные эксперимента, кристаллографические характеристики и результаты уточнения структуры представлены в табл. 1. Информация об исследованной структуре депонирована в банк данных: CCDC (CSD) № 2210265.
Таблица 1.
Кристаллографические характеристики, данные эксперимента и результаты уточнения структуры [Ni3(NO3)4L4]2(NO3)
| Химическая формула | C96H108N10Ni3O42 |
|---|---|
| Сингония, пр. гр., Z | Триклинная, P$\bar {1}$, 1 |
| a, b, c, Å | 12.823(1), 15.561(1), 16.137(1) |
| α, β, γ, град | 112.41(1), 112.95(1), 96.26(1) |
| V, Å3 | 2612.8(4) |
| D, г/см3 | 1.43 |
| μ, мм–1 | 0.629 |
| Излучение λ, Å | MoKα, 0.71073 |
| Т, К | 100 |
| Размер образца, мм | 0.1 × 0.06 × 0.025 |
| Дифрактометр | XtaLAB Synegry DW |
| Тип сканирования | ω |
| θmin–θmax, град | 1.49–45.93 |
| Пределы h, k, l | –22 $ \leqslant $h$ \leqslant $ 25, –29 $ \leqslant $k$ \leqslant $ 31, –32 $ \leqslant $l$ \leqslant $ 32 |
| Число отражений: измеренных/независимых/I > 3σ(I) | 25 322/2950/1336 |
| Rint | 0.146 |
| Метод уточнения | МНК по F 2 |
| Число уточняемых параметров | 313 |
| Экстинкция, k | Тип I, 0.40 |
| R1/wR2 | 0.0556/0.0919 |
| S | 1.13 |
| Δρmin/Δρmax, э/Å3 | –0.41/0.48 |
| Программы | CrysAlisPro [12], Jana2006 [14], Diamond [15] |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На первом этапе исследований синтезированных кристаллов никелевого комплекса были проанализированы рентгенофлуоресцентные спектры образцов в логарифмической шкале (рис. 1). Наиболее интенсивные пики в диапазоне значений энергии 7–9 кэВ соответствуют флуоресценции атомов никеля (K-серия), что свидетельствует о присутствии атомов никеля в составе монокристаллов.
Рис. 1.
Спектр рентгенофлуоресцентного анализа никелевого комплекса в логарифмической шкале. На вставке – микрофотография образца.
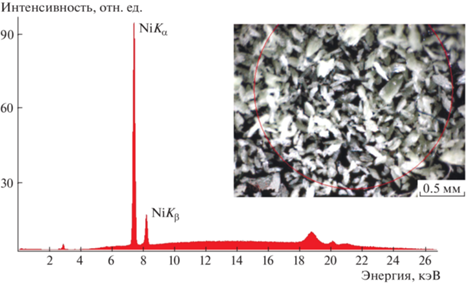
Из литературных данных известно, что металлы могут занимать краун-эфирные полости, образуя относительно компактные комплексы. В таком случае атомы никеля в настоящей работе должны были бы иметь тетраэдрическое или плоское квадратное координационное окружение, свойственное Ni2+ [16, 17]. Однако, согласно данным о строении комплексов с кобальтом и цинком [5–7], для удержания катиона d-металла внутри краун-эфирной полости необходим краун-эфир с большим количеством звеньев, а следовательно, и с большим объемом полости. Кроме того, комплексообразованию в краун-эфирной полости препятствует внутримолекулярная “вилочковая” водородная связь [18]. Согласно данным рентгеноструктурного анализа, полученным в настоящей работе, в процессе комплексообразования атомы Ni2+ действительно не вошли в краун-эфирную полость, что сильно усложнило геометрию молекулы комплекса.
Молекула комплекса состоит из четырех попарно симметричных лигандов L молекулы, соединенных через координационные связи трех позиций атомов никеля(II) (рис. 2). Лиганд в данном случае выступает в роли бидентатного в отличие от изученных ранее краун-эфирных комплексов с Ni2+, содержащих α-пиридинзамещенный биспидиновый заместитель [9]. Пары лигандов L одинаковы по составу, но искажены друг относительно друга, что связано с формированием координационных полиэдров атомов никеля (рис. 3а). Фрагменты комплекса A, C и B, D связаны операциями симметрии и имеют идентичную конформацию пиперидонового фрагмента (кресло). Три позиции атомов Ni2+ расположены в ряд в центре молекулы, вокруг которых находятся четыре попарно симметричные молекулы L (рис. 3б). Центральный атом никеля (позиция Ni1) координирован тремя парами атомов кислорода на расстояниях от 2.012, 2.050 2.076 Å и образует координационный полиэдр – тетрагональную бипирамиду (рис. 2, табл. 2). Каждая из четырех молекул лиганда данного тетрамера задействована в координации атома Ni1 через атомы кислорода пиперидоновых фрагментов, а другие два атома кислорода принадлежат двум этоксикарбонильным остаткам (рис. 3а). Две другие позиции никеля (Ni2, Ni2') в комплексе связаны оператором симметрии и также окружены шестью атомами кислорода (рис. 3б). В окружении каждого участвуют по одному атому кислорода от пиперидоновых фрагментов двух молекул L, один атом кислорода относится к этоксикарбольному остатку, три других атома кислорода – к двум внутримолекулярным анионам ${\text{NO}}_{3}^{ - }$. Таким образом, все шесть атомов кислорода, образующих тетрагональную бипирамиду, расположены в независимых позициях и находятся на различных расстояниях от 2.018 до 2.147 Å (табл. 2). Вследствие этого полиэдры атомов Ni2+ существенно искажены, торсионные углы сокращены до O5(B)–Ni2–O4(C) 168.37°, O4(B)–Ni2–O10 до 166.18°, O7–Ni2–O11 до 170.82°. Катионная форма координационного соединения стабилизируется двумя анионами ${\text{NO}}_{3}^{ - }$, не участвующими в координации атомов металла.
Рис. 2.
Упаковка структурных единиц комплекса [Ni3(NO3)4L4]2(NO3) (а), строение отдельной молекулы комплекса (б).

Рис. 3.
Строение молекулы лиганда L в составе комплекса [Ni3(NO3)4L4]2(NO3) (а), координация атомов Ni в структуре комплекса (б).
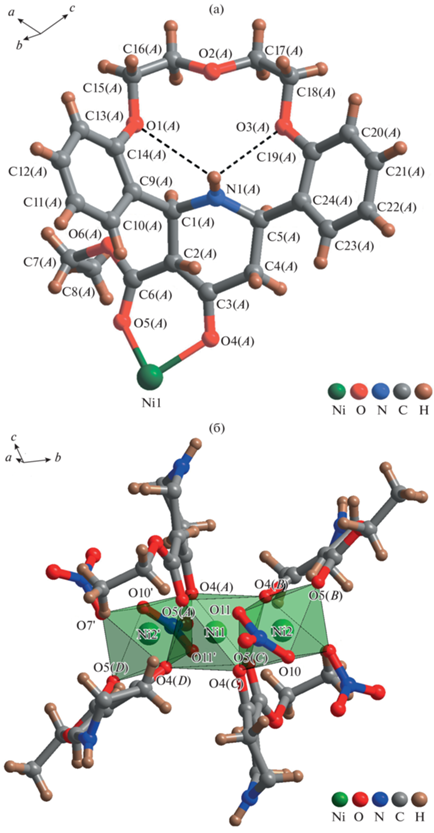
Таблица 2.
Координация атомов никеля в структуре комплекса [Ni3(NO3)4L4]2(NO3)
| Связь | Длина, Å |
|---|---|
| Ni1–O5(A) | 2.012(1) |
| Ni1–O5(C) | 2.012(1) |
| Ni1–O4(A) | 2.050(1) |
| Ni1–O4(C) | 2.050(1) |
| Ni1–O4(B) | 2.076(1) |
| Ni1–O4(D) | 2.076(1) |
| 〈Ni1–O〉 | 2.046 |
| Ni2–O5(B) | 2.018(1) |
| Ni2–O4(B) | 2.029(1) |
| Ni2–O10 | 2.029(1) |
| Ni2–O7 | 2.054(1) |
| Ni2–O4(C) | 2.064(1) |
| Ni2–O11 | 2.147(1) |
| 〈Ni2–O〉 | 2.056 |
Большой вклад в стабилизацию громоздкой молекулы комплекса [Ni3(NO3)4L4]2(NO3) вносят внутрикомплексные водородные связи. Наиболее прочные из них дополнительно удерживают группировки ${\text{NO}}_{3}^{ - }$, участвующие в координации атомов никеля: С10–Н⋅⋅⋅О5 (2.80 Å), С5–Н⋅⋅⋅O6 (2.55 Å) и С23–Н⋅⋅⋅O7 (2.83 Å) (рис. 2б). Важно отметить, что краун-эфирный фрагмент комплекса [Ni3(NO3)4L4]2(NO3) участвует в координации лишь опосредованно, что обусловлено неароматичностью азотсодержащего пиперидонового фрагмента и присутствием более слабых бифуркатных внутрикомплексных водородных связей N1–Н⋅⋅⋅О1 (3.06 Å), N1–H⋅⋅⋅О3 (3.24 Å), сопровождающихся замыканием двух шестичленных Н-циклов (рис. 3).
Работа выполнена с использованием оборудования ЦКП ФНИЦ “Кристаллография и фотоника” РАН при поддержке Министерства науки и высшего образования РФ в рамках госзадания ФНИЦ “Кристаллография и фотоника” РАН.
Список литературы
Fedorova O., Fedorov Yu., Oshchepkov M. // Electroanalysis. 2012. V. 24. P. 1739.
Rakow N.A., Suslick K.S. // Nature. 2000. № 406. P. 710.
Fedorova O. // J. Phys. Org. Chem. 2012. № 25. P. 835.
Мутасова А.Д., Ощепков М.С., Ощепков А.С., Федорова О.А. // Успехи в химии и химической технологии. 2014. Т. 8. № 9. С. 80.
Сокол В.И., Колядина Н.М., Кварталов В.Б. и др. // Изв. РАН. Сер. хим. 2011. № 10. С. 2086.
Колядина Н.М., Сокол В.И., Кварталов В.Б. и др. // Журн. неорган. химии. 2013. Т. 58. № 6. С. 762.
Сокол В.И., Кварталов В.Б., Колядина Н.М. и др. // Журн. неорган. химии. 2014. Т. 59. № 10. С. 1330.
Полякова И.Н., Сергиенко В.С., Кварталов В.Б. // Журн. неорган. химии. 2016. Т. 61. № 2. С. 180.
Полякова И.Н., Сокол В.И., Сергиенко В.С. и др. // Кристаллография. 2018. Т. 63. № 3. С. 401.
Левов А.Н., Строкина В.М., Комарова А.И. // Хим. гетероцикл. соединений. 2006. С. 139.
Официальный сайт EDAX. https://www.edax.com
Agilent Technologies. CrysAlisPro Software System, Version 41_64.119a. Agilent Technologies Limited. Oxford. England.
Palatinus L. // Acta Cryst. A. 2004. V. 60. P. 604.
Petricek V., Dusek M., Palatinus L. // Z. Krist. 2014. V. 229. № 5. P. 345.
Diamond Crystal and Molecular Structure Visualization. https://crystalimpact.com/diamond.
Логачев Н.М., Баулин В.Е., Пятова Н.Н. и др. // Координац. химия. 2009. Т. 35. № 3. С. 163.
Vatsadze S.Z., Semashko V.S., Manaenkova M.A. et al. // Russ. Chem. Bull. Intern. Edition. V. 63. № 4. P. 895.
Фонарь М.С., Фурманова Н.Г., Симонов Ю.А. // Журн. cтруктур. химии. 2009. Т. 50. С. 131.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


