Кристаллография, 2023, T. 68, № 2, стр. 276-280
Выделение, очистка и кристаллизация ГТФазы Era из золотистого стафилококка
Э. А. Клочкова 1, Д. Р. Исламов 1, А. Д. Биктимиров 1, А. В. Рогачев 2, 6, Ш. З. Валидов 1, А. Г. Бикмуллин 1, А. В. Симакин 3, Г. С. Петерс 4, М. М. Юсупов 5, К. С. Усачев 1, *
1 Казанский (Приволжский) федеральный университет
Казань, Россия
2 Московский физико-технический институт
Долгопрудный, Россия
3 Институт общей физики им. А.М. Прохорова РАН
Москва, Россия
4 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
5 Институт генетики, молекулярной и клеточной биологии (IGBMC)
Илькирш-Граффенштаден, Франция
6 Объединенный институт ядерных исследований
Дубна, Россия
* E-mail: k.usachev@kpfu.ru
Поступила в редакцию 01.07.2022
После доработки 20.07.2022
Принята к публикации 11.08.2022
- EDN: GBATXG
- DOI: 10.31857/S0023476123010137
Аннотация
Изучение кристаллической структуры белков является важным инструментом для разработки новых лекарств. Наиболее трудоемким этапом в получении структурных данных является выращивание хорошо дифрагирующих кристаллов белка. Представлены выделение, очистка и кристаллизация белка ГТФаза Era из патогенной бактерии золотистого стафилококка (Staphylococcus aureus). ГТФаза Era в клетках бактерий является одним из факторов сборки рибосомы. Фермент отвечает за рост и деление клетки, однако его структура мало изучена. Получены кристаллы белка Era из Staphylococcus aureus, которые могут быть использованы в дальнейших структурных исследованиях методом монокристального рентгеноструктурного анализа.
ВВЕДЕНИЕ
Золотистый стафилококк (Staphylococcus aureus) является возбудителем многих инфекционных заболеваний, возглавляет список бактерий, чаще всего вызывающих внутрибольничные инфекции и поражающих послеоперационные раны. Этот патогенный микроорганизм чрезвычайно устойчив к антибиотикам пенициллинового ряда, антисептикам, высоким температурам, прямым солнечным лучам. Наиболее опасными для человека являются штаммы S. aureus, устойчивые к метициллину (MRSA), ванкомицину (VRSA) и гликопептидам (GISA) [1–3].
Больше половины всех известных антибиотиков оказывают бактериостатический или бактерицидный эффект за счет нарушения или остановки белоксинтезирующего аппарата клетки бактерии. Ключевым звеном в процессе синтеза белка является рибосома.
Рибосомы (важнейшие органеллы клетки) представляют собой нуклеопротеид, собирающийся из одной (в малой 30S-субъединице) или нескольких (в большой 50S-субъединице) молекул рибосомальной РНК (рРНК) и специфических рибосомных белков. Сборка или созревание каждой частицы рибосомы – очень сложный и высококоординированный процесс, каждый этап которого зависит от целого ряда вспомогательных молекул – факторов сборки [4]. Даже небольшие нарушения в процессах сборки рибосом могут значительно уменьшить скорость синтеза всех белков в клетке или полностью остановить клеточное функционирование [5, 6].
Созревание малой 30S-субъединицы рибосомы в бактериальной клетке регулируется определенными факторами сборки, работающими в строгой последовательности [7, 8]. Одним из таких факторов является гуанозинтрифосфатсвязывающая гидролаза (ГТФаза) Era (Escherichia coli Ras-like protein), отвечающая за поздние этапы сборки рибосомной частицы и контролирующая таким образом клеточный рост и деление [9]. В настоящее время имеется мало информации об особенностях пространственного строения ГТФаз Era из различных микроорганизмов, в том числе из патогенной бактерии S. aureus [6].
ГТФаза Era относится к семейству гидролаз, но с характерным наличием в С-концевом регионе специфического домена, содержащего последовательность GxxG, ответственного за связывания с рРНК.
Era из S. аureus – низкомолекулярная ГТФаза (300 аминокислотных остатков, 35.3 кДа), состоящая из двух доменов: ГТФазный домен на N-конце (высококонсервативный среди семейства ГТФаз) и С-концевой домен, содержащий характерную для S. аureus последовательность GKGG. Согласно [10] ГТФаза Era благодаря участку GKGG распознает участок 16S рРНК в районе спирали 45 (h45) около 3'-конца с последовательностью 1531AUCACCUCCUUA1542, образует комплекс с рРНК, и это действие стимулирует ГТФазную активность Era. В свою очередь, гидролиз гуанозинтрифосфата (ГТФ) позволяет белку Era освободиться от зрелой 30S-субъединицы рибосомы [11]. Таким образом, ГТФаза Era отслеживает наличие достаточного количества ГТФ в клетке бактерии, необходимого для дальнейшей жизнедеятельности микроорганизма. Тем самым ГТФаза Era контролирует скорость роста клетки через регуляцию созревания рибосомной 30S-субъединицы [12].
Для некоторых бактерий ГТФаза Era жизненно необходима для клетки [13]. Поэтому ГТФаза Era из S. аureus может послужить отличной моделью для конструирования новых противомикробных препаратов на основе информации о ее трехмерной структуре.
Одним из современных методов точного определения структуры вещества является рентгеноструктурный анализ (РСА) кристаллов. Однако проблема таких исследований заключается в трудности получения кристаллов белков, что значительно увеличивает время эксперимента [14, 15]. Для получения информации о форме, размере, пространственной ориентации доменов белка в растворе используют метод малоуглового рентгеновского рассеяния (МУРР, или SAXS, small angle X-ray scattering). В данной работе проведены выделение, очистка, исследование структуры белка Era ГТФаза из S. аureus в растворе и выращивание кристаллов этого белка.
МАТЕРИАЛЫ И МЕТОДЫ
Клонирование и экспрессия Era. Ген era клонировали из генома S. aureus и на основе вектора pET28a создали конструкт Era_Sa::pET28a, несущий ген era c шестью гистидинами на С-конце (His6-Era) под контролем LacIq-промотора. Конструкт подтвержден секвенированием. Культуру трансформированных полученной плазмидой клеток (E. coli штамм BL21(DE3)pLysS) выращивали на богатой питательной среде LB при 37°C на шейкере со скоростью вращения 180 об./мин до OD600 = 0.6. Индукцию синтеза His6-Era проводили с помощью добавления изопропил-β-D-тиогалактопиранозида (IPTG) с дальнейшей культивацией клеточной культуры в течение 4 ч при этих же условиях. Далее клетки осаждали центрифугированием 10 мин при частоте вращения 5000 об./мин при 4°C (центрифуга “Beckman”, Avanti JXN-26, ротор JLA-9.1000, США), замораживали и хранили при –24°C.
Для выделения белка Era полученные замороженные клетки размораживали, ресуспендировали в специально подобранном буфере 1 (50 мМ Tris-HCl, pH 8.0, 0.8 М NaCl) в присутствии ингибиторов протеаз и разрушали с помощью ультразвукового гомогенизатора HD2070 (“Bandelin”, Германия). Полученный лизат центрифугировали при 45 000 об./мин при 4°C в течение 45 мин (центрифуга Optima XPN, ротор 45Ti) для осаждения клеточного дебриса.
Очистка Era. Очистку His6-Era от супернатанта проводили в два этапа: сначала методом металл-хелатной аффинной хроматографии (Immobilised Ion Affinity Chromatography, IMAC), затем с помощью гель-фильтрации. Для этого супернатант наносили на Ni-NTA-сорбент (Ni-NTA Agarose, QIAGEN, Германия), последовательно промывали смолу буферами 2 (50 мМ Tris-HCl, pH 8.0; 1 М NaCl), 3 (50 мМ Tris-HCl, pH 8.0; 0.8 М NaCl; 20 мМ имидазол) и элюировали белок буфером 4 (50 мМ Tris-HCl, pH 8.0; 0.8 М NaCl; 0.3 М имидазол). Гель-фильтрацию проводили с помощью хроматографической системы NGC Discover (“BioRad”, США) на колонке Enrich Sec 650 (“BioRad”, США) в буфере 1. Пиковые фракции были отобраны и сконцентрированы в концентраторах с отсечением 10 кДа (Amicon Ultra, Merk KGaA, Германия) центрифугированием при 14 500 об./мин, 4°C в течение 10 мин, многократно. Чистоту полученного образца оценивали с помощью денатурирующего электрофореза в полиакриламидном геле (ПААГ) (SDS-PAGE) в Tris-глициновом буферном растворе, рН 8.3 (25 мМ Tris-буфер; 250 мМ глицина; 0.1% додецилсульфат натрия) при температуре 20°С и рабочем напряжении 140 В.
Кристаллизация Era. Раствор очищенного белка сконцентрирован до значения 30 мг/мл в буфере 1. К объему белка Era, рассчитанному на кристаллизационный эксперимент, добавили нерасщепляемый аналог ГТФ (GppCp, Guanosine-5'-[(β,γ)-methyleno]triphosphate, Sodium salt, Jena Bioscience, Германия) до конечной концентрации 10 мМ. Поиск кристаллизационных условий был выполнен с использованием наборов JBScreen JCSG++1, ++2, ++3 и ++4 (Jena Bioscience, Германия) методом диффузии в парах в варианте висячей капли при 22°С в 24-луночных планшетах (Hampton Research, США). 1.25 мкл буфера с белком His6-Era+GppCp смешивали с 1.25 мкл противораствора и уравновешивали 250 мкл противораствора.
Малоугловое рентгеновское рассеяние. Для исследований методом МУРР использовали образец белка His6–Era из S. aureus с концентрацией 12 мг/мл в буфере 1. Предварительный анализ данных выполняли с использованием дифрактометра Nanostar SAXS (Bruker AXS GmbH, Германия) ФИЦ КазНЦ РАН. Дальнейшие эксперименты выполнены на установке Rigaku HighFlux HomeLab (Rigaku, Япония) [16] с вращающимся медным анодом MicroMax 007-HF. Длина волны генерируемого рентгеновского излучения 1.54 Å (CuKα). Расстояние от позиции образца до детектора составляло 2.0 м (диапазон q составляет 0.006–0.19 Å). Измерения выполнены при температуре 20°С. Азимутальное интегрирование полученных 2D-изображений с детектора выполнено с использованием программного обеспечения Saxsgui (Rigaku Innovative Technologies, Inc., Токио, Япония) и JJ X-ray System Aps (Хорсхольм, Дания).
Получение дифракционных данных. Данные рентгеновской дифракции были собраны при 100 K (криопротекция в градиенте концентрации глицерина 1–10% с шагом 1%) на дифрактометре Rigaku XtaLAB Synergy-S, оснащенном детектором HyPix-6000HE. Длина волны генерируемого рентгеновского излучения 1.54 Å (CuKα). Данные рентгеновской дифракции были собраны с шагом 0.5° при расстоянии от кристалла до детектора 40 мм и времени экспозиции 100 с. Дифракционные изображения обработаны с помощью пакета программ XDS [17].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
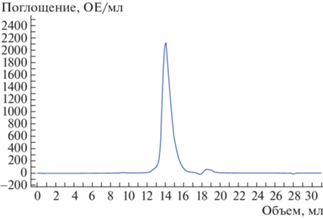
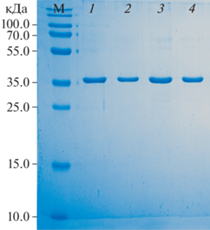
Для получения препарата белка, удовлетворяющего требованиям кристаллизации, провели подбор и оптимизацию условий получения белка His6-Era в культуре клеток E. coli, подбор состава и pH буфера на этапах разрушения клеток и очистки белка. В итоге были использованы буферные условия: 50 мМ Tris-HCl, pH 8.0; 200 мМ NaCl) [18]. Профиль гель-фильтрации приведен на рис. 1. Чистоту полученного после гель-фильтрации препарата белка анализировали с помощью электрофореза в ПААГ (рис. 2).
Рис. 2.
Электрофоретический анализ в ПААГ в денатурирующих условиях нескольких пиковых фракций His6–Era после гель-фильтрации (М – маркер, 1, 2 – фракции His6–Era с левого плеча пика, 3, 4 – фракции с правого плеча пика).
При концентрировании белка свыше 3 мг/мл наблюдалась его агрегация. Агрегации удалось избежать, повысив концентрацию NaCl до 0.8 М (буферы 1, 3, 4) и до 1 М (буфер 2), как это было сделано в [10]. В результате удалось сконцентрировать His6-Era до значения 30 мг/мл. Перед кристаллизацией к образцу белка добавляли негидролизуемый аналог ГТФ GppCp до 10 мМ для стабилизации структуры целевого белка и проводили поиск условий кристаллизации. В результате в условиях: 20% PEG 3350; 0.2 M цитрата калия; рН 8.3 (JBScreen JCSG++1/B12, Jena Bioscience, Германия), через 4 нед выросли монокристаллы белка His6-Era размером 80 × 50 × 40 мкм (рис. 3). Для подтверждения того, что полученные кристаллы являются кристаллами целевого недеградировавшего белка His6-Era, использовали методику отмывки, растворения кристаллов в воде и анализ полученного раствора с помощью денатурирующего электрофореза в ПААГ (рис. 4).
Рис. 4.
ПААГ электрофорез кристаллов His6–Era; 2 – растворенные кристаллы, 1 – весь оставшийся маточный раствор из кристаллизационной капли.

Данные по исследованию размера, формы и пространственного расположения молекул белка His6-Era из S. aureus в растворе методом МУРР обработаны в пакете программ ATSAS [19]. Проекции полученной формы частиц показаны на рис. 5. Полученная 3D-модель электронной плотности имеет форму цилиндра с параметрами радиуса гирации Rg = 23.1 Å и наибольшей длиной Dmax = 57.7 Å. Рассчитанная структура Era ГТФаза из S. aureus с помощью проекта AlphaFold2 [20] имеет размеры 62 Å × 56 Å × 47 Å. Для этой структуры в программном пакете CRYSOL был проведен теоретический расчет радиуса гирации, он составил Rg = 21.5 Å. Отметим, что согласно экспериментам РСА белок Era из E. coli кристаллизуется в виде димера [21]. Однако параметры полученной в настоящей работе формы свидетельствуют о том, что в исследуемом растворе при заданной концентрации белок Era ГТФаза из золотистого стафилококка находится в виде мономера.
Рис. 5.
Формы белка His6–Era из S. aureus в двух проекциях по данным МУРР. Для сопоставления размеров показана Era GTPase из S. aureus, полученная с помощью программы AlphaFold 2.0 (UniProt A5IT95).

На рис. 6 приведена дифрактограмма кристалла белка His6–Era, полученная при исследовании методом РСА. Дифракционная картина соответствует дифракции рентгеновского излучения на элементарной ячейке белкового кристалла с разрешением ~4 Å, что не позволяет решить структуру белка с высоким разрешением. Необходимы дальнейший подбор условий кристаллизации, криопротекции кристалла и сбор данных на более интенсивном синхротронном источнике излучения, что планируется при дальнейших исследованиях.
В данной работе впервые оптимизированы условия выделения, очистки и кристаллизации ГТФазы Era из S. аureus в комплексе с негидролизуемым аналогом ГТФ GppCp и найдены условия кристаллизации комплекса.
ЗАКЛЮЧЕНИЕ
Проведен синтез рекомбинантного белка Era из патогенной бактерии Staphylococcus aureus. Достаточное для кристаллизации количество белка было очищено с помощью металл-хелатной и эксклюзионной хроматографии, также показано предпочтительное мономерное состояние белка в растворе. Проведен подбор условий для кристаллизации. Кристаллы получены методом диффузии в парах в варианте висячей капли с использованием противораствора, содержащего PEG 3350 и цитрат калия. Данные кристаллы белка Era из Staphylococcus aureus демонстрируют дифракционную картину, характерную для белковых кристаллов. Оптимизация найденных условий кристаллизации белка Era из Staphylococcus aureus позволит в дальнейшем получить кристаллы, пригодные для структурных исследований методом РСА.
Исследование выполнено при финансовой поддержке Российского научного фонда (проект № 21-74-20034).
Список литературы
Stijn Blot R.N., Vandewoude K., Colardyn F. // N. Engl. J. Med. 1998. V. 339 (27). P. 2025. https://doi.org/10.1056/nejm199812313392716
Jeljaszewicz J., Mlynarczyk G., Mlynarczyk A. // Int. J. Antimicrob. Agents. 2000. V. 16 (4). P. 473. https://doi.org/10.1016/S0924-8579(00)00289-2
Fierobe L., Decré D., Mùller C. et al. // Clin. Infect. Dis. 1999. V. 29 (5). P. 1231. https://doi.org/10.1086/313454
Shajani Z., Sykes M.T., Williamson J.R. // Annu. Rev. Biochem. 2011. V. 80. P. 501. https://doi.org/10.1146/annurev-biochem-062608-160432
Kaczanowska M., Rydén-Aulin M. // Microbiol. Mol. Biol. Rev. 2007. V. 71 (3). P. 477. https://doi.org/10.1128/MMBR.00013-07
Усачев К.С., Юсупов М.М., Валидов Ш.З. // Биохимия. 2020. Т. 85 (11). С. 1690. https://doi.org/10.1134/S0006297920110115
Stern S., Powers T., Changchien L.I.-M., Noller H.F. // Science. 1989. V. 244 (4906). P. 783. https://doi.org/10.1126/science.2658053
Davis J.H., Williamson J.R. // Philos. Trans. R. Soc. 2017. V. 372 (1716). Art. 20160181. https://doi.org/10.1098/rstb.2016.0181
Bourne H.R. // Philos. Trans. R. Soc. 1995. V. 349 (1329). P. 283. https://doi.org/10.1098/rstb.1995.0114
Tu C., Zhou X., Tropea J. et al. // Proc. Natl. Acad. Sci. U S A. 2009. V. 106 (35). P. 14843. https://doi.org/10.1073/pnas.0904032106
Simon Goto, Akira Muto, Hyouta Himeno // J. Biochem. 2013. V. 153 (5). P. 403. https://doi.org/10.1093/jb/mvt022
Ji X. // Postepy Biochem. 2016. V. 62 (3). P. 335.
Xiaomei Zhou, Howard K. Peters III, Xintian Li et al. // J. Bacteriol. 2020. V. 202. P. 21. https://doi.org/10.1128/JB.00342-20
Ren H., Liang Y., Li R. et al. // Acta Cryst. D. 2004. V. 60. P. 1292. https://doi.org/10.1107/S0907444904010467
Meulenbroek E., Pannu N. // Acta Cryst. F. 2011. V. 68. P. 45. https://doi.org/10.1107/S1744309111045842
Murugova T.N., Vlasov A.V., Ivankov O.I. et al. // J. Optoelectron. Adv. Mater. 2015. V. 17. P. 1397.
Kabsch W. // Xds. Acta Cryst. D. 2010. V. 66. P. 125. https://doi.org/10.1107/S0907444909047337
Chen X., Chen S.-M., Powell B. et al. // FEBS Lett. 1999. V. 445. P. 425. https://doi.org/10.1016/S0014-5793(99)00178-7
Manalastas-Cantos K., Konarev P.V., Hajizadeh N.R. et al. // J. Appl. Cryst. 2021. V. 54. P. 343. https://doi.org/10.1107/S1600576720013412
Jumper J., Evans R., Pritzel A. et al. // Nature. 2021. V. 596 (7873). P. 583.
Chen X., Court D.L., Ji X. // PNAS. 1999. V. 15 (96). P. 8396. https://doi.org/10.1073/pnas.96.15.8396
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография