Кристаллография, 2023, T. 68, № 2, стр. 204-208
Выделение, очистка и анализ методом малоуголового рентгеновского рассеяния ГТфазы YsxC из золотистого стафилококка
А. Д. Биктимиров 1, Д. Р. Исламов 1, Ш. З. Валидов 1, Г. С. Петерс 2, А. В. Халиуллина 1, М. М. Юсупов 3, К. С. Усачев 1, *
1 Казанский (Приволжский) федеральный университет
Казань, Россия
2 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
3 Институт генетики, молекулярной и клеточной биологии
Илькирш-Граффенштаден, Франция
* E-mail: k.usachev@kpfu.ru
Поступила в редакцию 20.10.2022
После доработки 31.10.2022
Принята к публикации 31.10.2022
- EDN: BPYPCD
- DOI: 10.31857/S0023476123020042
Аннотация
Изучение структур различных биологических макромолекул является одним из основных направлений, которое активно развивается при помощи различных физических методов. Поскольку белки являются элементарной единицей структурной и функциональной организации клетки, одной из стратегий борьбы с патогенными микроорганизмами является изучение белоксинтезирующего аппарата бактерии и сопряженных с ним систем. Представлены выделение, очистка и анализ структуры методом малоуглового рентгеновского рассеяния белка YsxC из патогенной бактерии золотистого стафилококка (Staphylococcus aureus). Данный белок вовлечен в процессы роста и деления клеток, является энергозависимым фактором и участвует в сборке большой субъединицы рибосомы. Структурные исследования данного белка открывают возможность для поиска малых молекул, способных ингибировать его функцию. Поскольку вариабельность в строении белковых факторов выше, чем у консервативных сайтов рибосомы, их ингибирование дает возможность селективно воздействовать на патогенный микроорганизм.
ВВЕДЕНИЕ
Золотистый стафилококк является грамположительной шаровидной бактерией, вызывающей широкий спектр инфекционных заболеваний [1–3]. Бесконтрольное применение антибиотиков, вследствие влияния естественного отбора, привело к появлению новых штаммов со множественной устойчивостью к стрессовым условиям (перепады температуры, снижение оксигенации, давление антибиотиков и др.). В результате антибиотикорезистентность становится одним из серьезнейших вызовов, стоящих перед системой здравоохранения [4].
Механизм действия большинства существующих антибактериальных препаратов заключается в остановке синтеза белка в клетке, в частности работы бактериальной рибосомы [5, 6] – специальной каталитической биологической молекулярной машины, состоящей из порядка 50 рибосомных белков и 3 молекул РНК. При воздействии стрессовых условий перевод рибосом в инактивированное состояние позволяет клетке снижать общий уровень трансляции, а также сохранять рибосомы от воздействия антибиотиков. Поскольку синтез рибосом является высоко энергозатратным процессом, сохранение рибосом при стрессе позволяет существенно сэкономить энергию клетке и быстро восстановить синтез белка после снятия стрессовых условий [7]. Сборка рибосомных субъединиц в клетке – это высокоточный процесс, который регулируется специализированными факторами созревания. Одним из таких представителей является гуано-зинтрифосфат (ГТФ) связывающий белок YsxC, выполняющий структурную и организационную функции на поздних этапах сборки большой субъединицы рибосомы [8]. Исследуемый в настоящей работе белок YsxC из S. aureus состоит из 196 аминокислотных остатков с суммарной массой 22.6 кДа. Анализ аминокислотной последовательности данного белка показал наличие мотива Уокера А Gx(4)-GK-[TS], который является центром связывания энергетических молекул (ГТФ, аденозитрифосфата) [9], а также наличие сайта связывания ионов магния (Mg2+).
Согласно [10] для микроорганизма Bacillus subtilis потеря гена белка YsxC приводит к отсутствию шести рибосомных белков в составе большой субъединицы рибосомы. Такая функциональная особенность указывает на значимость данного белка в процессе биосинтеза и обусловливает актуальность структурных исследований фактора YsxC с целью определения механизмов связывания с рибосомой и поиска мишеней в его структуре для разработки новых ингибиторов. Анализ существующих в базе данных PDB пространственных структур белка YsxC патогенной бактерии S. aureus показал, что его структура неизвестна, а гомология по последовательности с ближайшим аналогом из B. subtilis (код pdb 1SUL) составляет менее 55%.
С целью получения данных о размерах, форме и ориентации доменов белковой молекулы, поиска оптимальных условий для растворимости и кристаллизации белков применяли метод малоуглового рентгеновского рассеяния (МУРР). Данная работа посвящена поиску условий выделения и очистки, а также анализу формы молекул в растворе методом МУРР белка YsxC из S. aureus.
МАТЕРИАЛЫ И МЕТОДЫ
Создание конструкции и экспрессия. В рамках работы провели клонирование гена целевого белка ysxC из S. aureus в векторную систему pet28a с добавлением шести аминокислот гистидина (гис-таг) на N-конце под контролем лактозного оперона LacIq. Правильность нуклеотидной последовательности полученного конструкта была подтверждена методом секвенирования.
Созданную плазмиду трансформировали в клетки E. coli Bl21(DE3)PlysS. Клеточную культуру выращивали в жидкой питательной среде LB с добавлением антибиотиков, соответствующих маркеру селекции (Km, Cm), в термошейкере при 180 об./мин с температурой 310 K до оптической плотности OD600 = 0.8. Индукцию экспрессии проводили с помощью добавления 0.1 мМ индуктора изопропил-β-D-тиогалактопиранозида (IPTG) и дальнейшей инкубации культуры при тех же настройках шейкера. Клеточную биомассу отделяли от жидкой среды методом центрифугирования на центрифуге BECKMAN Avanti J-25 (Beckman Coulter, США) 5000 об./мин при 277 K. Полученный осадок хранили в морозильном шкафу при температуре 253 K.
Очистка целевого белка. Осажденные клетки далее размораживали на льду и ресуспендировали в буфере A (50 мМ натрий-фосфатный буфер, pH 6.0, 250 мM NaCl) c добавлением ингибитора протеаз (PIC) (Roche, Швейцария). После получения гомогенного раствора разрушали клеточную стенку с помощью ультразвуковой установки HD2070 (Bandelin, Германия) (мощность 50%, цикл 5 раз по 50 с) при температуре 277 K. Полученный субстрат отделяли от разрушенной массы с помощью центрифугирования на центрифуге Avanti JXN-26 (Beckman Coulter, США) при 25 000 об./мин в течение 30 мин и температуре 277 K. Далее супернатант повторно осаждали центрифугированием в ультрацентрифуге XPN-80 (Beckman Coulter, США) при 45 000 об./мин в течение 45 мин при температуре 277 K. При таком сочетании ультрацентрифугирования все тяжелые клеточные субстраты оседают на дне в виде дебриса, а белок остается в жидкой фазе.
Полученную на предыдущем этапе неосажденную жидкость наносили на хроматографическую колонку, заполненную 2 мл никелевого (Ni-NTA) сорбента Superflow (QUIAGEN, Германия). За счет наличия гистидинового тага белок связывался с ионами никеля вследствие образования аффинной связи. После прохождения всего объема жидкости через колонку сорбент промывали от неспецифически связанных белков 20 мл буфера Б (50 мМ натрий-фосфатный буфер, pH 6.0, 500 мМ NaCl). После этого с помощью элюирующего буфера (50 мМ натрий-фосфатный буфер, pH 6.0, 250 мМ NaCl, 300 мМ имидазол) отмывали целевой белок с никелевой смолы во фракции объемом 500 мкл. Второй этап очистки проводили методом гель-фильтрации на хроматографе NGC Discover (BioRad, США) и колонке Superdex SEC-70 (BioRad, США) при 277 K в буфере А. На колонку наносили образец объемом 250 мкл с концентрацией 10 мг/мл. Анализ качества очистки образца проводили по профилю гель-фильтрации, регистрируя поглощение на длине волны 280 нм, и последующему анализу отобранных пиковых фракций методом денатурирующего гель-электрофореза в полиакриламидном геле (SDS-PAGE) в трис-глициновом буферном растворе, рН 8.3 (25 мМ Трис-буфер; 250 мМ глицин; 0.1-додецилсульфат натрия), при температуре 293 K и напряжении 110–140 В. Удовлетворяющие условиям чистоты образцы были отобраны и сконцентрированы для дальнейших исследований.
Малоугловое рентгеновское рассеяние. Для исключения влияния межчастичного взаимодействия между молекулами белков эксперимент МУРР проводили при двух концентрациях образца: 6 и 12 мг/мл. Предварительный анализ данных выполняли с использованием дифрактометра Nanostar SAXS (Bruker AXS GmbH, Германия) в ЦКП ФИЦ КазНЦ РАН. Дальнейшие эксперименты выполняли на Курчатовском специализированном источнике синхротронного излучения “КИСИ-Курчатов” [11] c параметрами энергии пучка 8 кэВ на детекторе DECTRIS Pilatus3 1M (1043 × 981 точек, 20 бит, 500 Гц) при температуре 293 K. Первичный анализ и обработку данных проводили в программном пакете PRIMUS [12], получение формы электронной плотности – в программе DAMMIN [13] сервиса ATSAS online (https://www.embl-hamburg.de/biosaxs/atsas-online).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для получения образца белка YsxC были проведены подбор и оптимизация условий выделения и очистки. Поиск буферных условий является одним из важнейших этапов в подготовке образца, поскольку для проведения эксперимента по МУРР необходим препарат, который будет стабилен во время длительных экспериментов, включающих в себя физические воздействия [14]. С этой целью подобрали условия, а также провели оценку стабильности образца. Таким образом, в качестве наиболее предпочтительного был выбран буфер А с составом 50 мМ натрий-фосфатный буфер, pH 6.0, 250 мМ NaCl, 10 мМ MgCl2. Степень очистки образца оценивали с помощью гель-фильтрации (рис. 1), качество очистки образца и наличие примесей в полученном растворе – с помощью денатурирующего полиакриламидного гель-электрофореза (рис. 2).
Рис. 1.
Профиль гель-фильтрации исследуемого белка: ${v}$ – объем, прошедший через колонку, A280 – поглощение на заданной длине волны.
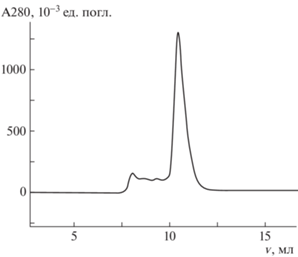
Рис. 2.
Электрофоретическая картинка белка YsxC после завершающего этапа очистки: М – маркерная лестница, 1 – контроль до очистки, 2–7 – фракции белка.

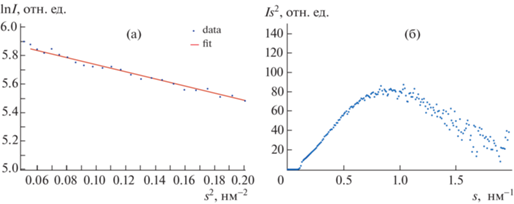
Для исследования способности к олигомеризации белковой молекулы в зависимости от ее концентрации в растворе получили два препарата исходного объекта в буфере А с концентрациями 6 и 12 мг/мл соответственно. Для гомологов белка YscC ранее была показа возможность кристаллизации как в форме димера, так и мономера [15]. Анализ разностной картины МУРР (рис. 3) от двух исходных концентраций образца показал, что концентрационная зависимость в исследуемом объекте отсутствует, и белок остается мономером при высоких концентрациях. Последующую обработку данных проводили в программном пакете PRIMUS: статистическое усреднение кривых по времени, а также их калибровку и вычитание сигнала от буфера, чтобы получить информацию только о монодисперсной системе белка. Для определения структурных инвариантов выполнили построения Гинье и Кратки. Полученные графики представлены на рис. 4. Поскольку в координатах Гинье есть линейная зависимость, это свидетельствует о том, что раствор является монодисперсным и условия для применения математического аппарата для обработки данных являются уместными. Для использования математического аппарата в приближении сферической молекулы необходимо понять, является ли молекула в растворе глобулярной, поскольку помимо сферического приближения можно использовать цилиндрическое (в случае, если молекула имеет форму вытянутого цилиндра). Данную информацию подтверждает кривая рассеяния в координатах Кратки (рис. 4б). Как видно из эксперимента, кривая рассеяния в координатах Кратки имеет куполообразную форму, что является доказательством глобулярности белковой структуры [16], поэтому дальнейшие вычисления проводили в приближении сферической молекулы.
Рис. 3.
Разностные кривые, полученные из эксперимента по МУРР для концентраций 12 (1) и 6 мг/мл (2).
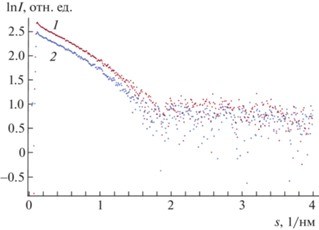
Рис. 4.
Построения для определения инвариантов белка YsxC: а – в координатах Гинье, б – в координатах Кратки.
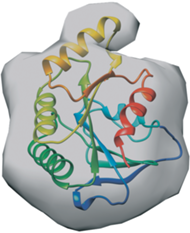
Один из методов ab initio восстановления формы электронной плотности с помощью применения виртуальных сферических атомов был предложен в [17]. Этот метод исполнен в программном пакете DAMMIN, в котором определяется форма молекулы из экспериментальных данных путем имитации отжига. Как видно из рис. 5, конечная модель электронной плотности имеет особенности поверхности, которые отличаются от заданной вначале сферической системы. Благодаря наличию таких особенностей можно однозначно сопоставить уже имеющуюся (или предсказанную) структуру с расчетными экспериментальными данными. Таким образом, была получена электронная плотность с параметрами радиуса гирации Rg = 27.4 Å и наибольшим размерным параметром рассчитанной частицы Dmax = 37.7 Å. Эксперимент in silico по МУРР в программном пакете CRYSOL [18] на расчетной модели из AlphaFold2 [19] белка YsxC показал, что теоретический параметр радиуса гирации в таком случае равен Rg = 26.9 Å. Расчетная масса электронной плотности исследуемого белка равна 23.67 кДа, тогда как молекулярная масса конструкции вместе с N-концевым гистидиновым тагом – 23.71 кДа. Сопоставление предсказанной структуры белка из AlphaFold2 и полученной электронной плотности, а также полученный ряд расчетных параметров свидетельствуют о том, что белок в растворе находится в виде мономера. Наблюдаемый вид поверхности электронной плотности указывает на то, что белковая молекула в растворе находится в компактном виде, не имеет неструктурированных частей, которые могли бы мешать дальнейшей ее кристаллизации и решению структуры методом рентгеноструктурного анализа.
ЗАКЛЮЧЕНИЕ
Проведен синтез рекомбинантного белка YsxC из патогенного микроорганизма Staphylococcus aureus в модельной системе Escherichia coli. Найдены стабилизирующие белок буферные условия, а также проведена оценка концентрационной зависимости белка в растворе для структурных исследований на основе разностных кривых МУРР. Получены ряд структурных параметров и электронная плотность белка, которые указывают на то, что белок в растворе является мономером, компактно свернут и не имеет неструктурированных участков на профиле поверхности молекулы. Полученные стабилизирующие белок условия могут быть использованы в дальнейших этапах по поиску условий кристаллизации исследуемой белковой молекулы.
Исследование выполнено при финансовой поддержке Российского научного фонда (проект № 21-74-20034).
Список литературы
Chambers H.F., Deleo F.R. // Nat Rev Microbiol. 2009. V. 7 № 9. P. 629. https://doi.org/10.1038/nrmicro2200
Stapleton P.D., Taylor P.W. // Sci Prog. 2002. V. 85 № 1. P. 57. https://doi.org/10.3184/003685002783238870
Gan T., Shu G., Fu H. et al. // BMC Vet Res. 2021. V. 17 P. 177. https://doi.org/10.1186/s12917-021-02884-z
Murray Ch.J.L., Shunji I.K., Sharara F. et al. // Lancet. 2022. V. 10325. № 399. P. 629. https://doi.org/10.1016/S0140-6736(21)02724-0
Poehlsgaard J., Douthwaite S. // Nat. Rev. Microbiol. 2005. V. 3. P. 870. https://doi.org/10.1038/nrmicro1265
Усачев К.С., Юсупов М.М., Валидов Ш.З. // Биохимия. 2020. Т. 85. № 11. С. 1690. https://doi.org/10.1134/S0006297920110115
Khusainov I., Fatkhullin B., Pellegrino S. // Nature Commun. 2020. V. 11 № 1656. https://doi.org/10.1038/s41467-020-15517-0
Cooper E.L., García-Lara J., Foster S.J. // BMC Microbiol. 2009. V. 9. № 266. https://doi.org/10.1186/1471-2180-9-266
Ramakrishnan C., Dani V.S., Ramasarma T. // Protein Eng. Des. Sel. 2002. V. 15. № 10. P. 783. https://doi.org/10.1093/protein/15.10.783
Ni X., Davis J.H., Jain N. et al. // Nucl. Acids Res. 2016. V. 44. № 17. P. 8442. https://doi.org/10.1093/nar/gkw678
Корчуганов В.Н., Валентинов А.Г., Полозов С.М. и др. // Кристаллография. 2022. Т. 67. № 5. С. 735. https://doi.org/10.31857/S0023476122050058
Konarev P.V., Volkov V.V., Sokolova A.V. et al. // J. Appl. Cryst. 2003. V. 36. P. 1277. https://doi.org/10.1107/S0021889803012779
Svergun D.I. // Biophys J. 1999. V. 76. № 6. P. 2879. https://doi.org/10.1016/S0006-3495(99)77443-6
Gosavi R.A., Mueser T.C., Schall C.A. // Acta Cryst. 2008. V. 64. P. 506. https://doi.org/10.1107/S0907444908004265
Ruzheinikov S.N., Das Sanjan K., Sedelnikova S.E. et al. // J. Mol. Biol. 2004. V. 339 № 2. P. 265. https://doi.org/10.1016/j.jmb.2004.03.043
Goldenberg D.P., Argyle B. // Biophys. J. 2014. V. 106. № 4. P. 895. https://doi.org/10.1016/j.bpj.2013.12.004
Chacon P., Moran F., Dia z J.F. et al. // Biophys. J. 1998. V. 74. P. 2760. https://doi.org/10.1016/S0006-3495(98)77984-6
Svergun D.I., Barberato C., Koch M.H.J. // J. Appl. Cryst. 1999. V. 28. P. 768. https://doi.org/10.1107/S1600576717007786
Jumper J., Evans R., Pritzel A. et al. // Nature. 2021. V. 596. P. 583. https://doi.org/10.1038/s41586-021-03819-2
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография