Кристаллография, 2023, T. 68, № 2, стр. 290-297
Структурно-фазовые превращения на поверхности суперпротонных кристаллов кислых солей сульфата калия-аммония
Р. В. Гайнутдинов 1, А. Л. Толстихина 1, *, Е. В. Селезнева 1, И. П. Макарова 1, А. Л. Васильев 1
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
* E-mail: alla@crys.ras.ru
Поступила в редакцию 23.11.2022
После доработки 01.12.2022
Принята к публикации 06.12.2022
- EDN: BQBENP
- DOI: 10.31857/S0023476123020066
Аннотация
Приведены результаты комплексных исследований структурно-фазовых превращений в суперпротонных кристаллах (K0.43(NH4)0.57)3H(SO4)2 под воздействием атмосферной влаги. С применением сканирующей электронной микроскопии и рентгеновского микроанализа проведена диагностика реальной структуры, состава и толщины модифицированных поверхностных слоев. Методом проводящей атомно-силовой микроскопии изучены локальные характеристики наноструктур, образующихся при электростатическом воздействии на поверхность свежего скола (001) кристалла. Установлена корреляция между изменениями во времени структуры, состава и величины электростатического потенциала поверхности кристаллов. Результаты рассматриваются в связи с оценкой химической стабильности образцов и поиском путей оптимизации составов и функциональных свойств суперпротонных соединений.
ВВЕДЕНИЕ
В настоящей работе продолжены исследования новых суперпротонных кристаллов (K0.43(NH4)0.57)3H(SO4)2, выращенных в многокомпонентной водно-солевой системе K2SO4–(NH4)2SO4–H2SO4–H2O [1–3]. Кристаллы с изоморфным замещением катионов K и NH4 в катионной подрешетке (K1–x(NH4)x)3H(SO4)2 (x ≥ 0.57) принадлежат семейству кислых солей щелочных металлов, представители которого демонстрируют высокую протонную проводимость при температурах 300–500 K и считаются перспективными материалами для изготовления мембран топливных элементов, работающих в области средних температур [4–6].
Прецизионные структурные исследования монокристаллов (K0.43(NH4)0.57)3H(SO4)2 позволили с высокой точностью определить их атомную структуру: пр. гр. R$\bar {3}$Z = 3, a = b = 5.7768(3), c = = 22.0983(1) Å при T ≈ 293 K [1]. Тригональная симметрия фазы обусловлена замещением аммония на калий, приводящим к повышению симметрии координационного окружения катионов, разупорядочению позиций атомов кислорода, участвующих в водородных связях, и образованию динамически разупорядоченной системы этих связей. В результате уже при комнатной температуре в кристаллических образцах наблюдается высокая проводимость [2].
С точки зрения практического применения и разработки электрохимического оборудования, в котором материалы используются в виде монокристаллов или порошков, наряду с информацией об атомной структуре необходимы данные о строении их поверхности и процессах, происходящих на границах разделов. В случае суперпротонных соединений сложность в получении таких данных и идентификации фаз электронно-дифракционными методами связана с неустойчивостью кристаллов по отношению к воздействию электронных пучков. Это определяет особые условия проведения электронно-микроскопических исследований и бросает вызов методам зондовой диагностики как источнику многообразной информации о физико-химических свойствах материалов.
Известно, что для работы с суперпротонными фазами соединений необходимо обеспечить их химическую стабильность во влажной атмосфере, кислороде и водороде [5, 7, 8]. В [3] было обнаружено, что свежая поверхность (001) кристалла (K0.43(NH4)0.57)3H(SO4)2 не остается неизменной в естественных атмосферных условиях, а модифицируется со временем, т.е. формируется новый поверхностный дефектный слой переменного состава. Образование неконтролируемого продукта и частичное изменение свойств относительно исходного состояния для протонных проводников в общем случае нежелательно даже в микроскопических масштабах толщин поверхностных слоев, в том числе для изучаемого кристалла.
В настоящей работе проведено систематическое исследование структуры, состава, дефектов и локальных электрических характеристик модифицированных слоев, образующихся на поверхности кристаллов ((K,NH4)HSO4)2 под воздействием атмосферной влаги. Достоверность полученных результатов подтверждается высоким уровнем обеспечения контроля и поддержания влажности и температуры воздушной среды при проведении экспериментов и использованием независимых и взаимодополняющих методов атомно-силовой и электронной микроскопии. Итогом настоящей и предыдущей работы [3] стало установление особенностей строения базисной поверхности суперпротонного кристалла и формирующихся нанокристаллических слоев, а также раскрытие закономерностей изменения поверхностного потенциала образцов вследствие структурно-фазовых превращений.
ЭКСПЕРИМЕНТАЛЬНЫЕ УСТАНОВКИ И МЕТОДИКИ ИЗМЕРЕНИЙ
Электронно-микроскопические исследования и микроанализ проводили на приборе Quanta 3D (FEI, США), оснащенном энергодисперсионным рентгеновским спектрометром Si (Li) EDX (EDAX Inc., Mahwah, NJ, USA). Микрофотографии и спектры рентгеновского излучения (EDXS) были получены при ускоряющем напряжении 30 кВ с регистрацией изображений в режиме детектирования вторичных электронов. Элементный состав образцов оценивали с помощью программы EDAX.
Подготовку и исследование поверхности образцов методом атомно-силовой микроскопии (АСМ) проводили на микроскопе NTEGRA Prima (NT-MDT Spectrum Instruments, Зеленоград) в условиях чистой зоны контрольно-измерительного комплекса “TRACKPORE ROOM-05” (класс чистоты 5 ИСО (100), точность поддержания температуры (Т) воздушной среды в чистой зоне в диапазоне 298 ± 5 K составляла ±0.05 K, относительная влажность – воздуха 35 ± 1%). Кремниевый кантилевер (HA_FM, балка B, Tipsnano, Эстония), покрытый Pt, имел следующие характеристики: резонансная частота f = 114 кГц, жесткость k = 6 Н/м, радиус закругления острия R < < 35 нм. Рельеф поверхности образцов изучали в прерывисто-контактном режиме с использованием кантилеверов той же марки.
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ
Микроструктура и химический состав поверхностных слоев. Изучаемые кристаллы получены в ИК РАН методом управляемого снижения растворимости из водных растворов K3H(SO4)2 и (NH4)3H(SO4)2 с соотношением ~3 : 7. С помощью поляризационной микроскопии были отобраны кристаллы (K0.43(NH4)0.57)3H(SO4)2 высокого оптического качества, без включений и участков с разной ориентацией. Плоскопараллельные сколы образцов, находившихся приблизительно три недели на воздухе с умеренной влажностью (35–40%), изучали методами сканирующей электронной (СЭМ) и зондовой микроскопии. Сопоставление электронно-микроскопических изображений свежих сколов и изменившихся в условиях влажности областей позволяет оценить произошедшую модификацию поверхности (001) (рис. 1). При выдержке образцов сформировался поверхностный слой в виде кристаллитов пластинчатой формы (рис. 1а), тогда как свежая поверхность (свежий скол образца) отличалась своим однородным контрастом (область 2, рис. 1б). Отметим, что для всех образцов (K0.43(NH4)0.57)3H(SO4)2 зарегистрированы аналогичные изменения. На поперечном сколе можно видеть срез слоя и оценить его толщину (~4–5 мкм) для данного образца (рис. 1в). Наблюдения в поляризационном микроскопе показали, что зарождение новой фазы происходит в виде отдельных микроскопических вкраплений белого налета в местах неоднородности поверхности [3], поэтому оценку толщины слоя по поперечным сколам можно сделать только приблизительно.
Рис. 1.
Электронно-микроскопические изображения образцов (K0.43(NH4)0.57)3H(SO4)2: a – поверхность, параллельная плоскости (001), изменившаяся в условиях влажности, б – скол этой поверхности (1 − модифицированный слой, 2 – свежий скол), в – поперечный скол образца вдоль оси с.

Для изучения химического состава образцов от различных областей размером 2 × 2 мкм2 были получены спектры EDXS. Химический состав кристаллов ((K,NH4)HSO4)2, атомная структура которых определена методом рентгеноструктурного анализа, с учетом формульных единиц Z = 3 можно записать как 3.87K 5.13N 6S 24O 23.52H [1]. Учитывая большую погрешность определения содержания кислорода и азота, влияющую на абсолютную величину долей других элементов в спектрах, данные EDXS использовали для оценки соотношения K : S. Спектры снимали с нескольких участков выбранного образца как с поверхности (модифицированной и свежего скола), так и с поперечных сколов. Вычисленные соотношения K : S представлены на рис. 2, разным частям образца соответствуют символы разной формы. Для более наглядного сравнения штриховой линией показано соотношение K : S = 3.87 : 6, соответствующее химическому составу (K0.43(NH4)0.57)3H(SO4)2. Полученные данные указывают на отсутствие значимых изменений в соотношениях содержания K и S после выдержки образцов на воздухе.
Рис. 2.
Отношения K : S, рассчитанные по данным EDXS; символы разной формы соответствуют разным областям образца; для более наглядного сравнения штриховой линией показано соотношение K : S = 3.87 : 6.
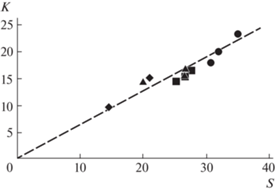
На основе результатов СЭМ и имеющихся структурных данных о соединениях с близким составом можно проанализировать формирование на поверхности образцов (K0.43(NH4)0.57)3H(SO4)2 модифицированного слоя. В [9, 10] показано, что при повышенных температурах в объеме или на поверхности кристаллов-суперпротоников могут происходить твердофазные реакции с образованием соединений MHAO4, M2AO4, K2S2O7. При рассмотрении возможности образования новых соединений на поверхности образцов необходимо учесть ряд ограничений. При формировании, например, соединения K2S2O7 одновременно должны были образоваться бы области, содержащие соединения с группами NH4. При формировании в поверхностном слое соединений, содержащих только группы NH4, в спектрах EDXS наблюдалось бы значительное изменение соотношений элементов – отсутствие K. Сохранение соотношения K : S порядка 3.87 : 6 в спектрах EDXS для разных областей образца (рис. 2) предполагает формирование на поверхности слоя переменного состава, содержащего соединения, не меняющие эти пропорции существенно, т.е. типа (K,NH4)HSO4 и (K,NH4)2SO4 (хотя возможность существования других соединений полностью отрицать нельзя).
Итак, при длительной выдержке кристаллов (K0.43(NH4)0.57)3H(SO4)2 в воздушной среде с умеренной относительной влажностью (35−40%) при 296 K на внешней поверхности формируется отличный от исходного объема нанокристаллический слой переменного состава толщиной до нескольких микрон.
Локальные свойства и поверхностные дефекты модифицированных слоев. С помощью топографических изображений, полученных в прерывисто-контактном режиме АСМ, может быть проиллюстрировано изменение морфологии поверхности свежих и выдержанных образцов (рис. 3а, 3б). Отчетливо проявляется слоистый характер рельефа свежей поверхности, в основном представленного плоскими террасами (рис. 3а). На них еще можно обнаружить более тонкие детали слоистой структуры: выступы и ямки с латеральными размерами от 40–250 нм и перепадами высот ~1/3 c. Среднеквадратическая шероховатость (Rq) участка свежей поверхности размером 20 × 20 мкм2 (рис. 3а) составляет Rq = 0.78 нм. Отметим, что по величине она сравнима с шероховатостью атомарно-плоского образца HOPG (Highly oriented pyrolytic graphite). Средняя разница высот между слоями последнего оценивалась в 0.7 нм при относительной влажности 45% и соответствовала примерно удвоенной толщине монослоя графита (т.е. 0.33 нм) [11]. Средняя разница высот в исследуемых образцах соответствует примерно толщине двойного сульфатного слоя кристалла (K0.43(NH4)0.57)3H(SO4)2 (т.е. 0.7 нм) [3]. При выдержке в течение 430−500 ч при 296 K и умеренной влажности воздуха (35−40%) морфология поверхности существенно изменяется, шероховатость возрастает почти в 40 раз (Rq = 28.51 нм). На изображениях нового слоя наблюдается большое количество пор, латеральные размеры и глубина которых составляет 300−800 и 50–300 нм соответственно (рис. 3б).
Рис. 3.
Изображения свежей поверхности (001) естественного скола кристалла (K0.43(NH4)0.57)3H(SO4)2 (а) и модифицированной (б, в); а, б – АСМ, в – СЭМ. Размер изображений 20 × 20 мкм2, 1 − поры, 2, 3 – нанопузырьки.

Электронно-микроскопическое изображение модифицированного слоя (в одном и том же с АСМ масштабе) представлено на рис. 3в. Заметно, что после длительной выдержки сформировалась рыхлая поверхностная наноструктура с порами (или точнее каналами, выходящими наружу) (стрелка 1 на рис. 3в) и пластинчатыми кристаллитами, соединенными в слои и вытянутыми вдоль одного направления. Кроме этого, на внешней поверхности наблюдаются метастабильные образования – нанопузырьки (стрелка 2 на рис. 3в) с разными размерами: минимальный и максимальный диаметр 1.6 и 2.0 мкм соответственно. Будучи в самом начале полусферическими, нанопузырьки по мере увеличения размера изменяют свою форму на продолговатую, вытягиваются вверх (показано стрелкой 3 на рис. 3в). Оболочка подвергается деструкции, при этом остается открытым канал. По-видимому, пузырьки появляются на стыках пластинчатых кристаллитов вследствие выхода из объема наружу жидких (не исключено газобразных/жидких) продуктов химических реакций. Появление нанопузырьков служит дополнительным доказательством существенной модификации поверхности, поскольку такие процессы наблюдаются на гидрофобных материалах, в то время как исходный материал гидрофильный. Нанопузырьки различного внешнего вида, стабильности, плотности и формы выявлены на гидрофобных поверхностях методом жидкостной АСМ при таких условиях, как температура и ее изменение, поверхностно-активные вещества, обработка поверхности [12–15]. В данном случае нанопузырьки образуются при дегидратации солей и способствуют дефектообразованию. На это указывают результаты сканирующей емкостной силовой микроскопии: на емкостных изображениях модифицированного поверхностного слоя обнаруживаются скрытые внутренние неоднородности [3].
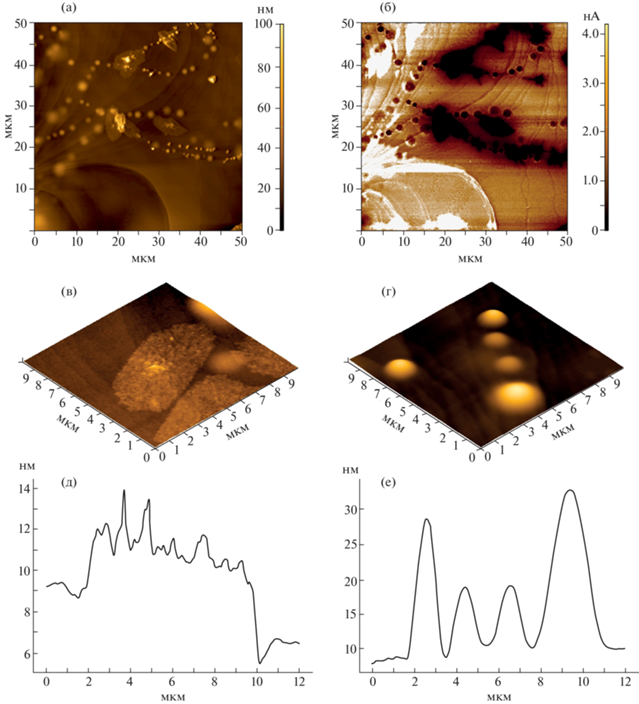
Ускоренное образование поверхностных наноструктур можно наблюдать в поле АСМ-зонда, покрытого платиной, катализирующей реакции дегидратации. Эксперименты были проведены в контактном режиме проводящей АСМ при подаче на нижний электрод постоянного напряжения Udc = +4 В. На рис. 4а, 4б представлены топографическое и токовое изображения одного и того же участка поверхности образца. Области светлого контраста на токовом изображении соответствуют проводящим участкам исходного кристалла. Локальная проводимость образцов невысока и зависит от кристаллографического направления: σDC = 7.95 × 10–4 См см–1 (⊥с) и σDC= 3.02 × × 10–4 См см–1 (||с) при U = +3 В [3]. Темные области на токовом изображении (непроводящие) связаны с появлением новых соединений на поверхности, т.е. с продуктами химических реакций. К последним относятся пластинчатые кристаллиты новой фазы (рис. 4в, 4д), а также куполообразные объекты сферической формы – нанопузырьки, ведущие себя под зондом как вязкоупругие твердые тела (рис. 4г, 4е). Высота кристаллитов 6.0–7.0 нм (примерно 3–4 параметра с), а латеральные размеры варьируются от 2 до 15 мкм. Минимальная и максимальная высота нанопузырьков составляет 3.7 и 27.0 нм соответственно, а латеральные размеры примерно на 2 порядка больше (690–3310 нм). Краевой угол составляет θ = 1.2°, что говорит об их приплюснутой форме при данных условиях образования.
Рис. 4.
Топографическое (а) и токовое изображение (б) модифицированной поверхности (001) естественного скола кристалла (K0.43(NH4)0.57)3H(SO4)2 после выдержки в течение 24 ч. Трехмерные топографические изображения пластинчатых нанокристаллов (в) и куполообразных нанопузырьков (д) с профилями сечения (д) и (е).
Образование нанопузырьков на поверхности образцов можно наблюдать в различных условиях: под электронным пучком в вакууме и электрическим полем зонда АСМ на воздухе. По данным СЭМ и АСМ продуктами гетерогенных химических реакций и дегидратации поверхности (K0.43(NH4)0.57)3H(SO4)2 являются нанокристаллические структуры, содержащие проводящие составы типа (K,NH4)HSO4 и непроводящие типа (K,NH4)2SO4, а также нанопузырьки с вязкоупругой жидкой фазой.
ОБСУЖДЕНИЕ ЭКСПЕРИМЕНТАЛЬНЫХ РЕЗУЛЬТАТОВ
При нормальных условиях окружающей среды – комнатной температуре и умеренной влажности – адсорбированная вода меняет состав и структуру поверхности суперпротонных кристаллов. Ценную информацию о свойствах поверхности дает измерение электростатического потенциала образцов методом сканирующей зондовой микроскопии Кельвина. Рассмотрим, как связаны изменения в величине поверхностного потенциала со структурой и составом поверхности (001), которая рассматривается как основная с точки зрения транспорта протонов (параллельная сетке динамически разупорядоченных водородных связей, обусловливающей высокую протонную проводимость).
Свежая поверхность скола (K0.43(NH4)0.57)3H(SO4)2 отрицательно заряжена: поверхностный электростатический потенциал составляет UCPD = = –114 мВ [3]. Стремясь снизить свою поверхностную энергию и нейтрализовать электрический заряд, поверхность притягивает к себе молекулы H2O, имеющие дипольную структуру. Вода проявляет себя как поверхностно-активный компонент для кислых солей сульфатов металлов, повышает реакционную способность поверхности за счет создания среды для ионной диссоциации и индуцирует зарождение и рост новой фазы, в результате чего изменяется химия поверхности и, соответственно, знак и величина поверхностного потенциала. Сплошной нанокристаллический слой переменного состава толщиной в сотни нанометров и более, образующийся после длительной выдержки, заряжен положительно (UCPD = = +84 мВ). Можно утверждать, что изменение электростатического потенциала тесно связано с изменениями структуры и химического состава поверхности кристаллов кислой соли сульфата калия-аммония.
Известно, что в естественных условиях поверхности ионных кристаллов часто реагируют с важными компонентами окружающей среды, такими как вода и кислород. Некоторые из этих химических реакций могут приводить к образованию на поверхности новых наноструктур с составом, отличным от исходных субстратов (CaCO3 и MnCO3) [11, 16, 17]. Согласно упомянутым работам ненулевые избыточные поверхностные потенциалы указывают на то, что наноструктуры, образовавшиеся в естественных условиях на поверхности ионных кристаллов, имеют состав, отличный от их исходных субстратов. Аналогичные закономерности наблюдаются для кристаллов кислых солей сульфатов калия-аммония, что говорит о некой общности процессов и значимости измерений поверхностного потенциала для оценки реакционной способности и химической стабильности твердой поверхности образцов.
Отметим, что в условиях переменной влажности микроскопия Кельвина дает полезную информацию для определения кислотно-щелочного характера твердых поверхностей [18]. В рассматриваемом случае смена знака и появление избыточного положительного потенциала указывают на изменение кислотности твердой поверхности в сторону преобладания щелочных свойств образующихся соединений. Диапазон открывающихся возможностей сканирующей зондовой микроскопии Кельвина в исследовании химии поверхности и границ раздела многообразен, как, впрочем, и сами поверхностные явления. Упомянем интересные применения этого метода для изучения взаимодействия между определенными функциональными группами и участками поверхности, изменяющего электронную структуру и смачиваемость поверхности минералов [19], роста пассивирующей оксидной пленки на металлах в воздухе [20] и связи между локальным поверхностным потенциалом и электрохимическим потенциалом материала литиевого катода [21].
Выполненные исследования позволили зафиксировать образование при различных условиях новых наноструктур на поверхности (001) кристалла (K0.43(NH4)0.57)3H(SO4)2, обладающей высокой реакционной способностью по отношению к адсорбированной влаге, описать их строение и специфические дефекты. Похожее возникновение нанопузырьков на границах раздела и пор/каналов в поверхностных слоях может происходить в неравновесных условиях внешних воздействий на кристалл, в частности в электрохимической ячейке. Можно сделать вывод, что в экспериментах с такого типа кристаллами необходимо учитывать возможность образования поверхностных слоев с измененными физико-химическими характеристиками, особенно при уменьшении размеров образцов, когда будет возрастать удельная доля поверхности. Кроме того, поры, каналы и внутренние дефекты в нанокристаллическом слое ухудшают химическую стабильность кристалла в целом, способствуя доступу атмосферных газов к границе раздела модифицированный слой/монокристалл.
ЗАКЛЮЧЕНИЕ
В результате комплексных микроскопических исследований дано описание структурно-фазовых превращений на поверхности (001) суперпротонных кристаллов (K0.43(NH4)0.57)3H(SO4)2 в естественных условиях под влиянием влажности. Установлено, что образующийся наноструктурированный слой имеет отличные от объемной фазы структуру, химический состав, физико-химические характеристики (проводимость, поверхностный потенциал, химия поверхности) и содержит специфические дефекты – поры, каналы и скрытые внутренние неоднородности. Выявлена прямая корреляция между изменением структуры и состава поверхностного слоя кристалла и изменением знака и величины поверхностного электростатического потенциала, который, по-видимому, является важным диагностическим параметром, характеризующим химическую стабильность и свойства суперпротонных фаз.
Работа выполнена при поддержке Министерства науки и высшего образования РФ в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН. Эксперименты проводились с использованием оборудования ЦКП ФНИЦ “Кристаллография и фотоника” при поддержке Минобрнауки.
Список литературы
Selezneva E.V., Makarova I.P., Malyshkina I.A. et al. // Acta Cryst. B. 2017. V. 73. P. 1105. https://doi.org/10.1107/S2052520617012847
Малышкина И.А., Селезнева Е.В., Макарова И.П., Гаврилова Н.Д. // Вестн. МГУ. Сер. 3. Физика. Астрономия. 2019. № 4. С. 52. https://doi.org/10.3103/S002713491904012X
Гайнутдинов Р.В., Толстихина А.Л., Селезнева Е.В., Макарова И.П. // Кристаллография. 2022. Т. 67. № 3. С. 442. https://doi.org/10.31857/S0023476122030080
Norby T. // Nature. 2001. V. 410. № 6831. P. 877.
Баранов А.И. // Кристаллография. 2003. Т. 48. № 6. С. 1081.
Ponomareva V., Lavrova G. // J. Solid State Electrochem. 2011. V. 15. P. 213. https://doi.org/10.1007/s10008-010-1227-1
Merle R.B., Chisholm C.R.I., Boysen D.A., Haile S.M. // Energy Fuels. 2003. V. 17. P. 210. https://doi.org/10.1021/ef0201174
Ikeda A. // Thesis by Ayako Ikeda. California: California Institute of Technology Pasadena, 2013. P. 6.
Макарова И.П., Черная Т.С., Филаретов А.А. и др. // Кристаллография. 2010. Т. 55. № 3. С. 429. https://doi.org/10.1134/S1063774510030065
Gainutdinov R., Selezneva E., Makarova I. et al. // Surf. Interfaces. 2021. V. 23. P. 100952 (1-9). https://doi.org/10.1016/j.surfin.2021.100952
Na Ch., T. Kendall T.A., Martin S.T. // Environ. Sci. Technol. 2007. V. 41. P. 6491.
Yang Sh., Dammer S.M., Bremond N. et al. // Langmuir. 2007. V. 23. P. 7072. https://doi.org/10.1021/la070004i
Zhang X.H., Quinn A., Ducker W.A. // Langmuir. 2008. V. 24. P. 4756. https://doi.org/10.1021/la703475q
An H., Liu G., Craig V.S.J. // Adv. Colloid Interface Sci. 2015. V. 222. P. 9. https://doi.org/10.1016/j.cis.2014.07.008
Lohse D., Zhang X. // Rev. Mod. Phys. 2015. V. 87. P. 981. https://doi.org/10.1103/RevModPhys.87.981
Kendall T.A., Na Ch., Jun Y.-Sh., Martin S.T. // Langmuir. 2008. V. 24. P. 2519. https://doi.org./https://doi.org/10.1021/la702350p
Na Ch., Tang Y., Wang H., Martin S.T. // Langmuir. 2015. V. 31. P. 2366. https://doi.org/10.1021/la504465y
Gouveia R.F., Bernardes J.S., Ducati T.R.D., Galembeck F. // Anal. Chem. 2012. V. 84. № 23. P. 10191. https://doi.org/10.1021/ac3009753
Walker S.M., Marcano M.C., Kim S. et al. // J. Phys. Chem. C. 2017. V. 121. № 50. P. 28017. https://doi.org/10.1021/acs.jpcc.7b09565
Revilla R.I., Terryn H., De Graeve I. // Electrochem. Commun. 2018. V. 93. P. 162. https://doi.org/10.1016/j.elecom.2018.07.010
Zhu X., Revilla R.I., Hubin A. // J. Phys. Chem. C. 2018. V. 122. № 50. P. 28556. https://doi.org/10.1021/acs.jpcc.8b10364
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


