Лесоведение, 2021, № 2, стр. 195-207
Криптогамные организмы – пионеры восстановления северотаежных лесов при снижении воздушного промышленного загрязнения
Г. П. Урбанавичюс a, *, Е. А. Боровичев a, В. В. Ершов a
a Институт проблем промышленной экологии Севера, ФИЦ КНЦ РАН
184209 Мурманская обл, Апатиты, Академгородок, 14а, Россия
* E-mail: g.urban@mail.ru
Поступила в редакцию 23.08.2019
После доработки 11.11.2019
Принята к публикации 08.12.2020
Аннотация
Изучение процессов восстановления напочвенного покрова в зоне воздействия горно-металлургического комбината “Североникель” (г. Мончегорск, Мурманская область), позволило установить, что криптогамные организмы первыми поселяются на территории, на которой прежде весь напочвенный покров был уничтожен в результате сверхкритических уровней загрязнения. Впервые установлены виды лишайников и мохообразных, обладающие наибольшей токсикотолерантностью и способные произрастать в зоне техногенной пустыни. Ими являются печеночники Isopaches bicrenatus, Nardia geoscyphus, Gymnocolea inflata, Solenostoma confertissimum и мхи Pohlia nutans, Dicranella cerviculata. Установлено, что для поселения пионерных видов лишайников, даже наиболее приспособленных к высоким концентрациям тяжелых металлов (Stereocaulon leucophaeopsis и St. pileatum), необходимо формирование своеобразной основы – подстилки, представленной дернинами мохообразных. Всего в пределах прямого влияния медно-никелевого производства (1.7–10 км) выявлено 18 видов мохообразных и 13 видов лишайников: в зоне техногенной пустыни (1.7–2.7 км) – 6 и 1 вид, соответственно, в зоне техногенной пустоши (4–6.5 км) – 10 и 5 видов, в зоне техногенных редколесий (7–10 км) – 15 и 11 видов. Начальные этапы восстановления напочвенного покрова и заметное (в 2–3 раза) увеличение разнообразия наземной криптогамной биоты наблюдаются на удалении 6.5–10 км от источника загрязнения при снижении уровня выпадений сульфатов примерно в 2.5–3 раза, Ni – в 17 раз и Cu – в 20 раз.
Восстановление ранее деградированных лесных ландшафтов и охрана биологического разнообразия – это два процесса, которые должны быть неразрывно связаны единой целью сохранения природной среды. Экономическая отдача в случае успешного восстановления ландшафтов может измеряться в миллиардах рублей, но главный потенциал кроется в возможности смягчения целого ряда последствий изменения климата вследствие деятельности человека (Beatty et al., 2018). При этом по своей сути восстановление лесных ландшафтов должно быть направлено на поддержание биологического разнообразия, а также видов и экосистем, которые его формируют. Конечная же цель восстановления проявится в предоставлении непосредственных или опосредованных экосистемных услуг людям (Beatty et al., 2018).
Изучению и охране биоразнообразия посвящено большое число работ. В то же время исследований, посвященных изучению восстановления биоразнообразия в тех местах, где оно было практически полностью уничтожено в результате хозяйственной деятельности человека, почти нет. Существующие работы по данной тематике связаны в основном с интродукцией или реинтродукцией растений, искусственным восстановлением и поддержанием экосистем (Young, 2000; Лукина и др., 2005; Pressey et al., 2007; и др.).
Проблема восстановления территорий, нарушенных воздушным промышленным загрязнением, имеет особую актуальность в Мурманской области, которая является одним из наиболее индустриально развитых регионов России. Наметившееся в течение последних двух десятилетий снижение объемов производства и сокращение выбросов обусловило начальные признаки восстановления экосистем. Произошло замедление дигрессионных процессов, и на расстоянии первых десятков километров уже наблюдаются признаки позитивной динамики восстановления растительного покрова (Черненькова и др., 2011; и др.). Но, тем не менее, на участках, прилегающих непосредственно к источникам выбросов в радиусе первых километров, пока наблюдается практически полное отсутствие напочвенного покрова и каких-либо высших сосудистых растений, что нашло отражение в названии “техногенная пустыня” (Влияние …, 1990; Проблемы …, 2005). Было установлено, что лимитирующими возобновление растительного покрова в таких условиях являются не только высокий уровень загрязнения атмосферы, но также неблагоприятные эдафические условия и нарушение питательного режима почв, а в непосредственной близости к источнику выбросов – полное разрушение органического горизонта почвы (Лукина, Никонов, 1998).
В последние два десятилетия проводятся эксперименты по восстановлению растительного покрова при помощи разных методов ремедиации техногенных пустошей в окрестностях г. Мончегорска в зоне влияния комбината “Североникель” (Лукина, Никонов, 1999; Ганичева и др., 2004; Никонов и др., 2005; Исаева и др., 2010, 2011). Но в основе этих исследований лежит искусственное восстановление растительности и напочвенного покрова. Изучение восстановления биоразнообразия в напочвенном покрове техногенной пустыни на начальных стадиях путем естественного заселения аборигенными пионерными видами не проводится. Наши исследования являются одними из первых в данном направлении и посвящены изучению видового состава криптогамных организмов – лишайников, печеночников и мхов, участвующих в формировании естественного напочвенного покрова в условиях сверхвысоких уровней загрязнения в пределах техногенной пустыни, где, в отличие от техногенной пустоши, не произрастают какие-либо высшие сосудистые растения.
Лишайники известны как организмы, наиболее чувствительные к загрязнению воздуха. Они первыми исчезают при повышении до определенного уровня загрязнения, при котором древесные растения, являющиеся субстратом для поселения эпифитных лишайников, могут существовать еще продолжительное время (Nimis et al., 2002). Данные свойства лишайников нашли широкое применение в лихеноиндикации загрязнения окружающей среды (Бязров, 2002). В окрестностях крупных источников воздушных промышленных выбросов и центрах крупных мегаполисов могут формироваться так называемые “лишайниковые пустыни” (Nimis et al., 2002). Но при снижении уровня загрязнения воздуха нередко наблюдаются обратные явления, когда лишайники начинают возвращаться в ранее покинутые районы (Stapper, Kricke, 2004). Известно немало случаев начала восстановления эпифитного лишайникового покрова в окрестностях закрытых металлургических комбинатов (Beckett, 1995; Gunn et al., 1995; Schram et al., 2015) или значительно сокративших объемы аэропромвыбросов (Михайлова, 2017). Тем не менее сведений о восстановлении напочвенных видов лишайников в местах, где они прежде были уничтожены сверхкритическим уровнем загрязнения, в литературе мы не обнаружили.
Широко известна способность мохообразных (мхи и печеночники) аккумулировать высокие концентрации тяжелых металлов (Tyler, 1990). На эту способность обратили внимание еще в XIX в., когда начал исчезать ряд видов с территории городов. Большинство напочвенных мхов крайне чувствительны и обычно не выдерживают повышенных уровней локального загрязнения. В результате лабораторных опытов были определены пределы чувствительности и оказалось, что мохообразные чувствительны уже к сравнительно низким концентрациям сернистого газа (Bell, 1973). Выявлено, что наиболее сильное воздействие на мхи оказывает сочетание окислов серы с солями тяжелых металлов, а их источниками являются предприятия цветной металлургии (Taoda, 1972). Но некоторые напочвенные верхоплодные мхи и печеночники необычайно толерантны и способны выдерживать даже инкрустацию поверхности побегов осажденными солями тяжелых металлов (Tyler, 1990).
Работы по изучению изменения мохового покрова при промышленном загрязнении в районе действия комбината “Североникель” проводились Е.Н. Андреевой (1990, 2005). Ею были получены данные об изменении видового состава мохообразных сосновых и еловых лесов в зависимости от расстояния до источника загрязнения. Выявлены три этапа деградации мохового покрова, соответствующие трем зонам поражения лесных экосистем.
Комплексные результаты изучения изменения биоразнообразия лесных экосистем на расстоянии от 5 до 30 км от источника были представлены в работе Т.В. Черненьковой с соавт. (2009). Авторами показано наличие в импактной зоне на удалении 5 и 10 км от комбината “Североникель” всего двух видов мохообразных (Pohlia nutans и Polytrichum hyperboreum) и 5 видов напочвенных лишайников (Cladonia chlorophaea, C. crispata, Flavocetraria nivalis, Stereocaulon condensatum и Trapeliopsis granulosa). Прочие виды лишайников, указанные для импактной зоны, не относятся к напочвенным либо неверно идентифицированы. Но эти данные относятся к техногенной пустоши (5 км от комбината) и техногенным редколесьям (10 км от комбината), согласно представлениям Н.В. Лукиной с соавт. (2005). Сведения о составе криптогамной биоты на более близких расстояниях к комбинату в зоне техногенной пустыни до наших исследований отсутствали.
Проводившие многолетние исследования влияния аэропромвыбросов комбината “Североникель” на лесные экосистемы специалисты Ботанического института им. В.Л. Комарова РАН В.Г. Ярмишко с соавт. полагают, что “… в импактной зоне при сохранении современного уровня аэротехногенной нагрузки мохово-лишайниковый ярус останется полностью разрушенным … При прекращении деятельности комбината восстановление мохово-лишайникового яруса в импактной зоне начнется через ~100 лет, когда концентрации тяжелых металлов в органогенном горизонте почвы достигнут значений, наблюдающихся в буферной зоне” (Ярмишко и др., 2011, стр. 29). Однако после подведения итогов полевого эксперимента этими же авторами получены свидетельства о незначительной миграции тяжелых металлов из загрязненной почвы в надземные части растительных организмов (Лянгузова и др., 2015). Накопление в живом талломе лишайника Cladonia stellaris тяжелых металлов – Cu 1.2–3.9 и Ni 1.9–4.8 мг кг–1 сух. в-ва, по данным этих авторов, не коррелирует с уровнем накопления тяжелых металлов в подстилке (Ni – от 9.4 до 120 мг кг–1, Cu – от 21.6 до 624 мг кг–1). Мы полагаем, что это может свидетельствовать о меньшей зависимости восстановительной способности мохово-лишайникового покрова от уровня накопления загрязняющих веществ в почве.
Восстановление и устойчивое функционирование лесных экосистем невозможно без восстановления основных компонентов, характерных для данных природно-климатических условий и конкретных ландшафтов. В условиях Кольской Субарктики одним из основных компонентов растительного покрова является мохово-лишайниковый ярус. Криптогамные организмы, наиболее примитивные из формирующих напочвенный ярус растительности – лишайники и мохообразные, являются пионерными видами, т.е. первопоселенцами в самых суровых природных условиях высокогорных и полярных пустынь Арктики и Антарктики. Такая их природная особенность способствует и тому, что они первыми осваивают техногенные пустыни, лишенные напочвенного покрова из-за крайне высокого уровня концентрации загрязняющих веществ.
Целью данной работы является выявление разнообразия криптогамных организмов и установление особенностей его пространственного варьирования по градиенту аэротехногенного загрязнения в импактной зоне на расстоянии первых 1.7–10 км от горно-металлургического комбината “Североникель”, г. Мончегорск, Мурманская область.
ОБЪЕКТЫ И МЕТОДИКА
Объектами исследования являются представители наземной криптогамной биоты – лишайники и мохообразные (печеночники и мхи). Сборы образцов и детальные описания видового состава и группировок лишайников и мохообразных осуществлялись согласно принятым во флористических и геоботанических исследованиях методикам. Было выбрано семь участков в направлении преобладающего переноса загрязняющих веществ на удалении от 1.7 до 10 км в зоне воздействия выбросов комбината “Североникель” (табл. 1).
Таблица 1.
Характеристика участков изучения криптогамной биоты в окрестностях комбината “Североникель” по градиенту загрязнения
| Номер участка | Местоположение и характер растительного покрова | Географические координаты участка | Расстояние от источника загрязнения, км | Зоны трансформации экосистем |
|---|---|---|---|---|
| 1 | Северный склон горы Сопча. Напочвенный покров полностью разрушен. Растительность на трех площадках отсутствует, на двух площадках отмечены мохообразные | 67°54′02–05″ с.ш., 32°51′03–08″ в.д. | 1.7 | Техногенная пустыня |
| 2 | Северо-восточный отрог горы Сопча. Напочвенный покров разрушен. На всех площадках присутствуют мохообразные в сильно угнетенном состоянии; на одной площадке присутствует один вид лишайника | 67°53′36–48″ с.ш., 32°51′11–14″ в.д. | 2.7 | |
| 3 | Средняя часть южного склона горы Сопча. Растительность на двух площадках отсутствует; на трех площадках отмечены мохообразные; на одной площадке присутствует один вид лишайника | 67°52′37–46″ с.ш., 32°49′10–20″ в.д. | 4.2 | Техногенная пустошь |
| 4 | Нижняя часть южного склона горы Сопча. На одной площадке растительность отсутствует, на остальных развит моховой покров с заметным участием сосудистых растений; на одной площадке присутствует один вид лишайника | 67°52′15–19″ с.ш., 32°49′06–11″ в.д. | 5 | |
| 5 | Южное подножие г. Сопча. Растительность на двух площадках представлена только мохообразными, на трех площадках – с участием сосудистых растений и лишайников | 67°51′29–33″ с.ш., 32°49′17–20″ в.д. | 6.5 | |
| 6 | Елово-березовое редколесье. Напочвенный покров представлен на всех площадках с участием мохообразных, лишайников и сосудистых растений | 67°51′12–15″ с.ш., 32°47′39–52″ в.д. | 7 | Техногенные редколесья |
| 7 | Сосновое редколесье. Напочвенный покров представлен на всех площадках с участием мохообразных, лишайников и сосудистых растений | 67°49′47–51″ с.ш., 32°45′31–41″ в.д. | 10 |
На каждом из участков было заложено и описано по 5 учетных площадок размером 2 × 2 м. Учетные площадки выбирались случайным образом, с охватом преобладающих элементов рельефа и степени развития (отсутствия) напочвенного покрова. На каждой учетной площадке выявлялся полный видовой состав произрастающих лишайников и мохообразных (сосудистые растения учитывались, если они там присутствовали), а также их проективное покрытие (ПП). Неопределяемые в полевых условиях образцы лишайников и мохообразных коллекционировались для последующего определения в лабораторных условиях.
Определение видового состава лишайников и мохообразных осуществлялось в лаборатории наземных экосистем Института проблем промышленной экологии КНЦ РАН, с использованием микроскопов “Микмед-6”, “Zeiss” и бинокуляра МСП-2, вариант 4, по общепринятым методикам. Названия таксонов приведены: лишайники – по чеклисту лихенофлоры России (Урбанавичюс, 2010), печеночников – согласно мировому списку печеночников (Söderström et al., 2016), мхов – по M.S. Ignatov et al. (2006), сосудистых растений – по С.К. Черепанову (1995), с некоторыми изменениями.
Отбор атмосферных осадков (дождевых – с мая по сентябрь, снеговых – с октября по март) осуществлялся в двух подзонах импактной зоны: 1) техногенная пустыня – осадкоприемники располагались на северном склоне горы Сопча на расстоянии 1.7–1.8 км от центра горно-металлургического комбината “Североникель”; 2) техногенные редколесья – осадкоприемники располагались на расстоянии 7 и 10 км от источника промвыбросов. На всех мониторинговых площадках осадкоприемники устанавливались не менее чем в трехкратной повторности. Осадкоприемники для дождевых вод представляют собой пластиковые трубы, внутрь которых помещается полиэтиленовый пакет вместимостью до 3 л., закрепляемый специальным колпаком с воронкой диаметром 16 см. На участке 1.7 км дождевые осадки отбирались с мая по сентябрь 2018 г., снеговые – в конце периода снегонакопления в марте 2018–2019 гг. В 7 и 10 км от источника выбросов атмосферные осадки (дождь и снег) отбирались в 2013–2018 гг. На промежуточных участках в зоне техногенной пустоши и на вершине горы Сопча осадки по техническим причинам не отбирались. Образцы дождевых выпадений отбирали ежемесячно; для анализа использована аликвотная часть пробы (не менее 250–300 мл). Металлы медь и никель определяли методом атомно-абсорбционной спектрофотометрии, сульфаты – методом ионообменной хроматографии.
Нами было изучено содержание основных загрязняющих веществ в подстилающем горизонте почвы на всех участках. Тем не менее мы считаем нецелесообразным приводить эти результаты в данной работе по двум причинам. Во-первых, полученные данные оказались очень вариабильны и не имели корреляции с обилием и разнообразием криптогамной биоты на изученных участках по градиенту загрязнения. Во-вторых, накопление тяжелых металлов в лишайниках слабо зависит от уровня накопления тяжелых металлов в подстилающих почвах. Эти организмы не имеют корней и питательные вещества они получают не из почвы, а из атмосферы вместе с влажным воздухом или осадками.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты изучения пространственного изменения выпадений основных загрязняющих веществ Cu, Ni и SO4 с атмосферными осадками (табл. 2) и разнообразия выявленных криптогамных организмов (рис. 1, табл. 3) показывают естественную закономерность по градиенту загрязнения. Уровень выпадения Cu и Ni в пределах первых 2 км и на расстоянии 7–10 км от источника аэропромвыбросов различается примерно в 15–30 и 10–20 раз, соответственно, по выпадениям SO4 различие составляет более чем 2 раза (табл. 2). При этом на первых 5 км число выявленных видов лишайников остается неизменным – здесь отмечено по 1 виду с крайне низким ПП. И лишь с расстояния 6.5 км происходит заметное увеличение разнообразия напочвенных лишайников – здесь найдено 5 видов, как и на расстоянии 7 км. Но на удалении 6.5 км ПП остается еще очень низким – порядка 2%; заметно увеличивается оно лишь с 7 км – до 20%. На удалении 10 км в напочвенном покрове обнаружено уже 10 видов лишайников, и ПП их достигает в среднем 45%. Аналогичные изменения по градиенту загрязнения происходят и среди мохообразных. Единственная особенность, которую мы можем подчеркнуть, это то, что мохообразные быстрее, более активно и обильно начинают проявлять себя на близких к источнику загрязнения площадках, чем лишайники (рис. 1).
Таблица 2.
Среднегодовые выпадение с атмосферными осадками Ni, Cu и на различном удалении от источника загрязнения, мг м–2
| Расстояние до источника загрязнения, км | Ni | Cu | |
|---|---|---|---|
| Жидкие осадки | |||
| 1.7 | 92.52* | 82.33* | 2335.64* |
| 7 | |||
| 10 | |||
| Твердые осадки | |||
| 1.7 | |||
| 7 | |||
| 10 | |||
Рис. 1.
Изменения разнообразия напочвенной биоты (а – лишайники, б – мохообразные) по градиенту загрязнения от комбината “Североникель”; 1 – число видов, 2 – проективное покрытие.
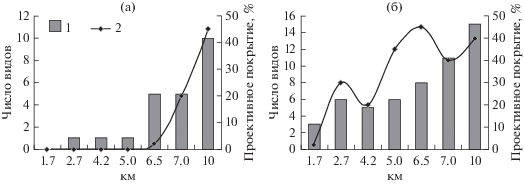
Таблица 3.
Изменение видового разнообразия и проективного покрытия лишайников и мохообразных по градиенту загрязнения
| Вид | Расстояние от источника промвыбросов, км | ||||||
|---|---|---|---|---|---|---|---|
| 1.7 | 2.7 | 4.2 | 5 | 6.5 | 7 | 10 | |
| Лишайники | |||||||
| Baeomyces placophyllus | – | – | – | – | – | – | + |
| Baeomyces rufus | – | – | – | – | – | – | + |
| Cetraria islandica | – | – | – | – | – | – | + |
| Cladonia borealis | – | – | – | – | – | – | + |
| Cladonia coccifera | – | – | – | – | – | – | + |
| Cladonia deformis | – | – | – | – | – | + | + |
| Placynthiella uliginosa | – | – | – | – | + | + | + |
| Protothelenella sphinctrinoides | – | – | – | – | + | + | + |
| Stereocaulon alpinum | – | – | – | – | – | – | + |
| Stereocaulon leucophaeopsis | – | + | – | – | + | – | – |
| Stereocaulon pileatum | – | – | + | + | + | – | – |
| Stereocaulon paschale | – | – | – | – | + | + | – |
| Trapeliopsis granulosa | – | – | – | – | – | + | + |
| Число видов | 0 | 1 | 1 | 1 | 5 | 5 | 10 |
| Среднее ПП, % | 0 | <0.01 | <0.01 | <0.01 | 2 | 20 | 45 |
| Мохообразные | |||||||
| Barbilophozia hatcheri | – | – | – | – | – | + | + |
| Blepharostoma trichophyllum | – | – | – | – | – | + | + |
| Bucklandiella microcarpa | – | – | – | – | – | – | + |
| Cephalozia bicuspidata | – | – | – | – | + | + | + |
| Dicranella cerviculata | + | + | – | – | + | – | – |
| Diplophyllum taxifolium | – | – | – | – | – | + | + |
| Gymnocolea inflata | – | + | + | + | + | + | + |
| Isopaches bicrenatus | – | + | – | + | + | + | + |
| Lophozia murmanica | – | – | – | + | + | – | + |
| Nardia geoscyphus | + | + | – | + | + | + | + |
| Oligotrichum hercynicum | – | – | – | – | – | + | + |
| Pohlia andalusica | – | – | + | – | – | – | – |
| Pohlia nutans | + | + | + | + | + | + | + |
| Polytrichum hyperboreum | – | – | – | – | – | + | + |
| Pseudolophozia sudetica | – | – | + | – | – | – | – |
| Solenostoma confertissimum | – | + | + | + | + | + | + |
| Sphenolobus minutus | – | – | – | – | – | – | + |
| Trilophozia quinquedentata | – | – | – | – | – | – | + |
| Число видов | 3 | 6 | 5 | 6 | 8 | 11 | 15 |
| Среднее ПП, % | 2 | 30 | 20 | 45 | 55 | 40 | 50 |
На подверженных максимальному воздействию загрязняющих веществ участках в пределах первых 3 км от источника выбросов (участки 1 и 2) в напочвенном покрове не отмечено сосудистых растений. Само понятие “напочвенный покров” для данных участков в прямом значении этих слов не применимо. Органогенный слой из отмерших растений здесь отсутствует. Даже на расстоянии 4–5 км от источника выбросов на части учетных площадок полностью отсутствует какая-либо растительность и лишайники. Первыми поселенцами, выдерживающими максимальные уровни загрязнения в зоне техногенной пустыни на расстоянии первых 3 км, являются мохообразные – печеночники и мхи (табл. 3). На расстоянии 1.7 км от источника загрязнения печеночник Nardia geoscyphus и листостебельные мхи Pohlia nutans и Dicranella cerviculata отмечены только на двух учетных площадках из пяти с минимальным ПП – от 2 до 4%; в среднем оно составляет около 2%. Это виды с широкой экологической амплитудой. Моховой покров представлен отдельными, неконтактирующими между собой группировками. Причем сохраняется фотосинтезирующая часть побега текущего года, а побег прошлого года минерализуется. Виды мохообразных, обитающие в этой зоне, можно отнести к наиболее токситолерантным. При этом надо отметить, что мох Pohlia nutans был отмечен на всех учетных площадках (табл. 3). В отсутствии каких-либо видов лишайников данную территорию однозначно можно охарактеризовать как “лишайниковая пустыня”.
Не отмечены сосудистые растения и на втором участке в 2.7 км от источника выбросов, расположенном на вершине горы Сопча, на высотах 480–490 м над ур. моря. Внешний аспект данного участка выглядит как техногенная пустыня, на которую, вероятно, могут накладываться суровые условия высотной поясности. Хотя на аналогичных высотах на прилегающих горных массивах Чуна-тундра и в Хибинах развиты типичные горные лишайниковые тундры. Мохообразные на этом участке отмечены на всех пяти учетных площадках и представлены уже 6 видами (табл. 3). Их ПП на отдельных учетных площадках колеблется от 0.5 до 60%, составляя в среднем около 30%. Здесь встречаются виды, нехарактерные для коренных лесов, и они приурочены к намывам почвы или мелкозема. На этом участке (как и на первом, третьем, четвертом и пятом) были отмечены различные анатомо-морфологические отклонения от нормы – развитие вторичной пигментации (коричневатая, буроватая) у Isopaches bicrenatus, Solenostoma confertissimum, Dicranella cerviculata; некротические процессы в побегах Nardia geoscyphus, Dicranella cerviculata и плазмолиз краевых клеток у Solenostoma confertissimum. Подобные явления уже отмечались для мохообразных в 8 км юго-юго-западнее источника загрязнения в окрестностях Мончегорска (Андреева, 1990).
Только на удалении 2.7 км от источника воздушных промышленных выбросов начинают отмечаться первые лишайники. На одной из пяти учетных площадок обнаружен лишайник Stereocaulon leucophaeopsis – один из немногих видов, эволюционно приспособившихся к обитанию в местах высокой концентрации тяжелых металлов, в том числе Cu и Ni (Purvis, James, 1985; Purvis, Halls, 1996; Wirth et al., 2013). По этой причине естественно произрастание такого вида на участках, наиболее приближенных к источнику загрязнения. Здесь лишайник был представлен только небольшими фрагментами (ПП < 0.01%) в стерильном состоянии, но с вегетативными пропагулами – соредиями. Известно, что соредиозные формы лишайников всегда более успешно расселяются – вероятно, таким образом реализуется их жизненная стратегия приспособления к неблагоприятным условиям среды. При этом St. leucophaeopsis поселялся исключительно на живых или отмирающих дернинках мхов и печеночников и не произрастал на минеральном грунте.
На третьем участке, расположенном на южном склоне горы Сопча и удаленном от источника выбросов на 4.2 км, только на одной учетной площадке из пяти отмечен лишайник – Stereocaulon pileatum (ПП < 0.01%). Он так же, как и St. leucophaeopsis, является токситолерантным по отношению к тяжелым металлам. В естественных природных условиях он нередко первым поселяется на каменистом субстрате или мелкоземе, содержащем какие-либо тяжелые металлы, в том числе Cu и Ni (Purvis, Halls, 1996; Wirth et al., 2013). St. pileatum также является соредиозным, что способствует его расселению в импактной зоне. На южном склоне и у подножия горы Сопча он отмечен с высоким обилием, как на каменистом субстрате, так и на участках почвы, соприкасающихся с камнями.
На третьем участке на трех из пяти учетных площадках выявлено 5 видов мохообразных – Gymnocolea inflata, Pohlia nutans, P. andalusica, Pseudolophozia sudetica, Solenostoma confertissimum. ПП их варьирует от 5 до 90%, составляя в среднем для пяти учетных площадок около 20%. На этих же трех учетных площадках были зафиксированы и первые сосудистые растения – Betula czerepanovii, Calamagrostis lapponica, Chamaenerion angustifolium, Equisetum arvense, Eriophorum polystachion, Poa pratensis, Salix borealis, Steris alpina. При этом на одной учетной площадке, расположенной в ложбине стока, проективное покрытие мохообразных достигает 90%. Здесь, у подножия горы Сопча, где оголенные всхолмления чередуются с сырыми понижениями, занятыми приручьевыми ценозами, чаще слегка заболоченными ивняками, существуют небольшие островки сомкнутой растительности (покрытие 70–90%). В основном, на данном участке практически полностью отсутствует напочвенный покров, а учетная площадка в ложбине стока скорее является исключением.
На четвертом участке, расположенном в 5 км от комбината “Североникель”, растительный покров в целом формируется на большей площади, чем на предыдущих участках. Здесь в напочвенном покрове отсутствует травяно-кустарничковый ярус, но отмечаются три вида древесных растений – Salix borealis, S. caprea и Betula czerepanovii. Напочвенный покров на этом участке сформирован исключительно мохообразными – Gymnocolea inflata, Isopaches bicrenatus, Lophozia murmanica, Nardia geoscyphus, Pohlia nutans, Solenostoma confertissimum. ПП мохообразных на четырех учетных площадках составляет от 20 до 85%. На одной учетной площадке мохообразные отсутствовали. Лишайники в напочвенном покрове отмечены только на одной учетной площадке и представлены единственным токситолерантным видом Stereocaulon pileatum, находящимся здесь также в стерильном состоянии и представленном единичным талломом (ПП ~0.1%). Необходимо отметить, что за пределами учетных площадок на данном участке он встречался неоднократно на каменистом субстрате (но не на почве).
На удалении 6.5 км от комбината “Североникель” (пятый участок) происходит увеличение как разнообразия видов лишайников, участвующих в сложении напочвенного покрова, так и их общего ПП до 5% на отдельных учетных площадках. На двух из пяти учетных площадках лишайники отсутствовали; на остальных трех площадках ПП варьирует от 0.1 до 5%. А еще на двух площадках лишайники были представлены только двумя токситолерантными видами, отмеченными и на предыдущих участках – Stereocaulon leucophaeopsis и St. pileatum. Но здесь лишайник St. leucophaeopsis был обнаружен с развитыми плодовыми телами, что может свидетельствовать о более благоприятных условиях обитания по сравнению с предыдущими участками.
В пределах данного участка на учетной площадке, расположенной в небольшом понижении с обильно развитым напочвенным покровом, зафиксированы первые виды лишайников, которые (по литературным сведениям) не являются токситолерантными. Лесной вид Stereocaulon paschale, обычный как в ненарушенных, так и в умеренно нарушенных естественных лесных экосистемах, здесь представлен единичной подушечкой. Еще два лишайника – Placynthiella uliginosa и Protothelenella sphinctrinoides – характерные виды нарушенных мест обитания (по естественным или антропогенным причинам). Здесь их проективное покрытие составляет немногим менее 5%. Эти виды нередко являются первопоселенцами на умеренно нарушенных местообитаниях без полного уничтожения органического слоя. Для их обитания необходима основа, состоящая их торфянистых остатков (для P. uliginosa) и угнетенных моховых дернин (для P. sphinctrinoides). Первый вид – P. uliginosa – иногда относят к лишайникам, устойчивым к загрязнению тяжелыми металлами (например, Михайлова, 2017); по второму виду – P. sphinctrinoides – нам такие сведения не известны. Поскольку Protothelenella sphinctrinoides обнаружен нами неоднократно с высоким покрытием и на других участках в 7 и 10 км от источника выбросов комбината “Североникель” со значительным уровнем выпадения атмосферных загрязняющих веществ, мы вполне уверенно можем считать данный вид токситолерантным.
Мохообразные на пятом участке немного более разнообразны по сравнению с предыдущим и произрастают здесь с несколько большим покрытием (табл. 3). Пока они продолжают оставаться преобладающими в напочвенном растительном покрове по сравнению с сосудистыми растениями и лишайниками. Проективное покрытие мохообразных на пяти изученных учетных площадках варьирует от 40 до 85%. На одной учетной площадке зафиксировано и максимальное число видов – 5: Cephalozia bicuspidata, Gymnocolea inflate, Nardia geoscyphus, Pohlia nutans, Solenostoma confertissimum. Всего на этом участке выявлено 7 видов мохообразных, со средним проективным покрытием 55% (наибольшее на всем изученном градиенте). Достаточно высокое разнообразие мохообразных (как и сосудистых растений) с большим покрытием на данной учетной площадке обусловлено особенностями рельефа – некоторое понижение, где больше и дольше всего застаивается влага, а также формируется более глубокий снежный покров.
На удалении 7 км от комбината “Североникель” в районе еловой техногенной пустоши растительный покров и остатки елового древостоя сильно варьируют в зависимости от положения в рельефе. На выпуклых склонах, где не задерживается влага, напочвенный покров очень разрежен или отсутствует, тогда как в понижениях, в условиях застоя влаги, наблюдается полностью сомкнутый напочвенный покров из сосудистых растений и мохообразных. По сравнению с предыдущими участками (1–5) здесь на всех учетных площадках сосудистые растения участвуют в сложении растительного покрова наряду с мохообразными и лишайниками. Среди лишайников появляются представители естественных ненарушенных лесов из рода Cladonia – вид C. deformis, который отмечен на трех из пяти учетных площадках. Но наиболее массовыми и постоянно встречающимися на всех площадках являются два вида – Placynthiella uliginosa и Trapeliopsis granulosa. Они оба (особенно последний) наиболее активно заселяют в естественных незагрязненных местообитаниях любые нарушенные участки почв с сохранившимся органогенным горизонтом. Лишайник T. granulosa обычно отмечают и среди пионеров восстановления напочвенной биоты после лесных пожаров или иных воздействий, разрушительных для растительного напочвенного покрова (Горшков, Баккал, 2012; Adamska, Deptula, 2015; и др.). Проективное покрытие лишайников на изученных площадках варьирует от 1 до 50%.
Роль криптогамной биоты в сложении растительного покрова на данном участке, по нашим наблюдениям, сильно зависит от условия увлажнения. На более сухих участках преобладают сообщества лишайников (главным образом из T. granulosa). Но в пониженных или умеренно затененных местах с большей увлажненностью преобладают мохообразные, как по числу выявленных видов, так и по проективному покрытию, которое варьирует от 20 до 70% и составляет в среднем около 40% (табл. 3). В такой же зависимости от увлажненности находится разнообразие и обилие сосудистых растений – Betula czerepanovii, B. nana, Empetrum hermaphroditum, Picea obovata, Salix caprea, Vaccinium myrtillus, V. uliginosum. Пример с шестым участком наилучшим образом демонстрирует, что при относительно равном уровне поступления из атмосферы загрязняющих веществ, распределение разнообразия напочвенной биоты и проективного покрытия определяется в значительной мере элементами ландшафта – с большим увлажнением в понижениях или сухих на положительных формах рельефа.
На седьмом участке, расположенном на удалении 10 км от комбината “Североникель” в сосновом редколесье, как и на предыдущем, в напочвенном покрове участвуют все группы биоты – сосудистые растения, мохообразные и лишайники. При этом происходит заметное увеличение видового разнообразия лишайников – здесь встречается уже 10 видов (табл. 3). Но еще более заметно, по сравнению с предыдущими участками, увеличивается проективное покрытие лишайников в напочвенном покрове (хотя на одной из учетных площадок ПП лишайников составляет около 1% в виду обильного покрытия мохообразными). На некоторых учетных площадках доминирующая роль в формировании напочвенного покрова принадлежит почти исключительно лишайникам (на одной из учетных площадок они занимают до 90%). Здесь основу всего напочвенного покрова составляет, как и на шестом участке, пионерный вид Trapeliopsis granulosa. Половина лишайников представлена здесь достаточно обычными в фоновых районах видами из родов Baeomyces, Cetraria, Cladonia, Stereocaulon, которые характерны для напочвенного покрова с умеренным или слабым нарушением. Но в условиях умеренного затенения под пологом соснового леса преобладающая роль в напочвенном покрове принадлежит мохообразным, ПП поторых варьирует от 5 до 90%, в среднем составляя около 50% (табл. 3), и сосудистым растениям – Arctous alpina, Avenella flexuosa, Betula czerepanovii, Calluna vulgaris, Diphasiastrum complanatum, Empetrum hermaphroditum, Ledum palustre, Lycopodium annotinum, Pinus sylvestris, Vaccinium myrtillus, V. vitis-idaea. Лишь мох Bucklandiella microcarpa произрастает на камнях, а не в напочвенном покрове.
ЗАКЛЮЧЕНИЕ
Проведенные исследования позволили выявить ряд закономерностей при естественном восстановлении растительного покрова и характере изменения разнообразия напочвенной биоты на градиенте загрязнения от комбината “Североникель”. В пределах зоны техногенной пустыни на расстоянии до 3 км от источника выбросов обнаружено 6 видов мохообразных и 1 вид лишайника. В зоне техногенной пустоши на удалении 4–6.5 км выявлено уже 15 видов – 10 мохообразных и 5 лишайников. В техногенных редколесьях на расстоянии 7–10 км от источника промышленных выбросов обитает 26 видов – 15 мохообразных и 11 лишайников. Так же существенно изменяется и проективное покрытие криптогамных организмов – от 0–5 до 90%.
Впервые выявлены самые первые из организмов, обладающих наибольшей токситолерантностью, которые обитают на ближайших к источнику загрязнения обследованных участках в пределах до 3 км. Ими оказались мохообразные: печеночники Isopaches bicrenatus, Nardia geoscyphus, Gymnocolea inflata и Solenostoma confertissimum, а также мхи Pohlia nutans и Dicranella cerviculata. Именно эти организмы формируют живой растительный покров на минеральном грунте, создавая тем самым основу для дальнейшего заселения другими организмами, в частности – лишайниками. Все эти виды являются пионерами зарастания при различного рода нарушениях, предпочитая поселяться по обочинам дорог и троп, на пятнах выдувания и т.п.
Лишайники, как и мохообразные, являются пионерными организмами, способными заселять местообитания, неблагоприятные для высших сосудистых растений, – свежие обнажения скальных пород, освободившихся из-подо льда в горах и полярных областях, недавно остывшие лавовые потоки вокруг вулканов. И, как нами показано, они также одними из первых заселяют техногенные пустыни, возникшие под воздействием высоких уровней атмосферного загрязнения. Из лишайников первыми появляются виды, эволюционно приспособленные к обитанию на субстратах, богатых тяжелыми металлами и обладающие наибольшей токсикотолерантностью, – Stereocaulon leucophaeopsis и St. pileatum. Впервые установлено, что для поселения пионерных видов лишайников, даже наиболее токсикотолерантных и приспособленных к высоким концентрациям тяжелых металлов, необходимо формирование своеобразной основы – подстилки, представленной дернинами мохообразных. Учитывая характер и особенности произрастания в зоне техногенной пустоши, еще два вида лишайников – Placynthiella uliginosa и Protothelenella sphinctrinoides – можно считать умеренно токсикотолерантными.
Признаки восстановления напочвенного покрова и заметное увеличение разнообразия наземной криптогамной биоты зафиксированы на удалении 6.5–10 км от источника загрязнения комбината “Североникель”. На таком удалении в сложении напочвенного покрова на учетных площадках принимают участие в общей сложности уже 29 видов мохообразных и лишайников. Максимальное покрытие и обилие наблюдаются в пониженных формах рельефа, где в большем количестве и на долгое время задерживается влага. Тем не менее, полноценное восстановление напочвенного покрова в импактной зоне в пределах до 10 км от источника выбросов, т.е. формирование сообществ, близких к исходному состоянию по видовому составу и уровню разнообразия, еще не произошло. В тоже время мы приходим к заключению, что восстановление мохово-лишайникового яруса может начаться не через ~100 лет после прекращения действия источника аэропромвыбросов, как предполагают некоторые авторы (Ярмишко и др., 2011), а гораздо быстрее, вне зависимости от уровня накопления тяжелых металлов в почве. По нашим наблюдениям оно уже происходит в настоящее время.
Несомненно, выявленное разнообразие криптогамных организмов в зоне влияния сверхвысоких уровней воздушного загрязнения еще не свидетельствует об однонаправленных процессах восстановления напочвенного покрова. Полученные в 2017–2018 гг. данные – лишь первая фиксация пула видов, который существует при действующем уровне загрязнения на изученных ландшафтах. Динамика изменений в числе видов, их обилии и проективном покрытии в связи с намеченным сокращением объемов воздушных промышленных выбросов может быть выявлена только после более продолжительного периода наблюдения.
Список литературы
Андреева Е.Н. Влияние атмосферного загрязнения на моховой покров северо-таежных лесов // Лесные экосистемы и атмосферное загрязнение. Л.: Ботанический институт им. В.Л. Комарова, 1990. С. 159–172.
Андреева Е.Н. Структура мохового покрова в условиях атмосферного загрязнения // Проблемы экологии растительных сообществ. СПб.: Изд-во ООО “ВВМ”, 2005. С. 105–129.
Бязров Л.Г. Лишайники в экологическом мониторинге. М.: Научный мир, 2002. 336 с.
Влияние промышленного атмосферного загрязнения на сосновые леса Кольского полуострова. Л.: Ботанический институт им. В.Л. Комарова, 1990. 195 с.
Ганичева С.Н., Лукина Н.В., Костина В.А., Никонов В.В. Техногенная дигрессия и восстановительная сукцессия в хвойных лесах Кольского полуострова // Лесоведение. 2004. № 3. С. 57–67.
Горшков В.В., Баккал И.Ю. Особенности послепожарной восстановительной динамики сообществ с доминированием лишайников // Изв. Самарского НЦ РАН. 2012. Т. 14. № 1(5). С. 1223–1227.
Исаева Л.Г., Лукина Н.В., Белова Н.В. Опыт восстановления растительности на техногенных пустошах вокруг комбината “Североникель”: методы, сравнительный анализ // Экологические проблемы северных регионов и пути их решения. Матер. III Всерос. науч. конф. с междунар. участием. Апатиты: Изд-во КНЦ РАН, 2010. Ч. 2. С. 28–33.
Исаева Л.Г., Лукина Н.В., Горбачева Т.Т., Белова Е.А. Ремедиация нарушенных территорий в зоне влияния медно-никелевого производства // Цветные металлы. 2011. № 11. С. 66–70.
Лукина Н.В., Никонов В.В. Питательный режим лесов северной тайги: природные и техногенные аспекты. Апатиты: КНЦ РАН, 1998. 316 с.
Лукина Н.В., Никонов В.В. Оптимизация питательного режима почв как фактор восстановления нарушенных лесных экосистем Севера // Лесоведение. 1999. № 2. С. 57–67.
Лукина Н.В., Сухарева Т.А., Исаева Л.Г. Техногенные дигрессии и восстановительные сукцессии в северотаежных лесах. М.: Наука, 2005. 244 с.
Лянгузова И.В., Горшков В.В., Баккал И.Ю., Бондаренко М.С. Воздействие почвенного загрязнения тяжелыми металлами на напочвенный покров сосняка лишайниково-зеленомошного в условиях полевого эксперимента // Вестник Поволжского государственного технологического университета. Серия: Лес. Экология. Природопользование. 2015. № 3(27). С. 74–86.
Михайлова И.Н. Начальные этапы восстановления сообществ эпифитных лишайников после снижения выбросов медеплавильного завода // Экология. 2017. № 4. С. 277–281.
Никонов В.В., Лукина Н.В., Исаева Л.Г., Горбачева Т.Т., Белова Е.А. Восстановление территорий, нарушенных воздушным загрязнением медно-никелевого производства на Кольском полуострове // Инновационный потенциал Кольской науки. Апатиты: Изд-во Кольского НЦ РАН, 2005. С. 288–293.
Проблемы экологии растительных сообществ Севера. СПб.: Изд-во ООО “ВВМ”, 2005. 450 с.
Урбанавичюс Г.П. Список лихенофлоры России. СПб.: Наука, 2010. 194 с.
Черепанов С.К. Сосудистые растения России и сопредельных государств (в пределах бывшего СССР). СПб.: Мир и семья, 1995. 992 с.
Черненькова Т.В., Басова Е.В., Бочарев Ю.Н., Пузаченко М.Ю. Оценка биоразнообразия лесов в зоне влияния горно-металлургического комбината “Североникель” // Лесоведение. 2009. № 6. С. 32–45.
Черненькова Т.В., Кабиров Р.Р., Басова Е.В. Восстановительные сукцессии северотаежных ельников при снижении аэротехногенной нагрузки // Лесоведение. 2011. № 6. С. 49–66.
Ярмишко В.Т., Горшков В.В., Лянгузова И.В., Баккал И.Ю. Экологический мониторинг лесных экосистем Кольского полуострова в условиях аэротехногенного загрязнения // Региональная экология. 2011. № 1–2(31). С. 21–30.
Adamska E., Deptula M. Epigeic lichens of different development stages of forest growing on the heathland // Ecological Questions. 2015. V. 21. P. 39–44.
Beatty C.R., Cox N.A., Kuzee M.E. Biodiversity guidelines for forest landscape restoration opportunities assessments. Gland, Switzerland: Published by IUCN, 2018. 43 p.
Beckett P.J. Lichens: Sensitive Indicators of Improving Air Quality // Restoration and recovery of an industrial region / Ed. J.M. Gunn. New York: Springer, 1995. P. 81–91.
Bell J.N.B. The effect of prolonged low concentration of sulphur dioxide on the growth of two moss species // J. Bryology. 1973. V. 7. P. 444–445.
Gunn J., Keller W., Negusanti J., Potvin R., Beckett P., Winterhalder K. Ecosystem Recovery after Emission Reduction: Sudbury, Canada // Water, Air & Soil Pollution 1995. V. 85. P. 1783–1788.
Ignatov M.S., Afonina O.M., Ignatova E.A., Abolina A., Akatova T.V., Baisheva E.Z., Bardunov L.V., Baryakina E.A., Belkina O.A., Bezgodov A.G., Boychuk M.A., Cherdantseva V.Ya., Czernyadjeva I.V., Doroshina G.Ya., Dyachenko A.P., Fedosov V.E., Goldberg I.L., Ivanova E.I., Jukoniene I., Kannukene L., Kazanovsky S.G., Kharzinov Z.Kh., Kurbatova L.E., Maksimov A.I., Mamatkulov U.K., Manakyan V.A., Maslovsky O.M., Napreenko M.G., Otnyukova T.N., Partyka L.Ya., Pisarenko O.Yu., Popova N.N., Rykovsky G.F., Tubanova D.Ya., Zheleznova G.V., Zolotov V.I. Check-list of mosses of East Europe and North Asia // Arctoa. 2006. V. 15. P. 1–130.
Monitoring with Lichens – Monitoring Lichens / Eds. Nimis P.L., Scheidegger C., Wolseley P.A. Dordrecht; Boston; London: Kluwer Academic Publishers, 2002. 408 p.
Nash III T.H., Nash E.H. Sensitivity of mosses to sulfur dioxide // Oecologia. 1974. Bd. 17. № 3. S. 257–263.
Pressey R.L., Cabeza M., Watts M.E., Cowling R.M., Wilson K.A. Conservation planning in a changing world // Trends in Ecology & Evolution. 2007. V. 22. P. 583–592.
Purvis O.W., Halls C. A review of lichens in metal-enriched environments // Lichenologist. 1996. V. 28. P. 571–601.
Purvis O.W., James P.W. Lichens of the Coniston copper mines // Lichenologist. 1985. V. 17. P. 221–237.
Schram L.J., Wagner C., McMullin R.T., Anand M. Lichen communities along a pollution gradient 40 years after decommissioning of a Cu–Ni smelter // Environmental Science and Pollution Research. 2015. V. 22. № 12. P. 9323–9331.
Söderström L., Hagborg A., von Konrat M., Bartholomew-Began S., Bell D., Briscoe L., Brown E., Cargill D.C., Costa D.P., Crandall-Stotler B.J., Cooper E.D., Dauphin G., Engel J.J., Feldberg K., Glenny D., Gradstein S.R., He X., Heinrichs J., Hentschel J., Ilkiu-Borges A.L., Katagiri T., Konstantinova N.A., Larraín J., Long D.G., Nebel M., Pócs T., Felisa Puche F., Reiner-Drehwald E., Renner M.A.M., Sass-Gyarmati A., Schäfer-Verwimp A., Moragues J.G.S., Stotler R.E., Sukkharak P., Thiers B.M., Uribe J., Váňa J., Villarreal J.C., Wigginton M., Zhang L., Zhu R.-L. World checklist of hornworts and liverworts // PhytoKeys. 2016. V. 59. P. 1–828.
Stapper N.J., Kricke R. Epiphytische Moose und Flechten als Bioindikatoren von städtischer Überwarmung, Standorteutrophierung und verkehrsbedingten Immissionen // Limprichtia. 2004. V. 24. P. 187–208.
Taoda H. Mapping of atmospheric pollution in Tokyo based upon epiphytic bryophytes // Japanese Journal of Ecology. 1972. V. 22. P. 125–133.
Tyler G. Bryophytes and heavy metals: a literature review // Botanical Journal of the Linnean Society. 1990. V. 104. P. 231–253.
Wirth V., Hauck M., Schultz M. Die Flechten Deutschlands. 2 Bände. Stuttgart: Ulmer Eugen, 2013. 1244 s.
Young T.P. Restoration Ecology and Conservation Biology // Biological Conservation. 2000. V. 92. P. 73–83.
Дополнительные материалы отсутствуют.


