Лесоведение, 2022, № 5, стр. 580-592
Разложение опада березы повислой на фоне выщелачивания и засоления в лабораторном эксперименте
Т. В. Нечаева a, *, Н. В. Смирнова a, С. А. Худяев a, И. И. Любечанский b
a Институт почвоведения и агрохимии СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, д. 8/2, Россия
b Институт систематики и экологии животных СО РАН
630091 Новосибирск, ул. Фрунзе, д. 11, Россия
* E-mail: nechaeva@issa-siberia.ru
Поступила в редакцию 15.11.2021
После доработки 25.04.2022
Принята к публикации 07.06.2022
- EDN: DKZPPS
- DOI: 10.31857/S0024114822050035
Аннотация
Среди лесных формаций лесостепной зоны Западной Сибири березняки имеют широкое распространение, и листья березы относятся к интенсивно разлагаемой активной фракции опада, что удобно для постановки краткосрочных лабораторных экспериментов с имитацией различных природных и антропогенных воздействий на окружающую среду. Цель работы – провести сравнительную оценку скорости разложения опада березы с учетом изменения его элементного химического состава на фоне выщелачивания и засоления. Свежеопавшие листья березы повислой (Betula pendula, далее – опад) собраны в октябре 2016 г. из лесополосы в 40 км восточнее г. Новосибирска и высушены. Эксперимент проведен в условиях инкубирования в термостате при 24°С в течение 105 сут. К 2 г воздушно-сухого опада, помещенного в емкости на 100 мл, приливали по 50 мл воды (Н2Одист) либо 0.3–1%-ных растворов солей натрия (NaCl, Na2SO4) или железа (FeCl3, Fe2(SO4)3). После 24‑часового замачивания опада в воде и растворах солей (варианты на фоне выщелачивания и засоления) жидкости сливали и анализировали на содержание ряда химических элементов (ХЭ), а опад подсушивали. В эксперимент также включили вариант без замачивания опада (Контроль). В одну часть емкостей трех вариантов (Контроль, на фоне выщелачивания и засоления) добавили по 5 мл Н2Одист, в другую – по 5 мл почвенной водной суспензии (ПВС). Затем все 150 емкостей с опадом перед инкубированием взвесили. Скорость разложения опада оценивали абсорбционным методом по эмиссии СО2 в динамике за каждый отбор и в сумме за весь период инкубации (кумулятивные потери углерода). В конце эксперимента опад просушили, взвесили и проанализировали на содержание ряда ХЭ. Наибольшую скорость разложения опада установили в варианте Контроль, особенно в первый месяц эксперимента. Замачивание листьев березы в воде привело к изменению элементного химического состава с потерями макро- (K, Na, Са, Mg) и микроэлементов (Zn, Cu, Ni) и снижению скорости разложения опада (в среднем в 1.7 раза). Засоление, с одной стороны, привело к насыщению листьев Na или Fe (в зависимости от соли), с другой – к более интенсивному выщелачиванию ряда других ХЭ (особенно K, Ca, Mg), чем замачивание опада в воде. В этих условиях отмечена тенденция к дальнейшему снижению скорости разложения опада. Ингибирующее влияние на эмиссию СО2 оказали соли железа в самом начале эксперимента, особенно при 1%-ной концентрации. И только в вариантах с солями железа скорость разложения опада с учетом добавления к листьям березы ПВС была выше, чем с водой.
Растительный опад, представляя собой сложно структурированную совокупность органического вещества и зольных элементов, является одним из важнейших блоков биогеохимических циклов наземных экосистем, определяющих эмиссию углекислого газа (СО2), формирование подстилки и поступление биофильных элементов в почву (Базилевич, Титлянова, 2008; Berg, McClaugherty, 2014). Среди множества факторов, управляющих разложением растительных остатков, можно выделить следующие: условия среды (климат, почву, местоположение в рельефе), структуру и химический состав (качество) опада и зоомикробный комплекс почвенных деструкторов (Почикалов, Карелин, 2014; Менько и др., 2018; Zhang et al., 2008; Berg, 2014; Bani et al., 2018). Важным показателем, отражающим процесс преобразования растительных остатков в подстилку и органическое вещество почвы, является скорость разложения опада (Карпачевский, 1981).
Высвобождение части органического вещества и зольных элементов с дальнейшим их выщелачиванием из разлагающихся растительных остатков дождевыми и талыми водами играет большую роль в изменении химизма и пригодности опада для заселения различными группами микроорганизмов и грибов (Чернова, 1977; Буянтуева и др., 2010). В связи с этим изменение элементного химического состава растительных остатков на фоне выщелачивания будет оказывать влияние на скорость разложения опада. Представляет интерес также изучение влияния засоления на жизнедеятельность зоомикробного комплекса почвенных деструкторов и скорость разложения опада, так как геоморфологические и климатические условия лесостепной зоны Западной Сибири, откуда был взят материал для исследования, обусловливают широкое распространение засоленных и солонцовых почв. Сокращение в последние годы пашни и увеличение площади колочно-западинных лесов способствуют ухудшению гидрологического режима данной территории, подъему уровня минерализованных грунтовых вод и развитию процессов вторичного засоления и осолонцевания почв вследствие их переувлажнения (Elizarov et al., 2020). Изучение структуры микробоценоза в почвах разной степени засоления показало, что засоленность не влияет на общий уровень разнообразия микробных популяций (Andronov et al., 2012). В то же время высокие концентрации солей и контрастный режим увлажнения засоленных почв создают специфические условия для жизнедеятельности биоты. Поэтому для выявления воздействия выщелачивания и засоления растительных остатков на состав и активность почвенных деструкторов, скорость разложения опада требуется проведение соответствующих экспериментов в лабораторных и полевых условиях.
Выбор нами минеральных солей натрия и железа для засоления растительных остатков связан с незначительным количеством данных по влиянию недостатка или избытка этих элементов в почвах и растениях на зоомикробный комплекс деструкторов и скорость разложения опада. Например, экспериментально доказано, что недостаток Na в тропических лесах Амазонки замедляет углеродный цикл, а дополнительное внесение NaCl увеличивает скорость разложения опада, а также численность почвенных деструкторов и потребляющих их хищников (Kaspari et al., 2009). Невысокие концентрации ионов потенциально токсичных легкорастворимых солей (до 1 ммоль-экв Na+, Cl– или ${\text{SO}}_{4}^{{2 - }}$ на 100 г почвы) влияют положительно на “здоровье” микробного сообщества, однако высокие концентрации солей (40–400 ммоль-экв/100 г), характерные для солончаков, сводят на нет микробную активность (Котенко, Зубкова, 2008). Низкая доступность почвенного железа для корней растений наблюдается в засушливых и полузасушливых регионах, характеризующихся щелочной реакцией среды и высокими концентрациями бикарбонатов, которые снижают растворимость Fe и уменьшают его поглощение растениями, что может препятствовать выращиванию ряда культур на щелочных почвах (Zuo, Zhang, 2011).
Леса России представлены шестью основными древесными породами (лиственница, ель, сосна, береза, осина, дуб), и это малое разнообразие поддерживает устойчивое развитие биосферы в тысячелетней шкале времени (Пулы и потоки …, 2007). Среди лесных формаций лесостепной зоны Западной Сибири березняки имеют широкое распространение, занимая 62% земель лесного фонда (Штоль, 2016). Листья березы относятся к интенсивно разлагаемой активной фракции опада (Буянтуева и др., 2010; Бобкова, Осипов, 2012), что удобно для постановки краткосрочных лабораторных экспериментов. Поэтому в качестве объекта исследования были выбраны свежеопавшие листья березы.
Цель работы – провести сравнительную оценку скорости разложения опада березы с учетом изменения его элементного химического состава на фоне выщелачивания и засоления в лабораторном инкубационном эксперименте. Для достижения данной цели были поставлены следующие задачи:
1) сравнить скорость разложения опада березы в вариантах Контроль, на фоне выщелачивания и засоления по эмиссии СО2 с пересчетом на углерод (С–СО2) как в динамике по каждому отбору, так и в сумме за весь период инкубации (кумулятивные потери углерода);
2) выявить из рассмотренных в эксперименте 0.3–1%-ных растворов солей натрия (NaCl, Na2SO4) и железа (FeCl3, Fe2(SO4)3) соединения, оказывающие ингибирующее влияние на скорость разложения растительных остатков;
3) сопоставить скорость разложения опада березы во всех вариантах эксперимента (Контроль, на фоне выщелачивания и засоления) с учетом добавления к растительным остаткам воды и почвенной водной суспензии.
Часть результатов по данному эксперименту были опубликованы нами ранее (Смирнова и др., 2017; Нечаева и др., 2020), где более подробно представлено изменение элементного химического состава опада березы, массы и зольности растительных остатков на фоне выщелачивания и засоления.
ОБЪЕКТЫ И МЕТОДИКА
Свежеопавшие листья березы повислой (Betula pendula, далее – опад, растительные остатки) собраны нами в октябре 2016 года из лесополосы с преобладанием березняка в 40 км восточнее г. Новосибирска (лесостепная зона Приобского плато). До начала эксперимента опад был высушен до воздушно-сухого состояния при комнатной температуре (23–25°С).
Для проведения эксперимента к 2 г воздушно-сухого опада березы (цельные листья без измельчения), помещенного в пластиковые емкости на 100 мл, приливали по 50 мл дистиллированной воды (Н2Одист) либо такой же объем растворов солей натрия или железа с концентрацией 0.3, 0.5, 0.7 и 1%. Использовали четыре вида соли: хлорид натрия (NaCl, х. ч.), сульфат натрия (Na2SO4, х. ч.), хлорид железа (III) (FeCl3, ч.), сульфат железа (III) (Fe2(SO4)3, ч. д. а.). Выбор концентрации растворов солей проведен исходя из следующей градации по степени засоления почв: 0.3% – слабая (в пределах 0.2–0.4); 0.5% – средняя (0.4–0.6); 0.7% – сильная (0.6–0.8); 1% – солончак (Классификация ..., 1977). Для каждой соли был свой вариант с замачиванием опада в воде, обозначенный концентрацией “0 (Н2Одист)” (табл. 1).
Емкости с опадом выдерживали 24 ч в воде или 0.3–1%-ных растворах солей (варианты на фоне выщелачивания и засоления), после чего жидкости отдельно сливали, фильтровали и определяли в них содержание ряда химических элементов (ХЭ). Емкости с опадом переворачивали вверх дном на фильтровальную бумагу для подсушивания при комнатной температуре в течение суток. Затем в одну часть емкостей с опадом (в 5 повторностей из 7) добавили по 5 мл почвенной водной суспензии (ПВС) с целью “оживления” микробоценоза, в другую часть (в 2 повторности из 7) – по 5 мл Н2Одист. Для получения ПВС был взят верхний слой (0–20 см) выщелоченного чернозема и приготовлена суспензия при соотношении почва : вода, равном 1 : 2.5. В эксперимент включили еще вариант без замачивания листьев березы в чем-либо (Контроль), где также к опаду добавили по 5 мл ПВС либо Н2Одист (по 5 повторностей). Итого было задействовано 150 емкостей с тремя вариантами подготовки опада березы (Контроль, на фоне выщелачивания и засоления). Для учета потерь массы за время эксперимента все емкости с опадом после добавления к растительным остаткам воды и ПВС взвесили с точностью до 0.01 г.
Для определения скорости разложения опада во все емкости на 100 мл помещали более мелкие емкости на 25 мл, содержащие по 10 мл 0.5 н. NaOH для абсорбции СО2, герметично закрывали и инкубировали в термостате при 24°С. Избыток 0.5 н. NaOH титровали 0.1 н. H2SO4 в присутствии фенолфталеина до перехода малиновой окраски в бесцветную (Шарков, 1985). Таким образом, по измерению содержания углекислого газа, выделяемого в процессе жизнедеятельности микроорганизмов-деструкторов и фиксируемого абсорбционным методом (эмиссия СО2), оценивали скорость разложения опада березы. После каждого измерения эмиссии СО2 в течение эксперимента емкости с опадом оставляли на несколько минут открытыми для проветривания. Скорость разложения опада представили в расчете на воздушно-сухое вещество с пересчетом на углерод (С–СО2, с учетом коэффициента 0.273) как в динамике по каждому отбору (рис. 1–4), так и в сумме за весь период инкубации (105 сут) – кумулятивные потери углерода (см. табл. 1)
Рис. 1.
Скорость разложения опада березы в вариантах Контроль (а) и на фоне выщелачивания (б) с учетом добавления к растительным остаткам воды или почвенной водной суспензии (ПВС). Результаты представлены (здесь и далее на рис. 2–4) в виде среднего арифметического значения (столбики) и стандартного отклонения (вертикальные планки).
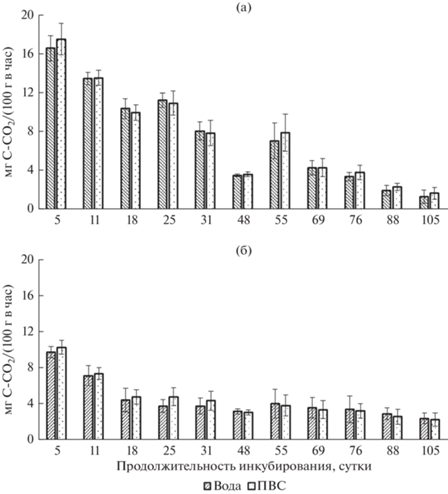
Рис. 2.
Скорость разложения опада березы в вариантах на фоне выщелачивания и засоления в 1%-ном растворе NaCl (а) или Na2SO4 (б) с учетом добавления к растительным остаткам только почвенной водной суспензии.
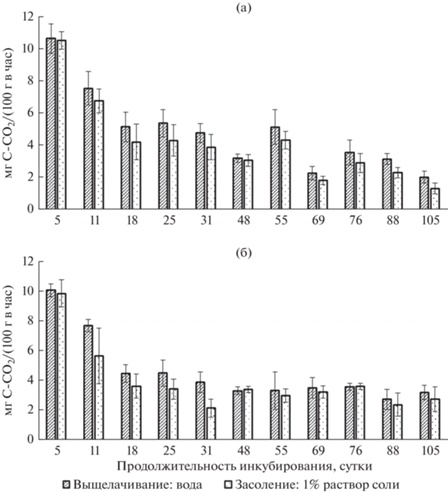
Рис. 3.
Скорость разложения опада березы в вариантах на фоне выщелачивания и засоления в 1%-ном растворе FeCl3 с учетом добавления к растительным остаткам воды (а) или почвенной водной суспензии (б).
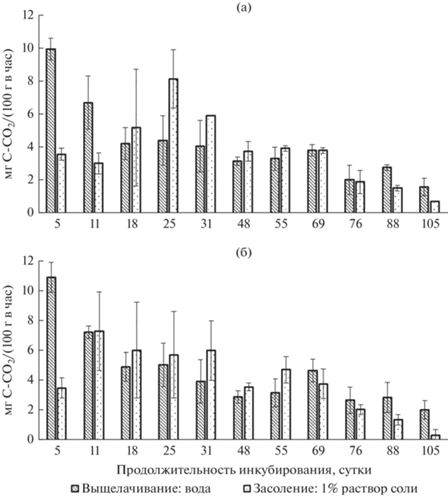
Рис. 4.
Скорость разложения опада березы в вариантах на фоне выщелачивания и засоления в 1%-ном растворе Fe2(SO4)3 с учетом добавления к растительным остаткам воды (а) или почвенной водной суспензии (б).
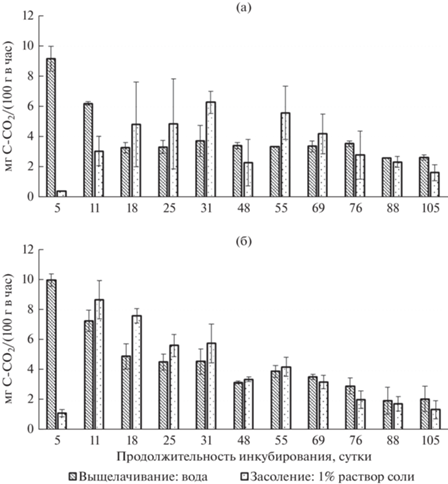
Таблица 1.
*Кумулятивные потери углерода в процессе разложения опада березы
| Концентрация растворов1, % | Кумулятивные потери углерода с добавлением к опаду H2O и ПВС2, мг С-СО2/(100 г в час) | Анализ действия факторов, влияние по Снедекору | ||
|---|---|---|---|---|
| +H2O | +ПВС | НСР по фактору А | выводы | |
| Вариант: NaCl | ||||
| 0 (H2Oдист) | 54.1 ± 0.9* | 53.2 ± 6.2 | Контроль | Различия средних фактора А недостоверны |
| 0.3 | 44.6 ± 0.7 | 52.7 ± 3.5 | 15.25 (1%) 9.20 (5%) |
|
| 0.5 | 52.5 ± 4.5 | 48.3 ± 2.8 | ||
| 0.7 | 44.9 ± 4.9 | 48.0 ± 6.8 | ||
| 1.0 | 41.9 ± 5.3 | 45.5 ± 3.1 | ||
| НСР по фактору В, выводы | Контроль | 9.65 (1%) 5.82 (5%) |
Различия средних фактора В недостоверны | |
| Вариант: Na2SO4 | ||||
| 0 (H2Oдист) | 52.9 ± 11.7 | 51.3 ± 5.1 | Контроль | Различия средних фактора А недостоверны |
| 0.3 | 49.1 ± 6.4 | 48.8 ± 4.4 | 13.37 (1%) 8.07 (5%) |
|
| 0.5 | 51.4 ± 1.7 | 52.2 ± 7.1 | ||
| 0.7 | 49.4 ± 5.0 | 52.4 ± 11.0 | ||
| 1.0 | 52.6 ± 5.0 | 44.7 ± 8.3 | ||
| НСР по фактору В, выводы | Контроль | 8.46 (1%) 5.10 (5%) |
Различия средних фактора В недостоверны | |
| Вариант: FeCl3 | ||||
| 0 (H2Oдист) | 46.3 ± 8.9 | 53.8 ± 6.8 | Контроль | Различия средних фактора А достоверны на уровне 5% |
| 0.3 | 37.5 ± 2.8 | 40.2 ± 4.7 | 9.21 (1%) 5.55 (5%) |
|
| 0.5 | 36.6 ± 4.6 | 44.6 ± 5.6 | ||
| 0.7 | 38.1 ± 4.7 | 45.7 ± 6.6 | ||
| 1.0 | 41.8 ± 5.3 | 44.2 ± 9.1 | ||
| НСР по фактору В, выводы | Контроль | 5.82 (1%) 3.51 (5%) |
Различия средних фактора В достоверны на уровне 5% | |
| Вариант: Fe2(SO4)3 | ||||
| 0 (H2Oдист) | 44.6 ± 1.9 | 49.2 ± 2.2 | Контроль | Различия средних фактора А недостоверны |
| 0.3 | 41.1 ± 3.2 | 41.5 ± 8.0 | 11.76 (1%) 7.09 (5%) |
|
| 0.5 | 35.0 ± 9.9 | 41.9 ± 6.6 | ||
| 0.7 | 41.9 ± 1.1 | 42.0 ± 5.8 | ||
| 1.0 | 38.2 ± 3.7 | 46.1 ± 3.5 | ||
| НСР по фактору В, выводы | Контроль | 7.43 (1%) 4.48 (5%) |
Различия средних фактора В не доказаны на уровне 5% | |
Примечание. * Рассчитаны по эмиссии углекислого газа с пересчетом на углерод (С–СО2), фиксируемого в процессе разложения опада в сумме за 11 отборов в течение эксперимента. ** Представлены среднее арифметическое значение и стандартное отклонение (M ± s). 1 – В эксперименте предусмотрены варианты с замачиванием опада в H2Oдист, 0.3–1% солевых растворах натрия и железа (фактор А). 2 – После замачивания и просушивания к опаду добавлена вода (+H2O) либо почвенная водная суспензия (+ПВС) (фактор В).
Продолжительность эксперимента с инкубированием опада при температуре 24°С составила 105 сут (с 24 мая по 6 сентября 2017 г.). За это время провели 11 отборов по измерению эмиссии СО2, зафиксированных на 5, 11, 18, 25, 31, 48, 55, 69, 76, 88 и 105 сут. В середине эксперимента (на 48 сут инкубирования) были получены низкие значения по эмиссии СО2, вероятно, из-за снижения микробной активности в результате подсушивания опада. Поэтому перед 7 отбором (на 55 сут инкубирования) все емкости с опадом увлажнили Н2Одист до веса, зафиксированного после добавления к листьям березы воды и ПВС во время постановки эксперимента.
По завершении эксперимента опад березы просушили при комнатной температуре и взвесили с точностью до 0.01 г. В воде и растворах солей (до и после замачивания листьев), растительных остатках определили содержание ряда ХЭ, а также рассчитали потери массы и зольность опада, что более подробно рассмотрено нами ранее (Нечаева и др., 2020).
Указывая “на фоне выщелачивания”, мы имеем в виду потери ряда ХЭ из свежеопавших листьев березы после их замачивания в воде, “на фоне засоления” – насыщение листьев натрием или железом после их замачивания в 0.3–1%-ных растворах этих солей с одновременными потерями из растительных остатков ряда других ХЭ.
Статистическую обработку данных выполнили методом многофакторного дисперсионного анализа с расчетом среднего арифметического значения и стандартного отклонения (M ± s), а также наименьшей существенной разницы (НСР) на уровне значимости 1% (α = 0.01, строгий эксперимент) с использованием пакета программ Microsoft Office Excel 2010 и прикладной статистики SNEDECOR V. 5.80 (Сорокин, 2012).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Разложение опада березы в вариантах Контроль и на фоне выщелачивания. Содержание общих углерода и азота в свежеопавших листьях березы составило 51.7 и 1.06% соответственно, соотношение C : N (молярное) – 56.8, зольность – 7.6%. Вышеперечисленные параметры вполне согласуются с литературными данными по химическому составу листьев березы (Буянтуева и др., 2010; Дымов и др., 2012; Иванова и др., 2019; Osipov, 2016).
Максимальная скорость разложения листьев березы в вариантах Контроль и на фоне выщелачивания установлена в первый отбор на 5 сут инкубирования, затем происходило снижение данного параметра с минимальными значениями в последний отбор на 105 сутки (см. рис. 1а, 1б). В варианте Контроль с добавлением к растительным остаткам воды скорость разложения опада за весь период инкубации уменьшилась с 16.7 до 1.4 мг, с добавлением ПВС – с 17.6 до 1.7 мг С–СО2/(100 г в час). На фоне выщелачивания скорость разложения опада была значительно ниже, чем в варианте Контроль, особенно в первый месяц эксперимента (в 1.7–2.9 раза), и уменьшилась за время эксперимента с учетом добавления к опаду воды с 9.9 до 3.9 мг, с ПВС – с 10.4 до 2.4 мг С–СО2/(100 г в час).
Для листьев березы, выдержанных сутки в воде, было также нами ранее установлено снижение потерь массы после 105 сут инкубирования. И если потери массы в варианте Контроль с учетом добавления к опаду воды и ПВС составили в среднем 40.9 и 37.4%, то на фоне выщелачивания – 29.7 и 28.1% соответственно. Это может быть связано с изменением элементного химического состава опада, когда произошло снижение содержания макро- (K, Na, Ca, Mg) и микроэлементов (Zn, Cu, Ni) в результате их освобождения из разлагающихся растительных остатков с дальнейшим выщелачиванием после 24-часового замачивания листьев березы в воде. Больше всего в водной вытяжке увеличилась концентрация K, Ca и Mg, а в самом опаде, наоборот, уменьшилось содержание в первую очередь Na и К, а также Ni, Mg, Zn и Cu (Нечаева и др., 2020). Изменение элементного химического состава растительных остатков, на наш взгляд, может повлиять на жизнедеятельность микроорганизмов-деструкторов за счет избирательного подавления или стимуляции отдельных видов и функциональных групп и, соответственно, на скорость разложения опада. Нельзя также исключить, что в период замачивания листьев березы в воде складываются менее благоприятные условия для аэробных микроорганизмов. Исследования других авторов (Аристовская, 1980; Буянтуева и др., 2010; Иванова и др., 2019; Berg, McClaugherty, 2014) также подтверждают, что потери массы опада на начальных стадиях разложения происходят в основном за счет выщелачивания водорастворимых веществ, и наиболее благоприятные условия для микробиологического разложения создаются при высоком содержании в растительных остатках белка и зольных элементов. Последние, являясь дополнительным источником питания микроорганизмов, способствуют более быстрой трансформации опада.
Скорость разложения опада зависит от доступности влаги и определяемой этим показателем активности почвенных животных и микроорганизмов (Аничкин, Тиунов, 2011; Менько и др., 2018). Об этом свидетельствуют и наши результаты по резкому увеличению скорости разложения опада в варианте Контроль в середине эксперимента (на 55 сут инкубирования) в среднем в 2.1 раза (см. рис. 1а). Это произошло после дополнительного увлажнения емкостей с опадом березы во всех вариантах эксперимента (Контроль, на фоне выщелачивания и засоления) перед седьмым отбором из-за низких значений по эмиссии СО2. Но этот “всплеск” микробной активности в варианте Контроль после дополнительного увлажнения растительных остатков был коротким, и на 69 сут инкубирования (8 отбор) скорость разложения опада была уже на уровне 48 сут инкубирования (6 отбор) и далее продолжала только снижаться. На фоне выщелачивания подобного “всплеска” микробной активности по оценке скорости разложения опада не наблюдали (см. рис. 1б).
Существенных различий в скорости разложения опада между добавлением к листьям березы воды и ПВС не выявлено (см. рис. 1а, 1б). Ранее нами также было установлено отсутствие различий в потере массы с добавлением к опаду воды и ПВС во всех вариантах эксперимента (Контроль, на фоне выщелачивания и засоления). Однако зольность опада с учетом добавления ПВС была выше в 1.1–1.3 раза, что, вероятно, связано с дополнительным привносом ряда ХЭ, содержащихся в ПВС (Нечаева и др., 2020). Другими исследователями (Semenov et al., 2019) отмечено, что при инкубации различных видов растительных остатков с почвой получаются в целом такие же характеристики процесса разложения, что и при смешивании остатков с вермикулитом, инокулированным почвенной суспензией.
Итак, результаты свидетельствуют о снижении скорости разложения опада на фоне выщелачивания (суточное выдерживание листьев березы в воде). В то же время существенных различий по скорости разложения опада между добавлением к листьям березы воды и ПВС не установлено как в варианте Контроль, так и на фоне выщелачивания.
Разложение опада березы на фоне засоления. Мы предположили, что на фоне засоления листья березы должны стать еще менее “привлекательными” для микроорганизмов-деструкторов, чем на фоне выщелачивания из-за изменений в элементном химическом составе опада. В данном случае, с одной стороны, происходит интенсивное насыщение опада натрием или железом (в зависимости от соли), с другой – отмечаются более значительные потери ряда других ХЭ, особенно K, Ca и Mg (Нечаева и др., 2020).
В вариантах с солями натрия (NaCl, Na2SO4) различий в скорости разложения опада с учетом добавления к листьям березы воды и ПВС не установлено. Поэтому рассмотрим более подробно скорость разложения опада только с добавлением ПВС на фоне выщелачивания и засоления с использованием максимальной в эксперименте концентрации соли – 1%-ной (см. рис. 2а, 2б). Результаты указывают на отсутствие существенных различий между вариантами на фоне выщелачивания и засоления. Однако отмечена тенденция к снижению скорости разложения опада на фоне засоления в среднем в 1.2 раза (обе соли). Вероятно, дальнейшее повышение концентрации растворов солей натрия будет оказывать более угнетающее влияние на микробный комплекс деструкторов и скорость разложения опада. Например, в исследовании мицелиальных актинобактерий засоленных почв аридных территорий Украины и России (Grishko et al., 2015) показано, что содержание NaCl в среде неоднозначно влияло на радиальную скорость роста колоний актиномицетов. В строгом статистическом смысле значения радиальных скоростей роста колоний в среде с 0.05 и 2%-ной концентрацией NaCl вообще не различалось с уровнем значимости 0.05. Различия между радиальными скоростями роста колоний при 2 и 5%-ной концентрации соли в среде уже были существенны – отмечено резкое уменьшение данного показателя при 5%-ной концентрации соли. То есть признаки потери резистентности исследователи наблюдали при достижении высокой, условно “критической” концентрации соли.
Ингибирующее действие солей железа (FeCl3, Fe2(SO4)3) на скорость разложения опада установлено в самом начале эксперимента на 5 и 11 сут инкубирования, наиболее сильно оно проявилось при 1%-ной концентрации растворов солей, и выявлены различия между добавлением к листьям березы воды и ПВС. Так, на фоне засоления в 1%‑ном растворе FeCl3 или Fe2(SO4)3 с добавлением воды скорость разложения опада в первые два из одиннадцати отборов была значительно ниже, чем на фоне выщелачивания (см. рис. 3а, 4а). Далее к середине эксперимента (3–7 отборы) скорость разложения опада увеличивалась, достигнув данных на фоне выщелачивания или несколько превысив их. С учетом добавления к листьям березы ПВС наблюдали резкое повышение скорости разложения опада уже ко второму отбору на 11 сут инкубирования (см. рис. 3б, 4б).
Самые низкие значения по скорости разложения опада как с добавлением к растительным остаткам воды, так и ПВС отмечены в первый отбор на 5 сут инкубирования на фоне засоления в 1%-ном растворе Fe2(SO4)3, что соответствует сильной степени засоления почв (см. рис. 4а, 4б).
Таким образом, насыщение листьев березы 0.3–1%-ными растворами солей натрия (NaCl, Na2SO4) и особенно железа (FeCl3, Fe2(SO4)3), а также более интенсивное выщелачивание из растительных остатков ряда других ХЭ на фоне засоления оказывало более угнетающее влияние на жизнедеятельность микроорганизмов-деструкторов и скорость разложения опада, чем суточное выдерживание листьев в воде.
Кумулятивные потери углерода в процессе разложения опада березы. В варианте Контроль с добавлением к опаду воды и ПВС кумулятивные потери углерода не различались и составили 84.3 мг С–СО2/(100 г в час). На фоне выщелачивания и засоления кумулятивные потери углерода были значительно ниже (в среднем в 1.7 и 1.7–2.1 раза, см. табл. 1).
В вариантах с 0.3–1%-ными растворами солей натрия (NaCl, Na2SO4) статистически значимых различий по кумулятивным потерям углерода не установлено как на фоне выщелачивания и засоления, так и с учетом добавления к опаду воды и ПВС. Например, для варианта NaCl кумулятивные потери углерода на фоне выщелачивания и засоления составили в среднем 53.7 и 47.3 мг; для варианта Na2SO4 – 52.1 и 50.1 мг С–СО2/(100 г в час) соответственно. Однако в целом отмечена тенденция к снижению кумулятивных потерь углерода на фоне насыщения листьев березы растворами солей натрия.
В вариантах с 0.3–1%-ными растворами солей железа (FeCl3, Fe2(SO4)3) кумулятивные потери углерода были ниже, чем в вариантах Контроль (в среднем в 2.1 раза) и на фоне выщелачивания (в 1.1–1.2 раза). Например, для варианта FeCl3 кумулятивные потери углерода на фоне выщелачивания и засоления составили в среднем 50.1 и 41.1 мг; для варианта Fe2(SO4)3 – 46.9 и 41.0 мг С–СО2/(100 г в час) соответственно. Насыщение листьев березы солями железа (особенно FeCl3) оказывало более угнетающее воздействие на кумулятивные потери углерода, чем замачивание опада в воде (см. табл. 1). Добавление к растительным остаткам ПВС, по сравнению с водой, способствовало более быстрому выравниванию данных по кумулятивным потерям углерода.
Из всего вышеизложенного можно заключить, что замачивание опада березы в виде свежеопавших листьев в течение суток в воде, 0.3–1%-ных растворах солей натрия и железа приводит уже к значительному изменению элементного химического состава растительных остатков и снижению скорости их разложения. В естественных условиях подобные процессы, на наш взгляд, могут происходить в результате временного переувлажнения лесной подстилки (например, в осенний и весенний холодные периоды года) и на участках с засоленными почвами.
ВЫВОДЫ
1. Наибольшая скорость разложения свежеопавших листьев березы повислой установлена в варианте Контроль (без замачивания опада в чем-либо), особенно в первый месяц эксперимента (на 5–31 сут инкубирования) и значительно снижающаяся со временем. На фоне выщелачивания (суточное выдерживание листьев в воде) изменяется элементный химический состав растительных остатков с потерями макро- (K, Na, Са, Mg) и микроэлементов (Zn, Cu, Ni), снижается скорость разложения опада (в среднем в 1.7 раза).
2. Засоление опада березы (суточное замачивание листьев в 0.3–1%-ных растворах NaCl, Na2SO4, FeCl3, Fe2(SO4)3) приводит, с одной стороны, к насыщению растительных остатков натрием или железом (в зависимости от соли), с другой – к более интенсивному выщелачиванию из растительных остатков ряда других химических элементов (особенно К, Са, Mg) по сравнению с вариантом на фоне выщелачивания. В этих условиях отмечается тенденция к дальнейшему снижению скорости разложения опада. Ингибирующее влияние на скорость разложения опада оказывали соли железа в самом начале эксперимента (на 5–11 сут инкубирования), особенно при 1%-ной концентрации растворов, что соответствует сильной степени засоления почв.
3. В вариантах Контроль, на фоне выщелачивания и насыщения листьев березы солями натрия (NaCl, Na2SO4) не установлено различий в скорости разложения опада между добавлением к растительным остаткам воды и почвенной водной суспензии. На фоне насыщения опада солями железа (FeCl3, Fe2(SO4)3) эмиссия СО2 с добавлением к растительным остаткам почвенной водной суспензии была выше, чем с добавлением воды.
Список литературы
Аничкин А.Е., Тиунов А.В. Динамика поступления и деструкции растительного опада // Структура и функции почвенного населения тропического муссонного леса (национальный парк Кат Тьен, Южный Вьетнам). М.: Товарищество научных изданий КМК, 2011. С. 188–206.
Аристовская Т.В. Микробиология процессов почвообразования. Л.: Наука, 1980. 187 с.
Базилевич Н.И., Титлянова А.А. Биотический круговорот на пяти континентах: азот и зольные элементы в природных наземных экосистемах. Новосибирск: СО РАН, 2008. 381 с.
Бобкова К.С., Осипов А.Ф. Круговорот углерода в системе фитоценоз-почва в чернично-сфагновых сосняках средней тайги Республики Коми // Лесоведение. 2012. № 2. С. 11–18.
Буянтуева Л.Б., Жапова Д.Н., Намсараев Б.Б. Годичная динамика микробной деструкции листового опада в лесных экосистемах пригородной зоны г. Улан-Удэ // Вестник Бурятского государственного университета. Сер. Биология, география. 2010. № 4. С. 85–87.
Дымов А.А., Бобкова К.С., Тужилкина В.В., Ракина Д.А. Растительный опад в коренном ельнике и лиственно-хвойных насаждениях // Известия вузов. Лесной журн. 2012. № 3(327). С. 7–18.
Иванова Е.А., Лукина Н.В., Данилова М.А., Артемкина Н.А., Смирнов В.Э., Ершов В.В., Исаева Л.Г. Влияние аэротехногенного загрязнения на скорость разложения растительных остатков в сосновых лесах на северном пределе распространения // Лесоведение. 2019. № 6. С. 533–546. https://doi.org/10.1134/S0024114819060044
Карпачевский Л.О. Лес и лесные почвы. М.: Лесная промышленность, 1981. 264 с.
Классификация и диагностика почв СССР / Составители: В.В. Егоров, В.М. Фридланд, Е.Н. Иванова, Н.Н. Розова, В.А. Носин, Т.А. Фриев. М.: Колос, 1977. 224 с.
Котенко М.Е., Зубкова Т.А. Влияние засоленных почв на состояние микробного сообщества // Вестник Казанского ГАУ. 2008. Т. 7. № 1. С. 138–141.
Менько Е.В., Тихонова Е.Н., Уланова Р.В., Сухачева М.В., Кузнецова Т.В., Удальцов С.Н., Кравченко И.К. Температурная чувствительность процессов начального этапа микробной деструкции древесного опада в лесной почве // Биофизика. 2018. Т. 63. № 5. С. 963–974. https://doi.org/10.1134/S0006302918050150
Нечаева Т.В., Смирнова Н.В., Худяев С.А., Любечанский И.И. Изменение элементного химического состава опада березы повислой (Betula pendula) при разложении на фоне выщелачивания и засоления в лабораторном эксперименте // Почвы и окружающая среда. 2020. Т. 3. № 4. e130. https://doi.org/10.31251/pos.v3i4.130
Почикалов А.В., Карелин Д.В. Окологодичные наблюдения за разложением опада тундровых растений через потерю массы и эмиссию СО2: роль биотических и абиотических факторов, сезонов года, биотопа и пространственно-временного масштаба // Журн. общей биологии. 2014. Т. 75. № 3. С. 163–181.
Пулы и потоки углерода в наземных экосистемах России / Под ред. Г.А. Заварзина. М.: Наука, 2007. 315 с.
Смирнова Н.В., Тиунов А.В., Нечаева Т.В., Худяев С.А., Крутень В.С., Любечанский И.И. Влияние солей натрия и железа на минерализацию опада березы в инкубационном эксперименте // Почвенные ресурсы Сибири: вызовы XXI в.: Сб. матер. Всерос. науч. конф. с междунар. участием, посвященной 110-летию выдающегося организатора науки и первого директора ИПА СО РАН Р.В. Ковалева, г. Новосибирск, 4–8 декабря 2017 г. Томск: Издательский Дом ТГУ, 2017. Ч. I. С. 254–257.
Сорокин О.Д. Прикладная статистика на компьютере. Новосибирск, 2012. 282 с.
Чернова Н.М. Экологические сукцессии при разложении растительных остатков. М.: Наука, 1977, 200 с.
Шарков И.Н. Абсорбционный метод определения эмиссии СО2. В кн. Методы исследований органического вещества почв. М.: Россельхозакадемия, ГНУ ВНИПТИОУ, 2005. С. 401–408.
Штоль В.А. Особенности вегетативного возобновления березняков лесостепи Западной Сибири // Вестник Тюменского государственного университета. Экология и природопользование. 2016. Т. 2. № 1. С. 92–103. https://doi.org/10.21684/2411-7927-2016-2-1-92-103
Andronov E.E., Pinaev A.G., Pershina E.V., Petrova S.N., Rakhimgalieva S.Z., Akhmedenov K.M., Sergaliev N.K., Gorobets A.V. Analysis of the structure of microbial community in soils with different degrees of salinization using T-RFLP and eal-time PCR techniques // Eurasian Soil Science. 2012. V. 45. № 2. P. 147–156. https://doi.org/10.1134/S1064229312020044
Bani A., Pioli S., Ventura M., Panzacchi P., Borruso L., Tognetti R., Tonon G., Brusetti L. The role of microbial community in the decomposition of leaf litter and Deadwood // Applied Soil Ecology. 2018. V. 126. P. 75–84. https://doi.org/10.1016/j.apsoil.2018.02.017
Berg B. Decomposition patterns for foliar litter: A theory for influencing factors // Soil Biology & Biochemistry. 2014. V. 78. P. 222–232. https://doi.org/10.1016/j.soilbio.2014.08.005
Berg B., McClaugherty C. Plant Litter: Decomposition, Humus Formation, Carbon Sequestration. Third Edition. Berlin, Heidelberg: Springer-Verlag, 2014. 315 p. https://doi.org/10.1007/978-3-642-38821-7
Elizarov N.V., Popov V.V., Semendyaeva N.V. Modern hydromorphism of solonetzes in the forest-steppe zone of Western Siberia // Eurasian Soil Science. 2020. V. 53. № 12. P. 1701–1708. https://doi.org/10.1134/S1064229320120054
Grishko V.N., Syshchikova O.V., Zenova G.M., Kozhevin P.A., Dubrova M.S., Lubsanova D.A., Chernov I.Y. Mycelial actinobacteria in salt-affected soils of arid territories of Ukraine and Russia // Eurasian Soil Science. 2015. V. 48. № 1. P. 72–76. https://doi.org/10.1134/S1064229315010081
Kasparia M., Stephen P., Yanoviakc R.D., May Y., Claya N.A. Sodium shortage as a constraint on the carbon cycle in an inland tropical rainforest // Proceedings of the National Academy of Sciences USA. 2009. V. 106. № 46. P. 19 405–19 409. https://doi.org/10.1073/pnas.0906448106
Osipov A.F. Carbon emission from the soil surface in a mature blueberry pine forest of the middle taiga (Republic of Komi) // Eurasian Soil Science. 2016. V. 49. № 8. P. 926–933. https://doi.org/10.1134/S1064229316080093
Semenov V.M., Pautova N.B., Lebedeva T.N., Khromychkina D.P., Semenova N.A., Lopes de Gerenyu V.O. Plant residues decomposition and formation of active organic matter in the soil of the incubation experiments // Eurasian Soil Science. 2019. V. 52. № 10. P. 1183–1194. https://doi.org/10.1134/S0032180X19100113
Zhang D., Hui D., Luo Y., Zhou G. Rates of litter decomposition in terrestrial ecosystems: global patterns and controlling factors // J. Plant Ecology. 2008. V. 1. P. 85–93. https://doi.org/10.1093/jpe/rtn002
Zuo Y., Zhang F. Soil and crop management strategies to prevent iron deficiency in crops // Plant and Soil. 2011. V. 339. P. 83–95. https://doi.org/10.1007/s11104-010-0566-0
Дополнительные материалы отсутствуют.
Инструменты
Лесоведение


