Мембраны и мембранные технологии, 2022, T. 12, № 1, стр. 38-46
Развитие электроконвекции у волнистой поверхности анионообменной мембраны в растворах хлорида и гидротартрата натрия
О. А. Рыбалкина a, *, И. А. Мороз a, А. Д. Горобченко a, Н. Д. Письменская a, В. В. Никоненко a
a Кубанский государственный университет
Краснодар, ул. Ставропольская, д. 149, Россия
* E-mail: olesia93rus@mail.ru
Поступила в редакцию 04.08.2021
После доработки 20.09.2021
Принята к публикации 08.10.2021
- EDN: AGLEWX
- DOI: 10.1134/S2218117222010060
Аннотация
Проведено сравнение электроконвективных (ЭК) вихревых структур, формирующихся у поверхности анионообменной мембраны АМХ в 0.02 М растворах NaCl и NaHT. Поверхность АМХ волнистая и представляет собой чередующиеся в шахматном порядке выпуклости и впадины. Зоны ЭК перемешивания визуализированы с использованием флуоресцирующего агента родамина. В случае NaCl вихревые ЭК структуры и распределение концентраций рассчитаны с использованием “базовой” модели, основанной на уравнениях Нернста–Планка–Пуассона–Навье–Стокса. Согласно расчету, зона низкой концентрации примерно совпадает в своих границах с крупным вихрем, локализованным вблизи дна впадины. Визуализация показывает, что в случае NaCl ЭК вихри более крупные, а концентрация электролита в них более высокая, чем в случае NaHT при одном и том же отношении тока к своему предельному значению. Причиной является более интенсивная генерация ионов Н+ на границах обедненный раствор/мембрана в результате потери протона частью тартрат-анионов при их входе в мембрану. Генерированные ионы H+ являются дополнительными переносчиками тока; их поток от обедненной поверхности мембраны снижает (по абсолютной величине) плотность объемного электрического заряда у поверхности мембраны, а, следовательно, и интенсивность электроконвекции.
ВВЕДЕНИЕ
Истощение ресурсов и все возрастающая урбанизация населения Земли требуют извлечения ценных нутриентов из сточных вод, пищевых или производственных жидких сред для их коммерческого или повторного использования [1]. Такие вещества, например, катионы аммония и анионы ортофосфорной кислоты, могут быть добыты из коммунальных и животноводческих стоков [2–5]. Еще одним источником ценных веществ (аминокислот, многоосновных карбоновых кислот и протеинов) являются молочная сыворотка [6], сыворотка крови животных [7–9], продукты микробиологической ферментации различных пищевых отходов [10, 11], а также отходы виноделия и производства соков [12]. Эти вещества очищают от органических и минеральных примесей, а также выделяют и концентрируют с помощью “зеленых” экологически целесообразных и ресурсосберегающие технологий, которые, зачастую, являются комбинацией биохимических и мембранных технологий. Электромембранные технологии, и в частности электродиализ (ЭД), все шире применяются для извлечения, разделения и концентрирования перечисленных выше веществ [2–12]. Причиной все возрастающему интересу к применению ЭД в этой сфере является возможность безреагентно управлять pH перерабатываемого раствора благодаря интенсификации или, напротив, подавлению генерации H+, OH– ионов на границах ионообменных мембран (ИОМ), образующих камеры обессоливания мембранных пакетов [9, 13, 14]. Дело в том, что катионы аммония, анионы многоосновных неорганических кислот (угольная, фосфорная и др.) и органических карбоновых кислот (винная, лимонная и др.), а также аминокислоты и протеины являются амфолитами: они вступают в реакции протонирования–депротонирования с водой и друг с другом [15]. Благодаря этим реакциям электрический заряд (а в случае аминокислот и протеинов – даже знак заряда) амфолитов определяется константами их диссоциации и pH среды. В результате можно создать условия, когда в процессе электродиализа одни амфолиты приобретают положительный заряд и переносятся через катионообменную мембрану, другие – отрицательный заряд и переносятся через анионообменную мембрану, а третьи, находящиеся в молекулярной форме, остаются в тракте камеры обессоливания.
Следует, однако, заметить, что реакции протонирования–депротонирования, которые сопровождают перенос амфолитов в электрическом поле, во многом усложняют их поведение по сравнению с сильными электролитами, например, NaCl. Так, при ЭД растворов сильных электролитов генерация H+, (OH–) ионов на границе ИОМ/обедненный раствор осуществляется с участием фиксированных групп и становится заметной только при токах, близких к предельному значению (ilim) и в сверхпредельных токовых режимах [16]. В случае амфолитов генерация протонов и ионов гидроксила анионообменной (АОМ) и катионообменной (КОМ) мембраной соответственно имеет место при любых плотностях тока [17]. Причина этого явления заключается в доннановском исключении из ИОМ H+ или OH– ионов, образовавшихся в результате реакций протонирования–депротонирования амфолита, если эти продукты являются коионами. Этот процесс усиливается с увеличением плотности тока благодаря интенсификации доннановского исключения из ИОМ по мере уменьшения приповерхностной концентрации амфолита в обедненном растворе [18]. При i > ilim он зачастую протекает параллельно с генерацией H+, (OH–) ионов с участием фиксированных групп ИОМ [19, 20].
При описании сверхпредельного переноса амфолитов в мембранных пакетах ЭД многие исследователи (по аналогии с сильными электролитами) обязательно упоминают электроконвекцию (ЭК) как явление, которое не только интенсифицирует сверхпредельный массоперенос [21], но и препятствует осадкообразованию [12]. Вместе с тем, систематические исследования закономерностей развития ЭК в амфолит содержащих растворах, по-видимому, пока не проводились, в то время как применительно к сильным электролитам это явление изучено достаточно всесторонне [22, 23].
Термином “электроконвекция”, как правило, обозначают перенос жидкости, вызванный действием электрической силы на пространственный заряд (в том числе в двойном электрическом слое) [24]. Для рассматриваемых нами систем с ИОМ наиболее характерной является гидродинамически неустойчивая ЭК, которая обусловлена электроосмотическим скольжением области пространственного заряда, формирующейся на границе ион-селективная поверхность/обедненный раствор [25]. Непременным условием возникновения такой ЭК является наличие тангенциальной составляющей электрической силы, росту которой, в частности, способствует увеличение геометрической неоднородности (криволинейности) поверхности ИОМ [26]. По теоретическим оценкам, сделанным И. Рубинштейном [25], 10%-ное искривление ион селективной поверхности может вызвать 30%-ное увеличение массопереноса благодаря развитию ЭК. Экспериментальные исследования, выполненные в растворах NaCl, подтверждают рост массопереноса после увеличения криволинейности благодаря профилированию поверхности ИОМ [27].
Целью данной работы является сравнительный анализ закономерностей развития электроконвекции у волнистой поверхности анионообменной мембраны в растворе, который содержит амфолит (гидротатртат натрия) или сильный электролит (хлорид натрия). Представлены результаты прямой визуализации электроконвективных течений при разных плотностях тока; эти результаты сопоставлены с данными теоретического расчета. Рассмотрено влияние ЭК на динамику формирования зон обедненного раствора у поверхности мембраны.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Мембраны и растворы
Гомогенная анионообменная мембрана Neosepta AMX (Astom, Japan) изготовлена пастовым методом [28] и содержит четвертичные аммониевые группы, а также небольшое количество вторичных и третичных аминов в качестве фиксированных групп. Ее свойства представлены во многих исследованиях, например, в [29]. Важным для данного исследования является тот факт, что AMX имеет волнистую поверхность. Впадины и выпуклости поверхности располагаются в шахматном порядке. Расстояние между верхними точками выпуклостей и нижними точками впадин для набухшей в 0.02 М растворе NaCl мембраны составляет около 30 ± 5 мкм [30], Расстояние между соседними “вершинами” равняется 300 ± 20 мкм [31], т.е. сопоставимо с толщиной обедненного диффузионного слоя, которая по нашим оценкам достигает 207 мкм. Угол смачивания поверхности набухшей мембраны AMX равен 51 ± 2 град. Вся поверхность AMX проводит электрический ток.
Вспомогательной являлась гетерогенная катионообменная мембрана МК-40 (Shchekinoazot, Russia) с сульфонатными фиксированными группами. Обе мембраны предварительно прошли солевую предподготовку в растворах NaCl, а затем уравновешивались с 0.02 М растворами хлорида натрия (pH 5.7 ± 0.1) или гидротартрата натрия (pH 3.7 ± 0.1). Эти же растворы использовались в дальнейших экспериментах. Они были приготовлены из кристаллических солей квалификации ч. д. а. (производитель Вектон, Россия) и дистиллированной воды (электрическое сопротивление 1.0 ± 0.1 мкСм см–1, pH 5.6).
Визуализация электроконвективных вихревых структур и обедненного раствора у поверхности исследуемой мембраны
Для визуализации явлений, вызванных концентрационной поляризацией мембранной системы, использовали экспериментальную установку (рис. 1) и методику, сходную с описанной в работе Kwak и соавт. [32]. Исследуемая анионообменная мембрана AMX (1) образует со вспомогательными катионообменными мембранами МК-40 (2) камеры концентрирования, КК (3) и обессоливания, КО (4). Длина этих камер составляет 5.3 мм, межмембранное расстояние равно 3.2 мм. Капилляры Луггина (7), соединенные с микроемкостями, в которые помещены измерительные Ag/AgCl электроды (8), находятся на расстоянии около 1.5 мм от каждой из поверхностей AMX. Поляризующие электроды (6) ограничивают электродные камеры, КЭ (5). Из емкостей (9) и (10) с помощью шприцевого насоса Dixion Instilar 1428 (12) через все камеры электрохимической ячейки прокачивается раствор исследуемого электролита. Растворы, прокачиваемые через КО и КК, содержат 10 μM Родамина 6G (RG6), диаметр частиц которого равен 16 Å. Линейная скорость прокачиваемых растворов равна 0.07 см с–1 (КО, КК) и 19 см с–1 (КЭ). Буферные емкости (11) предотвращают пульсации раствора, которые могут быть вызваны использованием насоса. Емкость (13) служит для сбора растворов, прошедших через электрохимическую ячейку.
Рис. 1.
Схема экспериментальной установки для параллельного измерения хронопотенциограмм исследуемой мембраны и визуализации вихревых структур у ее поверхностей. Пунктирными линиями обозначены концентрационные профили электролита в камерах обессоливания и концентрирования. Пояснения в тексте.

Плотность тока в мембранной системе задается источником тока Keithley source meter 2400 (14). Скачок потенциала между капиллярами Луггина измеряется вольтметром Keithley multimeter 2010 (15). Для визуализации вихревых структур используется оптический микроскоп с флуоресцентной приставкой (16), соединенный с компьютером (17). При pH, характерных для исследуемых растворов, R6G диссоциирует, образуя анион Cl– и катион R6G+ [33], который флуоресцирует в диапазоне длин волн 540–630 нм. Видеорегистрация концентрации этого иона у отдающей и принимающей поверхностей исследуемой мембраны осуществляется CMOS камерой оптического микроскопа (16) с увеличительным объективом 180X. Обогащенный катионом R6G+ (и катионами Na+) раствор на видеокадрах имеет светло-серый цвет. Обедненный этими катионами раствор имеет черный цвет. Соответственно, зоны обедненного раствора, возмущенные вихревыми структурами, которые формируются у принимающей (анионы) поверхности анионообменной мембраны, окрашены в темные тона. Разрешение цифровой оптической системы позволяет регистрировать объекты диаметром 20 мкм и более.
Перед экспериментами 0.02 М раствор исследуемого электролита прокачивался в течение 20 мин без наложения электрического тока. Затем включался постоянный ток и, параллельно с измерением скачка потенциала между капиллярами Луггина, осуществлялась цифровая видеозапись визуализируемых вихревых структур. Задаваемые токи изменялись от меньшего значения к большему значению. Длительность каждого импульса тока составляла 60 с, чтобы (а) обеспечить достижение системой стационарного состояния и (б) минимизировать возможную адсорбцию RG6 поверхностью AMX. Интервал между измерениями (i = 0) составлял 15 мин.
Теоретическую оценку предельного тока, $i_{{{\text{lim}}}}^{{{\text{theor}}}},$ и толщины диффузионного слоя, δtheor, осуществляли по уравнениям Левека, полученным в рамках конвективно-диффузионной модели [34] для относительно коротких каналов ($L \leqslant {{0.02{{h}^{2}}{{V}_{0}}} \mathord{\left/ {\vphantom {{0.02{{h}^{2}}{{V}_{0}}} D}} \right. \kern-0em} D}$), 1 : 1 электролита и ламинарного гидродинамического режима:
(1)
$i_{{\lim }}^{{{\text{theor}}}} = \frac{{FDC}}{{h({{T}_{1}} - {{t}_{1}})}}\left[ {1.47{{{\left( {\frac{{{{h}^{2}}{{V}_{0}}}}{{LD}}} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}}} \right],$(2)
${{\delta }^{{{\text{theor}}}}} = 0.68h{{\left( {\frac{{LD}}{{{{h}^{2}}{{V}_{0}}}}} \right)}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}}.$Рассчитанные значения $i_{{{\text{lim}}}}^{{{\text{theor}}}}$ и δtheor равны соответственно: 3.39 мА см–2, 231 мкм (NaCl) и 2.21 мА см–2, 207 мкм (NaHT).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Локализация зон обедненного раствора и электроконвективных вихрей
На рис. 2 представлено сечение части канала обессоливания, ограниченного исследуемой анионообменной мембраной AMX. Этот кадр из видео получен в 0.02 М растворе NaCl при ${i \mathord{\left/ {\vphantom {i {i_{{{\text{lim}}}}^{{{\text{theor}}}}}}} \right. \kern-0em} {i_{{{\text{lim}}}}^{{{\text{theor}}}}}}$ = 4.3 через 40 с после включения тока, когда регистрируемый скачок потенциала достигает стационарных значений. Объектив видеокамеры расположен не строго перпендикулярно поверхности AMX (как на рис. 1), а под некоторым углом к ней. Это позволяет увидеть, что затемненные зоны, которые характеризуются более низкой концентрацией катионов Na+, RG6+ и анионов Cl– локализуются во впадинах поверхности. Более светлые зоны, цвет которых лишь незначительно отличается от цвета ядра потока, граничат с вершинами выпуклостей поверхности AMX.
Рис. 2.
Визуализация зоны обессоливания, возмущенной электроконвективными структурами, у поверхности анионообменной мембраны AMX, обращенной в канал обессоливания электродиализной ячейки. Кадр видео получен в 0.02 М растворе NaCl при ${i \mathord{\left/ {\vphantom {i {i_{{{\text{lim}}}}^{{{\text{theor}}}}}}} \right. \kern-0em} {i_{{{\text{lim}}}}^{{{\text{theor}}}}}}$ = 4.3 через 40 с после включения тока. Окуляр видеокамеры расположен под углом 85 град. к поверхности мембраны.

Чтобы более детально рассмотреть это явление и соотнести форму и размеры обедненных электролитом зон с электроконвективными структурами, рассмотрим результаты математического моделирования исследуемой мембранной системы (рис. 4). Расчеты выполнены с использованием так называемой “базовой модели”, которая базируется на двумерных уравнениях Нернста–Планка–Пуассона–Навье–Стокса и учитывает ЭК перенос ионов и объема жидкости [37]. Данная модель успешно применяется для описания сверхпредельного массопереноса в протяженных каналах обессоливания ЭД аппаратов. В нашем случае, мембрана имеет геометрически неоднородную (волнистую) поверхность, характеризующуюся удвоенной амплитудой, А, и длиной волны, B (рис. 3). Рассматривается область раствора между анионообменной мембраной (предполагаемой непроницаемой для катионов) и серединой канала обессоливания. Данная версия модели приближена к реальной системе, и мы полагаем, что она дает возможность качественно адекватно охарактеризовать структуру вихревого движения жидкости у поверхности мембраны, а также оценить вклад ее геометрической неоднородности в сверхпредельный массоперенос. Расчет выполнен для раствора NaCl с входной концентрацией 0.01 моль м–3. Такая низкая концентрация взята для снижения времени счета до приемлемого [38]. Остальные входные параметры расчета брались равными параметрам экспериментальной системы. Численное решение данной задачи было найдено методом конечных элементов с использованием коммерчески доступного программного пакета COMSOL Multiphysics 5.5.
Рис. 4.
Результат математического моделирования распределения концентрации ионов Cl– волнистой поверхности анионообменной мембраны AMX в канале обессоливания электродиализной ячейки. Линии красного цвета соответствуют линиям конвективного потока, направление которого показано черными стрелками. Использованные для расчета параметры мембранной системы представлены в тексте.
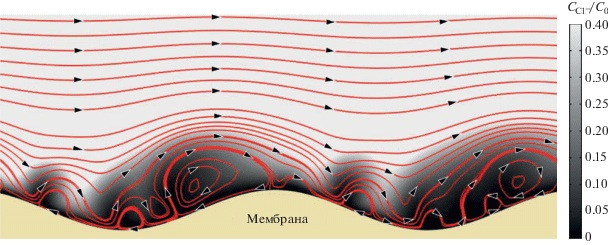
Из проведенных расчетов следует, что толщина обедненного диффузионного слоя (ДС) над впадинами достигает максимума, но является минимальной над вершинами выпуклостей поверхности AMX. Такое распределение толщины ДС обусловливает более быстрое снижение концентрации раствора во впадинах при заданной сверхпредельной плотности тока. В этой зоне формируется область пространственного заряда, на который воздействует тангенциальная составляющая электрического поля. В результате у поверхности AMX образуется достаточно сложная система парных вихрей, которые вращаются в противоположные стороны. В каждой паре вихрей имеется более крупный вихрь; скорость течения жидкости внутри него равна нулю, однако она нарастает по мере удаления от его центра и в конце концов становится равной скорости вынужденной конвекции раствора. Меньший из вихрей вращается в противоположную сторону. Раствор внутри этих вихрей перемешивается достаточно интенсивно, так что концентрацию электролита внутри него приближенно можно считать постоянной [23, 32]. Образовавшиеся кластеры вихрей, которые определяют округлую форму затемненных обессоленных участков раствора, локализуются во впадинах поверхности и образуют периодическую структуру. Огибающее их вынужденное течение жидкости периодически приближается к поверхности AMX над выпуклостями и отдаляется от нее над кластерами вихрей, то есть над впадинами. Соответственно, знак нормальной составляющей вынужденной конвекции меняется по продольной координате. Когда эта составляющая направлена из объема раствора к ИОМ, раствор из ядра потока поступает к поверхности мембраны, где формируются области со сравнительно высокой концентрацией электролита. Напротив, если нормальная составляющая вынужденной конвекции направлена от поверхности к ядру потока, обедненный раствор отводится от ИОМ. Вихревые кластеры почти неподвижны, однако имеются также одиночные вихри, которые движутся под действием вынужденного течения. Такие вихри локализованы на той стороне “склона”, где нормальная составляющая вынужденного течения направлена в сторону поверхности мембраны. Вынужденное течение сносит их по направлению ко дну впадины.
В случае, когда поверхность мембраны плоская и электрически однородная, кластеры ЭК вихрей под воздействием вынужденной конвекции раствора скользят вдоль поверхности мембраны [21, 22, 37]. В частности, именно этим скольжением (чередованием “проплывающих” между измерительными зондами обессоленных и достаточно концентрированных участков приповерхностного раствора) могут быть обусловлены осцилляции скачка потенциала, регистрируемые на вольтамперных характеристиках или хронопотенциограммах исследуемых ионообменных мембран [21, 22]. Кадры из видео (рис. 5), полученные через заданные интервалы времени (0.25 с), позволяют заключить, что в случае волнистой поверхности ИОМ сценарий эволюции вихревых структур в стационарном состоянии мембранной системы отличается от описанного выше, характерного для мембран с гладкой поверхностью. В обоих исследованных электролитах зоны наиболее обессоленного раствора (и, соответственно, области пространственного заряда) формируются вблизи дна впадин рельефа поверхности AMX. ЭК вихри, формирующиеся в этих зонах, выбрасывают обедненный раствор из впадин в ядро потока. Результатом этого в случае NaCl является практически полное периодическое “размывание” зоны обессоленного раствора, на месте которой примерно через 0.7 с образуется новая обедненная зона. Причем форма обессоленного участка приповерхностного раствора полностью повторяет форму предыдущего (не размытого) участка.
Рис. 5.
Эволюция вихревых структур и концентраций электролита у поверхности анионообменной мембраны AMX, визуализированная в 0.02 М растворах NaCl (а) и NaHT (б) в стационарном состоянии мембранной системы при ${i \mathord{\left/ {\vphantom {i {i_{{{\text{lim}}}}^{{{\text{theor}}}}}}} \right. \kern-0em} {i_{{{\text{lim}}}}^{{{\text{theor}}}}}},$ равном 5 (NaCl) и 7 (NaHT). Окуляр видеокамеры расположен перпендикулярно поверхности мембраны. Темной пунктирной линией указана граница зоны возмущенного электроконвекцией приповерхностного раствора. Величина dec характеризует протяженность этой зоны. Она определена как расстояние от поверхности мембраны до внешней границы возмущенной зоны в геометрическом центре пути обессоливания раствора.

Влияние типа электролита на параметры электроконвективных структур
Судя по размеру и более темному цвету визуализированных структур, возникающие в случае NaHT вихри менее крупные, а скорость их вращения меньше по сравнению с вихрями, наблюдаемыми в растворе NаCl. Толщина возмущенного электроконвекцией слоя приповерхностного раствора NaHT оказывается меньше, чем в растворе NaCl несмотря на то, что отношение ${i \mathord{\left/ {\vphantom {i {i_{{{\text{lim}}}}^{{{\text{theor}}}}}}} \right. \kern-0em} {i_{{{\text{lim}}}}^{{{\text{theor}}}}}}$ в случае NaHT (рис. 5б) почти в 1.5 раза превышает соответствующую величину в случае NaCl (рис. 5а).
Рис. 6, на котором приведены результаты визуализации вихревых структур при одинаковых для обоих мембранных систем отношениях ${i \mathord{\left/ {\vphantom {i {i_{{{\text{lim}}}}^{{{\text{theor}}}}}}} \right. \kern-0em} {i_{{{\text{lim}}}}^{{{\text{theor}}}}}},$ дает более полное представление о различиях, наблюдаемых в растворах NaCl и NaHT.
Рис. 6.
Визуализация зон обессоливания, возмущенных электроконвективными структурами, у поверхности анионообменной мембраны AMX. Кадры видео получены в 0.02 М растворах NaCl (а) и NaHT (б) при значениях ${i \mathord{\left/ {\vphantom {i {i_{{{\text{lim}}}}^{{{\text{theor}}}}}}} \right. \kern-0em} {i_{{{\text{lim}}}}^{{{\text{theor}}}}}},$ равных 3 и 6; в обоих случаях снимки получены через 40 с после включения тока. Окуляр видеокамеры расположен перпендикулярно поверхности мембраны.

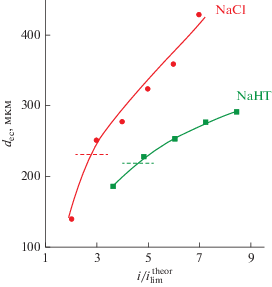
Развитие ЭК в растворе NaCl и других сильных электролитов хорошо изучены [23, 39, 40]. Размеры кластеров ЭК вихрей возрастают с ростом плотности тока (скачка потенциала). Как видно из рис. 7, при одном и том отношении ${i \mathord{\left/ {\vphantom {i {i_{{{\text{lim}}}}^{{{\text{theor}}}}}}} \right. \kern-0em} {i_{{{\text{lim}}}}^{{{\text{theor}}}}}}$ толщина зоны ЭК перемешивания значительно больше в случае раствора NaCl по сравнению с раствором NaHT. Причиной является более интенсивная генерация ионов Н+ на границе АМХ с обедненным раствором. Ионы H+, движущиеся от поверхности АМХ в объем раствора, переносят значительную часть заряда, поэтому для достижения сопоставимых потоков хлоридов и тартратов в случае NaHT величина отношения ${i \mathord{\left/ {\vphantom {i {i_{{{\text{lim}}}}^{{{\text{theor}}}}}}} \right. \kern-0em} {i_{{{\text{lim}}}}^{{{\text{theor}}}}}}$ должна быть гораздо больше. Кроме того, протоны, движущиеся от поверхности в объем раствора, снижают плотность объемного электрического заряда у поверхности мембраны. Вклад продуктов H+/OH– в перенос электрического заряда в системе AMX/раствор NaCl относительно невелик, поэтому генерация протонов не оказывает существенного влияния на интенсивность ЭК. Толщина зоны ЭК вихрей, dec, становится соизмеримой с толщиной диффузионного слоя для каждого электролита примерно при скачке потенциала 1.5 В. В случае NaCl такой скачок потенциала достигается при i = $3i_{{{\text{lim}}}}^{{{\text{theor}}}},$ тогда как в случае NaHT плотность тока должна быть гораздо выше: i = $8.5i_{{{\text{lim}}}}^{{{\text{theor}}}}.$ Значительная скорость генерации ионов H+ при диссоциации НТ− вызывает снижение сопротивления обедненного диффузионного слоя, которое может быть весьма существенным с учетом высокой подвижности ионов H+.
Рис. 7.
Зависимость толщины зоны ЭК перемешивания от отношения ${i \mathord{\left/ {\vphantom {i {i_{{{\text{lim}}}}^{{{\text{theor}}}}}}} \right. \kern-0em} {i_{{{\text{lim}}}}^{{{\text{theor}}}}}}.$ Пунктирные линии обозначают толщину диффузионного слоя, рассчитанную по уравнению (2). Значения dec определены через 40 с после включения электрического тока в геометрическом центре длины обессоливания раствора, как это показано на рис. 5.
ЗАКЛЮЧЕНИЕ
Визуализация вихревых структур в мембранной системе проведена с использованием родамина, окраска которого темнеет при уменьшении его концентрации в растворе. Для теоретической интерпретации результатов визуализации и лучшего понимания структуры вихревых кластеров проведены расчеты распределения концентраций и скоростей течения раствора в канале обессоливания ЭД ячейки с использованием уравнений Нернста–Планка–Пуассона–Навье–Стокса и учетом электроконвекции вблизи волнистой поверхности мембраны. Согласно расчету, зона низкой концентрации, которая идентифицируется на фото как более темная область, примерно совпадает в своих границах с крупным вихрем, локализованным вблизи дна впадины. Визуализация показывает, что при одном и том отношении ${i \mathord{\left/ {\vphantom {i {i_{{{\text{lim}}}}^{{{\text{theor}}}}}}} \right. \kern-0em} {i_{{{\text{lim}}}}^{{{\text{theor}}}}}}$ ЭК вихри более крупные, а концентрация электролита в них более высокая при использовании раствора NaCl по сравнению с раствором NaHT. Причиной является более интенсивная генерация ионов Н+, которая имеет место в результате потери протона частью тартрат-анионов при их входе в мембрану. Ионы H+, движущиеся от поверхности АМХ в объем раствора, переносят значительную часть тока, снижая тем самым выход по току при обессоливании раствора NaHT. Кроме того, протоны снижают (по абсолютной величине) плотность объемного электрического заряда в растворе, знак которого отрицательный. Это вызывает снижение интенсивности электроконвекции по сравнению со случаем раствора NaCl при прочих равных условиях. Вклад ионов H+/OH– в перенос электрического заряда в системе AMX/раствор NaCl относительно невелик, поэтому генерация протонов не оказывает существенного влияния на интенсивность ЭК. Размеры кластеров ЭК вихрей возрастают с ростом скачка потенциала, причем толщина зоны ЭК вихрей становится соизмеримой с толщиной диффузионного слоя уже при 1.5 В. Однако при этом в случае NaCl необходимо пропускать плотность тока i = $3i_{{{\text{lim}}}}^{{{\text{theor}}}},$ тогда как в случае NaHT плотность тока должна быть гораздо выше: i = $8.5i_{{{\text{lim}}}}^{{{\text{theor}}}}.$
БЛАГОДАРНОСТИ
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 20-38-90054.
Список литературы
Przybylski R., Bazinet L., Firdaous L., Kouach M., Goossens J.-F., Dhulster P., Nedjar N. // Food Chem. 2020. V. 304. № 125448.
Shashvatt U., Amurrio F., Portner C., Blaney L. // Chem. Engineer. J. 2021. V. 419. № 129626.
Meesschaert B., Ghyselbrecht K., Monballiu A., Pinoy L. // Environmental Technology and Innovation. 2021. V. 2. № 101 449.
Lee G., Kim K., Chung J., Han J.-I. // Chemosphere. 2021. V. 270. № 128631.
Deng Z., van Linden N., Guillen E., Spanjers H., van Lier J.B. // J. Envir. Manag. 2021. V. 295. № 113096.
Merkel A., Fárová H., Voropaeva D., Yaroslavtsev A., Ahrné L., Yazdi S.R. // Inter. Dairy J. 2021. V. 114. № 104 921.
Abou-Diab M., Thibodeau J., Fliss I., Dhulster P., Nedjar N., Bazinet L. Sep. Purif. Technol. 2021. V. 269. № 118 650.
Abou-Diab M., Thibodeau J., Deracinois B., Flahaut C., Fliss I., Dhulster P., Nedjar N., Bazinet L. // Membranes. 2020. V. 10(10). № 257. P. 1–22.
Castro-Muñoz R., García-Depraect O., León-Becerril E., Cassano A., Conidi C., Fíla V. // J. Chem. Technol. Biotechnol. 2021.
Din N.A.S., Lim S.J., Maskat M.Y., Mutalib S.A., Zaini N.A.M. // Bioresour. Bioprocess. 2021. V. 8(1). № 31.
Mores S., Vandenberghe L.P.D.S., Magalhães Júnior A.I., de Carvalho J.C., de Mello A.F.M., Pandey A., Soccol C.R. // Bioresour. Technol. 2021. V. 320. № 124426.
Bazinet L., Geoffroy T.R. Membranes. 2020. V. 10(9). № 221. P. 1–72.
Kattan Readi O.M., Rolevink E., Nijmeijer K. // J. Chem. Technol. Biotechnol. 2014. V. 89(3). P. 425–435.
Салем Р., Гаффар А., Мунавар А., Али Н., Хуссейни Т., Квайзер А. А. // Электрохимия. 2020. Т. 56. № 7. С. 639–648.
Березин Б.Д., Березин Д.Б. Органическая химия в 2 ч. Часть 1. – 2016.
Заболоцкий В.И., Бугаков В.В., Шарафан М.В., Чермит Р.Х. // Электрохимия. 2012. Т. 48. № 6. С. 721–721.
Rybalkina O., Tsygurina K., Melnikova E., Mareev S., Moroz I., Nikonenko V., Pismenskaya N. // Inter. J. Molec. Sci. 2019. V. 20(14). № 3593.
Гельферих Ф. Иониты. М.: Иностр. литература, 1962. 490 с.
Martí-Calatayud M.C., Evdochenko E., Bär J., García-Gabaldón M., Wessling M., Pérez-Herranz V. // J. Membr. Sci. 2020. V. 595. № 117592.
Pismenskaya N.D., Rybalkina O.A., Kozmai A.E., Tsygurina K.A., Melnikova E.D., Nikonenko V.V. // J. Membr. Sci. 2020. V. 601. № 117920.
Barros K.S., Martí-Calatayud M.C., Scarazzato T., Bernardes A.M., Espinosa D.C.R., Pérez-Herranz V. // Adv. Colloid Interface Sci. 2020.V. 293. № 102439.
Никоненко В.В., Мареев С.А., Письменская Н.Д., Узденова А.М., Коваленко А.В., Уртенов М.Х., Пурсели Ж. // Электрохимия. 2017. Т. 53. № 10. С. 1266–1289.
Mani A., Wang K.M. // Annu. Rev. Fluid Mech. 2020. V. 52. P. 509–529.
Левич В.Г. Физико-химическая гидродинамика. М.: Физматгиз, 1959. 699c.
Rubinstein I., Zaltzman B. // Phys. Rev. E. 2000. V. 62(2). P. 2238.
Andersen M., Wang K., Schiffbauer J., Mani A. // Electrophoresis. 2017. V. 38(5). P. 702–711.
Kotoka F., Merino-Garcia I., Velizarov S. // Membranes. 2020. V. 10. № 8. C. 160.
Hori Y., Nakatani T., Mizutane Y. // J. Electron. Microsc.1986. V. 35. P. 220.
Güler E., van Baak W., Saakes M., Nijmeijer K. // J. Membr. Sci. 2014. V. 455. P. 254–270.
Mareev S.A., Butylskii D.Yu., Pismenskaya N.D., Larchet C., Dammak L., Nikonenko V.V. // J. Membr. Sci. 2018. V. 563. P. 768–776.
Pismenskaya N.D., Pokhidnia E.V., Pourcelly G., Nikonenko V.V. // J. Membr. Sci. 2018. V. 566. P. 54–68.
Kwak R., Guan G., Peng W.K., Han J. // Desalination. 2013. V. 308. P. 138–146.
Magut P.K.S., Das S., Fernandv V.E., Losso J., McDonough K., Naylor B.M., Aggarwal S., Warner I.M. // J. Am. Chem. Soc. 2013. V. 135. P. 15873–15879.
Newman J.S. Electrochemical Systems; Prentice Hall: Englewood Cli s, N.Y., USA, 1973.
Sarapulova V., Nevakshenova E., Pismenskaya N., Dammak L., Nikonenko V. // J. Membr. Sci. 2015. V. 479. P. 28–38.
Lide D.R. CRC Handbook of Chemistry and Physics, CRC Press, N.Y., 1995.
Urtenov M.K., Uzdenova A.M., Kovalenko A.V., Nikonenko V.V., Pismenskaya N.D., Vasil’Eva V.I., Sistat P., Pourcelly G. // J. Memb. Sci. 2013. V. 447. P. 190–202.
Druzgalski C.L., Andersen M.B., Mani A. // Phys. Fluids. 2013. V. 25. P. 4818995.
Bazinet L., Geoffroy T.R. Membranes. 2020. V. 10(9). № 221. P. 1–72.
Kovalenko A.V., Wessling M., Nikonenko V.V., Mareev S.A., Moroz I.A., Evdochenko E., Urtenov M.K. // J. Membr. Sci. 2021. V. 636. P. 119583.
Дополнительные материалы отсутствуют.
Инструменты
Мембраны и мембранные технологии



