Мембраны и мембранные технологии, 2022, T. 12, № 4, стр. 245-253
Мембраны МФ-4СК, модифицированные карбоксилированными углеродными нанотрубками, для потенциометрического определения аланина, валина и фенилаланина в щелочных растворах
А. В. Паршина a, *, Е. Ю. Сафронова b, Т. С. Колганова a, В. А. Кулешова a, О. В. Бобрешова a
a Воронежский государственный университет
394018 Воронеж, Университетская пл., 1, Россия
b Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский просп., 31, Россия
* E-mail: parshina_ann@mail.ru
Поступила в редакцию 22.02.2022
После доработки 30.03.2022
Принята к публикации 08.04.2022
- EDN: ATQZFF
- DOI: 10.31857/S2218117222040071
Аннотация
Получены перфторированные сульфокатионообменные мембраны МФ-4СК, содержащие 0.5–1.0 мас. % углеродных нанотрубок с карбоксильными группами на поверхности. На их основе разработаны мультисенсорные системы для совместного определения аминокислот (суммарной концентрации их анионной и цвиттер-иононной форм) и катионов K+ в водных растворах при рН от 8 до 10 в диапазоне концентраций от 1.0 × 10–4 до 5.0 × 10–2 М. Относительная погрешность определения аланина (5–15%), валина (0.3–10%) и фенилаланина (0.7–5%) соизмерима с таковой для катионов K+ (1.4–11%). Различия в перекрестной чувствительности сенсоров на основе исходной и модифицированных мембран, необходимые для их использования в мультисенсорных системах, достигнуты за счет изменения микроструктуры мембран и появления новых реакционных центров, по разному влияющих на условия необменной сорбции алифатических и ароматической аминокислот.
ВВЕДЕНИЕ
Аминокислоты рассматривают в качестве актуальных аналитов, поскольку они являются нутриентами и маркерами различных заболеваний, а также представляют собой привлекательные модельные объекты для исследования влияния размера и природы радикала органических ионов на характеристики их определения разрабатываемыми методами. Традиционные методы определения аминокислот, такие как ВЭЖХ, спектрофотометрия и электрофорез, имеют ряд ограничений для потокового анализа пищевых, технологических и физиологических сред. Для экспрессного внелабораторного определения аминокислот в пищевой промышленности и клинической диагностике разрабатываются химические сенсоры. Подавляющее число работ в этой области посвящено вольтамперометрическим, амперометрическим [1–5] и оптическим [6–10] сенсорам на основе композиционных материалов, включающих перфторсульфополимеры Nafion, органические кислоты, наночастицы металлов и углеродные материалы. При создании потенциометрических сенсоров для определения аминокислот используют пластифицированные поливинилхлоридные мембраны, содержащие аниообменники на основе тетрафенилбората натрия или фосфорномолибденовой кислоты [11], которые избирательно взаимодействуют с протонированными азотсодержащими соединениями, поэтому не отличаются высокой селективностью к аминокислотам в реальных средах.
Невысокая селективность (перекрестная чувствительность) сенсоров может быть компенсирована объединением их в мультисенсорные системы с применением многомерных математических методов обработки данных. В работах [12, 13] показана возможность определения аминокислот с использованием массивов перекрестно чувствительных сенсоров, аналитическим сигналом которых является потенциал Доннана (ПД), на основе перфторированных сульфокатионообменных мембран Nafion и МФ-4СК. ПД-сенсоры не содержат компонентов, селективно взаимодействующих с аналитами, варьирование чувствительности к ним достигается повышением их сорбции, как по ионообменному, так и по необменному механизмам, а также подавлением сорбции некоторых мешающих ионов. Это может быть достигнуто посредством термообработки мембран при различной относительной влажности и введения наночастиц различной природы [12, 13]. Природа и концентрация допанта выбираются с целью введения в мембрану дополнительных реакционных центров для аналитов, а также повышения проницаемости мембран для них вследствие совокупного действия электростатических, осмотических и упругих сил, обусловленного присутствием наночастиц в порах и/или матрице мембраны. В работе [13] показана возможность существенного увеличения чувствительности и точности определения гидрофобных аминокислот аланина (Ala), валина (Val) и фенилаланина (Phe) в катионной форме посредством модификации мембран МФ-4СК углеродными нанотрубками (УНТ), предварительно обработанными окислителем для функционализации поверхности карбоксильными группами (УНТ-COO–). Такая модификация способствует поступлению в мембраны ионов аминокислот, в том числе за счет сродства к ним УНТ. Хорошие сорбционные свойства УНТ по отношению к аминокислотам описаны в ряде работ, посвященных иммобилизации аминокислот, пептидов и белков на поверхности УНТ с целью создания материалов для биосенсоров или адресной доставки биомолекул в организм [14–16]. Стоит отметить, что функционализация поверхности допантов часто приводит к существенному улучшению свойств ионообменных мембран, в частности, их селективности [17, 18]. На основании этого в данной работе исследованы мембраны МФ-4СК, содержащие наночастицы УНТ-COO–, для повышения чувствительности ПД-сенсоров к аминокислотам аланина, валина и фенилаланина в анионной и цвиттер-ионной формах в щелочных водных растворах.
Целью работы явилась разработка мультисенсорных систем с ПД-сенсорами на основе мембран МФ-4СК, модифицированных наночастицами УНТ-COO–, для определения анионов и цвиттер-ионов аланина, валина и фенилаланина совместно с катионами калия в щелочных водных растворах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования. Для приготовления градуировочных растворов использовали сухие вещества аланин (2-аминопропановая кислота; ≥99%; Sigma-Aldrich, США), валин (2-амино-3-метил бутановая кислота; ≥99%; Sigma-Aldrich, США), фенилаланин (2-амино-3-фенилпропановая кислота; ≥99%; Sigma-Aldrich, США), гидроксид калия (ООО “Экохим”, Россия; стандарт-титр) и деионизованную воду (сопротивление 18.2 МОм, рН 5.41 ± 0.05). Концентрации аминокислоты и щелочи варьировали в различном соотношении в диапазоне от 1.0 × 10–4 до 5.0 × 10–2 М. Значения рН растворов Ala + KOH, Val + KOH, Phe + KOH варьировались в диапазонах 8.19–9.97, 7.96–9.97 и 8.09–10.00, соответственно. В водных растворах в исследуемых диапазонах рН аминокислоты присутствуют преимущественно в форме цвиттер-ионов и частично в форме однозарядных анионов.
Получены мембраны МФ-4СК с однородным и градиентным распределением (по площади образца) нанотрубок УНТ-COO–. Однородно модифицированные образцы использовали для исследования равновесных и транспортных свойств, градиентно модифицированные – для организации ПД-сенсоров. В качестве образцов сравнения были также изготовлены немодифицированные мембраны. Исходными материалами служили 10% раствор перфторсульфополимера МФ-4СК в литиевой форме в диметилформамиде (эквивалентная масса ЭМ = 1100; ОАО “Пластполимер”, Россия) и многостенные УНТ Таунит S12 (внешний диаметр 20–40 нм, внутренний диаметр 5–10 нм, длина до 10 мкм, полученные каталитическим пиролизом-CVD углеводородов на Ni/Mg катализаторе; ООО “НаноТехЦентр”, Россия).
Модификация поверхности УНТ карбоксильными группами достигалась в результате очистки коммерческих образцов от остатков катализатора, использованного при синтезе. Для этого готовили их суспензию в растворе, содержащем 30% HNO3, в соотношении по массе 1 : 8, выдерживали в течение 1 ч при 90°С при постоянном перемешивании, затем промывали большим количеством воды до нейтрального pH и сушили на воздухе при 90°С в течение 24 ч.
Мембраны МФ-4СК, содержащие 0.5 и 1.0 мас. % УНТ-COO–, были получены отливкой из раствора полимера, смешанного с навеской предварительно подготовленных наночастиц допанта. Полученную смесь (объемом 25 мл) подвергали обработке с помощью заполненной водой ультразвуковой (УЗ) ванны RK-100 (частота 35 кГц, мощность 4.0 Вт; Bandelin electronic, Германия) в течение 45 мин, не допуская нагревания раствора полимера выше 50°С. Для получения однородно модифицированных образцов полученную взвесь из раствора полимера и допанта выливали на стеклянную поверхность. Для получения градиентно модифицированных образцов в прямоугольную стеклянную ячейку (4 × 10 см) одновременно выливали с одной стороны раствор полимера МФ-4СК без допанта и без УЗ обработки (немодифицированная сторона), а с другой – раствор полимера после УЗ обработки, содержащий допант (модифицированная сторона). Полученные пленки имели два участка равной длины, один из которых содержал допант, при этом граница между модифицированной и немодифицированной частями была несколько размыта (ширина переходной области не превышала 0.5 см). Наличие переходной области не вносило погрешность в отклик ПД-сенсора, т.к. в процессе измерения концы мембраны, имеющей длину 6–8 см, погружались в исследуемый раствор и раствор сравнения только на 0.3–0.5 см. При этом с раствором сравнения контактировал конец немодифицированной части, отсутствие допанта в которой, обеспечивало близость составов раствора сравнения и внутрипорового раствора, нивелируя межфазный скачок на соответствующей границе. Немодифицированные мембраны были получены из раствора полимера без УЗ обработки. Для удаления растворителя образцы сушили в следующем режиме: 60°С – 4 ч, 80°С – 12 ч, затем при 110°С в вакуумном шкафу 4 ч. Полученные пленки аккуратно снимали со стеклянной поверхности и подвергали горячему прессованию под давлением 5 МПа при температуре 110°С в течение 3 мин для обеспечения лучшей прочности.
Для приведения к стандартным условиям все полученные образцы мембран кондиционировали по методике, описанной в работе [13], а затем переводили в K+-форму. Для этого их выдерживали в 2 М растворе KCl в течение 72 ч с последующей промывкой в деионизованной воде. Аналогичным образом осуществляли “регенерацию” мембран после длительного использования (до 3 мес.). Высокое сродство сульфокатионообменников к катионам K+ обеспечивало быструю и полную “регенерацию” образцов после контакта с многокомпонентными исследуемыми растворами. Между сериями повторных измерений (~100) мембраны сначала выдерживали в 0.1 М растворе KCl в течение 30 мин при постоянном перемешивании, затем помещали на хранение в деионизованную воду.
Методы исследования. Влагосодержание мембран определяли с помощью установки дифференциально-термического и термогравиметрического анализа “Thermoscan-2” (ООО “Аналитприбор”, Россия). Исследовали влагосодержание образцов в K+-форме после длительного контакта с водой, а также после их контакта в течение 48 ч с 0.1 М растворами аминокислот. Образцы предварительно нагревали в кварцевой кювете от 25 до 105°С со скоростью 5 град/мин. После этого их выдерживали в эксикаторе над насыщенным раствором Na2HPO4 (относительная влажность 95%) в течение 12 ч для сорбции воды, взвешивали для определения массы в набухшем состоянии (m", г), а затем нагревали до 105°С и взвешивали для определения массы в сухом состоянии (m, г). Влагосодержание (W, мас. %) мембран определяли по формуле:
Оценку отклика ПД-сенсоров выполняли с помощью многосекционной ячейки, описанной в [12]. Мембраны модифицированным концом контактировали с исследуемым раствором, а немодифицированным концом – с раствором сравнения (1 М KCl). Близость состава раствора сравнения и внутреннего раствора мембраны нивелировало потенциал Доннана на соответствующей границе. Расстояние между раствором сравнения и исследуемым раствором соответствовало длине мембраны, что устраняло трансмембранный перенос в процессе измерения отклика и минимизировало диффузионный потенциал. С помощью многоканального потенциометра и набора хлоридсеребряных электродов ЭСр-10103 (ООО “Эконикс-эксперт”, Россия) измеряли напряжение нескольких цепей вида (2).
Технологические растворы при получении аминокислот содержат катионы K+ и продукты диссоциации воды. Аналитами для систем ПД-сенсоров выступают катионы K+ и аминокислоты в анионной и цвиттер-ионной формах. Для получения градуировочных зависимостей устанавливали значения отклика ПД-сенсоров в растворах с заданными концентрациями аналитов, а значения рН контролировали с помощью стеклянного электрода ЭС-10301/4 (ООО “Эконикс-эксперт”, Россия). Зависимость отклика ПД-сенсоров (∆φD, мВ) от отрицательного логарифма концентрации катионов K+ (рK), суммарной концентрации анионов и цвиттер-ионов аминокислот (pA) и рН имела линейный вид (3) в диапазоне концентраций аналитов 1.0 × 10–4–5.0 × 10–2 М. Разность между экспериментальными значениями откликов и значениями откликов, предсказываемыми по градуировочным уравнениям, составляла 3–5 мВ.
(3)
$\Delta {{\varphi }_{D}} = {{b}_{0}} + {{b}_{1}}{\text{pK}} + {{b}_{2}}{\text{pH}} + {{b}_{3}}{\text{pA}},$Дисперсию воспроизводимости (мВ2) отклика ПД-сенсора рассчитывали как среднее значение дисперсии отклика для матрицы градуировочных растворов. Для оценки времени установления отклика ПД-сенсоров и его дрейфа регистрировали хронопотенциометрические зависимости в растворах с эквимолярным содержанием аминокислот и KOH в течение 1 ч. Время, начиная с которого изменение значений отклика не превышало их разброс при дублировании эксперимента, считали временем установления отклика. Изменение значения отклика в единицу времени (мВ/ч) после установления квазиравновесия считали дрейфом отклика.
В массивы объединяли пары ПД-сенсоров с наименьшей корреляцией между откликами. Концентрацию катионов K+ и суммарную концентрацию анионной и цвиттер-ионной форм аминокислоты в исследуемых растворах рассчитывали, решая систему из двух градуировочных уравнений с учетом экспериментальных значений отклика ПД-сенсоров и рН растворов. Для оценки правильности определения аналитов рассчитывали относительную погрешность (δ, %) как относительное отличие установленных и теоретических значений концентраций. Для оценки воспроизводимости определения аналитов рассчитывали относительное стандартное отклонение (sr, %).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
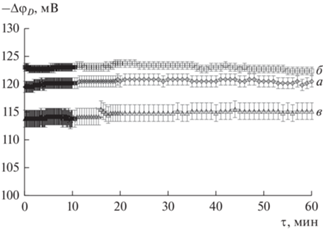
Зависимости отклика ПД-сенсора от времени имели сходный вид для всех исследуемых систем. В качестве примера представлено изменение отклика ПД-сенсора на основе мембраны МФ-4СК/1.0 мас. % УНТ-COO– в течение часа контакта с растворами, содержащими 5.0 × 10–3 М аминокислот и KОН (рис. 1). Время установления отклика ПД-сенсоров на основе исходной и модифицированных мембран не превышало 1 мин, а дрейф был незначим. Значения дисперсии воспроизводимости отклика составили 10–26 мВ2.
Рис. 1.
Зависимость отклика ПД-сенсора в растворах Ala + KOH (а), Val + KOH (б), Phe + KOH (в) от времени.
Для всех исследуемых образцов наблюдалась высокая чувствительность ПД-сенсоров к катионам K+ (57.1–77.8 мВ/рс, рис. 2) и существенно более низкая чувствительность к цвиттер-ионам и анионам аминокислот (7.2–24.1 мВ/рс, рис. 2), что обусловлено катионообменной природой мембраны МФ-4СК. Причиной значимого влияния концентрации аминокислот на отклик ПД-сенсоров на основе катионообменных мембран является смещение равновесия их ионных форм в сторону образования цвиттер-ионов в фазе мембраны вследствие доннановского исключения анионов гидроксила, обусловливающего снижение рН внутрипорового раствора на ~2 единицы по сравнению с рН внешнего раствора [19]. Положительно заряженная аминогруппа в структуре аминокислот способна к электростатическому взаимодействию и образованию водородных связей с сульфогруппами мембраны. Кроме того, не исключено формирование водородных связей между карбоксильными группами аминокислоты и гидратными оболочками противоионов, участвующих в формировании двойного электрического слоя с фиксированными группами мембраны. Различие рН внешнего и внутрипорового раствора, а также протекание реакций протонирования/депротонирования в исследуемых системах приводит к значимой чувствительности ПД-сенсоров к продуктам диссоциации воды (11.4–20.4 мВ/рН, рис. 2). Для анализа щелочных растворов влияние рН на отклик ПД-сенсора не является такой существенной проблемой, как для анализа растворов при рН ≤ 7, и может быть учтено при определении ключевых компонентов посредством контроля рН объекта анализа и введения соответствующего слагаемого (b2pH) в градуировочные уравнения.
Рис. 2.
Зависимость коэффициентов чувствительности ПД-сенсоров к ионам в растворах Ala + KOH (а), Val + KOH (б), Phe + KOH (в) от концентрации УНТ-COO– в мембране МФ-4СК.
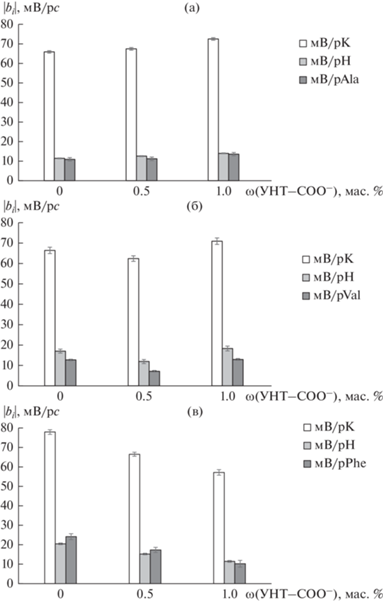
Значения чувствительности ПД-сенсора на основе немодифицированной мембраны МФ-4СК, как к катионам K+, так и к ионам аминокислот возрастают с увеличением размера и гидрофобности аминокислот в ряду Ala < Val < Phe (рис. 2). Введение в мембрану наночастиц УНТ-COO– и увеличение их концентрации приводит к некоторому росту чувствительности ПД-сенсоров к ионам K+ и Ala± в растворах Ala + KOH (рис. 2а), немонотонному изменению чувствительности к ионам K+ и Val± в растворах Val + KOH (рис. 2б) и существенному снижению чувствительности ПД‑сенсоров к ионам K+ и Phe± в растворах Phe + + KOH (рис. 2в).
Причинами различий в поведении ПД-сенсоров с разными материалами и аналитами могут быть изменения микроструктуры мембран в результате модификации и влияние сорбции органических аналитов.
Введение небольших количеств (0.5–1.0 мас. %) УНТ-COO– приводит к некоторому увеличению по сравнению с исходным образцом влагосодержания (от 16.9 до 17.4 мас. %), ионной проводимости (от 1.12 × 10–2 до 1.61 × 10–2 Ом–1 см–1 при 30°С) и диффузионной проницаемости мембран (от 1.8 × 10–8 до 2.5 × 10–8 см2/с для 0.1 М раствора KCl) [13]. Значения приведены для мембран в K+‑форме в контакте с водой. Одной из причин изменения свойств мембран является предварительная УЗ обработка раствора полимера и допанта перед отливкой модифицированных образцов, которая уменьшает степень агломерации и среднюю молекулярную массу макромолекул перфторсульфополимера (в результате отрыва боковых цепочек полимера) и увеличивает подвижность отдельных звеньев. Результатом является формирование более развитой микроструктуры и разветвленной системы пор и каналов мембран [20], а их ИОЕ несколько снижается (до 0.97–0.98 ммоль/г по сравнению с 1.00 ммоль/г для немодифицированной мембраны, полученной из раствора полимера без УЗ обработки). Ввиду своей природы наночастицы УНТ преимущественно располагаются в гидрофобной фазе. В то же время наличие на поверхности допанта функциональных групп, заряженных одноименно с фиксированными группами мембраны, способствует частичному расположению допанта в гидрофильных порах и некоторому их расширению [21].
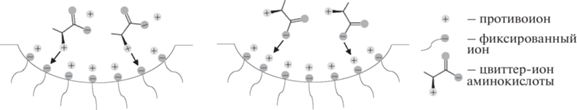
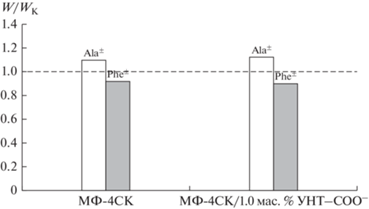
Образцы МФ-4СК и МФ-4СК/1.0 мас. % УНТ-COO–, приведенные в равновесие с растворами гидрофобной алифатической аминокислоты Ala±, имеют более высокое влагосодержание, чем те же образцы в K+-форме, а влагосодержание мембран, приведенных в равновесие с растворами гидрофобной ароматической аминокислоты Phe±, снижается (рис. 3). Видимо, цвиттер-ионы алифатической аминокислоты встраиваются в двойной электрический слой, сформированный сульфогруппами мембраны и катионами K+, что приводит к удалению друг от друга фиксированных групп и расширению пор (рис. 4). Теория ограниченной эластичности стенок пор перфтормембран [22], позволяет предположить, что сорбция аминокислот на поверхности допанта также может способствовать расширению пор. Вследствие этого доступность сульфогрупп мембраны повышается, как для катионов K+, так и для цвиттер-ионов аминокислоты, обеспечивая рост чувствительности ПД-сенсоров к ним с ростом концентрации допанта. Сорбция цвиттер-ионов ароматической аминокислоты способствует вытеснению воды из пор мембраны (рис. 3). Это, с одной стороны, повышает их концентрацию в мембране, обеспечивая более высокую чувствительность к ним, чем к алифатическим аминокислотам при использовании немодифицированного образца. С другой стороны, присутствие объемных цветтр-ионов фенилаланина в мембране и их закрепление на поверхности допанта может приводить к блокировке пор. Вследствие этого при введении и увеличении концентрации наночастиц УНТ-COO– наблюдается существенное снижение чувствительности ПД-сенсоров к ионам K+ и Phe± в растворах Phe + KOH.
Рис. 3.
Отношение значений влагосодержания мембран, приведенных в равновесие с растворами Ala± и Phe±, (W, %) и влагосодержания мембран в K+-форме (WK, %).
Таким образом, введение частиц УНТ-COO– в мембрану может оказывать, как положительное, так и отрицательное влияние на чувствительность ПД-сенсоров к анионам и цвиттер-ионам аминокислот в зависимости от их природы. В то же время для организации мультисенсорной системы принципиально важным является различное распределение чувствительности к аналитам разного типа (катионам K+ и ионным формам аминокислот), которое обусловливает необходимое для их совместного определения снижение корреляции между откликами ПД-сенсоров. Поскольку модификация мембран обеспечила отличную от исходных значений (для немодифицированного образца) перекрестную чувствительность ПД-сенсоров к ионам в растворах Ala + KOH, Val + KOH, Phe + KOH, это позволило сформировать массивы ПД-сенсоров для совместного определения ионов аминокислот и K+ в водных растворах в диапазоне концентраций от 1.0 × 10–4 до 5.0 × 10–2 М при рН от 8 до 10. Для определения ионов Ala–, Ala±, Phe–, Phe± и K+ были выбраны ПД-сенсоры на основе мембран МФ-4СК и МФ-4СК/1.0 мас. % УНТ-COO–, а для определения Val–, Val±, K+ – МФ-4СК/ 0.5 мас. % УНТ-COO– и МФ-4СК/1.0 мас. % УНТ-COO– (табл. 1–3). Относительная погрешность определения анионов и цвиттер-ионов аланина (5–15%), валина (0.3–10%) и фенилаланина (0.7–5%) в исследуемых растворах с помощью выбранных образцов мембран соизмерима с таковой для катионов K+ (1.4–11%).
Таблица 1.
Результаты определения ионов Ala±, Ala–, K+ с помощью массива ПД-сенсоров на основе мембран МФ-4СК и МФ-4СК/1.0 мас. % УНТ-COO–
| рН | стеор, М | сэксп, М | δ, % | sr, % | ||||
|---|---|---|---|---|---|---|---|---|
| K+ | Ala–, Ala± | K+ | Ala–, Ala± | K+ | Ala–, Ala± | K+ | Ala–, Ala± | |
| 8.42 ± 0.05 | 1.0 × 10–4 | 5.0 × 10–4 | (1.1 ± 0.3) × 10–4 | (5.7 ± 1.2) × 10–4 | 7 | 15 | 24 | 19 |
| 9.65 ± 0.02 | 5.0 × 10–4 | 1.0 × 10–3 | (4.43 ± 0.10) × 10–4 | (0.96 ± 0.13) × 10–3 | 11 | 5 | 2 | 12 |
| 9.67 ± 0.04 | 5.0 × 10–4 | 5.0 × 10–3 | (4.8 ± 0.4) × 10–4 | (5.3 ± 1.0) × 10–3 | 4 | 7 | 7 | 16 |
| 8.54 ± 0.02 | 5.0 × 10–4 | 1.0 × 10–2 | (4.5 ± 0.5) × 10–4 | (0.86 ± 0.10) × 10–2 | 11 | 14 | 10 | 10 |
| 8.90 ± 0.02 | 1.0 × 10–3 | 1.0 × 10–2 | (0.98 ± 0.10) × 10–3 | (0.9 ± 0.3) × 10–2 | 3 | 13 | 9 | 26 |
| 9.28 ± 0.02 | 1.0 × 10–2 | 5.0 × 10–2 | (0.95 ± 0.05) × 10–2 | (4.8 ± 0.7) × 10–2 | 5 | 5 | 4 | 13 |
Таблица 2.
Результаты определения ионов Val±, Val–, K+ с помощью массива ПД-сенсоров на основе мембран МФ-4СК и МФ-4СК/0.5 мас. % УНТ-COO–
| рН | стеор, М | сэксп, М | δ, % | sr, % | ||||
|---|---|---|---|---|---|---|---|---|
| K+ | Val–, Val± | K+ | Val–, Val± | K+ | Val–, Val± | K+ | Val–, Val± | |
| 8.33 ± 0.10 | 1.0 × 10–4 | 5.0 × 10–4 | (0.99 ± 0.02) × 10–4 | (4.5 ± 0.6) × 10–4 | 1.4 | 10 | 2 | 11 |
| 9.60 ± 0.04 | 5.0 × 10–4 | 1.0 × 10–3 | (4.9 ± 0.3) × 10–4 | (1.04 ± 0.14) × 10–3 | 2 | 4 | 5 | 12 |
| 8.93 ± 0.02 | 1.0 × 10–3 | 1.0 × 10–2 | (0.93 ± 0.08) × 10–3 | (1.00 ± 0.11) × 10–2 | 7 | 0.4 | 7 | 10 |
| 9.92 ± 0.02 | 5.0 × 10–3 | 1.0 × 10–2 | (5.55 ± 0.03) × 10–3 | (0.96 ± 0.04) × 10–2 | 11 | 5 | 0.5 | 4 |
| 9.04 ± 0.02 | 5.0 × 10–3 | 5.0 × 10–2 | (4.8 ± 0.3) × 10–3 | (5.1 ± 0.6) × 10–2 | 3 | 1.3 | 6 | 11 |
| 9.38 ± 0.02 | 1.0 × 10–2 | 5.0 × 10–2 | (0.98 ± 0.07) × 10–2 | (5.0 ± 0.6) × 10–2 | 2 | 0.3 | 6 | 10 |
Таблица 3.
Результаты определения ионов Phe±, Phe–, K+ с помощью массива ПД-сенсоров на основе мембран МФ-4СК и МФ-4СК/1.0 мас. % УНТ-COO–
| рН | стеор, М | сэксп, М | δ, % | sr, % | ||||
|---|---|---|---|---|---|---|---|---|
| K+ | Phe–, Phe± | K+ | Phe–, Phe± | K+ | Phe–, Phe± | K+ | Phe–, Phe± | |
| 8.95 ± 0.10 | 1.0 × 10–4 | 1.0 × 10–4 | (0.90 ± 0.06) × 10–4 | (0.99 ± 0.09) × 10–4 | 10 | 0.7 | 6 | 8 |
| 9.24 ± 0.06 | 5.0 × 10–4 | 1.0 × 10–3 | (4.6 ± 0.5) × 10–4 | (0.95 ± 0.09) × 10–3 | 7 | 5 | 10 | 9 |
| 10.00 ± 0.02 | 1.0 × 10–3 | 1.0 × 10–3 | (1.07 ± 0.05) × 10–3 | (0.95 ± 0.08) × 10–3 | 7 | 5 | 4 | 7 |
| 8.64 ± 0.04 | 1.0 × 10–3 | 1.0 × 10–2 | (0.96 ± 0.05) × 10–3 | (1.03 ± 0.12) × 10–2 | 4 | 3 | 5 | 10 |
| 8.53 ± 0.04 | 5.0 × 10–3 | 5.0 × 10–2 | (5.07 ± 0.08) × 10–3 | (5.0 ± 0.2) × 10–2 | 1.4 | 0.9 | 1.5 | 4 |
| 8.92 ± 0.03 | 1.0 × 10–2 | 5.0 × 10–2 | (0.97 ± 0.04) × 10–2 | (4.8 ± 0.4) × 10–2 | 3 | 5 | 3 | 8 |
ЗАКЛЮЧЕНИЕ
Методом отливки получены перфторированные сульфокатионообменные мембраны МФ-4СК, содержащие углеродные нанотрубки, поверхностно модифицированные карбоксильными группами. Установлены характеристики перекрестно чувствительных ПД-сенсоров на основе полученных мембран, а также исходного образца в растворах, содержащих щелочь и гидрофобные аминокислоты аланин, валин и фенилаланин в анионной и цвиттер-ионной формах в диапазоне концентраций от 1.0 × 10–4 до 5.0 × 10–2 М. Выявлено различное влияние присутствия и концентрации наночастиц УНТ-COO– в мембране на чувствительность ПД-сенсоров к ионам алифатических и ароматической аминокислот. Причинами являются изменение микроструктуры мембран в результате модификации и появление новых реакционных центров, изменяющие условия необменной сорбции органических частиц разного размера. В зависимости от природы аминокислот их сорбция оказывает противоположное действие на влагосодержание мембран. Для совместного определения анионов, цвиттер-ионов аминокислот и катионов K+ разработаны мультисенсорные системы на основе исходной мембраны МФ-4СК и мембраны, содержащей 0.5 или 1.0 мас. % наночастиц УНТ-COO–. Достигнуты соизмеримые характеристики определения ионных форм аминокислот и катионов K+ в исследуемых растворах. Предложенный способ не требует коррекции рН объекта анализа в диапазоне значений от 8 до 10.
Исследование выполнено при финансовой поддержке гранта Президента Российской Федерации, грант № МД-5732.2021.1.3 (The work was supported by the grant of the President of the Russian Federation, grant number MD-5732.2021.1.3).
Список литературы
Tajik S., Dourandish Z., Jahani P.M., Sheikhshoaie I., Beitollahi H., Asl M.S., Jang H.W., Shokouhimehr M. // RSC Adv. 2021. V. 11. № 10. P. 5411. https://doi.org/10.1039/D0RA07614G
Зильберг Р.А., Майстренко В.Н., Кабирова Л.Р., Гуськов В.Ю., Хамитов Э.М., Дубровский Д.И. // Журн. аналит. химии. 2020. Т. 75. № 1. С. 80. (Zil’berg R.A., Maistrenko V.N., Kabirova L.R., Gus’kov V.Y., Khamitov E.M., Dubrovskii D.I. // J. Anal. Chem. 2020. V. 75. № 1. P. 101.) https://doi.org/10.1134/S1061934820010189
Fooladi E., Razavizadeh B.M., Noori M., Kakooei S. // SN Appl. Sci. 2020. V. 2. P. 527. https://doi.org/10.1007/s42452-020-2332-0
Шелковников В.В., Алтыев А.М., Виноградов М.Е. // Журн. аналит. химии. 2019. Т. 74. № 12. С. 934. (Shelkovnikov V.V., Altyev A.M., Vinogradov M.E. // J. Anal. Chem. 2019. V. 74. № 12. P. 1239.) https://doi.org/10.1134/S1061934819120116
Yusoff N., Rameshkumar P., Huang N.M. // Microchim. Acta. 2018. V. 185. P. 246. https://doi.org/10.1007/s00604-018-2782-x
Chen X., Ji J., Wang D., Gou S., Xue Z., Zhao L., Feng S. // Microchem. J. 2021. V. 160. P. 105661. https://doi.org/10.1016/j.microc.2020.105661
Chauhan P., Saini J., Chaudhary S., Bhasin K.K. // Mater. Res. Bull. 2021. V. 134. P. 111113. https://doi.org/10.1016/j.materresbull.2020.111113
Thanzeel F.Y., Zandi L.S., Wolf C. // Org. Biomol. Chem. 2020. V. 18. № 42. P. 8629. https://doi.org/10.1039/D0OB01798A
Khan S.A., Choudhury R., Majumdar M., Misra T.K. // Spectrochim. Acta A Mol. Biomol. Spectrosc. 2020. V. 234. P. 118240. https://doi.org/10.1016/j.saa.2020.118240
Copur F., Bekar N., Zor E., Alpaydin S., Bingol H. // Sens. Actuators B Chem. 2019. V. 279. P. 305. https://doi.org/10.1016/j.snb.2018.10.026
Чернова Р.К., Варыгина О.В., Захаревич А.М. // Изв. Сарат. ун-та. Нов. сер. Сер. Химия. Биология. Экология. 2019. Т. 19. № 3. С. 268. (Chernova R.K., Varygina O.V., Zakharevich A.M. // Izv. Saratov Univ. (N. S.), Ser. Chemistry. Biology. Ecology. 2019. V. 19. № 3. P. 268 (in Russian).) https://doi.org/10.18500/1816-9775-2019-19-3-268-273
Parshina A., Kolganova T., Safronova E., Osipov A., Lapshina E., Yelnikova A., Bobreshova O., Yaroslavtsev A. // Membranes. 2019. V. 9. № 11. P. 142. https://doi.org/10.3390/membranes9110142
Паршина А.В., Титова Т.С., Евдокимова Д.Д., Бобрешова О.В., Сафронова Е.Ю., Прихно И.А., Ярославцев А.Б. // Мембраны и мембранные технологии. 2019. Т. 9. № 4. С. 256. (Parshina A.V., Titova T.S., Evdokimova D.D., Bobreshova O.V., Safronova E.Y., Prikhno I.A., Yaroslavtsev A.B. // Membranes and Membrane Technologies. 2019. V. 1. № 4. P. 220.) https://doi.org/10.1134/S2517751619040073
Oliveira S.F., Bisker G., Bakh N.A., Gibbs S.L., Landry M.P., Strano M.S. // Carbon. 2015. V. 95. P. 767. https://doi.org/10.1016/j.carbon.2015.08.076
Zardini H.Z., Amiri A., Shanbedi M., Maghrebi M., Baniadam M. // Colloids Surf. B. 2012. V. 92. P. 196. https://doi.org/10.1016/j.colsurfb.2011.11.045
Piao L., Liu Q., Li Y. // J. Phys. Chem. C. 2012. V. 116. № 2. P. 1724. https://doi.org/10.1021/jp2085318
Lysova A.A., Stenina I.A., Volkov A.O., Ponomarev I.I., Yaroslavtsev A.B. // Solid State Ion. 2019. V. 329. P. 25. https://doi.org/10.1016/j.ssi.2018.11.012
Yaroslavtsev A.B., Stenina I.A., Golubenko D.V. // Pure Appl. Chem. 2020. V. 92. № 7. P. 1147. https://doi.org/10.1515/pac-2019-1208
Сарапулова В.В., Клевцова А.В., Письменская Н.Д. // Мембраны и мембранные технологии. 2020. Т. 10. № 4. С. 281. (Sarapulova V.V., Klevtsova A.V., Pismenskaya N.D. // Membranes and Membrane Technologies. 2020. V. 2. № 4. P. 272.) https://doi.org/10.1134/S2517751620040101
Safronova E.Yu., Pourcelly G., Yaroslavtsev A.B. // Polym. Degrad. Stab. 2020. V. 178. P. 109229. https://doi.org/10.1016/j.polymdegradstab.2020.109229
Prikhno I.A., Safronova E.Yu., Yaroslavtsev A.B. // Int. J. Hydrog. Energy. 2016. V. 41. № 34. P. 15585. https://doi.org/10.1016/j.ijhydene.2016.04.100
Ярославцев А.Б., Караванова Ю.А., Сафронова Е.Ю. // Мембраны и мембранные технологии. 2011. Т. 1. № 1. С. 3. (Yaroslavtsev A.B., Karavanova Y.A., Safronova E.Y. // Pet. Chem. 2011. V. 51. № 7. P. 473. )https://doi.org/10.1134/S0965544111070140
Дополнительные материалы отсутствуют.
Инструменты
Мембраны и мембранные технологии