Микробиология, 2019, T. 88, № 1, стр. 32-44
Использование данных морфологии и молекулярной систематики для идентификации зеленых микроводорослей рода Chlorococcum и некоторых близкородственных таксонов
А. Д. Темралеева a, *, С. В. Москаленко a
a Институт физико-химических и биологических проблем почвоведения РАН
142290 Пущино, Россия
* E-mail: temraleeva.anna@gmail.com
Поступила в редакцию 25.06.2018
После доработки 28.08.2018
Принята к публикации 02.10.2018
Аннотация
Подтверждена полифилия трех родов зеленых микроводорослей – Chlorococcum, Deasonia и Neospongiococcum. Часть видов рода Chlorococcum вместе с типовым видом C. infusionum вошли в состав макроклады Moewusinia и образовали истинную кладу Chlorococcum. Ее представители отличались сверхдлинными ITS2 с необычной вторичной структурой. Остальные являются членами макроклады Stephanosphaerinia и должны быть переименованы. В результате наблюдений за аутентичными штаммами уточнены и дополнены морфологические диагнозы N. gelatinosum, C. diplobionticum, C. isabeliense и C. sphacosum. Предложения по номенклатурным изменениям даны на основании морфологического сходства, уровня замен в гене 18S рРНК, наличия компенсаторных замен в консервативных регионах ITS2, различий во вторичной структуре спейсера и в консервативном мотиве III шпильки.
Род Chlorococcum был впервые описан еще в XIX в. (Meneghini, 1842) и с тех пор неоднократно изменял свой объем (Коршиков, 1953; Silva, Starr, 1953; Trainor, Bold, 1954; Starr, 1955; Deason, Bold, 1960; Chantanachat, Bold, 1962; Bold, Parker, 1962; Trainor, Verses, 1967; McLean, 1968; Brown, Mc-Lean, 1969; McGuire, 1969; Archibald, Bold, 1970; Archibald, 1979; Metting, 1980; Ettl, Gärtner, 1987; Archibald, 1988; Chihara et al., 1994). Род характеризовался следующими морфологическими признаками: вегетативные клетки одиночные или во временных скоплениях, эллипсоидной и шаровидной формы, клеточная стенка гладкая, пристенный хлоропласт с отверстием или без него, пиреноид один или несколько, клетки одноядерные или многоядерные непосредственно перед размножением зооспорами, апланоспорами или изогаметами, зооспоры неметаболичные, не меняют форму при движении и не округляются после остановки (Chlamydomonas-тип), с двумя жгутиками равной длины (Андреева, 1998). По данным AlgaeBase род включает в себя 89 видов (Guiry, Guiry, 2018), описанных из пресноводных, морских и наземно-воздушных местообитаний (Андреева, 1998; Костiков и соавт., 2001; Canter-Lund, Lund, 1995; John, Tsarenko, 2002; Shubert, 2003).
Использование молекулярно-генетических методов позволило обнаружить полифилию рода и обосновало необходимость его ревизии (Nakayama et al., 1996; Klochkova et al., 2006; Kawasaki et al., 2015). Согласно последним номенклатурным изменениям по данным 18S рРНК-анализа (Watanabe, Lewis, 2017), истинные представители рода – типовой вид C. infusionum, C. costatozygotum, C. echinozygotum, C. hypnosporum – вошли в кладу Chlorococcum. Также в род Chlorococcum была перенесена часть видов родов Neospongiococcum и Tetracystis – N. macropyrenoidosum, N. vacuolatum, T. aeria и T. polymorpha, переименованные в C. macropyrenoidosum, C. vacuolatum, C. aerium и C. polymorphum соответственно. C. dorsiventrale и C. littorale образовали новый род Alvikia. Обе перечисленные клады находятся внутри макроклады Moewusinia. Виды C. oloefaciens, C. elkhartiense, C. minutum и C. ellipsoideum принадлежат макрокладе Stephanosphaerinia и образуют другой род. Следует отметить, что исследование S. Watanabe и L. Lewis (2017) было сфокусировано на 18S рРНК-филогении только 12 видов рода Chlorococcum, другие виды и филогенетические маркеры не были охвачены.
В данной работе впервые для представителей полифилетичного рода Chlorococcum были одновременно исследованы морфологические характеристики 19 штаммов, проведен 18S рРНК-анализ и оценена вторичная структура спейсера ITS2.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Изоляция и культивирование штаммов водорослей. Объектами данного исследования стали аутентичные штаммы рода Chlorococcum и некоторые близкородственные таксоны зеленых микроводорослей (Chlorophyceae, Chlorophyta), полученные из Коллекции культур водорослей Киевского национального университета им. Т. Шевченко (Algae Culture Collection of Kyiv University, ACKU) и депонированные нами в Альгологическую коллекцию Института физико-химических и биологических проблем почвоведения РАН (Algal Collection of Soil Science Institute, ACSSI): Chlorococcum citriforme ACSSI 200, C. costatozygotum ACSSI 201, C. diplobionticum ACSSI 202, C. echinozygotum ACS-SI 203, C. hypnosporum ACSSI 205, C. isabeliense ACSSI 207, C. oleofaciens ACSSI 208, C. sphacosum ACSSI 209, Neospongiococcum gelatinosum ACSSI 217. Кроме того, дополнительно был изучен дикий штамм Deasonia granata ACSSI 152, изолированный к. б. н. Ю.М. Бачура (Гомельский государственный университет им. Ф. Скорины). Культивирование штаммов проводили на среде BG11 с азотом (1% агар; pH 7.0) в климатостате при температуре 23–25°С, световом потоке 60–75 мкмоль фотонов м–2 с–1 и фотопериоде 12 ч (Темралеева и соавт., 2014).
Микроскопия. Морфологию и жизненные циклы штаммов изучали методами световой микроскопии (светлое поле и интерференционный контраст) с помощью микроскопов Leica DM750 и Carl Zeiss Axio Scope A1 (Германия) в ЦКП И-ФХиБПП РАН. Результаты наблюдений документированы рабочими рисунками и фотографиями, снятыми с помощью цветных цифровых камер ”Видеозавр“ (Россия) и Carl Zeiss MRc 5 (Германия). Сроки наблюдения составляли от 2 недель до 6 месяцев. При морфологической идентификации штаммов зеленых микроводорослей учитывали тип организации таллома, наличие и толщину слизистых оболочек, количество и тип хлоропластов, наличие и структуру пиреноида, форму и размеры клеток, способы размножения и другие характеристики. Названия таксонов приведены согласно Международной электронной базе данных AlgaeBase (Guiry, Guiry, 2018).
Выделение, амплификация, очистка и секвенирование ДНК. Суммарную ДНК выделяли с помощью колоночного набора DNeasy Plant Mini Kit (“Qiagen”, США) и набора на магнитных частицах ФитоСорб (“Синтол”, Россия), следуя протоколам производителей. Для амплификации использовали готовую смесь для ПЦР Screen Mix-HS (“Евроген”, Россия). Праймеры для амплификации гена 18S рРНК и спейсера ITS2 были использованы из статей Katana et al. (2001) и White et al. (1990) соответственно, условия при необходимости были оптимизированы (табл. 1). Детекцию целевых ПЦР-продуктов проводили электрофоретически в 1%-ном агарозном геле. Для дальнейшей очистки ампликонов из геля применяли набор Cleanup Mini (“Евроген”, Россия). Секвенирование нуклеотидных последовательностей осуществляли на базе ЗАО ”Синтол“ (Россия).
Таблица 1.
Праймеры и условия амплификации гена 18S рРНК и спейсера ITS2
| Локус | Праймер | Последовательность (5'–3') | Условия амплификации |
|---|---|---|---|
| 18S рРНК | F | AACCTGGTTGATCCTGCCAGT | 95°C – 5 мин; 95°C – 1 мин, 55°C – 1 мин, 72°C – 2 мин, 25 циклов; 72°C – 5 мин |
| R | TGATCCTTCTGCAGGTTCACCTACG | ||
| ITS2 | ITS3 | GCATCGATGAAGAACGCAGC | 95°C – 3 мин; 95°C – 30 с, 57.6°C* – 30 с, 72°C – 1 мин*, 35 циклов*; 72°C – 10 мин |
| ITS4 | TCCTCCGCTTATTGATATGC |
Молекулярно-филогенетический анализ. Для филогенетического анализа гена 18S рРНК и спейсера ITS2 штаммов зеленых водорослей был выполнен поиск гомологии нуклеотидных последовательностей по алгоритму BLASTn в GenBank (https://blast.ncbi.nlm.nih.gov), составлены наборы из собственных и депонированных в генетические базы данных последовательностей, имеющих максимальную гомологию, длину прочтения и принадлежащих типовым видам и коллекционным аутентичных штаммам (табл. 2). В программе BioEdit по алгоритму ClustalW было выполнено множественное выравнивание (Hall, 1999). Для выбора модели нуклеотидных замен использовали программу jModelTest (Darriba et al., 2012), ориентируясь на наименьший индекс AIC. Реконструкцию филогенетических взаимосвязей осуществляли с помощью метода максимального правдоподобия (ML) в программе PhyML. В качестве внешней группы выбрали представителя класса Trebouxiophyceae – Chlorella vulgaris (Chlorophyta). Статистическая поддержка топологии дерева была оценена с помощью бутстреп-анализа (1000 повторностей) и указана в узлах ветвей в виде процентов. Генетические различия между нуклеотидными последовательностями охарактеризовали с помощью генетических дистанций. Мерой генетических различий являлся процент несовпадений нуклеотидов при попарном сравнении выровненных последовательностей, вычисление которого проводили в программе MEGA 6.0 (Tamura et al., 2013).
Таблица 2.
Список штаммов зеленых микроводорослей, использованных в филогенетическом анализе
| Вид | Авторское название штамма | Коллекционный штамм | Идентификационный номер GenBank | Местообитание | |
|---|---|---|---|---|---|
| 18S рРНК | ITS2 | ||||
| Chlamydopodium starrii | – | SAG 16.87* | AB983625 | AB983644 | Почва, Южная Африка |
| Chlorococcum aquaticum | 64/88 | UTEX 2222* | AB983622 | KX147374 | Озеро, Куба |
| Chlorococcum chlorococcoides | – | NIES-155 | AB936287 | – | Почва, Япония |
| Chlorococcum citriforme | E6B | ACSSI 200* (SAG 62.80) | MG491514 | MG582214 | Почва торфяников, США |
| Chlorococcum costatozygotum | T 51 | ACSSI 201* (SAG 20.95) | MG491515 | – | Почва соснового леса, Италия |
| Chlorococcum diplobionticum | – | ACSSI 202* (SAG 32.95) | MG491512 | MG582213 | Почва кукурузного поля, Ямайка |
| Chlorococcum echinozygotum | – | ACSSI 203* (SAG 213-5) | MG491509 | – | Почва, Филлипины |
| Chlorococcum elkhartiense | 15T3A | UTEX 1772* | AB936286 | – | Почва торфяного болота, Индия |
| Chlorococcum ellipsoideum | T-1-3 | UTEX 972* | U70586 | – | Песчаная почва, США |
| Chlorococcum hypnosporum | F35-1 | ACSSI 205* (SAG 213-6) | MG491508 | – | Почва, США |
| Chlorococcum infusionum (T) | А 91 | SAG 10.86 | AB936281 | – | Пресные воды, терр. бывш. Чехословакии |
| Chlorococcum isabeliense | P. I. 92 | ACSSI 207* (SAG 65.80) | MG491510 | MG582211 | Прибрежный песок, США |
| Chlorococcum microstigmatum | 18T2A | UTEX 1777* | AB983616 | KX147360 | Торфяное болото, США |
| Chlorococcum minutum | W7-2 | SAG 213-7* (UTEX 117) | KR607490 | KX147343 | Почва, Индия |
| Chlorococcum nivale | – | UTEX 2225* | AB983623 | AB983641 | Снег, горы Высокие Татры, Словакия |
| Chlorococcum oleofaciens | FRT-2 | ACSSI 208* (SAG 213-11) | MG491516 | MG582215 | Почва с поля, США |
| Chlorococcum polymorphum | – | UTEX 1242 | AB936279 | – | – |
| Chlorococcum rugosum | P.I.7-3 | UTEX 1785* | AB983621 | AB983639 | Прибрежный песок, США |
| Chlorococcum sphacosum | W1D2 | ACSSI 209* (UTEX 1787; SAG 66.80) | MG491513 | KX147369 | Почва сфагнового болота, США |
| Chlorococcum vacuolatum | – | SAG 213-8* | KF144189 | KX147342 | Почва, Южная Африка |
| Chlorosarcinopsis minor (T) | – | UTEX 949* | AB049415 | – | – |
| Deasonia granata | – | ACSSI 152 | MG491517 | MG582216 | Почва, Беларусь |
| Deasonia granata | – | SAG 213-1* | KM020105 | – | Почва, Чехия |
| Deasonia multinucleata | – | SAG 25.95* | KM020098 | – | Садовая почва, Япония |
| Deasonia prolifera (T) | – | UTEX 1846* | AB936280 | – | Почва с хлопкового поля, США |
| Macrochloris radiosa | – | SAG 213-2a* | KM020104 | – | Почва, терр. бывш. Чехословакии |
| Macrochloris rubrioleum | – | CCCryo 340b-08* | AB983624 | AB983643 | Аэрофит, Шпицберген, Норвегия |
| Neospongiococcum alabamense (T) | – | UTEX 960 | AB972426 | – | – |
| Neospongiococcum gelatinosum | 15 K1A | ACSSI 217* (SAG 64.80) | MG491511 | MG582212 | Торфяное болото, США |
| Neospongiococcum macropyrenoidosum | – | UTEX 1839* | AB936284 | – | Почва, США |
| Neospongiococcum vacuolatum | – | UTEX 1838* | AB936283 | – | Почва, США |
| Protosiphon botryoides (T) | – | UTEX B 99 | JN880460 | LC095629 | Почва, США |
| Spongiochloris spongiosa (Т) | 318 | SAG 280-2b* (UTEX 1; CCAP 3/1) | KR607497 | U34776 | Почва, Швейцария |
| Tetracystis aeria (T) | C-6 | SAG 89.80* | JN903990 | – | Почва, США |
| Tetracystis tetraspora | 59A | SAG 98.80* | JN968582 | KM020024 | Почва, Куба |
| Внешняя группа | |||||
| Chlorella vulgaris (T) | 35 | SAG 211-11b* (CCAP 211/11B; UTEX 259) | FM205832 | AY591508 | Пруд, Нидерланды |
Для анализа вторичной структуры ITS2 была выполнена аннотация спейсера в ITS2-DataBase (http://its2.bioapps.biozentrum.uni-wuerzburg.de), его фолдинг с помощью веб-сервера Mfold (http://unafold.rna.albany.edu) и визуализация посредством программы PseudoViewer3 (Byun, Han, 2009). Сравнение вторичной структуры между штаммами, поиск консервативных мотивов и компенсаторных замен осуществляли в программе 4SALE (Seibel et al., 2006). В качестве инструмента разделения видов был использован подход, предложенный A. Coleman (2000, 2009), которая показала, что наличие хотя бы одной компенсаторной замены в консервативных регионах ITS2 (10 пар нуклеотидов для II шпильки и 18 пар для III шпильки) у двух водорослей коррелирует с их полной половой несовместимостью. Напротив, замены в менее консервативных регионах (I и IV шпильки), а также полукомпенсаторные замены в консервативных регионах не были связаны со способностью скрещиваться. На основе мета-анализа большого числа данных Müller et al. (2007) установили, что наличие даже одной компенсаторной замены в 93% исследованных случаев указывает на принадлежность организмов к разным видам. При оценке правильности фолдинга ITS2 зеленых водорослей ориентировались на работу Caisová et al. (2013).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Световая микроскопия. Длительное наблюдение за морфологией и размножением перечисленных коллекционных штаммов, а также изучение литературных источников и первоописаний показало, что виды, традиционно относимые к роду Chlorococcum, имеют существенные различия в таких признаках как количество ядер, тип хлоропласта, структура крахмальной обвертки пиреноида и др. (Андреева, 1998). Так в изученной выборке все виды рода Chlorococcum, кроме C. aquaticum и C. nivale, имеют одно ядро. Большинство имеют полый шаровидный хлоропласт (рис. 1а, 1в, 1г, 1ж, 1з, 1л, 1м), за исключением C. costatozygotum с глубокочашевидным и трещиноватым хлоропластом (рис. 1к) и C. nivale с лопастным хлоропластом (согласно рисунку Андреевой, 1998).
Рис. 1.
Фотографии штаммов водорослей ACSSI: а – C. sphacosum ACSSI 209; б – N. gelatinosum ACSSI 217; в – C. citriforme ACSSI 200; г – C. oleofaciens ACSSI 208; д – молодые клетки и е – зрелая клетка D. granata ACSSI 152; ж – C. isabeliense ACSSI 207; з – одиночные клетки, и – комплексы клеток (указаны стрелками) C. diplobionticum ACSSI 202; к – C. costatozygotum ACSSI 201; л – C. hypnosporum ACSSI 205; м – C. echinozygotum ACSSI 203. Во вклейке представлена увеличенная фотография крахмальной обвертки пиреноида. Масштабная линейка – 10 мкм.

По строению крахмальной обвертки пиреноида можно выделить 2 группы: виды со сплошной обверткой – C. aquaticum, C. sphacosum (рис. 1а), C. citriforme (рис. 1в), C. elkhartiense, C. ellipsoideum, C. isabeliense (рис. 1ж), C. microstigmatum, C. minutum, C. nivale, C. oleofaciens (рис. 1г), C. rugosum, C. vacuolatum, а также виды с сегментированной обверткой – C. chlorococcoides, C. diplobionticum (рис. 1з), C. costatozygotum (рис. 1к), C. hypnosporum (рис. 1л), C. echinozygotum (рис. 1 м), C. infusionum, C. polymorphum. Кроме того, при наблюдении за аутентичными штаммами был выявлен ряд несоответствий их первоначальным морфологическим диагнозам. Так, например, у аутентичного штамма C. diplobionticum ACSSI 202 мы наблюдали сегментированную, а не сплошную крахмальную обвертку пиреноида (рис. 1з) и способность к образованию комплексов клеток (рис. 1и), что ранее описано не было (Archibald, Bold, 1970). Однако в более раннем исследовании W. Herndon, открывшего данный вид, несмотря на отсутствие описания структуры крахмальной обвертки пиреноида, по рисункам исследователя можно заключить, что она ближе к прерывистой (Herndon, 1958).
Согласно первоописаниям, C. isabeliense и C. sphacosum имеют массивные хлоропласты (Archibald, Bold, 1970). Однако при изучении аутентичных штаммов ACSSI 207 и ACSSI 209, соответственно, мы охарактеризовали хлоропласт как полый шаровидный, слегка рассеченный по краям в первом случаем (рис. 1ж) и полый шаровидный с отверстием (рис. 1а) во втором. Кроме того, мы обратили внимание на морфологическую близость некоторых видов рода Chlorococcum с Neospongiococcum gelatinosum ACSSI 217 (рис. 1б), который имел пристенный полый шаровидный хлоропласт, нетипичный для представителей рода Neospongiococcum (Deason, 1971). Кроме того, наши дальнейшие наблюдения показали, что штамм ACSSI 152, идентифицированный и переданный в коллекцию к. б. н. Ю.М. Бачура как Deasonia granata, имел характерные признаки рода Macrochloris (Андреева, 1998) – центральный асимметричный хлоропласт (рис. 1д), несколько пиреноидов в зрелых клетках (рис. 1е).
18S рРНК-анализ. Морфологическую гетерогенность рода Chlorococcum подтвердил молекулярно-генетический анализ. Так, на 18S рРНК-дереве виды рода Chlorococcum не образовали единой клады, что подтверждает его полифилетичность (рис. 2). Истинными представителями рода могут считаться виды, образовавшие группу с типовым видом C. infusionum, а именно C. costatozygotum ACSSI 201, C. hypnosporum ACSSI 205, C. chlorococcoides NIES-155, C. echinozygotum ACSSI 203. Кроме того, к ним же были перенесены виды N. macropyrenoidosum, N. vacuolatum, T. aeria и T. polymorpha (Watanabe, Lewis, 2017). Все они вошли в макрокладу Moewusinia (Watanabe, Lewis, 2017). Различия в гене, кодирующем 18S рРНК, внутри клады ”истинных“ Chlorococcum составляли от 0.1 до 2%, при сравнении с Chlorococcum-подобными видами различия варьировали от 9.4 до 10.9%.
Рис. 2.
Укорененное филогенетическое дерево некоторых видов рода Chlorococcum и близкородственных таксонов, построенное методом максимального правдоподобия (ML), на основе анализа гена 18S рРНК (1760 п.н.). В качестве статистической поддержки узлов дерева указаны бутстреп-значения ML; значения <70% не показаны. Модель нуклеотидных замен: GTR + I +G. Жирным шрифтом выделены штаммы ACSSI.
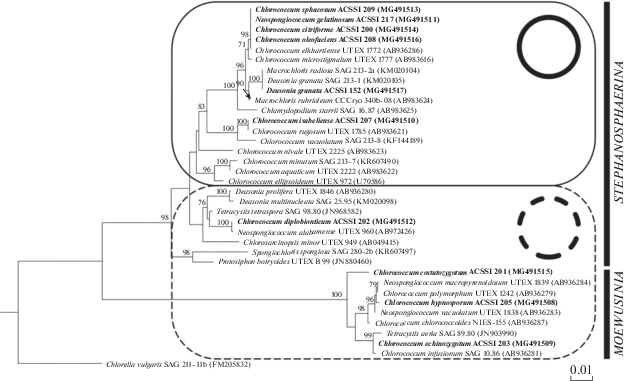
Сам род в настоящее время сложно выделить морфологически. Но, например, замечено, что кластеризация таксонов на дереве 18S рРНК соответствует их группированию по типу крахмальной обвертки пиреноида (рис. 2): кладу Chlorococcum, принадлежащую макрокладе Moewusinia, составляли водоросли с прерывистой крахмальной обверткой пиреноида. Среди представителей макроклады Stephanosphaerinia часть таксонов характеризовалась прерывистой крахмальной обверткой пиреноида, часть – сплошной. Вероятно, требуется более детальное изучение цитологических признаков вегетативных клеток и зооспор для разграничения таксонов. Остальные представители Chlorococcum вошли в состав макроклады Stephanosphaerinia и разделились на четыре группы и отдельно C. nivale (рис. 2). Первая группа объединила N. gelatinosum ACSSI 217, C. citriforme ACSSI 200, C. oleofaciens ACSSI 208, C. sphacosum ACSSI 209, C. elkhartiense UTEX 1772 и C. microstigmatum UTEX 1777 с различиями в гене 18S рРНК от 0 до 0.1%. Вторая группа со 100%-ной статистической поддержкой включает в себя C. isabeliense ACSSI 207, C. rugosum UTEX 1785 и C. vacuolatum SAG 213-8 (рис. 2). Между первыми двумя видами генетические различия в гене 18S рРНК отсутствуют, от C. vacuolatum они отличаются на 1.1%. В третью группу вошли C. aquaticum, C. minutum, C. ellipsoideum с генетическими дистанциями от 0.3 до 1%. В последнюю кладу образовал C. diplobionticum ACSSI 202 с N. alabamense и T. tetraspora с генетическими различиями в 0.1 и 1.0% соответственно.
Кроме того, в результате анализа установлена полифилия еще двух родов зеленых микроводорослей – Deasonia и Neospongiococcum. Кладу Deasonia образовали типовой вид D. prolifera и D. multinucleata (0.2% различий в гене 18S рРНК), а D. granata со 100%-ной статистической поддержкой группируется с Macrochloris radiosa (0% генетических различий), что позволяет перенести этот вид в род Macrochloris. Голотип рода N. alabamense вошел в кладу Neospongiococcum, остальные представители N. gelatinosum, N. macropyrenoidosum, N. vacuolatum были переименованы (Kawasaki et al., 2015; Watanabe, Lewis, 2017).
Анализ вторичной структуры ITS2. Поскольку 18S рРНК-анализа бывает недостаточно при исследовании близкородственных таксонов (Coleman, 2003; Hall et al., 2010), нами была дополнительно изучена вторичная структура ITS2 для разделения коллекционных штаммов ACSSI по A. Coleman. Между N. gelatinosum ACSSI 217, C. citriforme ACSSI 200 и C. oleofaciens ACSSI 208 не было обнаружено компенсаторных замен (рис. 3). Вторичная структура ITS2 данной группы отличается на 1 компенсаторную замену в I шпильке от ITS2 C. sphacosum UTEX 1787 и C. sphacosum ACSSI 152, между двумя последними структурами компенсаторных замен не выявлено. При сравнении перечисленных штаммов со штаммом C. microstigmatum UTEX 1777 в структуре ITS2 найдено 4 компенсаторные замены: одна – в I шпильке и три – на верхушке II шпильки (рис. 3). Все обнаруженные компенсаторные замены не относятся к заменам в консервативных регионах ITS2 и не учитываются при разграничении видов зеленых водорослей (Coleman, 2000, 2009).
Рис. 3.
Сравнение вторичной структуры ITS2 C. oleofaciens ACSSI 208 (показанная структура), C. sphacosum ACSSI 209 (а), C. microstigmatum UTEX 1777 (б).
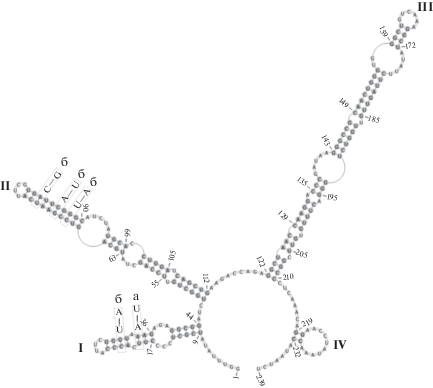
Таким образом, учитывая генетические различия в гене 18S рРНК от 0 до 0.1%, отсутствие компенсаторных замен в консервативных регионах ITS2, одинаковую консервативную последовательность III шпильки (табл. 3) и сходные морфологические характеристики (тип хлоропласта, форма вегетативных клеток и зооспор, количество ядер, тип крахмальной обвертки пиреноида), виды N. gelatinosum, C. citriforme, C. oleofaciens, C. sphacosum и C. microstigmatum следует объединить в один вид. Ранее C. microstigmatum был оставлен в качестве самостоятельного вида на основании формы стигмы (Kawasaki et al., 2015), что на наш взгляд и мнение других систематиков недостаточно (Ettl, Gärtner, 2014). Под сомнением оказывается самостоятельность вида C. elkhartiense (0–0.1% различий в гене 18S рРНК и сходные морфологические признаки), однако в генетических базах данных отсутствует депонированная последовательность ITS2 для аутентичного штамма UTEX 1772. Данный аутентичный штамм использовался в филогенетическом анализе рода Chlorococcum впервые. В ревизии Kawasaki et al. (2015) был исследован неаутентичный штамм C. elkhartiense UTEX 293, который не вошел в группу C. oleofaciens (макроклада Stephanosphaerinia), а принадлежал макрокладе Moewusinia.
Таблица 3.
Характеристика вторичной структуры ITS2 некоторых видов рода Chlorococcum и близкородственных таксонов
| Свойства ITS2 Штаммы |
Суммарное количество нуклеотидов | Консервативная последовательность III шпильки |
|---|---|---|
| C. citriforme ACSSI 200* | 239 | UGGGUGGGCUGUCAAAG |
| C. microstigmatum UTEX 1777* | 236** | |
| C. oleofaciens ACSSI 208* | 239 | |
| C. sphacosum ACSSI 209* | 238** | |
| N. gelatinosum ACSSI 217* | 239 | |
| Deasonia granata ACSSI 152 | 245 | UGGGUGGGCUGUCAAAA |
| Macrochloris rubrioleum CCCryo 340b-08* | 243 | |
| C. isabeliense ACSSI 207* | 235 | UGGGUGGGCAG− −AAAU |
| C. rugosum UTEX 1785* | ||
| C. vacuolatum SAG 213-8* | 224** | |
| C. nivale UTEX 2225* | 312 | UGGGUGAGCAUUAACCU |
| C. aquaticum UTEX 2222* | 235 | UGGGUGGGCAUUUCCAA |
| C. minutum SAG 213-7* | 250 | |
| C. diplobionticum ACSSI 202* | 257 | UGGGUAGGCAUUCACAG |
| T. tetraspora SAG 98.80* | 238 | UGGGUAGGCAUUCCGA− |
| P. botryoides UTEX 99* | 268 | UGAGUAGGCACUUGU−U |
| S. spongiosa SAG 280-2b* | 239 | |
| Chlorococcum echinozygotum ACSSI 203* | 366 | UAGGUAGGAGGGACCAU |
| Chlorococcum hypnosporum ACSSI 205* | 402 | UAGGUAGGCUCAAGGCA |
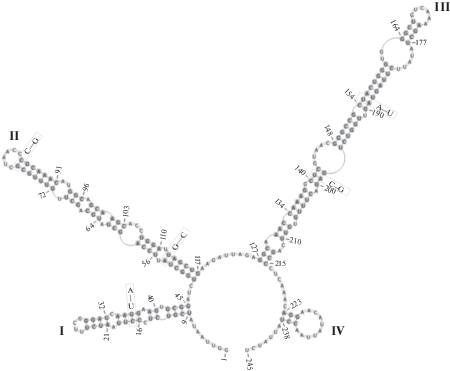
D. granata ACSSI 152 и Macrochloris rubrioleum CCCryo 340b-08 имеют идентичную консервативную последовательность III шпильки (табл. 3). Между ними было обнаружено 5 компенсаторных замен: одна в I шпильке, две – во II шпильке и две – в III, в том числе три из них в консервативных регионах ITS2 (рис. 4). Но определить является ли штамм ACSSI 152 самостоятельным видом M. granata или должен быть синонимизирован с M. radiosa невозможно без сравнения вторичной структуры его ITS2 с M. radiosa, нуклеотидная последовательность которого в настоящее время в генетических базах данных отсутствует.
Рис. 4.
Сравнение вторичной структуры ITS2 D. granata ACSSI 152 (показанная структура) и M. rubrioleum CCCryo 340b-08 (во вклейках).
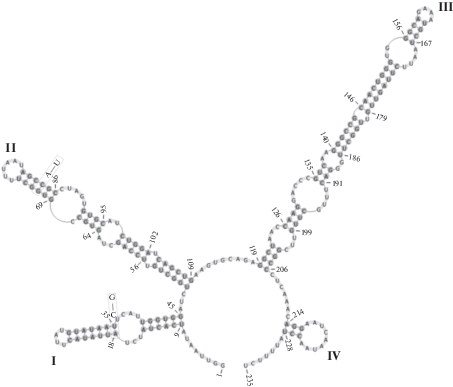
Группа штаммов C. isabeliense ACSSI 207, C. rugosum UTEX 1785, C. vacuolatum SAG 213-8 является морфологически сходной и имеет одинаковый консервативный мотив III шпильки (табл. 3). Между первыми двумя видами компенсаторные замены в ITS2 отсутствуют, благодаря чему их, возможно, следует объединить в один вид. От C. vacuolatum они отличаются на 2 компенсаторные замены (верхушки I и II шпилек). Несмотря на то, что компенсаторные замены произошли в неконсервативных регионах, структура ITS2 C. vacuolatum сильно отличается от C. isabeliense и C. rugosum, что позволяет его оставить в качестве самостоятельного таксона (рис. 5). Морфологически C. vacuolatum отличается от близкородственных видов бóльшими размерами вегетативных клеток и наличием толстой слизистой оболочки.
Рис. 5.
Сравнение вторичной структуры ITS2 C. isabeliense ACSSI 207 (показанная структура) и C. vacuolatum SAG 213-8 (во вклейках).
При сравнении вторичных структур ITS2 Chlorococcum diplobionticum ACSSI 202 и Tetracystis tetraspora SAG 98.80 было обнаружено две компенсаторные замены в неконсервативных участках ITS2 (рис. 6). Однако разница в длине спейсера и различия в консервативном мотиве III шпильки (табл. 3) дают возможность сохранить их в качестве отдельных видов.
Рис. 6.
Сравнение вторичной структуры ITS2 Chlorococcum diplobionticum ACSSI 202 (показанная структура) и Tetracystis tetraspora SAG 98.80 (во вклейках).
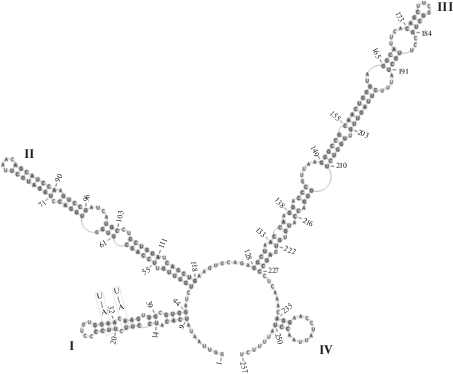
Все описанные штаммы имели длину ITS2 от 235 до 312 н. и типичную вторичную 4-х шпилечную структуру. Исключением являлись штаммы C. echinozygotum ACSSI 203 и C. hypnosporum ACSSI 205, принадлежащие макрокладе Moewusinia, которые имели длину 366 и 402 н. (табл. 3). Первоначальный анализ вторичной структуры ITS2 этих двух видов показал несоответствие консенсусной модели принятой для классов Chlorophyceae и Ulvophyceae (Caisová et al., 2013) с полученной нами на основе принципа минимальной энергии на сервере Mfold (данные не представлены). Описание необычной вторичной структуры ITS2 истинных Chlorococcum готовится к публикации.
Таким образом, подтверждена полифилия трех родов зеленых микроводорослей – Chlorococcum, Deasonia и Neospongiococcum. Часть видов рода Chlorococcum вместе с типовым видом C. infusionum вошли в состав макроклады Moewusinia и образовали истинную кладу Chlorococcum. Ее представители отличались сверхдлинными ITS2 с необычной вторичной структурой. Остальные являются членами макроклады Stephanosphaerinia и должны быть переименованы. Уточнены и дополнены морфологические диагнозы некоторых аутентичных штаммов. Так, описан пристенный полый шаровидный хлоропласт у N. gelatinosum ACSSI 217, C. isabeliense ACS-SI 207 и C. sphacosum ACSSI 209, а также сегментированная крахмальная обвертка пиреноида у C. diplobionticum ACSSI 202. На основании морфологического сходства, уровня замен в гене 18S рРНК, наличия компенсаторных замен в консервативных регионах ITS2, различий во вторичной структуре спейсера и в консервативном мотиве III шпильки предложено объединить виды N. gelatinosum, C. citriforme, C. oleofaciens, C. sphacosum и C. microstigmatum в один вид, а виды C. vacuolatum, C. diplobionticum и T. tetraspora оставить в качестве самостоятельных. Следует отметить, что на достоверность филогенетических выводов влияет полнота генетических баз данных и доступность необходимых нуклеотидных последовательностей конкретных таксонов, например, последовательностей ITS2 C. elkhartiense и M. rubrioleum.
Авторы благодарят зав. кафедрой ботаники Учебно-научного центра “Институт биологии” Киевского национального университета им. Т. Шевченко, д. б. н., проф. И.Ю. Костикова за предоставление аутентичных штаммов зеленых микроводорослей и ценные консультации по анализу вторичной структуры ITS2, а также к. б .н., доц. кафедры ботаники и физиологии растений Гомельского государственного университета им. Ф. Скорины Ю.М. Бачура за депонирование штамма Deasonia granata (ACSSI 152).
Работа выполнена при финансовой поддержке РФФИ в рамках научного проекта № 16-34-60020 мол_а_дк.
Список литературы
Андреева В.М. Почвенные и аэрофильные зеленые водоросли (Chlorophyta: Tetrasporales, Chlorococcales, Chlorosarcinales). СПб.: Наука, 1998. 351 с.
Коршиков О.А. Підклас протококові (Protococcineae) // Визначник прісноводних водоростей УРСР. Kиїв: Вид-во АН УРСР, 1953. Вип. 5. 440 с.
Темралеева А.Д., Минчева Е.В., Букин Ю.С., Андреева А.М. Современные методы выделения, культивирования и идентификации зеленых водорослей (Chlorophyta). Кострома: Костромской печатный дом, 2014. 215 с.
Костiков I.Ю., Романенко П.О., Демченко Е.М. Дарiенко Т.М., Михайлюк T.I., Рибчинский О.В., Солоненко А.М. Водоростi грунтiв України (iсторiя та методи дослiдження, система, конспект флори). Kиїв: Фiтосоцiцентр, 2001. 300 с.
Archibald P. Descriptions of new edaphic and aquatic species of Chlorococcum Meneghini (Chlorococcales) // Brit. Phycol. J. 1979. V. 14. P. 305–312.
Archibald P.A., Bold H.C. Phycological studies XI. The genus Chlorococcum Meneghini // University of Texas Publication. 1970. № 7015. P. 1–115.
Archibald P.A. Chlorococcum pamirum and C. salinum, two new species of the Chlorophyceae from Central Asia // Brit. Phycol. J. 1988. V. 23. P. 121–128.
Bold H.B., Parker B.C. Some supplementary attributes in the classification of Chlorococcum species // Arch. Microbiol. 1962. V. 42. P. 267–288.
Brown R.M., McLean R.J. New taxonomic criteria in the classification of Chlorococcum species. II. Pyrenoid fine structure // J. Phycol. 1969. V. 5. P. 114–118.
Byun Y., Han K. PseudoViewer3: generating planar drawings of large-scale RNA structures with pseudoknots // Bioinformatics. 2009. V. 25. P. 1435–1437.
Caisová L., Marin B., Melkonian M. A consensus secondary structure of ITS2 in the Chlorophyta identified by phylogenetic reconstruction // Protist. 2013. V. 164. P. 482−496.
Canter-Lund H., Lund J.W.G. Freshwater Algae. Their Microscopic World Explored. Bristol: UK Biopress, 1995. 360 p.
Chantanachat S., Bold H.C. Phycological studies. II. Some algae from arid soils // University of Texas Publications. 1962. № 6218. P. 1–74.
Chihara M., Nakayama T, Inoue I., Kodama M. Chlorococcum littorale, a new marine green coccoid alga (Chlorococcales, Chlorophyceae) // Archiv für Protistenkunde. 1994. V. 144. № 3. P. 227–235.
Coleman A.W. Is there a molecular key to the level of “biological species” in eukaryotes? A DNA guide // Mol. Phylogenet. Evol. 2009. V. 50. P. 197–203.
Coleman A.W. ITS2 is a double-edged tool for eukaryote evolutionary comparisons // Trends Genet. 2003. V. 19. P. 370–375.
Coleman A.W. The significance of a coincidence between evolutionary landmarks found in mating affinity and a DNA sequence // Protist. 2000. V. 151. P. 1–9.
Darriba D., Taboada G. L., Doallo R., Posada D. jModelTest 2: more models, new heuristics and parallel computing // Nature Methods. 2012. V. 9. №. 8. P. 772.
Deason T.R. The genera Spongiococcum and Neospongiococcum. I. The genus Spongiococcum and the multinucleate species of the genus Neospongiococcum // Phycologia. 1971. V. 10. P. 17–27.
Deason T.R., Bold H.C. Phycological studies. I. Exploratory studies of Texas soil algae // University of Texas Publication. 1960. № 6022. P. 1–72.
Ettl H., Gärtner G. Syllabus der Boden-, Luft- und Flechtenalgen. 2. Auflage. Springer: Berlin Heidelberg, 2014. 773 p.
Ettl H., Gärtner G. Taxonomic and nomenclatural changes and descriptions of new taxa of the Tetrasporales, Chlorococcales and Gloeodendrales (Chlorophyta, Chlamydophyceae and Chlorophyceae) // Nova Hedwigia. 1987. V. 44. P. 509–517.
Guiry M.D., Guiry G.M. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. 2018. http://www.algaebase.org. Searched on 24 May 2018.
Hall T.A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT // Nucleic Acids Symposium Series. 1999. № 41. P. 95–98.
Hall J.D., Fučíková K., Lo C., Lewis L.A., Karol K.G. An assessment of proposed DNA barcodes in freshwater green algae // Cryptogamie, Algol. 2010. V. 31. P. 529–555.
Herndon W. Some new species of chlorococcacean algae // Am. J. Bot. 1958. V. 45. P. 308–323.
John D.M., Tsarenko P.M. Order Chlorococcales // The Freshwater Algal Flora of the British Isles. An Identification Guide to Freshwater and Terrestrial Algae / Eds. John D.M., Whitton B.A., Brook A.J. Cambridge: Cambridge University Press, 2002. P. 327–409.
Katana A., Kwiatowski J., Spalik K., Zakryś B., Szalacha E., Szymańska H. Phylogenetic position of Koliella (Chlorophyta) as inferred from nuclear and chloroplast small subunit rDNA // J. Phycol. 2001. V. 37. P. 443–451.
Kawasaki Y., Nakada T., Tomita M. Taxonomic revision of oil-producing green algae, Chlorococcum oleofaciens (Volvocales, Chlorophyceae) and its relatives // J. Phycol. 2015. V. 51. P. 1000–1016.
Klochkova T.A., Kang S.H., Cho G.Y., Pueschel C.M., West J.A., Kim G.H. Biology of a terrestrial green alga Chlorococcum sp. (Chlorococcales, Chlorophyta), collected from the Miruksazi stupa in Korea // Phycologia. 2006. V. 45. P. 349–358.
McGuire R.F. Attributes of Chlorococcum species: A numerical analysis // J. Phycol. 1969. V. 5. P. 220–223.
McLean R.J. New taxonomic criteria in classification of Chlorococcum species. I. Pigmentation // J. Phycol. 1968. V. 4. P. 328–332.
Meneghini G. Monographia Nostochinearum Italicarum addito specimene de Rivulariis. Memorie della Reale Accademia delle Scienze di Torino. Ser. 2. 1842. V. 5. P. 1–143.
Metting B. New species of green microalgae (Chlorophycophyta) from an eastern Washington silt loam // Phycologia. 1980. V. 19. P. 296–306.
Müller T., Philippi N., Dandekar T., Schultz J., Wolf M. Distinguishing species // RNA. 2007. V. 3. P. 1469–1472.
Nakayama T., Watanabe S., Mitsui K., Uchida H., Inouye I. The phylogenetic relationship between Chlamydomonadales and Chlorococcales inferred from 18S rDNA sequence data // Phycol. Res. 1996. V. 44. № 1. P. 47–55.
Seibel P.N., Müller T., Dandekar T., Schultz J., Wolf M. 4SALE – a tool for synchronous RNA sequence and secondary structure alignment and editing // BMC Bioinformatics. 2006. V. 7. P. 498.
Shubert E. Nonmotile coccoid and colonial green algae // Freshwater Algae of North America. Ecology and Classification / Eds. Wehr J.D., Sheath R.G. San Diego: Academic Press, 2003. P. 253–309.
Silva P.C., Starr R.C. Difficulties in applying the International Code of Botanical Nomenclature to certain unicellular algae, with special reference to Chlorococcum // Svensk Botanisk Tidskrift. 1953. V. 47. № 2. P. 235–247.
Starr R.C. A comparative study of Chlorococcum meneghini and other spherical, zoospore-producing genera of the Chlorococcales // Indiana University Publications Science. 1955. V. 20. P. 1–111.
Tamura K., Stecher G., Peterson D., Filipski A., Kumar S. MEGA6: Molecular Evolutionary Genetics Analysis Version 6.0. // Mol. Biol. Evol. 2013. V. 30. P. 2725–2729.
Trainor F.R., Bold H.C. Three new unicellular Chlorophyceae from soil // Am. J. Bot. 1954. V. 40. P. 758–767.
Trainor F.R., Verses P.A. A new Chlorococcum from a Connecticut cornfield soil // Phycologia. 1967. V. 6. № 4. P. 237–239.
Watanabe S., Lewis L.A. Phylogenetic interpretation of light and electron microscopic features of selected members of the phylogroup Moewusinia (Chlorophyceae), with new generic taxonomy // Phycologia. 2017. V. 56. № 3. P. 329–353.
White T.J., Bruns T., Lee S., Taylor J.W. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics // PCR Protocols: A Guide to Methods and Applications / Eds. Innis M.A., Gelfand D.H., Sninsky J.J., White T.J. San Diego: Acad. Press, 1990. V. 3. P. 315–322.
Дополнительные материалы отсутствуют.


