Микробиология, 2019, T. 88, № 1, стр. 72-82
Подавление “кворум сенсинга” Chromobacterium violaceum при воздействии комбинаций амикацина с активированным углем или малыми молекулами растительного происхождения (пирогаллолом и кумарином)
К. С. Инчагова a, Г. К. Дускаев a, Д. Г. Дерябин a, *
a Федеральный научный центр биологических систем и агротехнологий Российской академии наук
460000 Оренбург, Россия
* E-mail: dgderyabin@yandex.ru
Поступила в редакцию 08.11.2018
После доработки 03.12.2018
Принята к публикации 10.12.2018
Аннотация
Целью исследования был поиск эффективных подходов к подавлению системы “кворум сенсинга” (QS) у модельной бактерии Chromobacterium violaceum ATCC 31532 на основе комбинированного использования соединений, реализующих различные механизмы анти-QS активности. Предварительно охарактеризованные механизмы их действия включали: 1) подавление синтеза автоиндуктора (С6-АГЛ) субингибиторными концентрациями аминогликозидного антибиотика амикацина; 2) сорбцию уже синтезированного С6-АГЛ на частицах активированного угля; 3) снижение чувствительности бактериальных клеток к автоиндуктору под действием низкомолекулярных соединений растительного происхождения – пирогаллола или кумарина. Одновременное присутствие амикацина и активированного угля в среде культивирования C. violaceum не увеличивало, но, напротив, парадоксально снижало их совместную анти-QS активность. Это объясняется частичным связыванием антибиотика на частицах сорбента, тогда как поэтапное использование антибиотика и сорбента обеспечивало развитие аддитивного эффекта, формирующегося за счет последовательного уменьшения внеклеточной концентрации С6-АГЛ. Совместное использование амикацина с пирогаллолом или кумарином приводило к наиболее выраженному анти-QS эффекту, при изоболографическом анализе, демонстрирующем признаки супераддитивности. Обсуждается возможность возникновения тестированных композиций в естественных условиях обитания микроорганизмов, а также перспективность их использования для борьбы с бактериальными инфекциями, возбудители которых используют системы “кворум сенсинга” для индукции своего патогенного потенциала.
Феномен “кворум сенсинга” (от англ. – quorum sensing; QS), представляющий собой систему плотностно-зависимой коммуникации у прокариот с участием низкомолекулярных химических сигналов – автоиндукторов, первоначально был описан на примере морских люминесцирующих бактерий (Greenberg et al., 1996). Однако достаточно быстро выяснилось, что стереотипно устроенные системы QS характерны и для большинства наземных свободно живущих и патогенных микроорганизмов, у которых они участвуют в регуляции разнообразных вариантов функциональной и морфологической дифференцировки (Waters, Bassler, 2005). В частности, под подобным контролем находятся такие важные процессы, как образование биопленок и синтез факторов вирулентности, что определило взгляд на QS как перспективную мишень для создания антибактериальных средств нового принципа действия (Хмель, 2006).
Предложенные к настоящему времени варианты подавления систем плотностно-зависимой коммуникации у бактерий включают: 1) внеклеточное связывание автоиндукторов специфическими антителами или неспецифическими адсорбентами; 2) их ферментативную деградацию; 3) химическую интерференцию за связывание с соответствующими рецепторными белками (Remy et al., 2018). Принято считать, что обеспечиваемое подобными воздействиями подавление кворум-зависимого образования биопленок может повысить чув-ствительность образующих их бактерий к воздействию антибиотиков, что впервые было продемонстрировано на примере Pseudomonas aeruginosa с использованием антибиотика тобрамицина и растительных ингибиторов QS: аджоена (Jakobsen et al., 2012) и байкалина (Brackman et al., 2011). Недавним подтверждением такого механизма являются наблюдения о потенцировании активности тобрамицина и других аминогликозидных антибиотиков фитоалексином ресвератролом (Zhou, Chen et al., 2018) или растительным алкалоидом хордеином (Zhou, Hou et al., 2018).
Вместе с тем, сами антибиотики в субингибиторных концентрациях также проявляют способность к подавлению QS, что соответствует современному взгляду на них как на “информбиотики”, ориентированные не столько на угнетение роста бактерий-конкурентов, сколько на регуляцию профиля их генной экспрессии (Кожевин и соавт., 2014). Так хорошо документированной является анти-QS активность азитромицина (Swatton et al., 2016), цефтазидима и ципрофлоксацина (Skindersoe et al., 2008), а наиболее обширные доказательства получены в отношении антибиотиков из группы аминогликозидов. При этом в работе (Babic et al., 2010) и нашем недавнем исследовании (Дерябин, Инчагова, 2018) в качестве наиболее вероятного механизма их действия названа блокада биосинтеза автоиндуктора, в условиях дефицита которого система “кворум сенсинга” перестает функционировать.
Целью настоящего исследования явилось исследование анти-QS активности антибиотика амикацина при его индивидуальном использовании и в комбинации с химическими соединениями, реализующими иные механизмы подавления системы “кворум сенсинга”. В качестве подобных соединений выбраны активированный уголь, демонстрирующий способность к эффективному связыванию автоиндукторов (Инчагова и соавт., 2016), а также малые молекулы растительного происхождения – пирогаллол и кумарин, активность которых связана с блокадой внутриклеточных путей передачи регуляторного сигнала (Defoirdt et al., 2013; Zhang et al., 2016). Основной акцент в настоящей работе сделан на их совместном эффекте в отношении системы “кворум сенсинга” модельного микроорганизма Chromobacterium violaceum при действии субингибиторных концентраций действующих компонентов.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Бактериальные штаммы. В качестве основного объекта исследования использован дикий штамм C. violaceum ATCC 31532 с двухкомпонентной системой QS, в которой образуемая под контролем гена cviI синтаза обеспечивает образование автоиндуктора – N-гексаноил-L-гомосерин лактона (С6-АГЛ), а кодируемый геном cviR рецепторный белок участвует в его восприятии с последующей кворум-зависимой транскрипцией ряда целевых генов (Stauff, Bassler, 2011). В частности, под таким контролем находится vioABEDC-оперон, ответственный за образование сине-фиолетового пигмента виолацеина с максимумом поглощения при 585 нм, количество которого в бактериальной культуре позволяет прямо оценивать активность системы QS.
Для исследования влияния антибиотика амикацина на продукцию автоиндуктора системы QS (С6-АГЛ) культурой C. violaceum ATCC 31532, а также в ряде других экспериментов использовали штамм C. violaceum CV026 (NCTC 13274). Его отличием от дикого штамма C. violaceum ATCC 31532 является инсерция транспозона mini-Tn5 в ген cviI, приведшая к утрате способности биосинтеза автоиндуктора при сохранении способности восприятия С6-АГЛ с участием функционального гена cviR (McClean et al., 1997). Дополнительным преимуществом штамма C. violaceum CV026 являлось присутствие в составе транспозона mini-Tn5 генетической детерминанты Kmr, контролирующей устойчивость к антибиотикам из группы аминогликозидов, что в проводимых экспериментах исключало возможность искажающего воздействия амикацина на результат детекции С6-АГЛ.
В экспериментах, направленных на исследование механизмов анти-QS активности активированного угля, пирогаллола и кумарина, использован сенсорный штамм Escherichia coli JLD271 с плазмидой pAL103; luxR+luxI_luxCDABE; TetR p15A (Lindsay, Ahmer, 2006). Клонированный в ее составе ген luxR кодирует рецепторный белок, воспринимающий АГЛ с шестью атомами углерода в боковой цепи, и на этой основе обеспечивает дозозависимое развитие биолюминесценции как следствие транскрипции luxCDABE-оперона.
При исследовании сорбции амикацина на частицах активированного угля дополнительно использован штамм Staphylococcus aureus subsp. aureus FDA 209P (ATCC 6538P), проявляющий высокую чувствительность к широкому кругу антибиотиков и, в этой связи, рекомендуемый для оценки их биоактивности.
Химические соединения. При воздействии на систему плотностно-зависимой коммуникации C. violaceum ATCC 31532 использована химически чистая субстанция антибиотика амикацина в виде амикацина сульфата (CAS 37517-28-5) (“Sigma”, США).
В качестве потенциального сорбента С6-АГЛ использован фармакопейный препарат активированного угля (CAS 16291-96-6) производства ОАО “Фармстандарт-Лексредства” (Россия) с показателем зольности менее 1% и значением йодного индекса 800–900 мг/г. Перед проведением исследований препарат измельчали с использованием электрической мельницы, отбирали гранулометрическую фракцию 130–250 мкм, которую высушивали до постоянной массы при 120°С.
Малые молекулы растительного происхождения – пирогаллол (1,2,3-тригидроксибензол; CAS 87-66-1) и кумарин (2Н-хромен-2он; CAS 91-64-5) были представлены их химически синтезированными аналогами производства компаний “TCI EUROPE N.V.” (ЕC) и “Enamine Ltd” (Украина).
Для контрольной индукции сенсорных штаммов C. violaceum 026 и E. coli JLD271 pAL103, а также в ряде других экспериментов использован химически синтезированный С6-АГЛ с чистотой ≥98% (CAS 147852-83-3) (“Cayman Chemicals”, США).
Методы исследования анти-QS активности на модели C. violaceum ATCC 31532. Для определения анти-QS активности каждого из использованных соединений в LB-бульоне (“Sigma”, США) готовили двукратные разведения (n × 2): 1) амикацина (0.05–100 мкг/мл); 2) активированного угля (1000–30000 мкг/мл); 3) пирогаллола (0.15–157.64 мкг/мл) или кумарина (1.43–1461.52 мкг/мл). Соответствующие объемы LB-бульона, не содержащие названных компонентов, использовали в качестве положительного (рост тест-штамма) и отрицательного (стерильного) контролей. В стеклянные емкости, содержащие по 2 мл приготовленных, как описано выше, опытных и контрольных проб, вносили по 20 мкл 1-сут культуры C. violaceum ATCC 31532 и подращивали в статическом режиме при 27°C в течение суток. Оценку результатов проводили с использованием микрострипового фотометра STAT FAX 303 VIS+ (“Awareness Technology”, США), регистрируя: 1) оптическую плотность биомассы при 450 ± 5 нм (ОП450) как показатель влияния исследуемых компонентов на рост бактерий; 2) количество пигмента виолацеина после его этанольной экстракции при 600 ± 5 нм (ОП600) как показатель влияния на активность QS-системы. Значения поглощения отрицательного контроля вычитали. Антибактериальный эффект исследуемых компонентов выражали значениями МИК100 и МИК50 – минимальными ингибирующими концентрациями, вызывающими 100- и 50%-ое подавление роста тест-штамма относительно положительного контроля. Интенсивность подавления системы “кворум сенсинга” выражали величинами EC100 и EC50, соответствующими 100- и 50%-ому ингибированию биосинтеза пигмента виолацеина.
Для исследования комбинированного воздействия амикацина использовали: 1) панели стеклянных емкостей (8 × 12) при сочетании антибиотика с активированным углем или 2) пластиковые 96-луночные планшеты при сочетании антибиотика с пирогаллолом и кумарином. В емкости или лунки вносили двукратные разведения тестируемых соединений в перпендикулярных друг другу направлениях, что обеспечивало их различные концентрационные соотношения. Пробами сравнения являлись ряды разведений, содержащие только одно из тестируемых соединений, а также положительный и отрицательный контроли. Дальнейшие инокуляцию C. violaceum ATCC 31532, культивирование и учет результатов исследования проводили, как описано выше.
Биотесты на основе C. violaceum CV026. Для количественной оценки автоиндуктора системы QS (С6-АГЛ), синтезируемого штаммом C. violaceum ATCC 31532, бактериальные культуры, выросшие в присутствии субингибиторных концентраций амикацина и в контроле, центрифугировали (6000 g, 15 мин), после чего полученные супернатанты в объеме 100 мкл переносили в ячейки 96-луночных планшетов. В лунки вносили по 20 мкл 1-сут культуры C. violaceum 026 и культивировали в статическом режиме при 27°C в течение сут, после чего определяли уровень биосинтеза виолацеина с использованием микрострипового фотометра при 600 ± 5 нм, как описано выше. Количество детектированного С6-АГЛ оценивали по калибровочным кривым, построенным для химически синтезированного С6-АГЛ в диапазоне концентраций от 10–4 до 10–8 М.
Аналогичным образом остаточное количество С6-АГЛ тестировали после последовательного воздействия на C. violaceum ATCC 31532 субингибиторных концентраций амикацина и последующей сорбции автоиндуктора из супернатанта с использованием активированного угля.
Биотесты на основе E. coli JLD271 pAL103. Сорбцию химически синтезированного С6-АГЛ на частицах активированного угля оценивали по остаточным концентрациям автоиндуктора, который определяли в тесте дозо-зависимого биолюминесцентного отклика E. coli JLD271 pAL103 (Инчагова и соавт., 2016).
Оценку механизма анти-QS активности малых молекул растительного происхождения (относительно соответствующих контролей) проводили в 96-луночных планшетах из непрозрачного пластика Microlite 2+ (“Thermo”, США) в тесте подавления бактериальной биолюминесценции методом, описанным в работе (Дерябин и соавт., 2014). Два варианта экспериментов предусматривали внесение в культуру E. coli JLD271 pAL103 пирогаллола в концентрациях 0.15–157.64 мкг/мл или кумарина 1.43–1461.52 мкг/мл с одновременным или последовательным добавлением С6-АГЛ в концентрации 10–6 М. Динамическую регистрацию развивающегося свечения проводили, помещая планшеты в термостатируемый измерительный блок биолюминометра LM 01T (“Immunotech”, Чехия).
Статистическая обработка результатов исследования. Все эксперименты выполнены не менее чем в пяти повторностях. Полученные результаты обработаны методами вариационной статистики в программе Excel для Windows 10. Для определения характера взаимодействия соединений в составе предложенных композиций использован изоболографический анализ (Tallarida, 2006), проведенный на основе сравнения значений EC50.
РЕЗУЛЬТАТЫ
Анализ эффектов амикацина, активированного угля и малых молекул растительного происхождения (пирогаллола и кумарина) в культуре C. violaceum. Культивирование C. violaceum ATCC 31532 в жидкой питательной среде LB в присутствии амикацина (в диапазоне концентраций 0.05–100 мкг/мл) с последующей раздельной оптической регистрацией значений оптической плотности (ОП450) выросших культур и пигментообразования (ОП600) позволило оценить воздействие антибиотика на рост и кворум-зависимый биосинтез виолацеина тестерного микроорганизма (рис. 1а). Полученные результаты характеризовали антибактериальную активность амикацина величинами МИК50 = 11.6 мкг/мл и МИК100 = 25 мкг/мл. При этом в широком диапазоне субингибиторных концентраций антибиотика было зафиксировано ингибирование кворум-зависимого биосинтеза виолацеина, которое характеризовалось величинами ЕС100 = 12.5 мкг/мл и ЕС50= 8.24 мкг/мл, соответствующими полному или 50% подавлению синтеза пигмента в растущей культуре C. violaceum ATCC 31532 (табл. 1).
Рис. 1.
Воздействие амикацина (а), активированного угля (б), пирогаллола (в) и кумарина (г) на рост и QS-зависимый биосинтез пигмента виолацеина в культуре С. violaceum ATCC 31532. Обозначения: по оси абсцисс – концентрации действующих соединений (мкг/мл); по оси ординат слева, сплошная линия на графиках (1) – оптическая плотность биомассы (ОП450); по оси ординат справа, пунктирная линия на графиках (2) – оптическая плотность пигмента (ОП600).
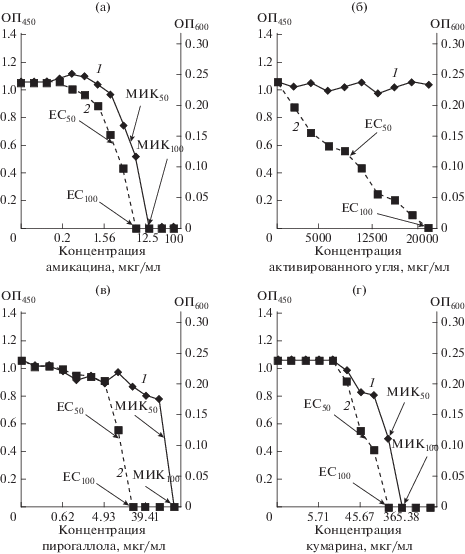
Таблица 1.
Действие амикацина, активированного угля, пирогаллола и кумарина (мкг/мл) на рост и QS-зависимый биосинтез пигмента виолацеина культурой C. violaceum
| Действующие соединения | Характеристики антибактериальной активности, мкг/мл | Характеристики анти-QS активности, мкг/мл |
Вероятный анти-QS механизм |
||
|---|---|---|---|---|---|
| МИК100 | МИК50 | ЕС100 | ЕС50 | ||
| Амикацин | 25 | 11.6 | 12.5 | 8.24 | Подавление синтеза С6-АГЛ |
| Активированный уголь | – | – | 20 000 | 8534.67 | Сорбция С6-АГЛ |
| Пирогаллол | 157.64 | 85.38 | 19.71 | 13.5 | Нарушение восприятия С6-АГЛ |
| Кумарин | 365.38 | 182.69 | 182.69 | 136 | |
Продукция автоиндуктора контрольной 24-ч культурой C. violaceum ATCC 31532, определенная в биотесте с использованием мутантного штамма C. violaceum 026, характеризовалась величиной 68.1 мкМ С6-АГЛ на 1 ед. ОП450. Воздействие субингибиторных концентраций амикацина в диапазоне от 0.1 до 6.25 мкг/мл прогрессивно снижало накопление С6-АГЛ от 67.42 до 0.68 мкМ на 1 ед. ОП450, а в присутствии 12.5 мкг/мл антибиотика автоиндуктор переставал детектироваться. Полученные результаты подтвердили вероятный механизм анти-QS активности амикацина, связав его с подавлением биосинтеза автоиндуктора.
Другим исследованным соединением был активированный уголь, который вносили в среду культивирования модельного штамма C. violaceum ATCC 31532 в количестве от 1000 до 30 000 мкг/мл (рис. 1б). Данное соединение не оказывало детектируемого воздействия на рост тестерного штамма, но в концентрации 8534.67 мкг/мл снижало продукцию виолацеина до 50% от контрольных значений, а в дозе 20 000 мкг/мл полностью подавляло QS-зависимый биосинтез пигмента (табл. 1).
Механизмом биологической активности активированного угля является сорбция молекул С6-АГЛ. Его остаточные количества после отделения частиц активированного угля с адсорбированным на них автоиндуктором оценивались в биотесте с E. coli JLD271 pAL103. При этом четкий дозозависимый биолюминесцентный отклик данного тестерного штамма позволил рассчитать равновесные концентрации С6-АГЛ при его сорбции на активированном угле и охарактеризовать его сорбционную емкость (qE) величиной (11 ± ± 0.9) × 10–9 мг/мг.
Третьим объектом исследования были малые молекулы – пирогаллол и кумарин, ранее идентифицированные в составе растительных экстрактов с выраженной анти-QS активностью (Ni et al., 2008; Reen et al., 2018). Их внесение в культуры C. violaceum ATCC 31532 (рис. 1в, 1г) выявило рост-ингибирующий эффект пирогаллола (рис. 1в) со значениями МИК50 = 85.38 мкг/мл и МИК100 = 157.64 мкг/мл, а кумарина – МИК50 = = 182.69 мкг/мл и МИК100 = 365.38 мкг/мл. Субингибиторные концентрации пирогаллола подавляли кворум-зависимую продукцию виолацеина на 50% в дозе 13.5 мкг/мл и приводили к полному угнетению пигментообразования в дозе 19.71 мкг/мл и выше (табл. 1). Аналогичный эффект кумарина регистрировался в более узком концентрационном диапазоне, характеризуясь величинами ЕС50= 136.0 мкг/мл и ЕС100 = 182.69 мкг/мл (табл. 1).
Анализ механизма анти-QS активности пирогаллола и кумарина был проведен с использованием сенсорного штамма E. coli JLD271 pAL103 в двух вариантах исполнения. Первый из них, в котором в культуру тестерного штамма одновременно вносили С6-АГЛ в концентрации 10–6 М и пирогаллол (в концентрациях от 157.64 до 0.15 мкг/мл) или кумарин (от 1461.52 до 1.43 мкг/мл), не выявил достоверных эффектов тестированных соединений на сроки индукции и уровень биолюминесценции E. coli JLD271 pAL103. Во втором варианте, предварительная 60-минутная инкубация тестерного штамма с пирогаллолом или кумарином в тех же концентрациях с последующей индукцией внесением С6-АГЛ существенно снижала интенсивность люминесцентного отклика: при действии пирогаллола EC50 = 7.08 мкг/мл и кумарина EC50 = 365.38 мкг/мл. Отметим, что отсутствие структурного сходства С6-АГЛ с тестированными малыми растительными молекулами свидетельствует против их возможной конкуренции за связывание со специфическим рецепторным участком белка LuxR. Вероятным механизмом регистрируемого анти-QS эффекта является неспецифическое понижение чувствительности бактериальных клеток к воздействию автоиндуктора.
Оценка воздействия комбинации амикацина с активированным углем на кворум-зависимый биосинтез виолацеина у C. violaceum. Результаты исследований, проведенных в перекрестной матрице концентраций амикацина (в диапазоне 0.05–100 мкг/мл) и активированного угля (в диапазоне 1000–30 000 мкг/мл) в растущих культурах C. violaceum ATCC 31532 заставили констатировать, что одновременное присутствие в среде культивирования антибиотика и сорбента неоднозначно сказывается на их совместной биологической активности.
Так эффект композиций с содержанием активированного угля 1000–2500 мкг/мл заключался в смещении кривых дозозависимого эффекта амикацина в сторону более высоких концентраций антибиотика, т.е. снижении анти-QS активности последнего (рис. 2а). В свою очередь комбинации с содержанием активированного угля от 5000 мкг/мл и более обеспечивали эффективное подавление кворум-зависимого биосинтеза виолацеина при более низких концентрациях амикацина в сравнении с соответствующим контролем. Интегральная оценка полученного результата с использованием изоболографического анализа (рис. 3а) показала смещение большинства индексов комбинированного воздействия выше прямой, соединяющей значения ЕС50 только для амикацина (8.24 мкг/мл) и активированного угля (8534.67 мкг/мл), что характеризовало действие этих компонентов как инфрааддитивное. На этом фоне единственным исключением являлась комбинация 3.54 мкг/мл антибиотика и 4738.52 мкг/мл сорбента, при изоболографическом анализе оцениваемая как аддитивная, когда действие компонентов суммируется, а индекс комбинированного воздействия расположен на линии изоболы.
Рис. 2.
Совместные эффекты амикацина с активированным углем (а – при одновременном; б – при последовательном использовании), пирогаллолом (в) и кумарином (г) в отношении QS-зависимого биосинтеза пигмента виолацеина у С. violaceum. Обозначения: по оси абсцисс – концентрации амикацина (мкг/мл); по оси ординат – оптическая плотность пигмента виолацеина (ОП600). Концентрации активированного угля, пирогаллола и кумарина, использованные в композициях с амикацином, и их обозначения на графиках приведены на полях рисунков.
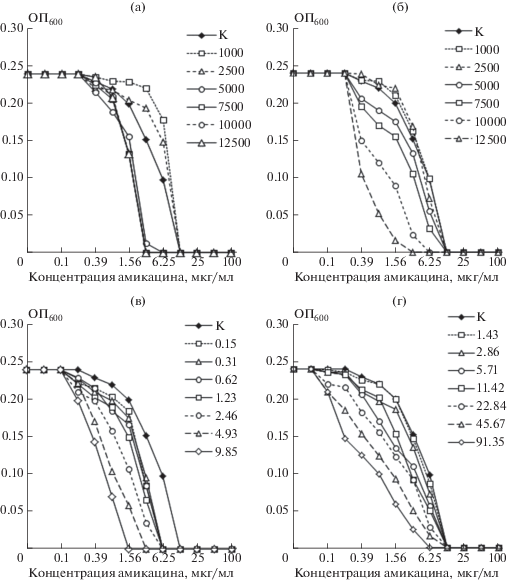
Рис. 3.
Изоболографический анализ совместного воздействия комбинаций амикацина с активированным углем (а), пирогаллолом (б) и кумарином (в) на QS-зависимый биосинтез пигмента виолацеина в культуре C. violaceum. Изоболы представлены в виде прямых линий, соединяющих концентрации каждого из соединений, вызывающих одинаковый биологический эффект (50% подавление биосинтеза виолацеина; ЕС50). Результат совместного действия двух соединений показан путем нанесения на график точек с координатами, соответствующими концентрациям в композиции, обеспечивающим достижение ЕС50. Комбинация характеризуется как аддитивная при расположении точек на изоболе, супераддитивная, если точка находятся под изоболой и инфрааддитивная при координатах точки выше изоболы. Обозначения: черные квадраты – одновременное использование действующих компонентов; белые квадраты – последовательное использование (при тестировании композиции амикацина с активированным углем).
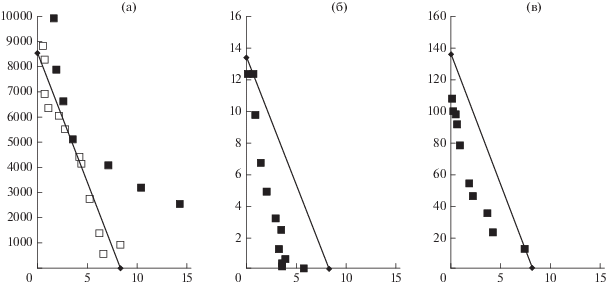
При анализе причин обнаруженного эффекта рассмотрена возможность сорбции амикацина на частицах активированного угля, изменяющей биодоступную концентрацию антибиотика в среде культивирования. Дизайн соответствующего эксперимента предусматривал: 1) внесение исследуемых компонентов в жидкую питательную среду (как описано выше); 2) их совместную инкубацию (60 мин, 25°С); 3) разделение частиц активированного угля с сорбированным антибиотиком и супернатанта с остаточными количествами амикацина; 4) оценку антимикробной активности супернатанта в биотесте подавления роста S. aureus FDA 209P, проявляющего высокую чувствительность к амикацину (МИК100 = 12.5 мкг/мл). В результате проведенного исследования установлено, что степень сорбционного извлечения антибиотика из среды культивирования активированным углем достигала 50–75%, что соответствовало 2–4-кратному увеличению МИК100 амикацина в отношении S. aureus FDA 209P.
С учетом указанного обстоятельства, второй вариант комбинированного использования антибиотика и сорбента включал: 1) воздействие амикацина (0.05–100 мкг/мл) на дикий штамм C. violaceum ATCC 31532; 2) разделение биомассы и культуральной жидкости с накопленным в ней автоиндуктором; 3) 60-минутный контакт последней с навесками активированного угля (1000–30 000 мкг/мл); 4) финальную оценку остаточных количеств автоиндуктора в биотесте с сенсорным штаммом C. violaceum 026, специфически отвечающим биосинтезом пигмента виолацеина на присутствие С6-АГЛ. В результате изменения дизайна эксперимента зарегистрировано смещение кривых дозозависимого эффекта в сторону более низких концентраций антибиотика (рис. 2б), а индексы его комбинированного использования с активированным углем расположились вдоль изоболы, соединяющей значения ЕС50 антибиотика и сорбента (рис. 3а), что характеризовало действие тестированной композиции как аддитивное.
Оценка воздействия комбинации амикацина с малыми молекулами растительного происхождения (кумарином и пирогаллолом) на культуру C. violaceum. Проведение исследований в перекрестной матрице концентраций амикацина (в диапазоне 0.05–100 мкг/мл) с пирогаллолом (0.15–157.64 мкг/мл) или кумарином (1.43–1461.52 мкг/мл) выявило их повышенную биоактивность в тесте подавления QS-зависимого биосинтеза пигмента виолацеина, проявляющуюся в смещении кривых совместного дозозависимого эффекта относительно соответствующего контроля (рис. 2в, 2г). При этом изоболографический анализ (рис. 3б, 3в) свидетельствовал о супераддитивном характере действия подобных композиций, проявляющемся в расположении всех расчетных индексов комбинированного воздействия под прямой, соединяющей значения ЕС50 антибиотика и малых молекул растительного происхождения. Одновременно, на фоне принципиального сходства биоактивности тестируемых композиций, изоболографический анализ фиксировал и их некоторые особенности. Так в присутствии низких концентраций пирогаллола (0.154–12.5 мкг/мл) концентрация амикацина, необходимого для 50% подавления биосинтеза виолацеина, снижалась в 2–3 раза (рис. 3б), в то время как сам амикацин в минимальных концентрациях (0.11–7.5 мкг/мл) обеспечивал аналогичный эффект в отношении анти-QS активности кумарина (рис. 3в).
Кроме того, одновременное воздействие на тестерный штамм антибиотика и пирогаллола или кумарина обусловливало 2–4-кратное снижение МИК100 по амикацину, что позволяло говорить о потенцирующем действии использованных малых молекул в отношении его рост-ингибирующей активности на C. violaceum ATCC 31532.
ОБСУЖДЕНИЕ
Проведенные исследования продемонстрировали анти-QS эффект достаточно разнородной по химическому строению и составу группы соединений, а также позволили охарактеризовать наиболее вероятные механизмы их действия на систему плотностно-зависимой коммуникации на примере тестерного штамма C. violaceum ATCC 31532, синтезирующего пигмент виолацеин под контролем QS системы.
Обнаруженное в присутствии субыингибиторных концентраций антибиотика амикацина подавление кворум-зависимого образования пигмента виолацеина хорошо согласуется с аналогичными эффектами тобрамицина (Garske et al., 2004), канамицина и гентамицина (Дерябин, Инчагова, 2018), что позволяет говорить об универсальности этого типа биологической активности антибиотиков из группы аминогликозидов. По-видимому, антибиотики этой группы имеют и общий механизм действия, а именно: нарушают биосинтез С4-АГЛ – автоиндуктора двухкомпонентной системы rhlI/rhlR у Pseudomonas aeruginosa, показанный ранее (Babic et al., 2010), а также подавляют образование С6-АГЛ – автоиндуктора аналогичным образом организованной системы cviI/cviR у C. violaceum, что показано в нашем настоящем и предшествующем (Дерябин, Инчагова, 2018) исследованиях.
Результаты исследования фармакопейного препарата активированного угля расширяют представления о нем как поливалентном физико-химическом антидоте, эффективно сорбирующем не только алкалоиды, гликозиды, производные фенола и разнообразные токсины (Senderovich, Vierhout, 2018), но и регуляторные молекулы бактериального происхождения, в том числе С6-АГЛ – автоиндуктор системы чувства кворума C. violaceum. Тем самым полученные данные согласуются с ранее описанным нами эффектом активированного угля в отношении N-(β-кетопролил)-L-гомосерин лактона (С6-оксо-АГЛ) – индуктора плотностно-зависимой биолюминесценции Vibrio fischeri (Инчагова и соавт., 2016). Химическая гомология названных лактонов и зарегистрированные в отношении них близкие значения сорбционной емкости объясняют происходящие процессы моделью мономолекулярной адсорбции на однородную поверхность (Лэнгмюра), происходящей по механизму физического закрепления молекул сорбата на поверхности сорбента при участии их гидрофобных фрагментов. В итоге активированный уголь может быть назван вторым (после алкиламин-модифицированного циклодекстрина; Morohoshi et al., 2013) неорганическим соединением, обеспечивающим эффективный “перехват” внеклеточных АГЛ.
Показанные в настоящем исследовании эффекты пирогаллола – компонента ряда растительных экстрактов с доказанной анти-QS активностью (Ni et al., 2008), развивают представления о фенольных соединениях растительного происхождения как регуляторах опосредованной гомосеринлактонами межклеточной коммуникации у C. violaceum и P. aeruginosa (Hossain et al., 2017). При этом, не исключается возможность анти-QS эффекта пирогаллола как дополнительного проявления его про-оксидантной активности (Defoirdt et al., 2013), что не противоречит показанному ранее снижению чувствительности бактериальных клеток к действию автоиндуктора под влиянием другой группы фенольных соединений растительного происхождения – алкилоксибензолов (Дерябин и соавт., 2014). Аналогичные эффекты кумарина хорошо согласуются с представлениями о нем как новом эффективном растительном ингибиторе “чувства кворума” у бактерий (Reen et al., 2018), механизм действия которого также связан со снижением чувствительности к природным и химически синтезированным автоиндукторам у клеток Vibrio splendidus (Zhang et al., 2016), и как показано в настоящем исследовании – у C. violaceum. При этом тонким механизмом действия кумарина, вероятно, является ингибирование метаболизма циклического 3',5'-дигуанилата – внутриклеточного посредника, вовлеченного в регуляцию синтеза бактериальных экзополисахаридов, образования биопленок, адгезии и вирулентности (D Almeida et al., 2017).
Второй блок экспериментов планировался как экспериментальное исследование комбинаций “амикацин + активированный уголь” и “амикацин + пирогаллол или кумарин”, каждый из компонентов которых воздействует на обособленное звено системы плотностно-зависимой коммуникации у C. violaceum ATCC 31532, что позволяло ожидать взаимного потенцирования итогового анти-QS эффекта.
Однако одновременное присутствие амикацина и активированного угля в среде культивирования C. violaceum ATCC 31532 не дало ожидаемого результата, но, напротив, привело к негативному эффекту, что объяснялось сорбцией молекул антибиотика на частицах активированного угля. Разрешением данного конфликта явилось последовательное использование амикацина, который в субынгибиторных концентрациях подавлял продукцию автоиндуктора в растущей культуре C. violaceum ATCC 31532, и затем – активированного угля, обеспечивающего сорбцию остаточных количеств С6-АГЛ из среды культивирования (рис. 4, слева).
Рис. 4.
Механизмы подавления системы автоиндукции у C. violaceum АТСС 31532 при воздействии аминогликозидного антибиотика амикацина в комбинации с активированным углем (слева) и малыми молекулами растительного происхождения – пирогаллолом и кумарином (справа).
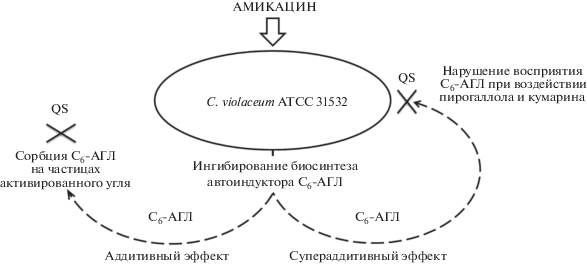
Более однозначные результаты были получены при исследовании композиций “амикацин + + пирогаллол” и “амикацин + кумарин”, во всем диапазоне тестированных субингибиторных концентраций действующих компонентов проявивших выраженный супераддитивный анти-QS эффект. Механизм его формирования может быть объяснен подавлением образования С6-АГЛ под действием антибиотика, остаточные количества которого оказываются неспособными к индукции кворум-зависимых реакций у бактериальных клеток, вследствие снижения их чувствительности к автоиндуктору под действием малых молекул растительного происхождения (рис. 4, справа).
Обсуждая фундаментальный аспект полученного результата, следует отметить реальность формирования синергетических композиций “антибиотик + малые молекулы растительного происхождения” в природных экологических нишах, в частности – почвах, что определяется типичным присутствием бактерий, синтезирующих антибиотики, в микробных сообществах ризосферы растений (Poomthongdee et al., 2015). Одним из вариантов биологической целесообразности таких синергетических композиций является совместное противодействие растительно-бактериальных симбиозов колонизации фитопатогенными микроорганизмами, использующими стереотипно устроенные системы плотностно-зависимой коммуникации для индукции своего патогенного потенциала (Ansari, Ahmad, 2018).
Практически-ориентированный аспект проведенного исследования заключается в обосновании комбинированного использования амикацина (а в перспективе и других антибиотиков из группы аминогликозидов) в сочетании с активированным углем и малыми молекулами растительного происхождения как средства борьбы с инфекционными агентами, использующими системы “кворум сенсинга” для образования биопленок и индукции своего патогенного потенциала. При этом на фоне принципиальной возможности разобщенного во времени применения антибиотика и активированного угля, более предпочтительным является использование комбинаций амикацина с пирогаллолом или кумарином, что определяет перспективу их дальнейшего доклинического и клинического исследования.
Исследования выполнены при финансовой поддержке Российского научного фонда (проект № 16-16-10048).
Список литературы
Дерябин Д.Г., Инчагова К.С. Ингибирующий эффект аминогликозидов и тетрациклинов на систему “кворум сенсинга” Сhromobacterium violaceum // Микробиология. 2018. Т. 87. № 1. С. 3–11.
Deryabin D.G., Inchagova K.S. Inhibitory effect of aminoglycosides and tetracyclines on Quorum sensing in Chromobacterium violaceum // Microbiology (Moscow). 2018. V. 87. P. 1–8.
Инчагова К.С., Строганова Е.А., Дерябин Д.Г. Сорбционные свойства активированного угля в отношении N-(бета-кетокапроил)-L-гомосерин лактона, оцененные с использованием индуцибельного бактериального lux-биосенсора // Вопросы биологической, медицинской и фармацевтической химии. 2016. Т. 19. № 11. С. 11–15.
Дерябин Д.Г., Камаева А.А., Толмачева А.А., Эль-Регистан Г.И. Влияние алкилоксибензолов на индуцируемые гомосеринлактонами проявления кворум сенсинга у бактерий // Прикл. биохимия и микробиология. 2014. Т. 50. № 4. С. 391–397.
Deryabin D.G., Kamayeva A.A., Tolmacheva A.A., El-Re-gistan G.I. The effects of alkylhydroxybenzenes on homoserine lactone-induced manifestations of quorum sensing in bacteria // Appl. Biochem. Microbiol. 2014. V. 50. P. 353–358.
Кожевин П.А., Виноградова К.А., Булгакова В.Г. Природные функции антибиотиков как “информбиотиков” // Вестн. Московского ун-та. Сер. 17. Почвоведение. 2014. Т. 3. С. 3–9.
Kozhevin P.A., Vinogradova K.A., Bulgakova V.G. Natural functions of antibiotics as "informbiotics" // Moscow University Soil Science Bulletin. 2014. V. 69. № 3. P. 93–98.
Хмель И.А. Quorum-sensing регуляция экспрессии генов: фундаментальные и прикладные аспекты, роль в коммуникации бактерий // Микробиология. 2006. Т. 75. № 4. С. 457–464.
Khmel I.A. Quorum-sensing regulation of gene expression: Fundamental and applied aspects and the role in bacterial communication // Microbiology (Moscow). 2006. V. 75. P. 390–397.
Ansari F.A., Ahmad I. Quorum sensing in phytopathogenic bacteria and its relevance in plant health. In: Kalia V. (eds) Biotechnological Applications of Quorum Sensing Inhibitors. Springer, Singapore. 2018, pp. 351−370.
Babic F., Venturi V., Maravic-Vlahovicek G. Tobramycin at subinhibitory concentration inhibits the RhlI/R Quorum sensing system in a Pseudomonas aeruginosa environmental isolate // BMC Infect. Diseases. 2010. V. 10. P. 148.
Brackman G., Cos P., Maes L., Nelis H.J., Coenye T. Quorum sensing inhibitors increase the susceptibility of bacterial biofilms to antibiotics in vitro and in vivo // Antimicrob. Agents Chemother. 2011. V. 55. P. 2655–2661.
D Almeida R.E., Molina R.D., Viola C.M., Luciardi M.C., Nieto Penalver C., Bardon A., Arena M.E. Comparison of seven structurally related coumarins on the inhibition of Quorum sensing of Pseudomonas aeruginosa and Chromobacterium violaceum // Appl. Microbiol. Biotechnol. 2017. V. 101. P. 3371–3378.
Defoirdt T., Pande G.S., Baruah K., Bossier P. The apparent quorum-sensing inhibitory activity of pyrogallol is a side effect of peroxide production // Antimicrob. Agents Chemother. 2013. V. 57. P. 2870–2873.
Garske L.A., Beatson S.A., Leech A.J., Walsh S.L., Bell S.C. Sub-inhibitory concentrations of ceftazidime and tobramycin reduce the Quorum sensing signals of Pseudomonas aeruginosa // Pathology. 2004. V. 36. P. 571–575.
Greenberg E.P., Winans S., Fuqua C. Quorum sensing by bacteria // Ann. Rev. Microbiol. 1996. V. 50. P. 727–751.
Hossain M.A., Lee S.J., Park N.H., Mechesso A.F., Birhanu B.T., Kang J.W., Reza M.A., Suh J.W., Park S.C. Impact of phenolic compounds in the acyl homoserine lactone-mediated Quorum sensing regulatory pathways // Sci. Rep. 2017. V. 7. P. 10618.
Jakobsen T.H., Gennip M., Phipps R.K., Shanmugham M.S., Christensen L.D., Alhede M., Skindersoe M.E., Rasmussen T.B., Friedrich K., Uthe F., Jensen P.O., Moser C., Nielsen K.F., Eberl L., Larsen T.O., Tanner D., Hoiby N., Bjarnsholt T., Givskov M. Ajoene, a sulfur-rich molecule from garlic, inhibits genes controlled by quorum sensing // Antimicrob. Agents Chemother. 2012. V. 56. P. 2314–2325.
Lindsay A., Ahmer B.M.M. Effect of sdiA on biosensors of N-acylhomoserine lactones // J. Bacteriol. 2005. V. 187. P. 5054−5058.
McClean K.H., Winson M.K., Fish L., Taylor A. Quorum sensing and Chromobacterium violaceum: exploitation of violacein production and inhibition for the detection of N-acylhomoserine lactones // Microbiology (UK). 1997. V. 143. P. 3703−3711.
Morohoshi T., Tokita K., Ito S., Saito Y., Maeda S., Kato N., Ikeda T. Inhibition of Quorum sensing in gram-negative bacteria by alkylamine-modified cyclodextrins // J. Biosci. Bioeng. 2013. V. 116. P. 175–179.
Ni N., Choudhary G., Li M., Wang B. Pyrogallol and its analogs can antagonize bacterial quorum sensing in Vibrio harveyi // Bioorg. Med. Chem. Lett. 2008. V. 18. P. 1567–1572.
Poomthongdee N., Duangmal K., Pathom-aree W. Acidophilic actinomycetes from rhizosphere soil: diversity and properties beneficial to plants // J. Antibiot. (Tokyo). 2015. V. 68. № 2. P. 106–114.
Reen F.J., Gutierrez-Barranquero J.A., Parages M.L., O Gara F. Coumarin: a novel player in microbial Quorum sensing and biofilm formation inhibition // Appl. Microbiol. Biotechnol. 2018. V. 102. P. 2063–2073.
Remy B., Mion S., Plener L., Elias M., Chabriere E., Daude D. Interference in bacterial Quorum sensing: a biopharmaceutical perspective // Front. Pharmacol. 2018. V. 9. P. 203.
Senderovich H., Vierhout M.J. Is there a role for charcoal in palliative diarrhea management? // Curr. Med. Res. Opin. 2018. V. 34. P. 1253–1259.
Skindersoe M.E., Alhede M., Phipps R., Yang L., Jensen P.O., Rasmussen T.B., Bjarnsholt T., Tolker-Nielsen T., Hoiby N., Givskov M. Effects of antibiotics on Quorum sensing in Pseudomonas aeruginosa // Antimicrob. Agents Chemother. 2008. V. 52. P. 3648–3663.
Stauff D.L., Bassler B.L. Quorum sensing in Chromobacterium violaceum: DNA recognition and gene regulation by the CviR receptor // J. Bacteriol. 2011. V. 193. P. 3871–3878.
Swatton J.E., Davenport P.W., Maunders E.A., Griffin J.L., Lilley K.S., Welch M. Impact of azithromycin on the quorum sensing controlled proteome of Pseudomonas aeruginosa // PLoS One. 2016. V. 11. P. e0147698.
Tallarida R.J. An overview of drug combination analysis with isobolograms: perspectives in pharmacology // Pharmacol. Exp. Ther. 2006. V. 3. № 19. P. 1–7.
Waters C.M., Bassler B.L. Quorum sensing: Cell-to-cell communication in bacteria // Annu. Rev. Cell. Dev. Biol. 2005. V. 21. P. 319–346.
Zhang S., Liu N., Liang W., Han Q., Zhang W., Li C. Quorum sensing-disrupting coumarin suppressing virulence phenotypes in Vibrio splendidus // Appl. Microbiol. Biotechnol. 2016. V. 101. P. 3371–3378.
Zhou J.W., Chen T.T., Tan X.J., Sheng J.Y., Jia A.Q. Can the quorum sensing inhibitor resveratrol function as an aminoglycoside antibiotic accelerant against Pseudomonas aeruginosa? // Int. J. Antimicrob. Agents. 2018. V. 52. P. 35–41.
Zhou J.W., Hou B., Liu G.Y., Jiang H., Sun B., Wang Z.N., Shi R.F., Xu Y., Wang R., Jia A.Q. Attenuation of Pseudomonas aeruginosa biofilm by hordenine: a combinatorial study with aminoglycoside antibiotics // Appl. Microbiol. Biotechnol. 2018. P. 1–14.
Дополнительные материалы отсутствуют.


