Микробиология, 2019, T. 88, № 2, стр. 137-143
Оптимизация фракционирования и структурный анализ реактивирующего фактора Luteococcus japonicus subsp. casei
Е. А. Рогожин a, b, Л. И. Воробьева c, *, Е. Ю. Ходжаев c, Е. С. Герасимов c
a Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, Россия
b Институт по изысканию новых антибиотиков им. Г.Ф. Гаузе
119435 Москва, Россия
c Московский государственный университет им. М.В. Ломоносова, биологический факультет
119192 Москва, Россия
* E-mail: livorobjeva@mail.ru
Поступила в редакцию 25.09.2018
После доработки 20.11.2018
Принята к публикации 30.11.2018
Аннотация
Определена химическая структура внеклеточного реактивирующего фактора (РФ) Luteococcus ja-ponicus subsp. casei, способствующего выживанию малочисленной субпопуляции клеток продуцента при летальных стрессорных воздействиях. Для очистки и выделения РФ был оптимизирован разработанный нами ранее метод выделения РФ из Saccharomyces cerevisiae. В результате, из культуральной жидкости Luteococcus casei было получено 15 фракций, у двух из которых (I и IV) обнаружена реактивирующая активность в отношении клеток, подвергнутых летальному стрессовому воздействию – УФ-облучению. Метод включал твердофазную экстракцию пептидов на гидрофобном сорбенте с фазой С8 с их последующим многоступенчатым разделением и использованием аналитической ОФ-ВЭЖХ. С помощью масс-спектрометрического анализа (MALDI-TOF) были определены молекулярные характеристики фракции IV. Для фракции I не удалось получить эффективной ионизации. Для фракции IV масс-заряды составили 773.394 и 788.102 Да. Методом автоматического секвенирования по Эдману эти компоненты были идентифицированы как пептиды: Ala-Pro-Asn-Glu-Asn-Gln-Gly и Ala-Pro-Asn-Glu-Glu-Gln-Gly. По базам данных первичных структур полипептидов для них не выявлено сходства с известными полноразмерными функциональными пептидными молекулами. Предположительно, образование биологически активных пептидов L. casei связано с нематричным синтезом, возможно, с протеолизом крупного белка.
Изучение стрессовых реакций микроорганизмов и выяснение механизмов их формирования относятся к важнейшим аспектам фундаментальной биологии. Эволюционно выработанную устойчивость микроорганизмов к стрессорам различной природы рассматривают как основную причину растущей неэффективности антимикробной терапии. В природных условиях способность микроорганизмов противостоять стрессорным воздействиям за счет продуцирования внеклеточных соединений играет важную роль в формировании и поддержании гомеостаза микробных сообществ. В наших предыдущих исследованиях была продемонстрирована способность бактерий, архей и низших эукариот (дрожжей) продуцировать внеклеточные соединения пептидной природы, обладающие протекторным и реактивирующим действием в отношении клеток как самих продуцентов, так и представителей других доменов, которые подвергались воздействию различных стрессоров, в том числе, УФ-облучению, нагреванию, действию окислителей, солей желчных кислот (Воробьева и соавт., 2013, 2015).
Тест-объектами, подвергавшимися летальным воздействиям, были грамположительные и гр-амотрицательные бактерии (Воробьева и соавт., 2010б; Воробьева и соавт., 2013), дрожжи различных физиологических и экологических групп (Воробьева и соавт., 2011), археи (Воробьева и соавт., 2013). Основным модельным организмом для изучения закономерностей образования реактивирующего фактора (РФ), его физико-химических характеристик, условий проявления биологической активности была бактерия Luteococcus japonicus subsp. casei (L. casei). Выбор объекта был обусловлен его широкими адаптационными свойствами, что проявлялось в способности утилизировать разнообразные субстраты (Vorobjeva, 1999; Thorenoor et al., 2009) и распространении представителей рода Luteococcus в широком ареале окружающей среды. Штаммы Luteococcus sp. были выделены из почвы и воды (Tamura et al., 1994), молочных продуктов и сыра (Воробьева и соавт., 1983), образцов крови (Collins et al., 2003), глубоких морских осадков Тихого океана (Fan et al., 2014), активного ила стоков очистных сооружений целлюлозо-перерабатывающих предприятий (Thorenoor et al., 2009).
Штамм L. japonicus subsp. casei был выделен нами из сыра “Советский”. Молекулярно-биологические исследования, риботипирование, рестрикционный анализ 16S и 23S рДНК-фрагментов показали, что выделенный штамм в составе рода Luteococcus должен быть включен в семейство Propionibacteriaceae (Van Niewholtz, 1998; Vorobjeva, 1999). Ближайшим родственником штамма является Propioniferax innocuum. Ранее из культуральной жидкости L. casei нами был выделен реактивирующий фактор (РФ), обладающий протекторным и реактивирующим действием в отношении клеток, как продуцента, так и других организмов: бактерий, архей и дрожжей. Было показано, что РФ имеет пептидную природу и представлен комплексом, в состав которого входят две активные фракции (Воробьева и соавт., 2015). РФ синтезируется и экскретируется неповрежденными клетками в нормальных условия роста в крайне низких концентрациях (Воробьева и соавт., 2013). Была установлена обратная зависимость между силой стрессорного воздействия и эффективностью РФ (уровнем выживаемости клеток микроорганизмов) (Воробьева и соавт., 2011, 2013). Таким образом, функционирование РФ имеет особое значение при стрессах летальной интенсивности. РФ не проявляет строгой видоспецифичности, что выражается в междоменном перекрестном действии препарата (Воробьева и соавт., 2013). Тип концентрационной зависимости, высокая скорость реактивирующего действия и устойчивость к стрессорным воздействиям предполагают сигнальный механизм действия пептидного РФ (Воробьева и соавт., 2009). С использованием сконструированного тестерного штамма Escherichia coli, несущего оперон umuD-lacZ, было установлено, что протекторное действие РФ не связано с индукцией SOS-ответа (Лойко и соавт., 2013) и, по-видимому, обеспечивается действием РФ сигнального типа на цитоплазматическую мембрану клеток.
Целью настоящей работы было идентифицировать структуру реактивирующего фактора пептидной природы L. casei.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования и условия культивирования. Объектом исследования была грамположительная бактерия Luteococcus japonicus subsp. casei, первоначально выделенная из сыра (Воробьева и соавт., 1983). Штамм выращивали в статических условиях при 32°С в колбах со 100 мл глюкозо-минеральной среды следующего состава (%): глюкоза – 1.0, (NH4)2SO4 – 0.3, KH2PO4 – 0.1, NaH2PO4 – 0.2, MgSO4 – 0.002, CaCl2 – 0.002, NaCl – 0.002, дрожжевой экстракт – 0.1; pH 7.0. Культуру L. casei фазы линейного роста центрифугировали (10 000 g, 20 мин), культуральную жидкость (КЖ) использовали для выделения РФ. Клетки L. casei дважды отмывали 0.05 М Na-фосфатным буферным раствором, рН 7.4, и суспендировали в том же буфере до клеточной плотности ОП540 = 0.4–0.6. Клеточную суспензию использовали для определения биологической активности РФ.
Определение активности РФ. КЖ пропускали через нитроцеллюлозный мембранный фильтр диаметром 0.22 мкм (“Millipore”, США), адсорбированные на нем компоненты элюировали 3%-ным раствором NaCl c последующим пропусканием раствора через мембранный фильтр c низким сродством к белку (“Pall”, США) для полного удаления клеток.
Численность клеток в суспензиях L. сasei, различных штаммов дрожжей, молочнокислых и пропионовокислых бактерий определяли по титру колониеобразующих единиц (КОЕ/мл) после высева 10N-кратно разведенных суспензий на соответствующие плотные среды с 2% агаром. Использовали микрометод высева с внесением аликвот суспензий объемом 5 мкл в шестикратной повторности для каждого разведения.
Выделение и определение структуры реактивирующего фактора. В настоящем исследовании использовали разработанную ранее схему фракционирования и очистки полипептидных компонентов, секретируемых L. casei в культуральную жидкость (Воробьева и соавт., 2015). Культуральную жидкость обессоливали, концентрировали и фракционировали методом аффинной хроматографии на колонке Heparin HiTrap Sepharose (“GE HealhCare”, Швеция). Несвязавшуюся с сорбентом анионную суммарную фракцию рехроматографировали методом аналитической обращенно-фазовой (ОФ) ВЭЖХ на колонке Vydac C18 Protein & Peptide 4.6 × 250 мм (“GraceVydac”, США). Хроматографию осуществляли, используя линейный градиента растворителя Б (80%-ый CH3CN, 0.1% ТФУ) относительно растворителя А (0.1% ТФУ) от 0 до 50% в течение 50 мин при скорости потока мобильной фазы 1 мл/мин. Пептиды детектировали по поглощению при длине волны 214 нм. Молекулярные массы активных компонентов измеряли на MALDI-масс-спектрометре Ultraflex (“Bruker Daltonics”, Германия), оснащенном УФ-лазером (337 нм) в режиме положительных ионов. В качестве матрицы использовали 2,5-дигидроксибензойную кислоту. На мишени смешивали равные объемы (1 мкл) образцов и матрицы (20 мг матрицы/мл в 80% водном CH3CN, 0.1% ТФУ в деионизованной воде MQ), полученную смесь высушивали на воздухе. Масс-спектры анализировали с помощью программы FlexAnalysis for TOF. Ошибка измерения составляла 2 ppm. Первичную структуру биологически активного пептида определяли методом автоматической ступенчатой деградации по методу Эдмана на автоматическом секвенаторе белков и пептидов PPSQ-33A (“Shimadzu Corp.”, Япония) в соответствии с протоколом фирмы-производителя. Полученные экспериментальные данные интерпретировали с помощью программного обеспечения LabSolutions (“Shimadzu Corp.”, Япония). Поиск гомологий аминокислотных последовательностей проводили по базам данных UniProt/SwissProt и trEMBL с применнием алгоритма BLASTP, поиск транслированных последовательностей осуществляли на основании аннотированного генома L. casei, любезно предоставленного V. Loux (Collective Genomes Gbk 17320. contigs final gbk).
Определение биологической активности РФ. В качестве стрессорных факторов использовали УФ-облучение, соли желчных кислот и окислительный стресс. Источником УФ-облучения служила установка из двух параллельно-смонтированных ламп БУВ-15 (Россия) мощностью 30 Вт, основная часть эмиссии которых приходилась на область 253.7 нм. В предварительных экспериментах была установлена зависимость “доза–ответ”. При дозе облучения 81 Дж/м2 выживаемость облучаемых клеток составляла 0.01–0.03%. Для определения целевой активности суспензию клеток до или после стрессорного воздействия инкубировали с РФ в течение 10 и 15 мин соответственно. Реактивирующий эффект оценивали сравнением жизнеспособных клеток (КОЕ), выросших на плотной среде (2% агара) в опытном и контрольном вариантах; в последний при облучении не вносили реактивирующий фактор. Выживаемость бактерий в опытных и контрольных вариантах выражали в процентах по отношению к необлученному контролю. В качестве тест-объектов использовали клетки продуцента РФ, Luteococcus casei, а также клетки молочнокислых бактерий из музея кафедры микробиологии (МГУ, биологический факультет): Lactobacillus acidophilus (Lb. acidophilus), Lactobacillus casei (Lb. casei). Пропионовокислые бактерии Propionibacterium freudenreichii (№ 1857), P. acidipropionici (№ 1859) получены из Чешской коллекции микроорганизмов (ССM). Дрожжи Saccharomyces cerevisiae ВКПМ Y-1200 – из Всероссийской коллекции промышленных микроорганизмов. Суспензии клеток тестерных штаммов получали, как описано выше.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Биологическая характеристика РФ. Бактерия L. casei – факультативный анаэроб, представлен неподвижными, неспорообразующими крупными шарообразными клетками, которые образуют оранжевые колонии на поверхности агара. Основными продуктами брожения являются пропионовая и уксусная кислоты, в незначительных количествах образуются каприловая, изокапроновая, масляная, капроновая, муравьиная кислоты (Воробьева и соавт., 2014). Ранее было показано, что кратковременная (10–15 мин) пред- или постынкубация клеток L. casei с фракцией внеклеточных пептидных метаболитов различной степени очистки, подвергнутых УФ-облучению и нагреванию, увеличивает численность выживаемых бактерий (Воробьева и соавт., 2003).
Фракция внеклеточных пептидов, именуемая РФ (реактивирующий фактор), выделенная из КЖ L. casei, оказывала защитное действие в отношении подвергнутых стрессу клеток не только продуцента, но и других объектов прокариотной и эукариотной природы.
Пептидные экзометаболиты с антистрессовыми свойствами образуются и выделяются клетками в среду в условиях, благоприятных для нормального роста микроорганизмов, и накапливаются в среде к началу стационарной фазы роста (табл. 1).
Таблица 1.
Реактивирующее действие РФ L. casei на подвергнутые стрессу клетки микроорганизмов
| Тест-объект, стрессорное воздействие | Численность клеток, КОЕ/мл | ||
|---|---|---|---|
| до стресса (К1) (%) | после стресса (К2) (%) | после стресса и инкубации с РФ (%) | |
| L. casei экспоненциальная фаза, УФ-облучение* | 175 × 105 (100) | 0.12 × 105 (0.07) | 0.47 × 105 (0.27) |
| L. casei стационарная фаза, УФ-облучение* | 200 × 105 (100) | 0.012 × 105 (0.06) | 0.22 × 105 (0.11) |
| L. casei, Н2О2** | 212 × 106 (100) | 25 × 106 (11.8) | 182 × 106 (85.8) |
| S. cerevisiae, УФ-облучение* | 130 × 105 (100) | 0.012 × 105 (0.009) | 0.050 × 105 (0.038) |
| Lb. casei, желчные соли*** | 50 × 106 (100) | 0.042 × 106 (0.084) | 0.554 × 106 (1.11) |
| Lb. acidophilus, желчные соли*** | 160 × 106 (100) | 0.441 × 106 (0.275) | 1.880 × 106 (1.175) |
| P. freudenreichii, желчные соли*** | 130 × 106 (100) | 0.014 × 106 (0.011) | 0.032 × 106 (0.025) |
| P. acidipropionici, желчные соли*** | 100 × 106 (100) | 0.031 × 106 (0.031) | 0.064 × 106 (0.064) |
РФ проявляет универсальность защитного действия в отношении клеток, подвергаемых неродственным стрессам: УФ-облучению, нагреванию, действию окислителей, солей желчных кислот (табл. 1).
Установлена обратная зависимость эффективности защитного (протекторного) и реактивирующего действия РФ и степени выживаемости стрессированных клеток. Наиболее высокий антистрессовый эффект экзометаболита проявляется при чрезвычайно низкой численности выживаемых после летального воздействия клеток (0.01–0.1%). При этом протекторный эффект (предынкубация с РФ) был в разы больше выражен, чем реактивирующий (постынкубация с РФ), проявляемый после летального воздействия (Воробьева и соавт., 2003). Отмечено также, что эффективность реактивации клеток L. casei стационарной фазы была в 2 раза ниже, чем клеток логарифмической фазы роста (Воробьева и соавт., 2009).
Универсальность биологического действия РФ проявлялась в отношении микроорганизмов различных таксонов, включая пробиотические, в условиях действия на них стрессорных факторов различной природы (табл. 1).
Обнаруженные и перечисленные закономерности проявления биологической активности РФ предполагают, что его эффекты связаны с образованием малочисленной субпопуляции стрессоустойчивых клеток-персистеров. Возможно, РФ индуцирует фенотипический переход регулярных вегетативных клеток в персистеры, что объясняет его существенно больший эффект в вариантах предынкубации культуры до стрессорного воздействия, по сравнению с вариантом постынкубации (до 10 раз). Однако нельзя исключить также возможного действия РФ на стадии индукции обратного перехода персистеров к вегетативному росту. В этом случае большая эффективность РФ при предынкубации может объясняться повышением его биологической активности за счет УФ-облучения. Этому объяснению не противоречат данные о повышении эффективности РФ при его облучении (в составе очищаемой фракции) до действия на клетки в варианте постынкубации (Воробьева и соавт., 2010а)
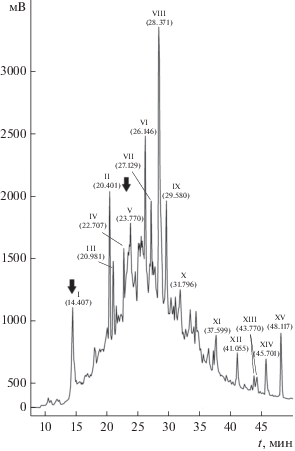
Определение структуры внеклеточного РФ L. casei. Для выделения внеклеточного РФ из культуральной жидкости L. casei был использован оптимизированный протокол, включающий твердофазную экстракцию (обессоливание) концентрата КЖ на гидрофобном сорбенте с фазой С8, с последующим упариванием, лиофилизацией и разделением путем аффинной хроматографии в ступенчатом градиенте увеличения концентрации NaCl от 0 до 1 М. Всю суммарную не связавшуюся фракцию без этапа разделения методом аналитической градиентной анионообменной хроматографии разделяли путем ОФ-ВЭЖХ, в результате чего были собраны 15 преобладающих фракций, обозначенных I–XV (рис. 1). Эти фракции были лиофилизованы для удаления остаточных количеств ТФУ. Результаты тестирования фракций на искомый реактивирующий эффект показали его наличие только в двух компонентах (I и IV). Для определения структурной характеристики обе фракции были проанализированы методом MALDI-TOF масс-спектрометрии. Для фракции I не удалось получить эффективной ионизации и, соответственно, сигналов масс-спектра, в то время как для компонента IV масс-заряды составили 773.394 и 788.102 Да. Дальнейшая идентификация данной активной фракции проводилась методом автоматического ступенчатого секвенирования по Эдману, в результате чего были установлены полные аминокислотные последовательности двух пептидов, находящихся в составе компонента IV: 1Ala-Pro-Asn-Glu-Asn-Gln-Gly8 (пептид IV-1) и 1Ala-Pro-Asn-Glu-Glu-Gln-Gly8 (пептид IV-2). Следовательно, оба пептида высоко гомологичны и различаются единственной аминокислотной заменой Asn5Glu. Их образование, по-видимому, не связано с матричным синтезом, т.к. такие последовательности не обнаружены в геноме L. casei (V. Loux, Collective Genomes Gbk). Поиск гомологий по базам данных первичных структур полипептидов не выявил сходства с какими-либо известными полноразмерными функциональными пептидными молекулами. Однако, на основании полученных данных, можно с некоторой значимой долей вероятности утверждать, что этот пептид является фрагментом частичного протеолиза более крупного белка. Характерно, что, согласно геномным данным, этот белок может содержать уникальный повторяющийся мотив типа APNENQCAPNENQCAPNENQC, который в дальнейшем подвергается ограниченному протеолизу с образованием коротких последовательностей с сигнальной функцией. Кроме того, дополнительным аргументом в пользу протеолизного происхождения РФ может являться частичное совпадение данной короткой последовательности с отдельными участками ряда бактериальных белков по данным (GenBank reference sequence IDs: WP_012104305.1, WP_007615369.1, WP_020569836.1). Идентифицированные пептиды не имеют никакой гомологии с определенным ранее РФ, обладающим функциями стрессового “реактиватора” из пекарских дрожжей (S. cerevisiae) (Воробьева и соавт., 2017), однако близкие физико-химические свойства, а также схожие предсказанные элементы вторичной структуры по типу “random coil”, свидетельствуют в пользу присутствия в филогенетически удаленных живых организмах, принадлежащих к различным царствам, схожих механизмов генерации сигнальных пептидов в ответ на стрессорные воздействия.
Рис. 1.
ОФ-ВЭЖХ-профиль фракционирования несвязавшейся фракции после разделения обессоленного концентрата внеклеточной жидкости L. japonicus методом аффинной хроматографии в ступенчатом градиенте. Собранные фракции обозначены римскими цифрами (I–XV), времена их удерживания на колонке подписаны. Черными стрелками указаны пики, продемонстрировавшие наличие реактивирующего эффекта.
Список литературы
Воробьева Л.И., Турова Т.П., Краева Н.И., Алексеева М.А. Пропионовокислые кокки и их систематическое положение // Микробиология. 1983. Т. 52. № 3. С. 465–471.
Vorob’eva L.I., Turova T.P., Kraeva N.I., Alekseeva A.A. Propionic acid cocci and their systematic position // Microbiology (Moscow). 1983. V. 52. P. 368–374.
Воробьева Л.И., Ходжаев Е.Ю., Пономарева Г.М. Внеклеточный белок Luteococcus japonicus subsp. casei реактивирует клетки, инактивированные ультрафиолетовым облучением и нагреванием // Микробиология. 2003. Т. 72. № 4. С. 482–487.
Vorobjeva L.I., Khodjaev E.Yu., Ponomareva G.M. The extracellular protein of Luteococcus japonicus subsp. reactivates cells inactivated by UV-irradiation or heat shock // Microbiology (Moscow). 2003. V. 72. P. 482–487.
Воробьева Л.И., Ходжаев Е.Ю., Мулюкин А.Л., Торопыгин И.Ю. Механизм действия реактивирующего фактора Luteococcus japonicus subsp. casei // Прикл. биохимия и микробиология. 2009. Т. 45. № 5. С. 544–549.
Vorobjeva L.I., Khodzhaev E.Yu., Mulyukin A.L., Toropygin I.Yu. The mechanism of action of reactivating factor from Luteococcus japonicus subsp. casei // Appl. Biochem. Microbiol. 2009. V. 45. P. 489–493.
Воробьева Л.И., Ходжаев Е.Ю. Протекторное и реактивирующее действие белкового экзометаболита на клетки дрожжей, инактивированные ультрафиолетовым излучением // Прикл. биохимия и микробиология. 2010. Т. 46. № 2. С. 191–197.
Vorobjeva L.I., Khodzhaev E.Yu. Protective and reactivating effect of the protein exometabolite on yeast cells inactivated by the ultraviolet irradiation // Appl. Biochem. Microbiol. 2010. V. 46. P. 177–183.
Воробьева Л.И., Федотова А.В., Ходжаев Е.Ю. Защитное действие реактивирующего фактора Luteococcus j-aponicus subsp. casei на инактивированные УФ-светом клетки репарационных мутантов Escherichia coli // Прикл. биохимия и микробиология. 2010. Т. 46. № 6. С. 617–623.
Vorobjeva L.I., Fedotova A.V., Khodzhaev E.Yu. Protective action of reactivating factor of Luteococcus japonicus subsp. casei toward cells of Escherichia coli reparation mutants inactivated with UV-light // Appl. Biochem. Microbiol. 2010. V. 46. P. 567–573.
Воробьева Л.И., Ходжаев Е.Ю., Вустин М.М. Перекрестная антистрессовая защита УФ-облученных клеток дрожжей при участии внеклеточных пептидных факторов // Прикл. биохимия и микробиология. 2011. Т. 47. № 3. С. 291–296.
Vorobjeva L.I., Khodzhaev E.Yu., Vustin M.M. Extracellular protein metabolite of Luteococcus japonicus subsp. casei reactivates cells subjected to oxidative stress // Appl. Biochem. Microbiol. 2011. V. 47. P. 264–269.
Воробьева Л.И., Ходжаев Е.Ю., Новикова Т.М., Мулюкин А.Л., Чудинова Е.М., Козлова А.Н., Эль-Регистан Г.И. Стресс-защитное и перекрестное действие внеклеточного реактивирующего фактора микроорганизмов доменов бактерий, архей и эукариот // Микробиология. 2013. Т. 82. № 5. С. 588–594.
Vorobjeva L.I., Khodzhaev E.Yu., Novikova T.M., Mulyukin A.L., Chudinova E.M., Kozlova A.N., El’-Registan G.I. Stress-protective and cross action of the extracellular reactivating factor of the microorganisms of the domains bacteria, archaea, and eukaryota // Microbiology (Moscow). 2013. V. 82. P. 594–599.
Воробьева Л.И., Рогожин Е.А., Ходжаев Е.Ю., Николаев И.В., Турова Т.П. Реактивирующий фактор Luteococcus ja-ponicus subsp. casei: выделение и характеристика // Прикл. биохимия и микробиология. 2015. Т. 51. № 1. С. 37–45.
Vorob’eva L.I., Rogozhin E.A., Khodzhaev E.Yu., Nikolaev I.V., Turova T.P. Reactivating factor of Luteococcus japonicus subsp. casei: isolation and characterization // Appl. Biochem. Microbiol. 2015. V. 51. P. 44–51.
Воробьева Л.И., Ходжаев Е.Ю., Рогожин Е.А., Самойленко B.A., Харченко Н.В. Структурная характеристика и защитное действие внеклеточных пептидных метаболитов Luteococcus japonicus subsp. casei на пробиотические бактерии // Микробиология. 2015. Т. 84. № 4. С. 438–449.
Vorobjeva L.I., Khodzhaev E.Yu., Rogozhin E.A., Samoilenko V.A., Kharchenko N.V. Structural characterization of the extracellular peptide metabolites of Luteococcus japonicus subsp. casei and their protective effect on probiotic bacteria // Microbiology (Moscow). 2015. V. 84. P. 502–511.
Воробьева Л.И., Ходжаев Е.Ю., Рогожин Е.А., Чердынцева Т.А., Нетрусов А.И. Характеристика и стрессозащитное действие внеклеточных пептидных факторов дрожжей в отношении пробиотических молочнокислых бактерий // Микробиология. 2016. Т. 85. № 4. С. 393–402.
Vorob’eva L.I., Khodzhaev E.Yu., Rogozhin E.A., Cherdyntseva T.A., Netrusov A.I. Characterization of extracellular yeast peptide factors and their stress-protective effect on probiotic lactic acid bacteria // Microbiology (Moscow). 2016. V. 85. № 4. P. 411–419.
Воробьева Л.И., Рогожин Е.А., Ходжаев Е.Ю., Володяшкин Р.А., Самойленко В.А. Характеристика и стрессозащитное действие внеклеточных пептидных факторов Saccharomyces cerevisiae на пропионовокислые бактерии // Микробиология. 2017. Т. 86. № 6. С. 684–695.
Vorob’eva L.I., Rogozhin E.A., Khodzhaev E.Yu., Volodyazhkin R.A., Samoilenko V.A. Characterization and stress-protective action of Saccharomyces cerevisiae extracellular peptide factors on propionic acid bacteria // Microbiology (Moscow). 2017. V. 86. P. 698–707.
Лойко Н.Г., Воробьева Л.И., Ходжаев Е.Ю., Козлова А.Н., Гальченко В.Ф, Эль-Регистан Г.И. Действие реактивирующего фактора Luteococcus japonicus subsp. casei на экспрессию генов SOS-ответа // Микробиология. 2013. Т. 82. № 2. С. 139–146.
Loiko N.G., Vorob’eva L.I., Khodzhaev E.Yu., Kozlova A.N., Gal’chenko V.F., El’ Registan G.I. Effect of the reactivating factor of Luteococcus japonicus subsp.casei on the expression of SOS response genes // Microbiology (Moscow). 2013. V. 82. P. 126–132.
Collins M.D., Hitson R.A., Nikolaitchouk N., Nyberg A., Folsen E. Luteococcus sanguinis sp. nov., isolated from human blood // Int. J. Syst. Evol. Microbiol. 2003. V. 53. P. 1889–1891.
Fan X., Zhang Z., Zhang X.H. Luteococcus sediminum sp. nov., isolated from subseafloor sediment of the South Pacific Gyre // Int. J. Evol. Microbiol. 2014. V. 64. P. 2522–2527.
Tamura T., Takaechi M., Yokota A. Luteococcus japonicus gen. nov., sp., nov., a new gram-positive coccus with LL-diaminopimelic acid in the cell wall // Int. J. Syst. Bacteriol. V. 44. P. 348–356.
Thorenoor N., Kim Y., Lee C., Yu M.H., Engesser K.H. A previously uncultured papermill Propionibacteria is able to degrade O-aryl alkyl ethers and various aromatic hydrocarbons // Chemosphere. 2009. V. 75. P. 1287–1293.
Van Niewholtz J.A. A taxonomic re-evaluation of Propionibacterium coccoides // Ph.D. Dep. of Microbiol. Biochemistry. University of Orange Free State, Bloemfontein. South Africa. 1998.
Vorobjeva L.I. Propionibacteria. Kluwer Academic Publishers, 1999. 248 p.
Дополнительные материалы отсутствуют.


