Микробиология, 2019, T. 88, № 2, стр. 184-196
Характеристика ультрамелких бактерий рода Chryseobacterium FM1 и FM2, выделенных с кожных покровов шпорцевой лягушки Xenopus laevis
Д. В. Росс a, Н. Е. Сузина a, А. Б. Гафаров a, А. В. Мачулин a, Т. З. Есикова a, А. П. Шорохова a, В. И. Дуда a, *, А. М. Боронин a
a Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН,
ФИЦ Пущинский научный центр биологических исследований РАН
142290 Пущино, Россия
* E-mail: duda@ibpm.pushchino.ru
Поступила в редакцию 25.09.2018
После доработки 30.10.2018
Принята к публикации 30.11.2018
Аннотация
С поверхности кожных покровов гладкой шпорцевой лягушки Xenopus laevis выделены и описаны два штамма ультрамелких грамотрицательных бактерий (УГОБ) – FM1 и FM2. Изучены цитологические, физиолого-биохимические и генотипические характеристики полученных изолятов. На основании данных о нуклеотидной последовательности гена 16S рРНК и фенотипических свойств изученные штаммы отнесены к роду грамотрицательных бактерий Chryseobacterium. Клетки выделенных штаммов характеризуются ультрамелкими размерами: объем их клеток в развивающихся культурах составляет ~0.06 мкм3 для штамма FM1 и ~0.015 мкм3 для штамма FM2. Клетки изученных УГОБ прочно прикреплены к поверхности кожи лягушек и не удаляются при многократной промывке водой, что позволяет отнести эти бактерии к эпибионтам. Прочности связывания УГОБ с кожей лягушек, по-видимому, способствуют адгезивные свойства фимбриоподобных отростков, обнаруженных у клеток штаммов FM1 и FM2 с помощью электронной микроскопии. Локализация ультрамелких грамотрицательных бактерий позволяет заключить, что на поверхности кожи лягушек они могут являться своеобразным защитным бактериальным фильтром, а поверхность кожных покровов гладкой шпорцевой лягушки X. laevis впервые характеризуется как специфическое местообитание некоторых ультрамелких хризеобактерий. Выделение и описание двух новых ультрамелких хризеобактерий – штаммов FM1 и FM2, расширяет сведения о разнообразии структурно-функциональных свойств клеток и экониш обитания бактерий рода Chryseobacterium.
Симбиотические микроорганизмы – эпибионты кожи лягушки, активно исследуются на протяжении последних десятилетий. В настоящее время известно, что слизистые покровы земноводных населены бактериями-представителями нескольких десятков родов, таких как Pseudomonas, Brevundimonas, Pseudoclavibacter, Rhodococcus и других (Bevins, Zasloff, 1990; Bulet et al., 2004; Belden, Harris, 2007; Brucker et al., 2008; Becker, Harris, 2010; Conlon, 2011; Bell et al., 2013; Antwis et al., 2014). Данные ряда исследователей свидетельствуют о том, что роль симбиотических микроорганизмов можно в целом охарактеризовать как защитную. Микроорганизмы могут продуцировать вещества с антимикробной активностью, конкурировать за субстрат с болезнетворными микроорганизмами, изменять микроокружение поверхностных покровов хозяйского организма, предотвращая колонизацию покровов микроорганизмами из окружающей среды, либо стимулировать секрецию защитных пептидов кожными железами лягушек (Zasloff, 1987; Zairi et al., 2009; Conlon et al., 2012; King et al., 2012; Clay, 2014). Секрет кожных желез амфибий содержит (часто в высоких концентрациях) значительное количество биологически активных веществ. В его состав входят соединения с антимикробной и противовирусной активностью, представленные по большей части короткими пептидами, такими как мегаинины, пептид глицин-лейцин-амид (PGLa), фрагмент-предшественник церулеина (CPF) и фрагмент-предшественник ксенопсина (XPF) (Conlon et al., 2012; King et al., 2012; Clay, 2014). Таким образом, химический состав слизистых покровов делает кожную поверхность амфибий неблагоприятной средой обитания для многих болезнетворных микроорганизмов.
Морфология изученных в настоящее время бактерий-симбионтов разнообразна, в основном, они представлены грамотрицательными и грамположительными бактериями с обычными размерами клеток. При этом данные по выделению и характеристике ультрамелких форм симбиотических бактерий эукариотных земноводных организмов в литературе отсутствуют. С поверхности кожных покровов гладкой шпорцевой лягушки Xenopus laevis нами были выделены два штамма грамотрицательных бактерий FM1 и FM2. В настоящей работе приводятся данные об их свойствах и результаты анализа нуклеотидных последовательностей гена 16S рРНК. Выделение и характеристика новых штаммов микроорганизмов-эпибионтов земноводных позволит расширить представление о видовом разнообразии бактерий, населяющих экстремальные природные биотопы.
Целью настоящей работы было изучить цитологические, физиолого-биохимические и генотипические свойства изолятов FM1 и FM2, выделенных с кожных покровов лягушки X. laevis, а также провести сравнительный анализ штаммов FM1 и FM2 между собой и c ранее выделенными ультрамелкими бактериями из рода Chryseobacterium.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Выделение бактериальных культур и условия их инкубирования. Источником для выделения бактериальных культур были слизистые слои кожных покровов африканской гладкой шпорцевой лягушки Xenopus laevis (рис. 1).
Образцы слизистых покровов лягушки отбирали соскобом после предварительного ополаскивания животного в стерильной водопроводной воде для удаления бактерий-контаминантов из окружающей среды. Полученный материал слизистых покровов переносили в 2 мл фосфатного буфера (г/л: NaH2PO4 – 6.0; Na2HPO4 – 22.0; pH 6.9), ресуспендировали, пропускали через фильтр с диаметром пор 0.4 мкм, и аликвоты суспензии (100 мкл) высевали на специально разработанную агаризованную среду AQ. Среду готовили на основе аквариумной воды, в которой развивались лягушки, и измельченных водорослей Lemna minor и Ceratophyllum submersum (200.0 г/л), служивших источником углерода, азота и микроэлементов. Накопительные и чистые культуры выделяли с использованием питательных сред: (а) разработанной в Институте биохимии и физиологии микроорганизмов РАН триптон-соевой среды 5/5 следующего состава (г/л): экстракт сои – 30.0, гидролизат казеина – 5.0, дрожжевой экстракт – 1.0 и аминопептид (мл/л) – 60.0, pH 8.0; агаризованной (20 г/л) среды того же состава; (б) питательного агара BBL (“Difco”); (в) среды Лурия–Бертани (LB); (г) среду М-9 (г/л): NaH2PO4 – 6.0; KH2PO4 – 3.0; NaCl – 0.5; NH4Cl – 1.0; MgSO4 – 0.25; CaCl2 – 0.01; агар – 20. Чистоту выделенных культур контролировали с помощью световой фазово-контрастной и трансмиссионной электронной микроскопии, а также путем рассевов изолятов на агаризованную среду AQ и выявления в посевах посторонних, не свойственных выделенным штаммам, колоний. Полученные изоляты культивировали в жидкой триптон-соевой питательной среде 5/5.
Определение физиолого-биохимических свойств выделенных штаммов. Для определения условий оптимального роста бактерий использовали жидкую полноценную среду 5/5. Температурный оптимум роста определяли в диапазоне 4–42°С, влияние pH на рост культур оценивали в интервале pH 4.0–11.0. Изменения pH среды осуществляли добавлением 3 M NaOH или 1 M HCl. Галотолерантность изолятов определяли при выращивании культур в средах с содержанием NaCl от 0 до 10%. Интенсивность роста культур оценивали по их оптической плотности, определяемой при длине волны 590 нм, толщине кюветы 5 мм в спектрофотометре UV Specord (“Carl Zeiss”, Германия). Все варианты опыта выполняли в 3-х повторностях. Спектры утилизируемых субстратов и биохимические свойства изолятов определяли с использованием тестов API 32E и 50CH (“bioMerieux”, Франция) и цветных сред Гисса с углеводами (г/л: пептон – 10, NaCl – 5, углевод – 7, индикатор бромтимоловый синий – 1 мл 1.6% раствора).
Для определения антибиотикорезистентности выделенных бактерий антибиотик в определенной концентрации вносили в теплую агаризованную (2%) триптон-соевую питательную среду 5/5 и разливали в чашки Петри. После застывания среды, культуры рассевали штрихом и инкубировали в течение 2–3 сут при температуре 28°С. По наличию или отсутствию роста культур судили о действии антибиотиков на них. Концентрации антибиотиков указаны в табл. 2.
Таблица 1.
Сравнительная характеристика некоторых свойств Chryseobacterium sp. FM1, FM2 и Chryseobacterium sp. NF4 и NF5
| Свойства | FM1 | FM2 | NF4* | NF5* |
|---|---|---|---|---|
| Источник выделения | Кожные покровы Xenopus laevis | Кожные покровы Xenopus laevis | Ил (оз. Байкал) | Нефтешлам (Нижнекамск) |
| Морфология | Палочки, короткие овоиды и кокки | Палочки, короткие овоиды и кокки | Короткие палочки и коккоиды | Короткие палочки и коккоиды |
| Размеры клеток, мкм | 0.6–0.8 × 0.2–0.5 | 0.3–0.7 × 0.2–0.25 | 0.2–0.4 × 0.2–0.5 | 0.2–0.4 × 0.2–0.5 |
| Объем клеток, мкм3 | 0.05–0.07 | 0.01–0.02 | 0.01–0.04 | 0.01–0.04 |
| Тип клеточной стенки | Гр– | Гр– | Гр– | Гр– |
| Температурный диапазон роста (оптимум), С° | 9–30 (25) | 9–30 (25) | 5–30 (28) | 5–30 (28) |
| Диапазон pH (оптимум для роста) | 6–8.5 (7–7.5) | 6.5–9 (7.5) | 6–9 (7–8) | 6–9 (7–8) |
| Диапазон NaCl, % (оптимум для роста) | 0–4 (0) | 0–3 (1) | 0–1 (0) | 0–1 (0) |
| Активность ферментов: | ||||
| Оксидаза | + | + | + | + |
| Каталаза | + | + | + | + |
| Уреаза | – | – | – | – |
| β-Галактозидаза | – | – | – | – |
| Желатиназа | – | – | – | – |
| Продукция индола | + | + | + | + |
| Восстановление NO3– до NO2– | – | – | – | – |
| Восстановление NO3– до N2 | – | – | – | – |
| Лизиндекарбоксилаза | + | – | Но | Но |
| Липаза | + | – | Но | Но |
| β-Глюкозидаза | + | + | Но | Но |
| α-Глюкозидаза | + | + | Но | Но |
| α-Мальтозидаза | + | + | Но | Но |
| L-Аспартатариламидаза | + | + | Но | Но |
| Гидролиз: | ||||
| Твин-80 | – | – | – | – |
| Твин-60 | +/– | +/– | + | + |
| Твин-40 | – | – | – | – |
| Твин-20 | – | – | – | – |
| Целлюлоза | – | – | – | – |
| Эскулин железа цитрат | + | + | +/– | +/– |
| Казеин | – | – | – | – |
| Крахмал | +/– | +/– | + | + |
| Ассимиляция: | ||||
| Глюкоза | + | + | + | + |
| Мальтоза | + | + | + | + |
| Лактоза | +/– | – | – | – |
| Манноза | – | – | – | – |
| Маннит | – | – | – | – |
| Арабиноза | – | – | – | – |
| Цитрат | + | + | + | – |
| Пируват | + | + | + | +/– |
| Пропионат | + | + | + | – |
| Лактат | + | + | + | + |
| Ацетат | + | + | – | +/– |
| Сукцинат | + | + | + | + |
Таблица 2.
Устойчивость штаммов FM1 и FM2 к антибиотикам
| Антибиотик, мкг/мл | Штамм | |
|---|---|---|
| FM1 | FM2 | |
| Пенициллин, 100 | + | + |
| Триметоприм, 100 | + | + |
| Канамицин, 25, 50 | + | + |
| Цефазоллин, 100 | + | + |
| Ампициллин, 250 | + | + |
| Оксациллин, 10 | + | + |
| Рифампицин, 25 | – | – |
| Хлорамфеникол, 25 | – | – |
| Стрептомицин, 25 | – | – |
| Гентамицин, 10 | – | – |
| Тетрациклин, 10 | – | – |
| Эритромицин, 15 | – | – |
| Амикацин, 30 | – | – |
| Бацитрацин, 10 | – | – |
| Фурадонин, 300 | – | – |
Физиолого-биохимические свойства изолятов изучали общепринятыми методами, учитывая минимальный перечень стандартных признаков, рекомендованных для описания новых таксонов семейства Flavobacteriaceae (Bernardet et al., 2002).
Антагонистическую активность штаммов FM1 и FM2 оценивали луночно-диффузионным методом. Для этого 15 мкл суточной культуры вносили в лунки, внеклеточным метаболитам давали диффундировать в агар и сверху заливали полужидким питательным агаром (0.7%), содержащим 5–7 × × 107 кл./мл тест-культуры. Чашки инкубировали при температуре 24°C в течение 72 ч. Антагонистическую активность оценивали визуально по наличию и величине зон угнетения роста тест-культур вокруг лунок каждые 24 ч. В качестве тест-культур использовали грамотрицательные бактерии: Escherichia coli K12, Erwinia amylovora B34, Alcaligenes ruchlandii B 1333, Pseudomonas putida KT2442, P. aeruginosa PAO1, P. caryophylii ВКМВ129 и грамположительные бактерии: Micrococcus luteus B 1819, Microbacterium sp. S3, Bacillus sphaericus B506–2, B. weihenstephanensis KBAB4, Arthrobacter sp. BS2.
Определение морфологических признаков и ультраструктурной организации клеток изолированных штаммов бактерий. Световая фазово-контрастная микроскопия. Микроскопические наблюдения проводили с использованием микроскопов Nikon Eclipse Ci microscope (“Nikon”, Япония) с камерой ProgRes SpeedXT (“Jenoptic”, Германия).
Просвечивающая электронная микроскопия. Для приготовления ультратонких срезов клетки концентрировали центрифугированием (10 000 g, 15 мин) и фиксировали в 2% растворе глутарового альдегида в 0.05 М какодилатном буфере (рН 7.2) в течение 1 ч при 4°С. Затем материал трижды отмывали в 0.05 М какодилатном буфере (рН 7.2) и дополнительно фиксировали 2%-ным раствором OsO4 в том же буфере в течение 4 ч при 18–20°С. После обезвоживания в этаноле возрастающей концентрации (с 30 до 100% в течение 20 мин на каждом этапе) и абсолютном 100% ацетоне, материал заключали в эпоксидную смолу Epon 812. Для приготовления ультратонких срезов фрагментов поверхностного слоя эпидермиса осуществляли аналогичную процедуру фиксации, обезвоживания и заключения в эпоксидную смолу без процедуры центрифугирования материала. Срезы монтировали на опорные сеточки, контрастировали в течение 30 мин в 3% растворе уранилацетата в 70% спирте и дополнительно контрастировали цитратом свинца (Reynolds, 1963).
Ультратонкие срезы просматривали в трансмиссионном электронном микроскопе JEM-1400 (“JEOL”, Япония) при ускоряющем напряжении 80 кВ.
Сканирующая электронная микроскопия. В качестве материала для сканирующей электронной микроскопии использовали фрагменты поверхностного слоя эпидермиса, взятые сразу после линьки животного. Перед фиксацией в глутаровом альдегиде образцы очищали от микроорганизмов-контаминантов окружающей среды путем промывки в нескольких сменах стерильной водопроводной воды. Образцы фиксировали в 1.5% растворе глутарового альдегида в 0.05 М какодилатном буфере (рН 7.2) при 4°С в течение 1 ч, затем трижды отмывали в том же буфере и дополнительно фиксировали в 1% растворе OsO4 в 0.05 М какодилатном буфере (рН 7.2) в течение 3 ч при 20°С. После обезвоживания в серии этанола возрастающей концентрации (с 30 до 100% в течение 20 мин на каждом этапе) клетки дополнительно пропитывали в терт-бутиловом спирте (tert-butanol, “SIGMA-ALDRICH”) в двух сменах по 20 мин при 26°С. Далее образцы замораживали в трет-бутиловом спирте и проводили процедуру замораживания–высушивания в установке JFD-320 (“JEOL”, Япония) в соответствии с рекомендациями фирмы-производителя. На поверхность высушенных образцов наносили золото в напылительной установке JFC 1100 (“JEOL”, Япония). Электронно-микроскопический анализ проводили на сканирующем электронном микроскопе JSM-6510LV (“JEOL”, Япония).
Расчет объемов клеток проводили по данным морфометрического анализа электронно-микроскопических изображений негативно окрашенных 0.3% водным раствором уранилацетата или тотальных препаратов бактерий. При расчетах объемов клеток считали, что они имеют форму шара или эллипсоида вращения. Для расчетов использовали формулу:
где l – длина клетки, d – диаметр клетки.Методы молекулярной систематики. Выделение и очистку ДНК проводили методом Мармура (Marmur, 1961). Мол. % ГЦ-пар в ДНК определяли методом тепловой денатурации, используя ДНК E. coli K12 в качестве стандарта.
ПЦР-амплификацию фрагментов генов 16S рРНК бактерий (~1200 п.н.) проводили с использованием универсальных бактериальных праймеров 27f и 1525r. ПЦР проводили на амплификаторе Gen Amp PCR System 9700 (“Applied Biosystems”, США). Проверку продуктов ПЦР осуществляли путем их электрофореза в 1% агарозном геле с последующей визуализацией продуктов реакции с помощью УФ-трансиллюминатора. Секвенирование нуклеотидной последовательности ПЦР-фрагмента, очищенного с помощью набора реактивов QIAEX II Gel Extraction Kit (“QIAGEN”, США) согласно рекомендациям производителя, осуществляли на автоматическом секвенаторе фирмы Applied Biosystems 3130 Genetic Analyzer. Использовали принцип автоматического секвенирования ДНК (по Сэнгеру) с последующим капиллярным гель-электрофорезом и детекцией терминированных продуктов секвенирующих реакций в режиме реального времени. Нуклеотидные последовательности анализировали с помощью программного пакета BLAST (http://www.ncbi. nlm.nih.gov/BLAST). Редактирование и выравнивание нуклеотидных последовательностей производили с использованием программы MEGA6 (http://www.megasoftware.net/ mega.php). Филогенетический анализ проводили методом “ближайших соседей” (neighbor-joining), используя реализованные в пакете программ M-EGA6 алгоритмы.
Для получения геномых рестрикционных профилей (Hector, Johnson, 1990) использовали нативную хромосомную ДНК, иммобилизованную в агарозе. ДНК выделяли согласно протоколу FIGE Mapper. Instruction Manual and Application Guide (“BioRad”, США). Рестрикцию нативной хромосомной ДНК осуществляли с помощью набора 20 ферментов (“Fermentas”, США), узнающих последовательность из 6 или 8 пар нуклеотидов, согласно рекомендациям производителя. Из этого набора ферментов были отобраны четыре – NheI, SpeI, SgsI и NotI, дающие оптимальное для анализа количество рестрикционных фрагментов. Размеры небольших фрагментов ДНК (от 5 до 150 т.п.н.) определяли с помощью инверсионного электрофореза (FIGE Mapper, “BioRad”, США). Электрофорез проводили согласно рекомендациям производителя по программе № 8. Фрагменты большого размера определяли с помощью пульс-электрофореза (Pulsaphor System, “Pharmical LKB”) который проводили по программе: время – 24 ч, напряжение – 180 В, пульсы – 30–70 с, температура – 14°С. В качестве стандарта размеров фрагментов использовали CHEF DNA Size Standart, Lambda Ladder (“Bio-Rad”, США). Размеры рестрикционных фрагментов генома определяли относительно размеров конкатемеров стандарта.
РЕЗУЛЬТАТЫ
Наблюдения in situ. Изучение поверхности кожи африканской шпорцевой лягушки Xenopus laevis in situ c помощью трансмиссионной и сканирующей электронной микроскопии показало, что на поверхности локализуются разнообразные по морфологии бактерии (рис. 1, 2), преимущественно представленные грамотрицательными палочками (0.3–0.7 × 0.2–0.4 мкм) и кокками (0.3–0.5 мкм в диаметре). Бактерии заселяют поверхность кожи очагами, их средняя плотность составляет приблизительно 1200 клеток на 1000 мкм2, наибольшее их скопление можно наблюдать в области пор кожных желез (рис. 2, 3, 5).
Рис. 2.
Фрагмент поверхности кожи лягушки. Видна пора железы и локализованные вокруг нее палочковидные и кокковидные клетки бактерий. Стрелками указаны ультрамелкие кокковидные бактериальные клетки. Сканирующая электронная микроскопия. Масштабная метка – 5 мкм.
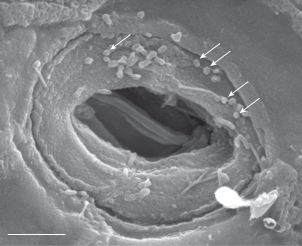
Рис. 3.
(а–в) – ультратонкие срезы фрагментов поверхности кожи лягушки (ПК) с прикрепленными к ней бактериальными клетками. Просвечивающая электронная микроскопия. Обозначения: Ф – фибриллы бактериальных капсул, Н – нуклеоид, НМ – наружная мембрана, ЦМ – цитоплазматическая мембрана. Масштабная метка – 1 мкм.
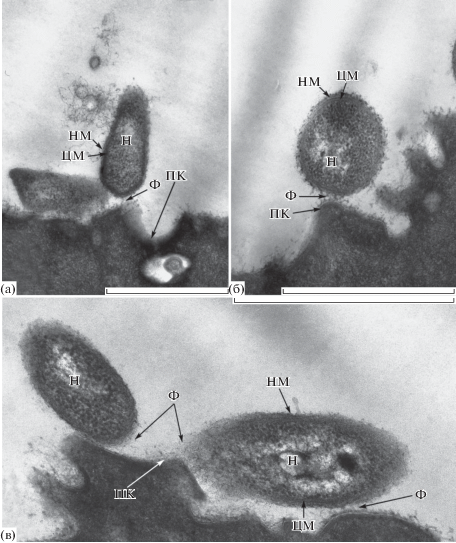
Рис. 4.
Вид клеток штаммов FM1 (а) и FM2 (б) культур, растущих в жидкой питательной среде 5/5 (при 28°С). Фазово-контрастная микроскопия. Масштабная метка – 10 мкм.

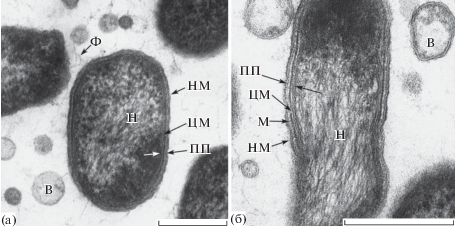
Рис. 5.
Ультратонкие срезы клеток штаммов FM1 (а) и FM2 (б). Видно, что клетки обладают оболочкой, типичной по строению с грамотрицательными бактериями. Обозначения: НМ – наружная мембрана, М – муреин, ЦМ – цитоплазматическая мембрана, ПП – периплазматическое пространство, Н – нуклеоид, Ф – экстрацеллюлярные фибриллы, В – внеклеточные мембранные везикулы. Масштабная метка – 0.3 мкм.
Выявленные в трансмиссионном и сканирующем электронных микроскопах на поверхности кожи ультрамелкие клетки многочисленных грамотрицательных бактерий имеют значительное сходство по ультраструктуре и морфометрическим показателям с представителями рода Chryseobacterium (Vandamme et al., 1994; Сузина и соавт., 2011; Сузина и соавт., 2015) (рис. 2, 3). Как видно на ультратонких срезах, в связи этих клеток с поверхностью кожи участвуют капсулярные фибриллы (рис. 3а–3в).
Выделение штаммов. Образцы секрета кожных желез лягушки получали путем стерильного отбора слизи с дорзального участка кожи животного после его отмывки в нескольких сменах стерильной воды с целью удаления бактерий-контаминантов из окружающей среды. Из взятых образцов слизи методом накопительных культур было выделено 15 бактериальных штаммов, характеризовавшихся ультрамелкими размерами клеток при росте на среде AQ. Из них два штамма – FM1 и FM2, были отобраны для детальных исследований, поскольку средний размер их клеток не превышал 0.1 мкм3 при росте на всех использованных средах. Кроме того, клетки этих штаммов морфологически были наиболее сходными с клетками, выявляемыми in situ на поверхности кожи с помощью электронно-микроскопического анализа. Выделение чистых культур проводили на среде AQ с последующим пересевом на среды 5/5 и LB. При замене среды 5/5 на LB наблюдалось увеличение объема клеток в среднем на 0.02 мкм3. Два других штамма, использованных в сравнительных исследованиях, были выделены нами ранее и охарактеризованы как ультрамелкие бактерии из рода Chryseobacterium (Сузина и соавт., 2011).
Размеры и ультраструктура клеток. Средний размер клеток полученных изолятов составил 0.7 × 0.35 мкм для FM1 и 0.5 × 0.2 мкм для FM2. Средний объем клеток ~0.06 мкм3 для штамма FM1 и ~0.015 мкм3 для штамма FM2.
Для обоих исследуемых штаммов характерным свойством являлось формирование в развивающейся культуре мелких и ультрамелких жизнеспособных клеток в экспоненциальной фазе роста культуры (рис. 4). Палочковидные клетки, имеющие длину от 0.3 до 0.8 мкм и объем <0.1 мкм3, встречались в лаг-фазе и начале логарифмической фазы роста у обоих исследуемых штаммов. В экспоненциальной фазе роста они начинали активно размножаться в результате дробления и/или бинарного деления (рис. 4).
Клетки штаммов FM1 и FM2 характеризовались типичным для грамотрицательных бактерий строением оболочки, в состав которой входят наружная мембрана, периплазматическое пространство, слой муреина и цитоплазматическая мембрана (рис. 5). Сравнительный морфометрический анализ ультратонких срезов клеток исследуемых штаммов показал, что они имеют слой муреина толщиной от 8 до 12 нм. Их клетки неподвижны и не обладают способностью к скольжению. Кроме того, для них характерно отсутствие многих внутриклеточных органелл, известных для “обычных” прокариот, и включений резервных веществ. Сравнительный анализ ультратонких срезов показал наличие у клеток исследуемых штаммов обширной фибриллярной сети в виде тонких протяженных разветвленных фибрилл, ассоциированных с внешней поверхностью наружной мембраны клеток и ориентированных в межклеточное пространство (рис. 5).
Характерным свойством изученных штаммов было присутствие на клетках и в межклеточном пространстве крупных электронно-прозрачных сферических мембранных везикул с гетерогенным содержимым, выявляемым на всех фазах роста культур, развивающихся на питательных средах различного состава (рис. 5). Часть из них, вероятно, являются “пустыми” и не несут какого-либо содержимого, но большая часть везикул заполнена веществом гранулярно-фибриллярной природы. Мембранные везикулы для каждого штамма различаются между собой по диаметру и плотности упаковки их содержимого. Диаметр везикул может варьировать в диапазоне от 80 до 100 нм у штамма FM2 и от 250 до 280 нм у штамма FM1. Анализ электронно-микроскопических изображений показывает, что у обоих штаммов везикулы являются производными наружной мембраны. Для выяснения вопроса о составе содержимого везикул и их роли требуются дополнительные исследования.
Физиолого-биохимические cвойства. Штаммы FM1 и FM2 относятся к аэробным, хемоорганотрофным, оксидазо- и каталазоположительным бактериям, представителям рода Chryseobacterium (рис. 6). Они растут в диапазоне температур 9–30°С с оптимумом при 25–28°С, что позволило отнести их к мезофильным организмам. Как было показано ранее (Сузина и соавт., 2011, 2015), рост изученных в этих работах штаммов Chryseobacterium sp. NF4 и NF5 наблюдался при более низких температурах (до 5°С), с оптимум роста при 28°С (табл. 1).
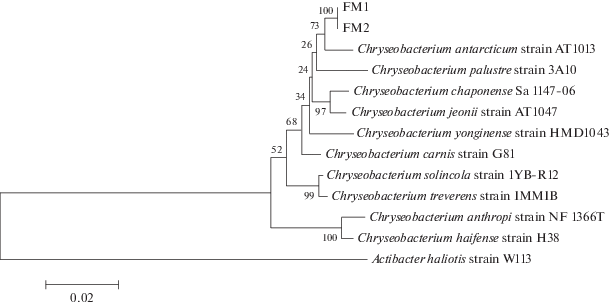
Рис. 6.
Положение штаммов Chryseobacterium FM1, FM2 на филогенетическом дереве близких видов рода Chryseobacterium, полученном на основе анализа нуклеотидных последовательностей гена 16S рРНК (“neighbor-joining method”). Эволюционные дистанции между последовательностями рассчитаны с использованием однопараметрической модели Джукса–Кантора (Jukes–Cantor model). Масштаб соответствует одной замене на каждые 100 нуклеотидов. Указаны значения статистической достоверности порядка ветвления для 1000 альтернативных деревьев “bootstrap” (выше 50%). В качестве внешней группы использована нуклеотидная последовательность гена 16S рРНК Actibacter haliotis DSM 19423T (NZ_ATXP01000015).
Оптимальный для роста всех изолятов pH находился в нейтральной области, однако для штаммов FM1 и FM2 был несколько смещен в область низких значений. Кроме того, штаммы FM1 и FM2 отличались более высокой галотолерантностью по сравнению со штаммами Chryseobacterium sp. NF4 и NF5; они способны расти при наличии в среде 4 и 3% NaCl соответственно. В качестве источника углерода и энергии штаммы Chryseobacterium sp. NF4 и NF5 использовали узкий набор органических, в том числе, жирных кислот, а также несколько сахаров и полисахаридов, в то время как спектр субстратов, ассимилируемых штаммами FM1 и FM2, был более широким за счет увеличения числа утилизируемых органических кислот.
Сравнительный анализ физиологических свойств штаммов FM1 и FM2 с типовым близкородственным штаммом C. antarcticum выявил ряд дополнительных отличий между ними. Так C. antarcticum может ассимилировать Твин-80, в то время как штаммы FM1 и FM2 такой способностью не обладают. Но, в отличие от C. antarcticum, они имеют фермент β-глюкозидазу и расщепляют D-фруктозу. Кроме того, температурный оптимум роста у исследуемых штаммов ниже, чем у типового штамма C. antarcticum (25 и 30°С соответственно) (Kämpfer et al., 2009).
Между собой штаммы FM1 и FM2 демонстрируют высокую степень сходства как по нуклеотидным последовательностям гена 16S рРНК (99.5%), так и по молярным процентам Г + Ц (35.9 и 35.4% соответственно), что свидетельствует о возможной их принадлежности к одному виду. Различия между штаммами состоят в том, что у штамма FM1 выявляется активность ферментов липазы и лизиндекарбоксилазы, в то время как у штамма FM2 она не проявляется.
Анализ антибиотикорезистентности штаммов FM1 и FM2 показал, что они оба устойчивы к действию пенициллина, триметоприма, цефазолина, канамицина, ампицилина, оксациллина и чувствительны к рифампицину, хлорамфениколу, стрептомицину, гентамицину, тетрациклину, эритромицину, амикацину, бацитрацину и фурадонину (табл. 2).
Изучение антагонистической активности показало, что штаммы FM1 и FM2 не ингибируют рост тестированных грамположительных и грамотрицательных бактерий, использованных в работе.
Филогенетическое положение штаммов FM1 и FM2. На основании филогенетического анализа фрагментов генов 16S рРНК длиной около 1200 п.н. исследуемые бактерии были отнесены к роду Chryseobacterium. Наиболее близкородственным видом для обоих штаммов является C. antarcticum (типовой штамм АТ1013): уровень сходства нуклеотидных последовательностей гена 16S рРНК исследуемых штаммов и типового штамма C. antarcticum АТ1013 составляет 98.42% (рис. 6). Сравнительный анализ физиологических свойств этих штаммов выявил ряд дополнительных отличий (см. выше) между ними.
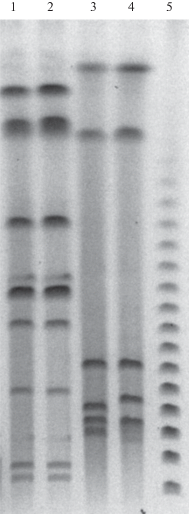
Рестрикционный анализ геномов выделенных штаммов. Как ранее нами было установлено, что для рестрикционного анализа генома бактерий, принадлежащих к роду Chryseobacterium, наиболее подходящими эндонуклеазами рестрикции являются ферменты NheI и SpeI (Сузина и соавт., 2011). В связи с этим первоначально рестрикционный анализ исследуемых штаммов осуществляли также с помощью этих ферментов. Однако полученные результаты показали, что они не являются оптимальными для генотипирования штаммов Chryseobacterium spp. FM1 и FM2 ввиду образования большого количества рестрикционных фрагментов малого размера (рис. 7). Расположение фрагментов ДНК на электрофореграмме показало очевидное геномное сходство штаммов FM1 и FM2. В то же время, при использовании рестриктазы NheI фингерпринт штамма FM2 характеризовался наличием двух дополнительных полос (72 и 125 т.п.н.) в отличие от фингерпринта штамма FM1. При использовании рестриктазы SpeI также отмечается разница в размере верхних фрагментов (177 т.п.н. у штамма FM1 и 195 т.п.н. у штамма FM2). Наиболее четкое разделение рестрикционных полос наблюдалось при использовании ферментов SgsI и NotI, при этом оба штамма имели идентичный профиль фрагментов (рис. 8).
Рис. 7.
Электрофореграмма рестрикционных фрагментов геномов штаммов Chryseobacterium sp. FM1, FM2, NF4, NF5. Дорожки: 1 – Lambda Ladder; 2, 3 – штаммы FM1, FM2, эндонуклеаза рестрикции NheI; 4, 5 – штаммы NF4, NF5, эндонуклеаза рестрикции NheI; 6, 7 – штаммы FM1, FM2, эндонуклеаза рестрикции SpeI; 8, 9 – штаммы NF4, NF5, эндонуклеаза рестрикции SpeI.
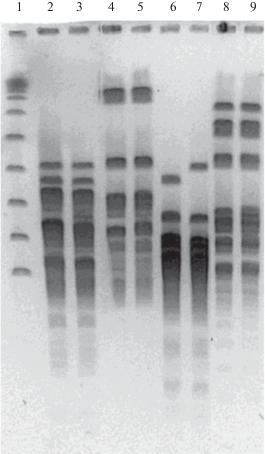
Рис. 8.
Электрофореграмма рестрикционных фрагментов геномов штаммов Chryseobacterium sp. FM1 и FM2. Дорожки: 1, 2 – штаммы FM1, FM2, эндонуклеаза рестрикции SgsI; 3, 4 – штаммы FM1, FM2, эндонуклеаза рестрикции NotI; 5 – Lambda Ladder.
Рестрикционный профиль геномов штаммов Chryseobacterium sp. NF4 и NF5, выделенных нами ранее из образцов почвы (Сузина и соавт., 2011), значительно отличался от рестрикционных профилей штаммов Chryseobacterium sp. FM1 и FM2 (рис. 7). Это может свидетельствовать о принадлежности штаммов, выделенных с кожных покровов лягушки Xenopus laevis, и штаммов NF4 и NF5 к разным видам.
ОБСУЖДЕНИЕ
Описанные в настоящей работе штаммы Chryseobacterium sp. FM1 и FM2 являются первыми ультрамелкими бактериями, обнаруженными на кожных покровах лягушки X. laevis. Средний объем клеток этих бактерий, сохраняющийся у них при росте на всех использованных в настоящей работе средах, составляет <0.1 мкм3. По этим показателям изученные бактерии близки к ультрамикробактериям (УМБ), описанным в работах (Cavicchioli, Ostrowski, 2003; Duda, 2011; Сузина и соавт., 2011, 2015). Однако для окончательного заключения о принадлежности изученных бактерий к УМБ желательно провести сравнительное изучение размера геномов у штаммов FM1 и FM2 и известных видов УМБ.
Следует отметить, что согласно филогенетическому анализу нуклеотидной последовательности гена 16S рРНК штаммов FM1 и FM2, эти организмы являются представителями рода Chryseobacterium. Генотипирование, осуществленное с помощью ферментов рестрикции SpeI, NheI, SgsI и NotI подтвердило принадлежность штаммов к одному виду. С этим выводом коррелируют также полученные нами данные об ультраструктурной организации изученных штаммов. Установлено, что клетки штаммов FM1 и FM2, как и клетки штаммов Chryseobacterium sp., NF4 и NF5, обладают типичной грамотрицательной стенкой, состоящей из наружной мембраны с трехслойным профилем на срезах, муреинового слоя и периплазмы. На поверхности этой оболочки расположен фибриллярный капсулярный слой и фимбриоподобные структуры (рис. 3а–3в, 5). Клетки изученных УГОБ, как отмечалось выше, прочно адсорбированы на поверхности кожи лягушек, и прочности их адсорбции, по-видимому, способствуют адгезивные свойства охарактеризованных выше фимбриоподобных отростков и капсулярного слоя. Электронная микроскопия ультратонких срезов кожных покровов лягушки позволила выявить локализованные на них несмывающиеся с поверхности бактериальные клетки, размеры и ультраструктурная организация которых обладали значительным сходством с таковыми у УМБ из рода Chryseobacterium (Сузина и соавт., 2011, 2015). По-видимому, эти бактерии выполняют у лягушек защитную функцию. В пользу наличия своеобразного бактериального фильтра свидетельствуют полученные нами данные о высокой концентрации клеток бактерий эпибионтов на поверхности кожи X. laevis: даже после тщательной отмывки на 1 мкм2 локально остается свыше 12 прочно прикрепленных клеток. Как показано, именно “кожные бактерии” предотвращают гибель и заболеваемость лягушек, обусловленные патогенными хитридиомицетами (Shaw et al., 2014).
Поверхность кожных покровов лягушек представляет собой уникальную микробную эконишу, так как кожа этих земноводных покрыта слизью и выделяет, часто в высоких концентрациях, многочисленные антибиотические вещества (Zasloff, 1987; Zairi et al., 2009; Conlon et al., 2012; King et al., 2012; Clay, 2014). Очевидно, что микроорганизмы-эпибионты должны быть адаптированы к этим факторам их экониши. Особенностью клеток штаммов FM1 и FM2 является спектр утилизируемых ими субстратов, более широкий, чем у описанных нами ранее штаммов NF4 и NF5. Возможно, это связано со способностью изучаемых штаммов использовать в качестве источника углерода и энергии органические соединения, выделяемые макроорганизмом-хозяином. Кроме того, штаммы FM1 и FM2 характеризуются устойчивостью к ряду антибиотиков (табл. 2). Возможно, что они также устойчивы к пептидным антибиотикам, продуцируемым лягушками.
Сравнительный анализ морфологических признаков штаммов FM1 и FM2 показал их значительное сходство по таким признакам, как оптимальные условия культивирования, спектр ассимилируемых субстратов, активность ферментов и устойчивость к антибиотикам. Оба штамма имеют ряд существенных генетических и физиолого-биохимических отличий от наиболее близкородственного им вида C. antarcticum АТ1013, и они, возможно, представляют собой новый вид рода Chryseobacterium. В настоящее время известно, что род Cryseobacterium объединяет как сапротрофные, так и патогенные формы, выделяющиеся из различных местообитаний: почв, пресных водоемов, растений, насекомых, грунтов Антарктики (Vandamme et al., 1994; Boronina et al., 2003; Сузина и соавт., 2011). Представители всех описанных в литературе видов этого рода являются грамотрицательными, аэробными, гетеротрофными, мезофильными и психротолерантными бактериями (Boronina et al., 2003, Euzéby, 2009). Выделение и описание новых ультрамелких бактерий Chryseobacterium sp. FM1 и FM2, обитающих на коже лягушек Xenopus laevis, расширяет сведения об обьеме и разнообразии микроорганизмов рода Chryseobacterium. Кроме того, эти штаммы представляют значительный биотехнологический интерес для конструирования наноконтейнеров, предназначенных для целевой доставки лекарственных средств в организм человека и животных.
Электронно-микроскопические исследования выполнены на базе ЦКП “Коллекция UNIQEM”.
Работа выполнена при финансовой поддержке Программы фундаментальных исследований Президиума РАН № 32 “Наноструктуры: физика, химия, биология, основы технологий”, Подпрограмма 3 “Нанобиотехнологии”.
Список литературы
Сузина Н.Е., Дуда В.И., Есикова Т.З., Шорохова А.П., Гафаров А.Б., Олейников Р.Р., Акимов В.Н., Абашина Т.Н., Поливцева В.Н., Боронин А.М. Новая ультрамикробактерия из рода Chryseobacterium – факультативный эпибионт Bacillus subtilis // Микробиология. 2011. Т. 80. № 4. С. 529–542.
Suzina N.E., Duda V.I., Esikova T.Z., Shorokhova A.P., Gafarov A.B., Oleinikov R.R., Abashina T.N., Akimov V.N., Polivtseva V.N., Boronin A.M. Novel ultramicrobacteria, strains NF4 and NF5, of the genus Chryseobacterium: facultative epibionts of Bacillus subtilis // Microbiology (Moscow). 2011. V. 80. P. 535–548.
Сузина Н.Е., Есикова Т.З., Олейников Р.Р., Гафаров А.Б., Шорохова А.П., Поливцева В.Н., Росс Д.В., Абашина Т.Н., Дуда В.И., Боронин А.М. Сравнительная характеристика свободноживущих ультрамелких бактерий, выделенных из природных биотопов // Прикл. биохимия и микробиология. 2015. Т. 51. № 2. С. 151–160.
Suzina N.E., Esikova T.Z., Oleinikov R.R., Gafarov A.B., Shorokhova A.P., Polivtseva V.N., Ross D.V., Abashina T.N., Duda V.I., Boronin A.M. Comparative characteristics of free-living ultramicroscopical bacteria obtained from natural biotopes // Appl. Biochem. Microbiol. 2015. V. 51. P. 159–168.
Antwis R.E., Haworth R.L., Engelmoer D.J.-P., Ogilvy V., Fidgett A.L., Preziosi R.F. Ex situ diet influences the bacterial community associated with the skin of red-eyed tree frogs (Agalychnis callidryas) // PLoS One. 2014. V. 9. e85563.
Becker M.H., Harris R.N. Cutaneous bacteria of the redback salamander prevent morbidity associated with a lethal disease // PLoS One. 2010. V. 5. e10957.
Belden L.K., Harris R.N. Infectious diseases in wildlife: the community ecology context // Front. Ecol. Environ. 2007. V. 5. P. 533–539.
Bell S.C., Alford R.A., Garland S., Padilla G., Thomas A.D. Screening bacterial metabolites for inhibitory effects against Batrachochytrium dendrobatidis using a spectrophotometric assay // Dis. Aquat. Organ. 2013. V. 103. P. 77–85.
Bernardet J.-F., Nakagawa Y., Holmes B. Subcommittee on the taxonomy of Flavobacterium and Cytophaga-like bacteria of the International Committee on Systematics of Prokaryotes. Proposed minimal standards for describing new taxa of the family Flavobacteriaceae and emended description of the family // Int. J. Syst. Evol. Microbiol. 2002. V. 52. P. 1049–1070.
Bevins C.L., Zasloff M. Peptides from frog skin // Annu. Rev. Biochem. 1990. V. 59. P. 395–414.
Boronina L.G., Kukushkina M.P., Krutova K.V., Blinova S.M. Chryseobacterium (Flavobacterium) spp.: clinical significance, identification, antimicrobial susceptibility // Clin. Microbiol. Antimicrob. Chemother. 2003. V. 5. P. 243–250.
Brucker R.M., Harris R.N., Schwantes C.R., Gallaher T.N., Flaherty D.C., Lam B.A., Minbiole K.P. Amphibian chemical defense: antifungal metabolites of the microsymbiont Janthinobacterium lividum on the salamander Plethodon cinereus // J. Chem. Ecol. 2008. V. 34. P. 1422–1429.
Bulet P., Stöcklin R., Menin L. Anti-microbial peptides: from invertebrates to vertebrates // Immunol. Rev. 2004. V. 198. P. 169–184.
Cavicchioli R., Ostrowski M. Ultramicrobacteria // eLS. Chichester John Wiley & Sons Ltd. 2003. doi 10.1038/ npg.els.0000309
Clay K. Defensive symbiosis: a microbial perspective // Funct. Ecol. 2014. V. 28. P. 293–298.
Conlon J.M. Structural diversity and species distribution of host-defense peptides in frog skin secretions // Cell. Mol. Life. Sci. 2011. V. 68. P. 2303–2315.
Conlon J.M., Mechkarska M., King J.D. Host-defense peptides in skin secretions of African clawed frogs (Xenopodinae, Pipidae) // Gen. Comp. Endocrinol. 2012. V. 176. P. 513–518.
Duda V.I. Ultramicrobacteria // eLS. Chichester. UK. John. Wiley & Sons Ltd. 2011. P. 1–23. doi 10.1002/ 9780470015902.a0000309.pub2
Euzéby J.P. List of Prokaryotic names with standing in nomenclature – genus Chryseobacterium // www.bacterio.net. 2009. P. 1–19.
Hector J.S., Johnson A.R. Determination of genome size of Pseudomonas aeruginosa by PFGE: analysis of restriction fragments // Nucleic Acids. Res. 1990. V. 18. P. 3171–3174.
Kämpfer P., Lodders N., Vaneechoutte M., Wauters G. Transfer of Sejongia antarctica, Sejongia jeonii, and Sejongia marina to the genus Chryseobacterium as Chryseobacterium antarcticum comb. nov., Chryseobacterium jeonii comb. nov. and Chryseobacterium marinum comb. nov. // Int. J. Syst. Evol. Microbiol. 2009. V. 59. P. 2238–2240.
King J.D., Mechkarska M., Coquet L., Leprince J., Jouenne T., Vaudry H., Takada K., Conlon J.M. Host-defense peptides from skin secretions of the tetraploid frogs Xenopus petersii and Xenopus pygmaeus, and the octoploid frog Xenopus lenduensis (Pipidae) // Peptides. 2012. V. 33. P. 35–43.
Marmur J. A procedure for the isolation of deoxiribonucleic acid from microorganisms // J. Mol. Biol. 1961. V. 3. P. 208–218. http://dx.org/10.1016/S0022-2836(61)80047-8.
Reynolds E.S. The use of lead citrate at high pH as an electron-opaque stain in electron microscopy // J. Cell. Biol. 1963. V. 17. P. 208–212.
Shaw S.D., Berger L., Bell S., Dodd S., James T.Y., Skerratt L.F., Bishop P.J., Speare R. Baseline cutaneous bacteria of free-living New Zealand native frogs (Leiopelma archeyi and Leiopelma hochstetteri) and implications for their role in defense against the amphibian chytrid (Batrachochytrium dendrobatidis) // J. Wildl. Dis. 2014. V. 50. P. 723–732.
Vandamme P., Bernardet J.-F., Segers P., Kersters K., Holmes B. New perspectives in the classification of the Flavobacteria: Description of Chryseobacterium gen. nov., Bergeyella gen. nov., and Empedobacter nom. rev. // Int. J. Syst. Bacteriol. 1994. V. 44. P. 827–831.
Zairi A., Tangy F., Bouassida K., Hani K. Dermaseptins and magainins: antimicrobial peptides from frogs’ skin-new sources for a promising spermicides microbicides – a mini review // J. Biomed. Biotechnol. 2009. V. 2009. Article ID. 452567.
Zasloff M. Magainins, a class of antimicrobial peptides from Xenopus skin: isolation, characterization of two active forms, and partial cDNA sequence of a precursor // Proc. Natl. Acad. Sci. USA. 1987. V. 84. P. 5449–5453.
Дополнительные материалы отсутствуют.



