Микробиология, 2019, T. 88, № 2, стр. 197-206
Ультраструктурная организация и ферменты системы антиоксидантной защиты покоящихся клеток грамотрицательных бактерий Stenotrophomonas sp. FM3 и Morganella morganii subsp. sibonii FF1
Н. Е. Сузина a, *, В. Н. Поливцева a, А. П. Шорохова a, Д. В. Росс a, Т. Н. Абашина a, b, А. В. Мачулин a, Г. И. Эль-Регистан c, И. П. Соляникова a
a Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН,
ФИЦ Пущинский научный центр биологических исследований РАН
142290 Пущино, Россия
b Пущинский государственный естественно-научный институт
142290 Пущино, Россия
c Институт микробиологии им. С.Н. Виноградского,
ФИЦ Фундаментальные основы биотехнологии РАН
119071 Москва, Россия
* E-mail: suzina_nataliya@rambler.ru
Поступила в редакцию 23.08.2018
После доработки 26.11.2018
Принята к публикации 30.11.2018
Аннотация
В лабораторных условиях получены анабиотические покоящиеся формы (ПФ) грамотрицательных бактерий-эпибионтов гладкой шпорцевой лягушки Xenopus laevis – Stenotrophomonas sp. FM3 и Morganella morganii subsp. sibonii FF1, и изучены их характеристики. Выявленные особенности ультраструктурной организации покоящихся клеток штаммов FM3 и FF1 (обширное периплазматическое пространство, плотная гетерогенная цитоплазма, упорядоченная реорганизация компактизованного нуклеоида) типичны для цистоподобных покоящихся клеток (ЦПК) грамотрицательных бактерий других таксонов (Escherichia coli, Pseudomonas aeruginosa, P. fluorescens, Azospirillum brasilense и др.), изученных нами ранее. Впервые показано сохранение в анабиотических покоящихся формах потенциально активных ферментов системы антиоксидантной защиты, что, по-видимому, обусловливает выживание ПФ на ранних этапах их прорастания, обеспечивая в отсутствие синтеза ферментов de novo устойчивость клеток к стрессу новой среды и другим стрессорным воздействиям. Полученные результаты представляют интерес не только для фундаментальной микробиологии, но и для биомедицины, так как штаммы FM3 и FF1 близки по своему филогенетическому положению к бактериям – возбудителям нозокамиальных клинических инфекций, и продемонстрированное образование ими покоящихся форм объясняет устойчивость внутрибольничных инфекций к санитарным обработкам.
Изучение механизмов выживаемости бактериальных клеток, находящихся в покоящемся (анабиотическом) состоянии представляет значительный научный и практический интерес. Известно, что в природной среде обитания микроорганизмы, как правило, находятся под воздействием целого ряда неблагоприятных для роста факторов: дефицита или недоступности питательных веществ и воды, неблагоприятных температур, присутствия токсичных веществ, метаболитов систем кворум-сенсинга (QS), ограничивающих рост популяции, и т.п. Поэтому в различных природных биотопах микроорганизмы, в том числе неспорообразующие бактерии, находятся преимущественно в гипометаболическом или метаболически неактивном (анабиотическом) покоящемся (дормантном) состоянии в виде спор, цистоподобных покоящихся клеток (ЦПК) или некультивируемых клеток (НК) (Roszak, Colwell, 1987; Дмитриев и соавт., 2001, 2004; Сузина и соавт., 2004; Эль-Регистан и соавт., 2006; Suzina et al., 2006). В почвенных микробных сообществах число активных микроорганизмов составляет всего около 0.1–0.2% от их общей численности по результатам прямого учета и очень редко превышает 5% в условиях роста без добавления легкодоступных субстратов (Blagodatskaya, Kuzyakov, 2013). Поэтому изучение покоящихся форм микроорганизмов крайне важно для понимания фундаментальных закономерностей покоя и успешности мониторинговых исследований.
Особый интерес представляет способность патогенных (ПБ) и условно патогенных бактерий (УПБ) выживать в госпитальных помещениях, где регулярно осуществляется санитарная обработка помещений и стерилизация медицинского инструментария. Потенциально опасные бактерии в клинических условиях, также как в природной среде, выживают в виде покоящихся форм: находясь вне человеческого организма − в виде спор и цистоподобных анабиотических клеток, а в организме человека − в виде пролиферативно покоящихся клеток – персистеров (П), L-форм и биопленок (БП) (Lewis, 2007, 2010; Balaban et al., 2013; Grant, Hung, 2013). Это является одной из главных причин распространения нозокамиальных инфекций и реверсии хронических инфекций. Таким образом, в основе устойчивости микроорганизмов к внешним повреждающим воздействиям лежит их способность переходить в гипометаболическое (персистеры) или покоящееся анабиотическое (ПФ) состояние, что обусловливает их нечувствительность к действию не только антибиотиков, но и летальных воздействий различной природы, в том числе цитотоксичных антисептиков, облучения и т.д.
Молекулярно-генетические механизмы перехода метаболически активных, делящихся бактерий в гипометаболическое и анабиотическое состояние всегда сопряжены с развитием стресса и реализацией механизмов стрессового ответа, одним из которых является окислительный стресс (Ткаченко, 2018). Окислительный стресс сопровождается образованием активных форм кислорода (АФК), таких как супероксидный радикал (O2–), перекись водорода (H2O2) и гидроксильный радикал (•OH), являющихся высокореактивными молекулами, которые в определенных количествах необходимы для метаболической активности клеток, а в высоких концентрациях повреждают клеточные макромолекулы (ДНК, белки) и надмолекулярные структуры, мембраны (Kohen, Nyska, 2002; Mishra, Mishra, 2015). Элиминация излишней концентрации АФК и регуляция их физиологического уровня в клетке контролируются ферментами антиоксидантной защиты, а также низкомолекулярными соединениями антиоксидантной системы (Ткаченко, 2018). Следует отметить, что стресс развивается при любом нарушении гомеостаза клетки, как при их переходе от метаболической активности к состоянию покоя, так и при обратном переходе покоящихся форм к обмену со средой. Поэтому система антиоксидантной защиты является одной из центральных для жизнеспособности и выживания микроорганизмов.
Наши исследования строились на следующем предположении. Хотя покоящиеся, длительно хранящиеся (мес. – годы – млн лет) формы, в отличие от вегетативных клеток, находятся в метаболически неактивном состоянии и у них отсутствует дыхание − внутриклеточный источник АФК, но в покоящихся формах должны сохраняться ферменты антиоксидантной защиты (как и другие биополимеры, ферментные белки, транскрипты), так как дыхание – первичное событие при реактивации покоящихся форм в модели бактериальных эндоспор, имеющее место еще до их регидратации и вырастания. Ключевыми и наиболее изученными ферментами системы антиоксидантной защиты (АОЗ) являются супероксиддисмутаза, каталаза и глутатионредуктаза. В настоящей работе проведена сравнительная оценка активности этих ферментов в вегетативных клетках и впервые – в покоящихся формах модельных штаммов.
Целью настоящей работы было получить в лабораторных условиях покоящиеся формы ранее выделенных нами (Сузина и соавт., 2018) грамотрицательных бактерий − эпибионтов лягушки Xenopus laevis, изучить их цитологические характеристики и активность ферментов антиоксидантной защиты по сравнению с вегетативными клетками бактерий.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования были грамотрицательные бактерии: Stenotrophomonas sp. FM3 (Сузина и соавт., 2018) и новый изолят бактерий, штамм FF1, который, по данным анализа нуклеотидной последовательности гена 16S рРНК, имеет 99.9% сходства с бактерией Morganella morganii sub-sp. sibonii. Оба штамма выделены с кожного покрова гладкой шпорцевой лягушки Xenopus laevis.
Бактерии культивировали в триптон-соевой среде 5/5, следующего состава (г/л): экстракт сои – 30.0, гидролизат казеина – 5.0, дрожжевой экстракт – 1.0 и аминопептид (мл/л) – 60.0; pH 8.0. Культивирование проводили в колбах Эрленмейера объемом 750 мл, содержащих 200 мл среды при 28°С на качалке при 120 об./мин в течение 48 ч для вариантов исследования вегетативных клеток в фазе экспоненциального роста. Анабиотические покоящиеся формы бактерий получали при хранении их стационарных старвированных культур в течение 7 мес. при температуре 18–20°С. Старвацию создавали голоданием по азоту, как описано ранее (Мулюкин и соавт., 2008, 2009а, 2009б).
Микроскопические исследования. Светооптические исследования в фазовом контрасте проводили с использованием микроскопа Nikon Eclipse Ci microscope (“Nikon”) с камерой Jenoptic Pro-gResSpeedXTcore5.
Препарирование клеток модельных штаммов для электронно-микроскопического анализа ультратонких срезов, морфометрический анализ и исследование ультраструктурной организации ЦПК осуществляли по ранее описанным методикам (Сузина и соавт., 2004, 2018). Электронно-микроскопические исследования проводили на трансмиссионном электронном микроскопе JEM-1400 (“JEOL”, Япония) при ускоряющем напряжении 80 кВ.
Биохимические исследования. Для проведения биохимических исследований вегетативные клетки 48 ч культур и ПФ 7 мес. культур отделяли от среды роста центрифугированием (10 000 g, 20 мин), отмывали фосфатным буфером (pH 7.4), ресуспендировали в нем и замораживали. Замороженную биомассу разрушали на прессе типа Хьюза с рабочим давлением 3200 кг/см2, инкубировали с ДНК-азой (5 мин, 20°С) и центрифугировали (30 000 g, 30 мин). Полученный бесклеточный экстракт далее использовали для определения активности ферментов.
Определение активности ферментов проводили спектрофотометрически, используя спектрофотометр UV 1800 (“Shimadzu”, Япония), в кварцевых кюветах с длиной оптического пути 1 см при температуре 25°С.
Активность каталазы (КФ 1.11.1.6) в супернатантах бесклеточных экстрактах определяли спектрофотометрическим методом по степени разрушения пероксида водорода (Aebi, 1984). Реакционная смесь содержала 20 мкл клеточного экстракта и 750 мкл Nа-фосфатного буфера (50 моль/л, рН 7.0). Реакцию запускали добавлением в реакционную смесь Н2O2 (конечная концентрация 20 ммоль/л) и регистрировали изменение оптической плотности при 240 нм в течение 30 с. Активность каталазы рассчитывали, учитывая коэффициент молярной экстинции перекиси водорода ε = 43.6 M–1 см–1 на 1 мг белка. За единицу активности принимали количество фермента, катализирующее разложение 1 мкмоль H2O2 за 1 мин.
Активность супероксиддисмутазы СОД (КФ 1.15.1.1) определяли непрямым спектрофотометрическим методом, предложенным в работе (Костюк и соавт., 1990). Метод основан на определении степени ингибирования реакции супероксидзависимого окисления кверцетина в щелочной среде в присутствии тетраметилэтилендиамина (ТМЭДА). Реакция сопровождается обесцвечиванием рабочего раствора, что регистрируется при 406 нм. Аутоокисление кверцетина (1.4 мкмоль/л) проводили при комнатной температуре в 0.015 моль/л фосфатном буфере рН 7.8, содержащем ЭДТА (этилендиамидтетраацетат) (0.8 ммоль/л) и ТМЭДА (0.8 ммоль/л). К 3.5 мл К‑фосфатного буфера добавляли 5 мкл бесклеточного экстракта. Реакцию запускали внесением в среду инкубации 0.1 мл кверцетина, растворенного в диметилсульфоксиде (ДМСО) до конечной концентрации 10 мкм. Оптическую плотность инкубационной смеси при 406 нм регистрировали сразу и через 20 мин после внесения кверцетина. Процент ингибирования рассчитывали по формуле:
Активность глутатионредуктазы (КФ 1.6.4.2) определяли по методике (Li et al., 2003). Реакционная смесь содержала 2 мл К-фосфатного буфера рН 7.4 (0.2 моль/л), ЭДТА (2 ммоль/л), 50 мкл окисленного глутатиона (920 моль/л) и 50 мкл бесклеточного экстракта. Для инициации реакции в смесь добавляли 0.5 мл НАДФН (2 ммоль в 10 ммоль/л, рН 7.0) и регистрировали снижение оптической плотности при 340 нм (ε = 6.220 × × 103 М–l см–1). Активность фермента выражали в мкмоль НАДФН/(мин мг белка).
Концентрацию белка определяли модифицированным методом Бредфорд (Schlömann et al., 1990).
Статистическую оценку проводили с помощью однофакторного дисперсионного анализа (ANOVA). P-значение менее 0.05 считали статистически значимым. На диаграммах различия с контрольным образцом отмечали по следующей схеме: * для 0.005 < p ≤ 0.05; ** для 0.001 < p ≤ 0.005. Результаты определения активности представлены как среднее значение ± стандартная ошибка среднего (n = 3).
РЕЗУЛЬТАТЫ
Сравнительный анализ морфологических и ультраструктурных характеристик вегетативных и покоящихся клеток. В настоящем исследовании впервые были получены ПФ грамотрицательных бактерий – эпибионтов лягушки Xenopus laevis: Stenotrophomonas sp. FM3 и Morganella morganii subsp. sibonii FF1. Покоящиеся формы образовались в планктонных культурах бактерий, развивающихся в условиях лимита азота и хранившихся при комнатной температуре в течение 7 мес. Анализ морфологических и ультраструктурных перестроек покоящихся клеток модельных штаммов выявил значительное уменьшение их размеров/объемов (рис. 1в, 1г; 2б; 3б, 3в) по сравнению с вегетативными клетками (рис. 1а, 1б; 2а; 3а). Вегетативные клетки обоих штаммов имели палочковидную форму, но различались морфометрическими показателями. Вегетативные клетки штамма FM3 в отличие от клеток штамма FF1 представлены тонкими палочками, длина которых колеблется от 0.9 мкм до 2.0 мкм, и имеет малую толщину (≤0.4–0.3 мкм). Длина вегетативных клеток штамма FF1 колеблется от 0.8 мкм до 1.2 мкм, толщина составляет преимущественно 0.5–0.6 мкм. Покоящиеся формы обоих штаммов (ЦПК) представлены мелкими клеточными формами, имеющими вид коротких палочек длиной около 0.5 мкм или сфер, диаметром от 0.35 до 0.55 мкм. В популяциях ПФ обоих штаммов преобладают клетки объемом ≤0.02 мкм3 (~80%).
Рис. 1.
Морфология вегетативных и цистоподобных покоящихся клеток (ЦПК) модельных штаммов: вегетативные клетки Stenotrophomonas sp. FM3 (а) и Morganella morganii subsp. sibonii FF1 (б); ЦПК Stenotrophomonas sp. FM3 (в) и M. morganii subsp. sibonii FF1 (г). Световая микроскопия, фазовый контраст. Длина масштабной метки – 10 мкм.

Электронно-микроскопическое исследование структурной организации показало, что клетки обоих штаммов бактерий имеют характерное для грамотрицательных бактерий строение оболочки: наружную мембрану, периплазматическое пространство и цитоплазматическую мембрану. Особенностью клеток штамма FM3 является наличие S-слоя (рис. 2а), а для клеток штамма FF1 характерно наличие большого числа пилей (рис. 3а).
Рис. 2.
Особенности ультраструктурной организации вегетативных и цистоподобных клеток Stenotrophomonas sp. FM3. Ультратонкие срезы вегетативных клеток (а); цистоподобных клеток (б); фрагменты ультратонких срезов ЦПК штамма FM3 (в, г, д). Трансмиссионная электронная микроскопия. Длина масштабной метки: а, б – 0.5 мкм; в, г, д – 0.2 мкм. Обозначения: НМ – наружная мембрана; ЦМ – цитоплазматическая мембрана; ПП – периплазматическое пространство; Ц – цитоплазма; Н – нуклеоид; S – S-слой.
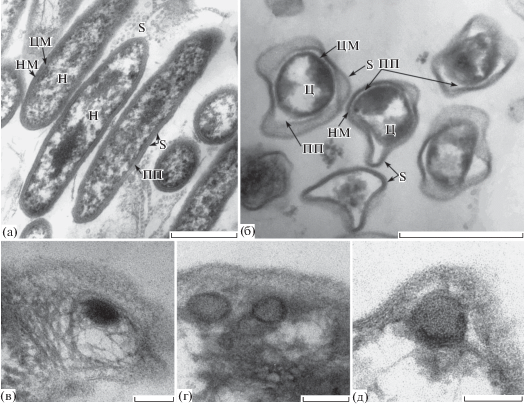
Рис. 3.
Особенности ультраструктурной организации вегетативных и цистоподобных клеток Morganella morganii subsp. sibonii FF1. Ультратонкие срезы вегетативных клеток (а); цистоподобных клеток (б, в). Трансмиссионная электронная микроскопия. Длина масштабной метки: а – 0.5 мкм; б, в – 0.2 мкм. Обозначения: НМ – наружная мембрана; ЦМ – цитоплазматическая мембрана; ПП – периплазматическое пространство; П – пили; Н – нуклеоид. Белыми стрелками указаны участки в цитоплазме ЦПК с периодической исчерченностью.

Анализ ультратонких срезов ПФ штаммов FM3 и FF1 выявил их существенные структурные отличия от вегетативных клеток. Для ПФ обоих штаммов были характерны обширное периплазматическое пространство, плотная гетерогенная цитоплазма и выраженная конденсация нуклеоида (рис. 2б–2г; 3б, 3в). Особенностью перестройки нуклеоида в ЦПК штамма FM3 было формирование плотных сферических образований, на периферии которых упаковывались нити нуклеоида в виде концентрически уложенных колец (рис. 2в–2д). В цитоплазме ЦПК штамма FF1 выявлялись электронно-плотные участки со слабо выраженной периодической исчерченностью (рис. 3б, 3в). Выявленная в обоих случаях ультраструктурная организация нуклеоида характерна для биокристаллов нуклеоида, представляющих собой упорядочено организованные комплексы ДНК с гистоноподобным белком стационарной фазы Dps, достаточно подробно изученных в стационарных клетках E. coli (Wolf et al., 1999; Frenkiel-Krispin, Minsky, 2006), и обнаруженных нами в ЦПК грамположительных и грамотрицательных бактерий, архей, а также в покоящихся формах in situ в вечной мерзлоте (Лойко и соавт., 2017).
Отметим, что по своим ультраструктурным характеристикам покоящиеся формы изучаемых бактерий были аналогичны цистоподобным покоящимся клеткам (ЦПК) грамотрицательных бактерий различных видов, ранее полученным нами in vitro в культурах Pseudomonas aeruginosa, P. fluorescens, P. aurantiaca, Azospirillum brasilense, Sinorhizobium meliloti и др. (Мулюкин и соавт., 2005, 2008, 2009а; Лойко и соавт., 2011).
Сравнительный анализ ферментов антиокислительной защиты вегетативных и покоящихся клеток. Оценку активности ферментов антиоксидантной защиты проводили в бесклеточных экстрактах, полученных после разрушения вегетативных и покоящихся клеток модельных штаммов Stenotrophomonas sp. FM3 и Morganella morganii subsp. sibonii FF1. Сравнительный анализ полученных результатов выявил новые, ранее не описанные физиолого-биохимические свойства ЦПК. Было обнаружено, что, во-первых, штаммы FM3 и FF1 обладают различной активностью антиоксидантных ферментов, более высокой у Morganella morganii subsp. sibonii FF1 (табл. 1). Во-вторых, ПФ обоих штаммов характеризовались сохранением этой ферментативной активности, и, в-третьих, в ПФ она была существенно более высокой, чем в вегетативных клетках (рис. 4): активность супероксиддисмутазы в ПФ штамма FM3 − в 3.5 раза и в ПФ штамма FF1 – в 2.8 раза, каталазы в ПФ штамма FM3 – почти в 10 раз и глутатионредуктазы в ПФ штамма FF1 − в 3.1 раза. При этом в ПФ FM3 было отмечено отсутствие активности глутатионредуктазы, а в ПФ FF1 – снижение в 9.3 раза активности каталазы. Таким образом, в настоящем исследовании впервые показано сохранение в ПФ потенциально активных ферментных белков на примере ферментов системы антиоксидантной активности клеток.
Таблица 1.
Определение активности антиоксидантных ферментов у исследуемых штаммов бактерий Stenotrophomonas sp. FM3 и Morganella morganii subsp. sibonii FF1
| Бактерия | Активность ферментов, ед/мг белка | ||
|---|---|---|---|
| супероксиддисмутаза | каталаза | глутатионредуктаза | |
| Штамм FM3 | 32.6 | 0.0559 | 0.0128 |
| Штамм FF1 | 60.6 | 0.1249 | 0.3812 |
Рис. 4.
Активность ферментов антиоксидантной защиты у вегетативных и покоящихся клеток модельных штаммов FM3 и FF1. На диаграммах показаны средние значения активности фермента с учетом стандартной ошибки среднего. * 0.001 < p ≤ 0.005; ** p ≤ 0.001 в сравнении с контрольным образцом. В – вегетативные клетки на среде 5/5; ПК – покоящиеся клетки.
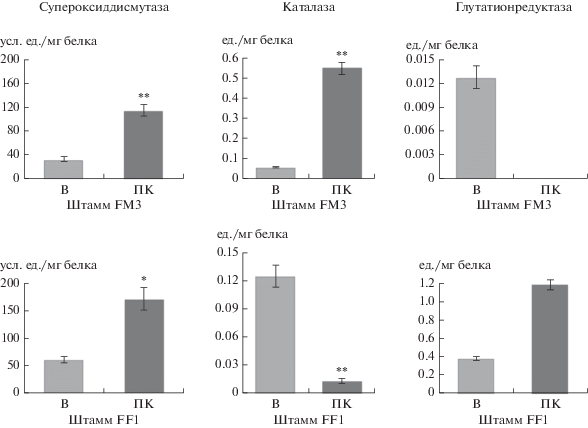
Отметим, что в покоящихся формах удельное содержание белка (к массе сухих клеток) меньше, чем в вегетативных, и этим может частично объясняться более высокая активность антиоксидантных ферментов в ПФ, но самое главное, что эта активность детектируется.
ОБСУЖДЕНИЕ
Как было показано в наших предыдущих исследованиях, неспорообразующие микроорганизмы различных таксонов как про-, так и эукариот всегда завершают цикл своего развития в жидких и на твердых средах образованием метаболически покоящихся форм (обобщения в работах: Бухарин и соавт., 2005; Эль-Регистан и соавт., 2006; Николаев и соавт., 2006; Мулюкин, 2010). Были разработаны несколько протоколов образования in vitro (получения) ПФ неспорообразующих бактерий, а также спорообразующих бактерий в условиях, когда образование эндоспор репрессировано условиями культивирования. Наиболее близкой к природным условиям и потому наиболее часто применяемой в лабораторной практике является модель образования ПФ в условиях старвации периодических планктонных культур, лимитированных источниками азота или С или Р (Мулюкин и соавт., 2008; Соляникова и соавт., 2017; Suzina et al., 2006; Anuchin et al., 2009).
В настоящем исследовании с использованием этого протокола было показано образование покоящихся форм в циклах развития планктонных культур Stenotrophomonas sp. FM3 и Morganella morganii subsp. sibonii FF1, впервые для эпибионтов земноводных. По своим характеристикам ПФ штаммов FM3 и FF1 были аналогичны цистоподобным покоящимся клеткам грамотрицательных бактерий, изученных ранее, в том числе эндосимбионта растений Azospirillum brasiliens (Мулюкин и соавт., 2009а).
Общепринято, что в покоящихся клетках микроорганизмов отсутствует экспериментально определяемая метаболическая активность (Sudo, Dvorkin, 1973), что было полностью подтверждено нами при определении дыхательной активности ЦПК всех изученных микроорганизмов (более 20 родов), как маркерного признака отсутствия метаболизма у бациллярных эндоспор и других ПФ микроорганизмов (Эль-Регистан и соавт., 2006; Мулюкин, 2010). Однако в последние годы появились экспериментальные доказательства того, что в ПФ присутствуют биополимерные компоненты метаболически активных клеток, но в неактивном или, правильнее сказать, потенциально активном состоянии. Так в покоящихся формах бактерий было обнаружено наличие транскриптов (Wu et al., 2016; Herlihy, 2017; Matsumoto et al., 2017), хотя канонически принятое время их полужизни составляет минуты: транскрипционная РНК разрушается РНКазами. Их сохранение в метаболически покоящихся клетках бактерий может быть обусловлено реорганизацией клеточного нуклеоида – его биокристаллизацией и конденсацией за счет образования упорядоченно организованных комплексов ДНК с гистоноподобным белком Dps (Wolf et al., 1999). Аналогичное объяснение может быть предложено для ситуации сохранения транскриптов в эндоспорах Bacillus subtilis, в составе биокристаллов нуклеоида, образованного комплексами ДНК с гистоноподобными белками SASP’s (Small Acid Soluble Proteins) (Frenkiel-Krispin, Minsky, 2006; Dittmann et al., 2015). Другое объяснение сохранения в ПФ биополимеров связано либо со структурной модификацией самой РНК как субстрата, либо конформационной модификацией РНКаз с их обратимой инактивацией в ПФ и восстановлением функциональной активности при прорастании. Такие конформационные изменения ферментных белков были показаны in vitro с участием низкомолекулярных соединений, имеющих функции химических шаперонов (эктoин, глицин, другие аминокислоты, ди- и трисахара, трегалоза, фенольные липиды, алкилрезорцины и др.), концентрационно и в зависимости от структуры влияющих на функциональную активность ферментов: от стимуляции активности до полного обратимого ингибирования (Николаев и соавт., 2006; Stasiuk, Kozubek, 2010; Solyanikova et al., 2010). С высокой долей вероятности можно полагать, что сохранение потенциальной активности ферментов антиоксидантной защиты в ПФ обусловлено также их структурной реорганизацией – изменением конформации молекул ферментных белков за счет их физико-химических взаимодействий с внутриклеточными малыми молекулами. Дополнительной и, по-видимому, более важной причиной обратимой инактивации ферментов, как и других клеточных биополимеров и структур, в ПФ микроорганизмов является обезвоживание покоящихся клеток и витрификация (остекленение) их цитоплазмы с потерей молекулярной подвижности всех внутриклеточных элементов как физической основы метаболической активности клеток (Sun, Leopold, 1997).
Полученные результаты и их анализ обосновывают важность проведенного исследования для фундаментальной микробиологии. Помимо этого, результаты работы интересны в биомедицинском аспекте. Близкие к Stenotrophomonas sp. FM3 и Morganella morganii subsp. sibonii FF1 виды бактерий являются одними из наиболее распространенных оппортунистических агентов, способных вызывать нозокамиальные внутрибольничные инфекции (De Mauri et al., 2014; Sarfraz et al., 2014; Trivedi et al., 2015; Brooke et al., 2017), что обусловливало дополнительный интерес к изучению их покоящихся форм.
Продемонстрированное образование штаммами FM3 и FF1 покоящихся клеток теоретически объясняет устойчивость внутрибольничных инфекций к санитарным обработкам и обосновывает формулирование следующих задач: выяснение условий минимизации образования покоящихся форм патогенных бактерий и разработку способов их эффективной элиминации.
Электронно-микроскопические исследования выполнены на базе ЦКП “Коллекция UNIQEM”.
Работа была выполнена при финансовой поддержке Российского фонда фундаментальных исследований (РФФИ), грант № 16-04-01347.
Список литературы
Бухарин О.В., Гинцбург А.Л., Романова Ю.М., Эль-Регистан Г.И. Механизмы выживания бактерий. М.: Медицина, 2005. 367 с.
Дмитриев В.В., Сузина Н.Е., Русакова Т.Г., Гиличинский Д.А., Дуда В.И. Ультраструктурные особенности природных форм микроорганизмов, изолированных из грунтов вечной мерзлоты Восточной Сибири методом низкотемпературного фракционирования // Д-окл. Академии наук. 2001. Т. 378. № 6. С. 846–849.
Дмитриев В.В., Сузина Н.Е., Баринова Е.С., Дуда В.И., Боронин А.М. Электронно-микроскопическое изучение ультраструктуры микробных клеток in situ в экстремальных биотопах // Микробиология. 2004. Т. 73. № 6. С. 832–840.
Dmitriev V.V., Suzina N.E., Barinova E.S., Duda V.I., Boronin A.M. An electron microscopic study of the ultrastructure of microbial cells in extreme biotopes in situ // Microbiology (Moscow). 2004. V. 73. P. 716–723.
Костюк В.А., Потапович А.И., Ковалева Ж.В. Простой и чувствительный метод определения активности супероксиддисмутазы, основанный на реакции окисления кверцетина // Вопросы мед. химии. 1990. Т. 36. № 2. С. 88–91.
Kostyuk V.A., Potapovich A.I., Kovaleva Zh.V. A simple, sensitive assay for determination of superoxide dismutase activity based on reaction of quercetin oxidation // Vopr. Med. Chimii (Moscow). 1990. V. 26. № 2. P. 88–91.
Лойко Н.Г., Кряжевских Н.А., Сузина Н.Е., Демкина Е.В., Муратова А.Ю., Тураковская О.В., Козлова А.Н., Гальченко В.Ф., Эль-Регистан Г.И. Покоящиеся формы Sinorhizobium meliloti // Микробиология. 2011. Т. 80. № 4. С. 465–476.
Loiko N.G., Kryazhevskikh N.A., Demkina E.V., Kozlova A.N., Galchenko V.F., El’-Registan G.I., Suzina N.E., Muratova A.Y., Turkovskaya O.V. Resting forms of Sinorhizobium meliloti // Microbiology (Moscow). 2011. V. 80. P. 472–482.
Лойко Н.Г., Сузина Н.Е., Соина В.С., Смирнова Т.А., Зубашева М.В., Азизбекян Р.Р., Синицын Д.О., Терешкина К.Б., Николаев Ю.А., Крупянский Ю.Ф., Эль-Регистан Г.И. Биокристаллические структуры в нуклеоидах стационарных и покоящихся клеток прокариот // Микробиология. 2017. Т. 86. № 6. С. 703–719.
Loiko N.G., Nikolaev Y.A., El’-Registan G.I., Suzina N.E., Soina V.S., Smirnova T.A., Zubasheva M.V., Azizbekyan R.R., Sinitsyn D.O., Tereshkina K.B., Krupyanskii Y.F. Biocrystalline structures in the nucleoids of the stationary and dormant prokaryotic cells // Microbiology (Moscow). 2017. V. 86. P. 714–727.
Мулюкин А.Л. Покоящиеся формы неспорообразующих бактерий: свойства, разнообразие, диагностика. Дис. … докт. биол. наук. М.: ИНМИ РАН, 2010.
Мулюкин А.Л., Вахрушев М.А., Стражевская Н.Б., Шмырина А.С., Жданов Р.И., Сузина Н.Е., Дуда В.И., Козлова А.Н., Эль-Регистан Г.И. Влияние микробных аутоиндукторов анабиоза – алкилоксибензолов – на структурную организацию ДНК Pseudomonas aurantiaca и индукцию фенотипической диссоциации // Микробиология. 2005. Т. 74. № 2. С. 157–165.
Mulyukin A.L., Kozlova A.N., El’-Registan G.I., Vakhrushev M.A., Strazhevskaya N.B., Shmyrina A.S., Zhdanov R.I., Suzina N.E., Duda V.I. Effect of alkylhydroxybenzenes, microbial anabiosis inducers, on the structural organization of Pseudomonas aurantiaca DNA and on the induction of phenotypic dissociation // Microbiology (Moscow). 2005. V. 74. P. 128–135.
Мулюкин А.Л., Сузина Н.Е., Дуда В.И., Эль-Регистан Г.И. Структурное и физиологическое разнообразие цистоподобных покоящихся клеток бактерий рода Pseudomonas // Микробиология. 2008. Т. 77. № 4. С. 512–523.
Mulyukin A.L., El’-Registan G.I., Suzina N.E., Duda V.I. Structural and physiological diversity among cystlike resting cells of bacteria of the genus Pseudomonas // Microbiology (Moscow). 2008. V. 77. P. 455–465.
Мулюкин А.Л., Сузина Н.Е., Погорелова А.Ю., Антонюк Л.П., Дуда В.И., Эль-Регистан Г.И. Разнообразие морфотипов покоящихся клеток и условия их образования у Azospirillum brasilense // Микробиология. 2009а. Т. 78. № 1. С. 42–51.
Mulyukin A.L., Pogorelova A.Yu., El-Registan G.I., Suzina N.E., Duda V.I., Antonyuk L.P. Diverse morphological types of dormant cells and conditions for their formation in Azospirillum brasilense // Microbiology (Moscow). 2009a. V. 78. P. 33–41.
Мулюкин А.Л., Демкина Е.В., Кряжевских Н.А., Сузина Н.Е., Воробьева Л.И., Дуда В.И., Гальченко В.Ф., Эль-Регистан Г.И. Покоящиеся формы Micrococcus luteus и Arthrobacter globiformis, не прорастающие на стандартных средах // Микробиология. 2009б. Т. 78. № 4. С. 456–468.
Mulyukin A.L., Demkina E.V., Kryazhevskikh N.A., Galchenko V.F., El-Registan G.I., Suzina N.E., Duda V.I., Vorob’eva L.I. Dormant forms of Micrococcus luteus and Arthrobacter globiformis not platable on standard media // Microbiology (Moscow). 2009b. V. 78. P. 407–418.
Николаев Ю.А., Мулюкин А.Л., Степаненко И.Ю., Эль-Регистан Г.И. Ауторегуляция стрессового ответа микроорганизмов // Микробиология. 2006. Т. 75. № 4. С. 489–496.
Nikolaev Yu.A., Mulyukin A.L., Stepanenko I.Yu., El’-Registan G.I. Autoregulation of stress response in microorganisms // Microbiology (Moscow). 2006. V. 75. P. 420–426.
Соляникова И.П., Сузина Н.Е., Егозарьян Н.С., Поливцева В.Н., Мулюкин А.Л., Егорова Д.О., Эль-Регистан Г.И., Головлёва Л.А. Особенности структурно-функциональных перестроек клеток актинобактерий Microbacterium foliorum BN52 при переходе от вегетативного роста в состояние покоя и при прорастании покоящихся форм // Микробиология. 2017. Т. 86. № 4. С. 463–475.
Solyanikova I.P., Suzina N.E., Egozarjan N.S., Polivtseva V.N., Mulyukin A.L., Egorova D.O., El-Registan G.I., Golovleva L.A. // Structural and functional rearrangements in the cells of actinobacteria Microbacterium foliorum BN52 during transition from vegetative growth to a dormant state and during germination of dormant forms // Microbiology (Moscow). 2017. V. 86. P. 476–486.
Сузина Н.Е., Мулюкин А.Л., Козлова А.Н., Шорохова А.П., Дмитриев В.В., Баринова Е.С., Мохова О.Н., Эль-Регистан Г.И., Дуда В.И. Тонкое строение покоящихся клеток некоторых неспорообразующих бактерий // Микробиология. 2004. Т. 73. № 4. С. 516–529.
Suzina N.E., Mulyukin A.L., Kozlova A.N., Shorokhova A.P., Dmitriev V.V., Barinova E.S., Mokhova O.N., El’-Registan G.I., Duda V.I. Ultrastructure of resting cells of some non-sporeforming bacteria // Microbiology (Moscow). 2004. V. 73. P. 435–447.
Сузина Н.Е., Росс Д.В., Шорохова А.П., Абашина Т.Н., Поливцева В.Н., Есикова Т.З., Мачулин А.В., Мулюкин А.Л., Дуда В.И. Цитофизиологические особенности вегетативных и покоящихся клеток бактерии Stenotrophomonas sp. FM3, выделенной с поверхности кожных покровов лягушки Xenopus laevis // Микробиология. 2018. Т. 87. № 3. С. 266–278.
Suzina N.E., Ross D.V., Shorokhova A.P., Abashina T.N., Polivtseva V.N., Esikova T.Z., Machulin A.V., Mulyukin A.L., Duda V.I. Cytophysiological characteristics of the vegetative and dormant cells of Stenotrophomonas sp. FM3, a bacterium isolated from the skin of a Xenopus laevis frog // Microbiology (Moscow). 2018. V. 87. P. 339–349.
Ткаченко А.Г. Стрессорные ответы бактериальных клеток как механизм развития толерантности к антибиотикам (Обзор) // Прикл. биохимия и микробиология. 2018. Т. 54. № 2. С. 110–133.
Tkachenko A.G. Stress responses of bacterial cells as mechanism of development of antibiotic tolerance (review) // Appl. Biochem. Microbiol. 2018. V. 54. P. 108–127.
Эль-Регистан Г.И., Мулюкин А.Л., Николаев Ю.А., Сузина Н.Е., Гальченко В.Ф., Дуда В.И. Адаптогенные функции внеклеточных ауторегуляторов микроорганизмов // Микробиология. 2006. Т. 75. № 4. С. 446–456.
El-Registan G.I., Mulyukin A.L., Nikolaev Yu.A., Gal’chenko V.F., Suzina N.E., Duda V.I. Adaptogenic functions of extracellular autoregulators of microorganisms // Microbiology (Moscow). 2006. V. 75. P. 380–389.
Aebi H. Catalase in vitro // Methods Enzymol. 1984. V. 105. P. 121–126.
Anuchin A.M., Mulyukin A.L., Suzina N.E., Duda V.I., El-Registan G.I., Kaprelyants A.S. Dormant forms of Micobacterium smegmatis with distinct morphology // Microbiology (SGM). 2009. V. 155. P. 1071–1079.
Balaban N., Gerdes K., Lewis K., McKinney J.D. A problem of persistence: still more questions than answers? // Nat. Rev. Microbial. 2013. V. 11. P. 587–591.
Blagodatskaya E., Kuzyakov Ya. Active microorganisms in soil: Critical review of estimation criteria and approaches // Soil Biol. Biochem. 2013. V. 67. P. 192–211.
Brooke J.S., Di Bonaventura G., Berg G., Martinez J.-L. Editorial: A multidisciplinary look at Stenotrophomonas maltophilia: An emerging multi-drug-resistant global opportunistic pathogen // Front. Microbiol. 2017. V. 8. Article 1511. www.frontiersin.org.
De Mauri A., Torreggiani M., Chiarinotti D., Andreoni S., Molinari G., De Leo M. Stenotrophomonas maltophilia: an emerging pathogen in dialysis units // J. Med. Microbiol. 2014. V. 63. P. 1407–1410.
Dittmann C., Han H.M., Grabenbauer M., Laue M. Dormant Bacillus spores protect their DNA in crystalline nucleoids against environmental stress // J. Struct. Biol. 2015. V. 191. P. 156–164. doi 10.1016/j.jsb.2015.06.019
Frenkiel-Krispin D., Minsky A. Nucleoid organization and the maintenance of DNA integrity in E. coli, B. subtilis and D. radiodurans // J. Struct. Biol. 2006. V. 156. P. 311–319.
Grant S.S., Hung D.T. Persistent bacterial infections, antibiotic tolerance, and oxidative stress response // Virulence. 2013. V. 4. P. 1–11.
Herlihy A.E., de Bruin R.A.M. The role of the transcriptional response to DNA replication stress // Genes (Basel). 2017. V. 8. P. 92. doi 10.3390/genes8030092
Kohen R., Nyska A. Oxidation of biological systems: Oxidative stress phenomena, antioxidants, redox reactions, and methods for their quantification // Toxicol. Pathol. 2002. V. 30. P. 620–650.
Lewis K. Persister cells, dormancy and infectious disease // Nature Rev. Microbiol. 2007. V. 5. P. 49–56.
Lewis K. Persister cells // Annu. Rev. Microbiol. 2010. V. 64. P. 357–372.
Li Y., Hugenholtz J., Abee T., Molenaar D. Glutatione protects Lactococcus lactis against oxidative stress // Appl. Environ. Microbiol. 2003. V. 69. P. 5739–5745.
Matsumoto S., Kawai Y., Miyagawa S., Iwamoto Y., Okuda S., Sánchez-Gorostiaga A., Vicente M., Tsuneda S. Unique transcriptional profile of native persisters in Escherichia coli // J. Biosci. Bioeng. 2018. V. 125. P. 15–22. doi 10.1016/ j.jbiosc.2017.07.015
Mishra A., Mishra K.P. Bacterial resistance mechanism against oxidative stress (review article) // J. Med. Pharm. Innovat. 2015. V. 2. P. 1–9.
Roszak D.B., Colwell R.R. Survival strategies of bacteria in the natural environment // Microbiol. Rev. 1987. V. 51. P. 365–379.
Sarfraz A., Ansari M.A.A., Bhattacharyya S., Jaiswal N., Das S., Singh S., Ravikirti. Liver abscess caused by Morganella morganii subspecies sibonii biogroup G in a chronic alcoholic patient // Res. J. Pharm. Biol. Chem. Scis. 2014. V. 5. P. 467–469.
Schlömann M., Schmidt E., Knackmuss H.-J. Different types of dienelactone hydrolase in 4-fluorobenzoate-utilizing bacteria // J. Bacteriol. 1990. V. 172. P. 5112–5118.
Solyanikova I.P., Konovalova E.I., El-Registan G.I., Golovleva L.A. Effect of alkyl hydroxybenzenes on the properties of dioxygenases // J. Environ. Sci. Health. B. 2010. V. 45. P. 810–818. doi 10.1080/03601234.2010.515481
Stasiuk M., Kozubek A. Biological activity of phenolic lipids // Cell. Mol. Life Sci. 2010. V. 67. P. 841–860. doi 10.1007/ s00018-009-0193-1
Sudo S.Z., Dvorkin M. Comparative biology of prokaryotic resting cells // Adv. Microbial Physiol. 1973. V. 9. P. 153–233.
Sun W.Q., Leopold A.C. Cytoplasmic vitrification and survival of anhydrobiotic organisms // Comp. Biochem. Physiol. 1997. V. 117A. P. 327–333.
Suzina N.E., Moulyukin A.L., Dmitriev V.V., Nikolaev Yu.A., Shorokhova A.P., Bobkova Yu.S., Barinova E.S., Plakunov V.K., El’-Registan G.I., Duda V.I. The structural bases of long-term anabiosis in non-spore-forming bacteria // Adv. Space Res. 2006. V. 3. P. 1209–1219.
Trivedi M.K., Patil Sh., Shettigar H., Gangwar M., Jana S. An evaluation of biofield treatment on susceptibility pattern of multidrug resistant Stenotrophomonas maltophilia: An emerging global opportunistic pathogen // Clin. Microbiol. 2015. V. 4. doi 10.4172/2327-5073.1000211
Wolf S.G., Frenkiel D., Arad T., Finkel S.E., Kolter R., Minsky A. DNA protection by stress-induced biocrystallization // Nature. 1999. V. 400. P. 83–85. doi 10.1038/21918
Wu M.-L., Gengenbacher M., Chung Jade C.S., Lin C. S., Mollenkopf H.-J., Kaufmann S.H.E., Dick T. Developmental transcriptome of resting cell formation in Mycobacterium smegmatis // BMC Genomics. 2016. V. 17:837. doi 10.1186/ s12864-016-3190-4
Дополнительные материалы отсутствуют.


