Микробиология, 2019, T. 88, № 2, стр. 165-174
Железовосстанавливающие микробные сообщества низкотемпературных донных осадков озера Байкал
А. Г. Захарюк a, *, Я. В. Рыжманова a, А. Н. Автух a, В. А. Щербакова a
a Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН
142290 Московская обл., Пущино, Россия
* E-mail: kuran82@mail.ru
Поступила в редакцию 01.08.2018
После доработки 11.10.2018
Принята к публикации 30.11.2018
Аннотация
Из проб поверхностных донных осадков озера Байкал, отобранных с глубин от 404 до 1396 м, впервые получены психроактивные накопительные культуры бактерий, восстанавливающие антрахинон 2,6-дисульфонат (AQDS) и растворимые комплексы трехвалентного железа при температурах 5–20°С. В результате культивирования образовывалось до 6 мМ Fe(II), что составило более 50% от начальной концентрации Fe(III) в среде, и 5.5 мМ AH2QDS (около 30% от начальной концентрации хинона). Накопительная культура железовосстанавливающих бактерий St3 использовала цитрат Fe(III) в качестве терминального акцептора электронов, окисляя при этом формиат с 6.5 до 2.0 г/л при 15°С. Филогенетический анализ показал, что исходные пробы донных осадков оз. Байкал и накопительные культуры, полученные из этих образцов, содержали таксоны классов α- и β-Proteobacteria, являющиеся близкородственными бактериями, способными окислять ароматические соединения с использованием неорганических акцепторов электронов, в том числе трехвалентного железа.
Микробное восстановление железа – один из геохимически значимых процессов в природе, который оказывает влияние не только на распределение железа, но и играет важную роль в деструкции органического вещества (Lovley, 1991). По литературным данным приблизительно от 40 до 90% микроорганизмов микробного сообщества, развивающегося в анаэробных условиях, способно к ассимиляционному или диссимиляционному восстановлению Fe(III) (Anderson et al., 1998). Предполагается, что организмы так широко и разнообразно используют этот переменно-валентный элемент в процессе жизнедеятельности не только из-за его химических особенностей, но, прежде всего, из-за его распространенности и повсеместной доступности на Земле. На сегодняшний день известны и достаточно хорошо изучены различные представители бактерий, восстанавливающих железо в термальных источниках, морских и пресных водоемах, щелочных экосистемах (Slobodkin, Wiegel, 1997; Vargas et al., 1998; Kashefi et al., 2004; Заварзина и соавт., 2006; Жилина и соавт., 2009). Между тем, значительно менее изучен процесс микробной железоредукции в низкотемпературных эконишах и бактерии, которые осуществляют этот процесс. До конца не выяснена роль микробиологического цикла железа в холодных экосистемах и его возможная связь с циклами других биогенных элементов. Информация о физиологии и биохимии восстановления соединений Fe(III) психрофильными микроорганизмами ограничена единичными сообщениями. К настоящему моменту выделено несколько чистых культур железовосстанавливающих бактерий (ЖВБ), отнесенных к классу δ-Proteobacteria, способных выживать при 4°С, однако оптимумы роста и восстановления железа у них наблюдались при более высокой температуре 22–30°С (Holmes et al., 2004; Nevin et al., 2005). В ряде исследований было продемонстрировано присутствие ЖВБ в водной толщи озера Байкал с использованием молекулярно-экологических методов. Удалось получить несколько клонов, отнесенных к родам Geobacter, Pelobacter и Desulforomonas (Белькова и соавт., 2003; Zemskaya et al., 2010). Ранее изучение культивируемых психрофильных микробных сообществ, в состав которых входят ЖВБ, в озере Байкал не проводилось.
Целью работы было выявить микробные процессы восстановления железа, получить накопительные культуры ЖВБ, а также изучить филогенетическое разнообразие бактерий в донных осадках озера Байкал.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Отбор и описание проб. В работе использовали пробы поверхностных донных осадков, которые были отобраны в результате экспедиций в 2009–2010 гг. на озеро Байкал, организованных Лимнологическим институтом СО РАН на НИС “Г.Ю. Верещагин”, с помощью ГОА “Мир” (Zemskaya et al., 2011). Четыре пробы были любезно предоставлены для исследований лабораторией микробиологии углеводородов ЛИН СО РАН, три из них были отобраны в северной части озера, в районе бухты Фролиха, и одна проба взята в центральной части озера Байкал пластиковыми бентосными трубками с глубины 900 м. Пробы отобраны в районе газо- и нефтепроявлений и представлены черными маслянистым илами с примесями углеводородов (табл. 1). Максимальная концентрация ${\text{HCO}}_{3}^{ - }$ в пробах достигала 11 мМ, наибольшее количество ${\text{SO}}_{4}^{{2 - }}$ (0.8 мМ) зафиксировано в водной вытяжке из пробы, отобранной на станции Gorevoy Utes. Концентрации ${\text{NO}}_{3}^{ - }$ и Cl– варьировали в районе 0.2–0.7 мМ. Концентрация общего железа в осадках исследуемых проб превышала 80 мМ (Zemskaya et al., 2012). Температура воды у дна озера была около 4°С. Среднее значение рН осадков – 7.03.
Таблица 1.
Описание проб поверхностных донных отложений озера Байкал
| Станция | Координаты | Тип пробы | Глубина, м |
|---|---|---|---|
| St1 | 55°30.94′ N 109°46.58′ E | Светло-коричневый илистый песок | 404 |
| St3 | » | Серый песок с примесями мелких камней | 409 |
| St11 | » | Окисленный ил, район газопроявлений | 1396 |
| Gorevoy Utes | 53°18′ N 108°23′ E | Восстановленный ил, район нефтепроявлений | 900 |
Условия культивирования микроорганизмов. Для получения накопительных культур ЖВБ и дальнейшего их исследования 1 г осадка вносили в 100 мл среды. Использовали модифицированную среду (Zhang et al., 1999), в которую добавляли (мл/л): раствор микроэлементов (Slobodkin, Wiegel, 1997) – 1.0, раствор витаминов – 10.0 (Wolin et al., 1963) и дрожжевой экстракт “Difco” – 0.002 г/л. В качестве источника углерода и донора электронов использовали формиат натрия и ацетат натрия в конечной концентрации 20 мМ. В качестве акцепторов электронов вносили (мМ): цитрат Fe(III) – 10, AQDS – 20 и аморфную гидроокись окисного железа (АГОЖ) – 10, которую готовили путем титрования 10% NaOH (вес/об.) раствора FeCl3 ∙ 6H2O. Приготовление минеральной среды и культивирование микроорганизмов проводили в анаэробных условиях под N2 (100% в газовой фазе), рН среды 7.0–7.2. Инкубировали в темноте при 5, 15 и 20°С в течение 30–60 сут. В качестве химического контроля использовали минеральную среду без инокуляции.
Морфология. Живые клетки исследовали с помощью светового микроскопа Axiostar PLUS (“Carl Zeiss”, Германия) с фазовым контрастом при увеличении 1000×.
Учет численности бактерий. Количественный учет числа клеток микроорганизмов осуществляли методом Виноградского–Брида (Нетрусов и соавт., 2005) на фиксированных окрашенных препаратах под микроскопом. Образец был предварительно сконцентрирован в 10 раз.
Аналитические методы. Восстановление Fe(III) определяли колориметрическим методом по образованию стабильного окрашенного комплекса двухвалентного железа с феррозином (Viollier et al., 2000). Для определения восстановленной формы AH2QDS использовали анаэробные 1-см кюветы, которые продували N2 (100% газовой фазы). Концентрацию AH2QDS (мМ) определяли путем измерения поглощения при 450 нм, используя коэффициент экстинкции 2.25 AU на спектрофотометре Shimadzu (Япония) (Cervantes et al., 2000).
Состав жирных кислот определяли методом ВЭЖХ на хроматографе “Knauer” (Германия) с колонкой Inertsil ODS-3 (5 мкм, 250 × 4.6 мм; “Dr. Maisch GmbHs”, Германия) при 210 нм и 35°C со скоростью потока 1 мл/мин. Подвижная фаза – 20 мМ раствор ортофосфорной кислоты. Жирные кислоты идентифицировали, используя стандартные растворы кислот с концентрацией 1 г/л (“Sigma-Aldrich”, США) по временам удержания. Концентрации жирных кислот в образцах рассчитывали по высоте и площади пиков в программе EuroChom v. 3.05 P5 (“Knauer GmbH”, Германия).
Выделение ДНК, амплификация и секвенирование гена 16S рРНК. Исследуемые образцы ДНК экстрагировали с помощью Ultra Clean Mega Prep Soil DNA Kit (“MO Bio”, США). Концентрацию и чистоту выделенной ДНК измеряли на NanoPhotometer®P-Class (“Implen”, Германия). Для изучения таксономического состава микробных сообществ использовали праймеры на ген 16S рРНК с различной степенью специфичности: на порядок Desulfuromonadales: 494F (5'-AGGAAGCACCGGCTAACTCC-3'), Geo825R (5'-TACCCGCRACACCAGT-3') и род Shewanella: She211F (5'-CGCGATTGGATGAACCTAG-3'), She1259R (5'-GGCTTTGCACCCTCTGTA-3') (Todorova, Costello, 2006). Для амплификации гена 16S рРНК с дальнейшим анализом ПЦР-фрагментов методом температурного градиентного гель-электрофореза использовали пару праймеров 1055F (5'-ATGGCTGTCGTCAGCT-3'), 1541-1522R-GC (5'-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGGGCAAGGAGGTGATCCAGC- CGCA-3'). Полимеразную цепную реакцию (ПЦР) проводили на амплификаторе Терцик (“ДНК-Технология”, Россия). Для получения ПЦР-фрагментов применяли следующий температурно-временной режим: начальная денатурация – 94°С × 3 мин; последующие 30 циклов – 94°С × 30 с, 55°С × 10 с, 72°С × 30 с; конечная полимеризация – 72°С × 1 мин. Реакционная смесь (25 мкл) содержала: 1× буфер для Taq-полимеразы (“Fermentas”, Литва), 10 нг ДНК-матрицы, по 50 мкмоль каждого dNTP (“Fermentas”, Литва), по 10 пмоль соответствующих праймеров (“Синтол”, Россия), 2.5 ммоль MgCl2 и 1 ед. Taq-полимеразы (“Силекс”, Россия). Полученные фрагменты анализировали электрофорезом в 1% агарозном геле, содержащем бромистый этидий. Секвенирование ДНК проводили в Межинститутском Центре коллективного пользования “Геном” ИМБ РАН (http://www.genome-centre.ru/) с помощью набора реактивов ABI PRISM® BigDyeTM Terminator v. 3.1 с последующим анализом продуктов реакции на автоматическом секвенаторе ДНК ABI PRISM 3730 Applied Biosystems.
Температурный градиентный гель-электрофорез. Анализ ПЦР-фрагментов методом температурного градиентного гель-электрофореза (TGGE) проводили с помощью прибора TGGE System (“Biometra”, Германия). Денатурирующий гель (мочевина 8 М, 6% акриламид/бис-акриламид, 1× ТАЕ буфер, 2% глицерин, 20% формамид) аккуратно дегазировали в течение 15 мин и добавляли 40 мкл 4% APS и 9 мкл TEMED. Температурный градиент (33–44°С) был оптимизирован для эффективного разделения полос. Параметры электрофореза: 130 В, 120 мин. Полосы в геле визуализировали с помощью окрашивания серебром согласно протоколу производителя. Отдельные полосы были вырезаны, помещены в 20 мкл стерильного ТЕ-буфера и использованы для переамплификации.
Филогенетический анализ. Сравнительный анализ нуклеотидных последовательностей гена 16S рРНК проводили с помощью программы BLAST базы данных NCBI (http://blast.ncbi.nlm.nih.gov/ Blast.cgi). Для построения филогенетических деревьев использовали программу MEGA 6 (Tamura et al., 2013).
Последовательности генов 16S рРНК переамплифицированных полос из TGGE профилей St11_1, GU_1 и St1_1 были помещены в GenBank под номерами MH782660, MH828346 и MH783194 соответственно.
РЕЗУЛЬТАТЫ
Получение накопительных культур ЖВБ. Из проб поверхностных слоев донных осадков озера Байкал в результате длительной инкубации было получено девять накопительных культур бактерий, восстанавливающих цитрат железа и AQDS при всех исследуемых значениях температур и во всех вариантах субстратов. Однако при использовании в качестве акцептора электронов АГОЖ, процесс восстановления железа, а также рост бактерий в лабораторных посевах зафиксирован не был. Большая часть накопительных культур из донных отложений озера была получена при температурах культивирования 15−20°С. Количество двухвалентного железа в исследуемых накопительных культурах варьировало в пределах от 3.4 до 6.0 мМ (табл. 2). Максимальная концентрация ионов Fe(II) (6.0 мМ) зафиксирована в накопительной культуре, полученной из пробы светло-коричневого илистого песка St1, отобранной с глубины 404 м и выращенной при 15°С с ацетатом в качестве источника углерода. Наименьшая концентрация ионов Fe(II) (3.4 мМ) отмечена в накопительной культуре GU, полученной из осадков восстановленного ила станции Gorevoy Utes, отобранной с глубины 900 м. Данная накопительная культура инкубировалась при 15°С с ацетатом (табл. 2). Восстановление хинона накопительными культурами сопровождалось изменением окраски среды с желтого цвета на ярко-оранжевый по сравнению с абиогенным контролем. Максимальная концентрация AH2QDS (5.5 мМ) зафиксирована в накопительной культуре St3, полученной из пробы серого песка с примесями камней, культивируемой при 5°С с формиатом (табл. 2).
Таблица 2.
Характеристика накопительных культур ЖВБ, полученных из поверхностных донных осадков озера Байкал
| Накопительная культура | Акцептор электронов | Донор электронов | Температура инкубации, °С | Fe(II), мМ |
AH2QDS, мM |
|---|---|---|---|---|---|
| St3 | Цитрат Fe(III) | Формиат | 20 | 5.3 | – |
| St3 | AQDS | Ацетат | 20 | – | 2.3 |
| St1 | Цитрат Fe(III) | Ацетат | 15 | 6.0 | – |
| St3 | Цитрат Fe(III) | Ацетат | 15 | 4.8 | – |
| St3 | Цитрат Fe(III) | Формиат | 15 | 4.0 | – |
| St3 | AQDS | Ацетат | 15 | – | 1.9 |
| GU | Цитрат Fe(III) | Ацетат | 15 | 3.4 | – |
| St3A | AQDS | Формиат | 5 | – | 5.5 |
| St3B | Цитрат Fe(III) | Ацетат | 5 | 5.7 | – |
Все изученные нами накопительные культуры ЖВБ, полученные из глубинных осадков озера Байкал, имели схожую морфологию и были представлены подвижными и неподвижными клетками палочковидной формы, также встречались палочки с терминально расположенной спорой.
Дальнейшие эксперименты проводили с накопительными культурами, которые в течение 2–5 пассажей не теряли способность восстанавливать Fe(III) в описанных выше условиях. В результате было отобрано четыре культуры, в которых нами были определены изменения концентраций ацетата и формиата, прирост числа клеток, а также образование ионов Fe(II) в процессе 2-х месячного культивирования при 5 и 15°С.
В результате эксперимента было показано, что сформировавшиеся микробные сообщества накопительных культур St1 и St3, инкубируемых при 15°С, в процессе роста восстанавливали цитрат Fe(III) (на 20–40% от начальной концентрации) без видимого потребления ацетата, либо с незначительным уменьшением его концентрации. Число клеток при этом увеличивалось приблизительно в 3 раза. В полученном микробном сообществе накопительной культуры St3, инкубируемой при 5°С, где в качестве субстрата также использовался ацетат, через 30 сут наблюдался прирост биомассы, увеличение концентрации двухвалентного железа (в 2–2.5 раза), сопровождающееся увеличением концентрации ацетата. Через 60 сут культивирования концентрация Fe(II) продолжала возрастать (до 3.0 мМ), однако процесс уже сопровождался слабым окислением субстрата (табл. 3). Можно предположить, что полученное микробное сообщество состоит из представителей микроорганизмов с тесными трофическими связями и разным типом метаболизма. Присутствие цитрата Fe(III) в качестве внешнего акцептора электронов стимулирует рост бактерий и, вероятно, влияет на изменение концентрации ацетата. В данном случае накопление двухвалентного железа происходит за счет ассимиляционного восстановления. В абиотическом контроле восстановления трехвалентного железа не было зафиксировано.
Таблица 3.
Увеличение числа клеток, образования Fe(II) и изменение концентрации ацетата в накопительных культурах ЖВБ
| Накопительная культура | Т, °С | Время роста, сут |
Число клеток, 105 кл./мл | Концентрация Fe(II), мM | Концентрация ацетата, г/л |
|---|---|---|---|---|---|
| St1 | 15 | 0 | 7.0 | 0.70 | 2.10 |
| 30 | 21.0 | 2.30 | 2.09 | ||
| 60 | 26.0 | 3.15 | 1.80 | ||
| St3 | 15 | 0 | 7.0 | 0.60 | 1.89 |
| 30 | 25.0 | 1.90 | 1.86 | ||
| 60 | 28.0 | 2.10 | 1.0 | ||
| St3 | 5 | 0 | 5.0 | 0.60 | 2.08 |
| 30 | 19.0 | 1.60 | 2.21 | ||
| 60 | 27.0 | 2.92 | 2.92 |
Анализ активности микробного сообщества накопительной культуры St3, инкубируемой при 15°С, где в качестве субстрата использовался формиат, показал, что через 60 сут культивирования наблюдался рост микробных клеток, и их число возросло в 4 раза. Увеличение числа клеток сопровождалось значительным уменьшением концентрации формиата: на 4.37 г/л, что составляло 70% от начальной концентрации субстрата в среде. При этом образовывалось 3.2 мМ Fe(II), что составляло 30% от начальной концентрации Fe(III) (рис. 1).
Рис. 1.
Рост клеток, образование Fe(II) и потребление формиата в накопительной культуре St3 при 15°С: 1 – Fe(II), мМ; 2 – число клеток; 3 – формиат, г/л.
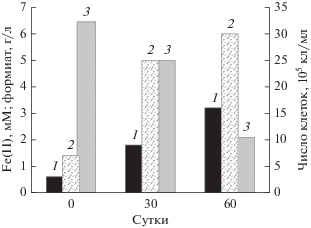
Несмотря на то, что психрофильные и психроактивные ЖВБ были открыты более 20 лет назад, на сегодняшний день известны лишь единичные представители бактерий, способные использовать железо в качестве терминального акцептора электронов при температуре ниже 15°С (Holmes et al., 2004; Ramana, Sasikala, 2009). Используя микробиологические подходы, нами было показано, что в пресноводных экосистемах с постоянно низкой положительной температурой возможен микробиологический процесс восстановления растворимых комплексов железа. Восстановление окисных форм железа большинством из полученных нами накопительных культур ЖВБ является следствием ассимиляционного процесса. Тем не менее, микробное сообщество одной накопительной культуры оказалась способно при 15°С к анаэробному дыханию на железе, сопряженному с окислением такого несбраживаемаемого субстрата, как формиат.
Определение состава микробных сообществ молекулярно-генетическими методами. Для изучения таксономического состава микробных сообществ донных осадков озера Байкал были использованы универсальные праймеры на ген 16S рРНК и праймеры на этот ген, специфичные для представителей порядка Desulfuromonadales и рода Shewanella. Большинство выделенных и описанных на сегодняшний день психрофильных ЖВБ относятся к видам, принадлежащим к этим филогенетическим группам. В результате работы нам не удалось получить продукты ПЦР из изучаемых образцов осадков и накопительных культур со специфическими праймерами на порядок Desulfuromonadales и род Shewanella. Можно предположить, что в состав микробных сообществ исследуемых проб оз. Байкал и накопительных культур, полученных из этих осадков, входят иные культивируемые и некультивируемые виды бактерий. Дальнейшие исследования были продолжены с использованием универсальных праймеров на ген 16S рРНК.
Амплифицированные фрагменты гена 16S рРНК были разделены с помощью температурного градиентного гель-электрофореза. Анализ TGGE профилей поверхностных осадков выявил присутствие доминирующих представителей исследуемых микробных сообществ, которые принадлежали к классам α-Proteobacteria и β‑Proteobacteria. Филогенетический анализ показал, что полученные последовательности имели низкий уровень сходства с сиквенсами, доступными в базе данных GenBank, большая часть из которых была представлена последовательностями гена 16S рРНК из клоновых библиотек природных микробных сообществ. На филогенетическом древе (рис. 2) полученные последовательности из образцов донных отложений St11 и Gorevoy Utes образуют один кластер и относятся к β-Proteobacteria. Ближайшими родственниками секвенированного фрагмента ST11_1 (95% сходства) оказались Sulfuriferula multivorans TTNT – мезофильная анаэробная бактерия, способная использовать нитрат, тиосульфат и элементную серу в качестве акцепторов электронов (Watanabe et al., 2015), и некультивируемый бактериальный клон V6_44, полученный из природного образца, отобранного в районе добычи бурого угля. Большая часть близкородственных некультивируемых бактериальных клонов была получена из природных экосистем ледников Гренландии и вулканических льдов Антарктики. Наиболее высокий процент сходства полученной нуклеотидной последовательности GU_1 обнаружен с некультивируемыми бактериальными клонами из различных природных проб: бактериальным клоном СР3, полученным из образца промышленных сточных вод, загрязненных соединениями Cr(VI) и Cr(III), и клоном KNA6-ST_40, полученным из природных биопленок глубинных экосистем, загрязненных тяжелыми металлами (97 и 96% сходства соответственно). А ближайшим культивируемым соседом с 95% сходства являлась факультативно автотрофная бактерия Sulfuritalea hydrogenivorans sk43HT, выделенная из воды пресноводного озера в Японии (Kojima and Fukui, 2011). По литературным данным, все культивируемые близкородственные микроорганизмы способны к окислению ароматических соединений с использованием Fe(III), Mn(IV) или нитрата в качестве акцепторов электронов. Так, например, Georgfuchsia toluolica G5G6T (92% сходства), анаэроб, выделенный из сточных вод, окисляющий толуол, восстанавливая при этом Fe(III) и другие переменно валентные металлы (Weelink et al., 2009). Отдельные виды рода Thiobacillus (94% сходства) способны как окислять железо, так и восстанавливать его в присутствии элементной серы (Sugio et al., 1985).
Рис. 2.
Филогенетическое древо, показывающее положение нуклеотидных последовательностей гена 16S рРНК переамплифицированных полос из TGGE профилей донных осадков озера Байкал в классе Proteobacteria. Степень ветвления определена методом Maximum Likelihood. Масштаб соответствует 2 нуклеотидным заменам на каждые 100 нуклеотидов. Данные “bootstrap”-анализа указаны в узлах ветвления.
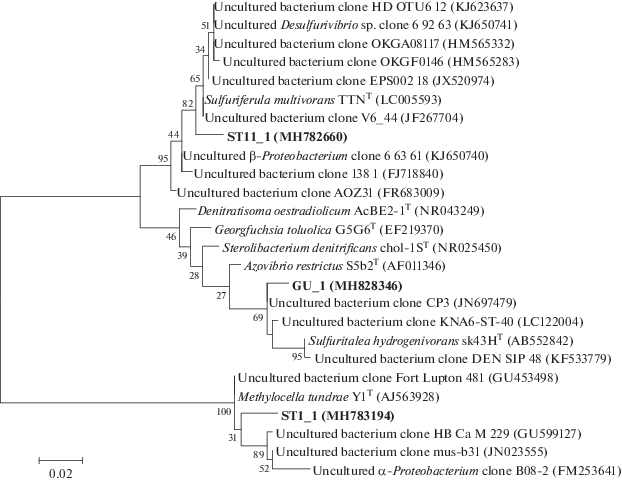
Последовательность гена 16S рРНК фрагмента ST1_1 из образца донных отложений St1 образует отдельную филогенетическую ветвь и относится к α-Proteobacteria. Его ближайшим соседом является Methylocella tundrae Y1T (89% сходства) – метанотрофная бактерия, выделенная из кислых сфагновых торфяников тундры (Dedysh et al., 2004).
В результате секвенирования TGGE профилей двух накопительных культур ЖВБ, полученных из разных станций озера Байкал: St1, выращенной на комбинации цитрат Fe(III)/формиат и культивируемой при 15°С, и St3, выращенной на AQDS/формиат и культивируемой при 5°С, было получено несколько коротких нуклеотидных последовательностей гена 16S рРНК (около 176 п.н.). Филогенетический анализ полученных последовательностей показал присутствие в микробных сообществах только представителей α-Proteobacteria (табл. 4). Культивируемое сообщество накопительной культуры St1 было представлено двумя доминирующими представителями, которые принадлежали к семейству Sphingomonadaceae: последовательность ekSt1_1 имела наиболее высокий процент сходства с Sphingobium yanoikuyae FM-2T (96% сходства), выделенной из речной воды и способной использовать ароматические соединения в качестве источника углерода (Inoue et al., 2008). Ближайшим родственником второго секвенированного фрагмента ekSt1_2 оказалась бактерия Novosphingobium lindaniclasticum LE124T (97% сходства), растущая на гексахлорциклогексане (Saxena et al., 2013). Близкородственным организмом доминирующего культивируемого представителя накопительной культуры St3 оказалась психрофильная ультрамикробактерия Sphingopyxis alaskensis RB2256T (98% сходства), выделенная из вод Аляски с оптимальной температурой для роста 4–10°С (Ting et al., 2010).
Таблица 4.
Филогенетический состав микробных сообществ поверхностных слоев донных осадков оз. Байкал и накопительных культур ЖВБ из этих образцов на основе поиска ближайших родственников полученных нуклеотидных последовательностей гена 16S рРНК переамплифицированных полос из TGGE профилей в базе данных GenBank
| Нуклеотидные последовательности гена 16S рРНК | Длина фрагмента, п.н. | Номер в GenBank | Ближайший представитель, % сходства | Ссылка |
|---|---|---|---|---|
| Донные осадки | ||||
| St11_1 | 451 | MH782660 | Sulfuriferula multivorans TTNT (LC005593), 95% бактериальный клон V6_44 (JF267704), 95% |
(Watanabe et al., 2015) |
| GU_1 | 435 | MH828346 | Бактериальные клоны СР3 (JN697479) и KNA6-ST_40 (LC122004), 97% и 96%
соответственно Sulfuritalea hydrogenivorans sk43HT (AB552842), 95% |
(Kojima and Fukui, 2011) |
| St1_1 | 447 | MH783194 | Methylocella tundrae Y1T (AJ563928), 89% | (Dedysh et al., 2004) |
| Накопительные культуры | ||||
| ekSt1_1 | 166 | – | Sphingobium yanoikuyae FM-2T (MH714965), 96% | (Inoue et al., 2008) |
| ekSt1_2 | 176 | – | Novosphingobium lindaniclasticum LE124T (KU051414), 97% | (Saxena et al., 2013) |
| ekSt3_1 | 170 | – | Sphingopyxis alaskensis RB2256T (FJ377386), 98% | (Ting et al., 2010) |
Таким образом, используя метод TGGE, нами были получены первичные экспериментальные данные о составе микробных сообществ низкотемпературных донных отложений озера Байкал. Показано, что в образцах, отобранных в районах нефте- и газопроявлений и в накопительных культурах, полученных из этих образцов, присутствуют микроорганизмы, ближайшие родственники которых способны использовать в качестве источника углерода широкий спектр субстратов, в том числе и нефтяные углеводороды, восстанавливая при этом различные переменно-валентные металлы.
ОБСУЖДЕНИЕ
Температура является одним из важнейших экологических факторов, влияющих на микроорганизмы. В данной работе приведены результаты исследований процесса микробной железоредукции, а также результаты филогенетического разнообразия бактерий в поверхностных слоях глубоководных донных отложений озера Байкал, относящегося к холодным экосистемам. Температура поверхностных слоев воды летом в озере не превышает 8–9°С, температура придонной воды составляет 4°С.
В донных осадках, отобранных с глубин от 404 м до 1396 м, нами впервые был зафиксирован психрофильный процесс микробного восстановления железа. Анализ полученных микробных сообществ показал, что в низкотемпературных пресноводных экосистемах присутствуют микроорганизмы с тесными трофическими связями, включая вторичных деструкторов, способных использовать низкомолекулярные соединения, такие как формиат, в качестве доноров электронов, восстанавливая при этом трехвалентное железо в анаэробных условиях.
Семь из девяти накопительных культур, полученных из донных отложений, отобранных с разных станций, восстанавливали цитрат Fe(III) и AQDS при температурах культивирования 15°С и ниже. В результате образовывалось до 6 мМ Fe(II), что составило более 50% от начальной концентрации железа(III) в среде, и 2.3 мМ AH2QDS (около 10% от начальной концентрации хинона). Две накопительные культуры (St3А и St3В), полученные из осадков, отобранных с глубины 409 м, в результате инкубации при 5°С образовывали 5.5 мМ AH2QDS и 5.7 мМ Fe(II) соответственно. Накопительные культуры, полученные зарубежными исследователями из донных осадков Тихого океана, в несколько раз быстрее восстанавливали растворимые формы Fe(III) при температуре инкубации 10°С по сравнению с 25 и 4°С. При этой же температуре наблюдался самый активный рост клеток. В работе Жанга и соавт. показано, что более 80% накопительных культур способны к микробному восстановлению железа в психрофильных условиях (Zhang et al., 1999). Результаты исследования накопительных культур ЖВБ из осадков оз. Байкал свидетельствуют о том, что основная часть микробных сообществ, скорее всего, адаптирована к холоду и может играть важную роль в цикле железа и деструкции органического вещества в холодных экосистемах. Следует отметить, что накопительные культуры, способные восстанавливать нерастворимые комплексы трехвалентного железа, в ходе экспериментов нами получены не были.
Исходные пробы поверхностных донных отложений и накопительные культуры, полученные из этих образцов, содержали таксоны классов α‑ и β-Proteobacteria, являющиеся близкородственными бактериями, способными окислять ароматические соединения с использованием неорганических акцепторов электронов, в том числе и Fe(III). Филогенетическое изучение нашими российскими коллегами микробных сообществ донных отложений из других районов оз. Байкал, характеризующихся выходом высокоминерализованных флюидов и газов, показало значительное количество представителей δ-Proteobacteria. В библиотеке сообществ были выявлены последовательности протеобактерий родов Syntrophus (деградируют органические соединения в синтрофной ассоциации с водород-окисляющими микроорганизмами), Desulfobacca (восстанавливают сульфат при окислении ацетата) и Geothermobacter (восстанавливают железо(III) при окислении органического вещества). β-Proteobacteria составляли 3.5% бактериального сообщества, наименее представленными оказались α-Proteobacteria (Черницына и соавт., 2016). Доминирование α- и β-Proteobacteria в исследуемых нами сообществах донных отложений, скорее всего, обеспечивается постоянным присутствием углеводородов, доминированием метана как основного газа в местах отбора проб. Культивируемое сообщество состояло из бактерий, принадлежащих к семейству Sphingomonadaceae. Представители этого семейства ранее обнаружены в придонной воде оз. Байкал, и показано их участие в деструкции диатомовых водорослей (Zakharova et al., 2013).
Полученные нами результаты расширяют представления о микроорганизмах, участвующих в глобальном цикле железа – четвертого по распространению элемента в земной коре. Нами было показано, что, несмотря на холодные и олиготрофные условия, микробные сообщества донных осадков озера Байкал продуктивны и филогенетически разнообразны. Наличие в микробных сообществах микроорганизмов, способных использовать в качестве источника углерода и энергии широкий спектр субстратов, в том числе и несбраживаемые соединения, свидетельствует о потенциальной способности сообществ обеспечивать деградацию различных соединений на терминальных этапах деструкции органического вещества, обеспечивая тем самым замкнутость цикла углерода.
Авторы выражают благодарность д. б. н. Т.И. Земской – заведующей лабораторией микробиологии углеводородов ЛИН СО РАН и к. б. н. О.П. Дагуровой – с. н. с. лаборатории микробиологии ИОЭБ СО РАН за любезно предоставленные образцы донных осадков озера Байкал.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (гранты № 12-04-31353, 12-05-01085).
Список литературы
Белькова Н.Л., Парфенова В.В., Косторнова Т.Я., Денисова Л.Я., Зайчиков Е.Ф. Характеристика биоразнообразия микробного сообщества водной толщи озера Байкал // Микробиология. 2003. Т. 72. № 2. С. 239–249.
Bel’kova N.L., Dryukker V.V., Hong S.-H., Ahn T.-S. A study of the composition of the aquatic bacterial community of Lake Baikal by the in situ hybridization method // Microbiology (Moscow). 2003. V. 72. P. 240–243.
Жилина Т.Н., Заварзина Д.Г., Осипов Г.А., Кострикина Н.А., Турова Т.П. Natronincola ferrireducens sp. nov. Natronincola peptidovorans sp. nov. – новые анаэробные алкалофильные пептидолитические и железоредуцирующие бактерии из содовых озер // Микробиология. 2009. Т. 78. № 4. С. 506–518.
Zhilina T.N., Zavarzina D.G., Osipov G.A., Kostrikina N.A., Tourova T.P. Natronincola ferrireducens sp. nov., and Natronincola peptidovorans sp. nov. New anaerobic alkaliphilic peptolytic iron-reducing bacteria isolated from soda lakes // Microbiology (Moscow). 2009. V. 78. P. 445–454.
Заварзина Д.Г., Колганова Т.В., Булыгина Е.С., Кострикина Н.А., Турова Т.Н., Заварзин Г.А. Geolkalibacter ferrihydriticus gen. nov., sp. nov., первый алкалофильный представитель семейства Geobacteraceae, выделенный из содового озера // Микробиология. 2006. Т. 75. № 6. С. 775–785.
Zavarzina D.G., Kolganova T.V., Boulygina E.S., Kostrikina N.A., Tourova T.P., Zavarzin G.A. Geoalkalibacter ferrihydriticus gen. nov. sp. nov., the first alkaliphilic representative of the family Geobacteraceae, isolated from a soda lake // Microbiology (Moscow). 2006. V. 75. P. 664–672.
Нетрусов А.И., Егорова М.А., Захарчук Л.М. Практикум по микробиологии. М.: Академия, 2005. 608 с.
Черницына С.М., Мамаева Е.В., Ломакина А.В., Погодаева Т.В., Галачьянц Ю.П., Букин С.В., Пименов Н.В., Хлыстов О.М., Земская Т.И. Филогенетическое разнообразие микробных сообществ в донных отложениях Посольской банки озера Байкал // Микробиология. 2016. Т. 85. № 6. С. 652–662.
Chernitsyna S.M., Mamaeva E.V., Lomakina A.V., Pogodaeva T.V., Galach’yants Yu.P., Bukin S.V., Pimenov N.V., Khlystov O.M., Zemskaya T.I. Phylogenetic diversity of microbial communities of the Posolsk Bank bottom sediments, Lake Baikal // Microbiology (Moscow). 2016. V. 85. P. 664–671.
Anderson R.T., Rooney-Varga J., Gaw C.V., Lovley D.R. Anaerobic benzene oxidation in the Fe(III)-reduction zone of petroleum-contaminated aquifers // Environ. Sci. Technol. 1998. V. 32. P. 1222–1229.
Cervantes F.J., van der Velde S., Lettinda G., Field J.A. Competition between methanogenesis and quinone respiration for ecologically important substrates in anaerobic consortia // FEMS Microbiol. Ecol. 2000. V. 34. P. 161–171.
Dedysh S.N., Berestovskaya Y.Y., Vasylieva L.V., Belova S.E., Khmelenina V.N., Suzina N.E., Trotsenko Y.A., Liesack W., Zavarzin G.A. Methylocella tundrae sp. nov., a novel methanotrophic bacterium from acidic tundra peatlands // Int. J. Syst. Evol. Microbiol. 2004. V. 54. P. 151–156.
Holmes D., Nicoll J., Bond D., Lovley D. Potential role of a novel psychrotolerant member of the family Geobacteraceae, Geopsychrobacter electrodiphilus gen. nov., sp. nov., in electricity production by a marine sediment fuel cell // Ap-pl. Environ. Microbiol. 2004. V. 70. P. 6023–6030.
Inoue D., Hara S., Kashihara M., Murai Y., Danzl E., Sei K., Tsunoi S., Fujita M., Ike M. Degradation of bis(4-hydroxyphenyl)methane (bisphenol F) by Sphingobium yanoikuyae strain FM-2 isolated from river water // Appl. Environ. Microbiol. 2008. V. 74. P. 352–358.
Kashefi K., Holmes D.E., Lovley D.R., Tor J. Potential importance of dissimilatory Fe(III)-reducing microorganisms in hot sedimentary environments // The Subseafloor Biosphere at Mid-Ocean Ridges, Geophysical Monograph Series. Washington, DC: American Geophysical Union Press, 2004. № 144. P. 199–211.
Kojima H., Fukui M. Sulfuritalea hydrogenivorans gen. nov., sp. nov., a facultative autotroph isolated from a freshwater lake // Int. J. Syst. Evol. Microbiol. 2011. V. 61. P. 1651–1655.
Lovley D.R. Dissimilatory Fe(III) and Mn(IV) reduction // Microbiol. Rev. 1991. V. 55. P. 259–287.
Nevin K.P., Holmes D.E., Woodard T.L., Hinlein E.S., Ostendorf D.W., Lovley D.R. Geobacter bemidjiensis sp. nov. and Geobacter psychrophilus sp. nov., two novel Fe(III)-reducing subsurface isolates // Int. J. Syst. Evol. Microbiol. 2005. V. 55. P. 1667–1674.
Ramana C., Sasikala C. Albidoferax, a new genus of Comamonadaceae and reclassification of Rhodoferax ferrireducens (Finneran et al., 2003) as Albidoferax ferrireducens comb. nov. // J. Gen. Appl. Microbiol. 2009. V. 55. P. 301–304.
Saxena A., Anand S., Dua A., Sangwan N., Khan F., Lal R. Novosphingobium lindaniclasticum sp. nov., a hexachlorocyclohexane (HCH)-degrading bacterium isolated from an HCH dumpsite // Int. J. Syst. Evol. Microbiol. 2013. V. 63. P. 2160–2167.
Slobodkin A.I., Wiegel J. Fe(III) as an electron acceptor for H2 oxidation in thermophilic anaerobic enrichment cultures from geothermal areas // Extremophiles. 1997. V. 1. P. 106–109.
Sugio T., Domatsu C., Munakata O., Tano T., Imai K. Role of a ferric ion-reducing system in sulfur oxidation of Thiobacillus ferrooxidans // Appl. Environ. Microbiol. 1985. P. 1401–1406.
Tamura K., Stecher G., Peterson D., Filipski A., Kumar S. MEGA6: Molecular Evolutionary Genetics Analysis Version 6.0 // Mol. Biol. Evol. 2013. V. 30. P. 2725–2729.
Ting L., Williams T.J., Cowley M.J., Lauro F.M., Guilhaus M., Raftery M.J., Cavicchioli R. Cold adaptation in the marine bacterium, Sphingopyxis alaskensis, assessed using quantitative proteomics // Environ. Microbiol. 2010. V. 12. P. 2658–2676.
Todorova S.G., Costello A.M. Design of Shewanella-specific 16S rRNA primers and application to analysis of Shewanella in a minerotrophic wetland // Environ. Microbiol. 2006. V. 3. P. 426–432.
Vargas M., Kashefi K., Blunt-Harris E.L., Lovley D.R. Microbiological evidence for Fe(III) reduction on early Earth // Nature. 1998. V. 395. P. 65–67.
Viollier E., Inglett P.W., Hunter K., Roychoudhury A.N., van Cappellen P. The ferrozine method revisited: Fe(II)/Fe(III) determination in natural waters // Appl. Geochem. 2000. V. 15. P. 785–790.
Watanabe T., Kojima H., Fukui M. Sulfuriferula multivorans gen. nov., sp. nov., isolated from a freshwater lake, reclassification of “Thiobacillus plumbophilus” as Sulfuriferula plumbophilus sp. nov., and description of Sulfuricellaceae fam. nov. and Sulfuricellales ord. nov. // Int. J. Syst. Evol. Microbiol. 2015. V. 65. P. 1504–1508.
Weelink S.A.B., Van Doesburg W., Saia F.T., Rijpstra W.I.C., Roling W.F.M., Smidt H., Stams A.J.M. A strictly anaerobic Betaproteobacterium Georgfuchsia toluolica gen. nov., sp. nov. degrades aromatic compounds with Fe(III), Mn(IV) or nitrate as an electron acceptor // FEMS Microbiol. Ecol. 2009. V. 70. P. 575–585.
Wolin E.A., Wolin M.J., Wolfe R.S. Formation of methane by bacterial extracts // J. Biol. Chem. 1963. V. 238. P. 2882–2886.
Zakharova Yu.R., Kurilkina M.I., Likhoshvay A.V., Shishlyannikov S.M., Kalyuzhnaya O.V., Petrova D.P., Likhoshway E.V. Effect of bacteria from the bottom water layer of Lake Baikal on degradation of diatoms // Paleontol. J. 2013. V. 47. № 9. P. 1030–1034.
Zemskaya T.I., Sitnikova T.Y., Kiyashko S.I., Kalmychkov G.V., Pogodaeva T.V., Mekhanikova I.V., Naumova T.V., Shubenkova O.V., Chernitsina S.M., Kotsar O.V., Chernyaev E.S., Khlystov O.M. Faunal communities at sites of gas- and oil-bearing fluids in Lake Baikal // Geo-Mar. Lett. 2012. V. 32. P. 437–451.
Zemskaya T.I., Pogodaeva T.V., Shubenkova O.V., Chernitsina S.M., Dagurova O.P., Buryukhaev S.P., Namsaraev B.B., Khlystov O.M., Egorov A.V., Krylov A.A., Kalmychkov G.V. Geochemical and microbiological characteristics of sediments near the Malenky mud volcano (Lake Baikal, Russia), with evidence of Archaea intermediate between the marine anaerobic methanotrophs ANME-2 and ANME-3 // Geo-Mar. Lett. 2010. V. 30. P. 411–425.
Zhang C., Stapleton R.D., Zhou J., Palumbo A.V., Phelps T.J. Iron reduction by psychrotrophic enrichment cultures // FEMS Microbiol. Ecol. 1999. V. 30. P. 367–371.
Дополнительные материалы отсутствуют.


