Микробиология, 2019, T. 88, № 3, стр. 367-371
Фотозависимое окисление метана – важнейший процесс цикла метана в водной толще полярного озера Большие Хрусломены
А. С. Саввичев a, В. В. Кадников b, А. Ю. Каллистова a, И. И. Русанов a, Д. А. Воронов c, Е. Д. Краснова d, Н. В. Равин b, Н. В. Пименов a, *
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
b Институт биоинженерии, ФИЦ Биотехнологии РАН
119071 Москва, Россия
c Институт проблем передачи информации им. А.А. Харкевича РАН
127051 Москва, Россия
d Биологический факультет МГУ им. М.В. Ломоносова
119192 Москва, Россия
* E-mail: npimenov@mail.ru
Поступила в редакцию 25.11.2018
После доработки 24.01.2019
Принята к публикации 01.02.2019
В последние годы произошли значительные изменения в представлениях о микроорганизмах и микробных сообществах, осуществляющих процессы окисления метана в морских и пресных водоемах. Ранее считалось, что в пресных водоемах основными окислителями метана являются аэробные метанотрофные протеобактерии I и II типа, имеющие метанмонооксигеназу (ММО) – ферментный комплекс, катализирующий ключевую реакцию окисления метана кислородом до метанола. Затем, около 20 лет назад появились первые прямые доказательства существования процесса анаэробного окисления метана (АОМ), сопряженного с сульфатредукцией (Boetius et al., 2000; Knittel, Boetius, 2009), происходящего при участии консорциума метанотрофных архей и сульфатредуцирующих бактерий. Позднее выяснилось, что в отсутствии сульфатов акцептором электронов при АОМ может быть нитрат, нитрит, а также окисленные формы Fe и Mn (Beal et al., 2009; Haron et al., 2013; Ettwig et al., 2016). В последнее десятилетие появились исследования, существенно меняющие представления о метаболических возможностях метанотрофных бактерий. Например, установлено, что в отсутствии кислорода бактерии Ca. “Methylomirabilis oxyfera” (группа NC10) осуществляют нитрит-зависимое анаэробное окисление метана по “внутриаэробному” пути, при котором внутри бактериальной клетки при диспропорционировании NO происходит высвобождение молекулярного кислорода, который затем расходуется на окисление метана с участием ММО и дыхание (Ettwig et al., 2010). Совсем недавно появились сообщения о том, что метанотрофные гаммапротеобактерии (тип I), которые ранее считались строгими аэробами, способными сохранять активность в гипоксидных и даже анаэробных условиях (Chistoserdova, 2015). Одно из объяснений сохранения активности метанотрофных гаммапротеобактерий в гипоксидных условиях связано с предположением о формировании трофической взаимосвязи между аэробными метанотрофами и оксигенными фототрофами. Образованный фототрофами кислород немедленно подхватывается метанотрофами для окисления метана (Milucka et al., 2015; Oswald et al., 2015). Процесс светозависимого метанокисления был экспериментально подтвержден в стратифицированных пресноводных озерах Кадано, Ротзее (Швейцария), Ла Круз (Milucka et al., 2015; Oswald et al., 2015, 2016), а также в наших работах по изучению пресноводного меромиктического оз. Светлое в Архангельской области (Кallistova et al., 2019). У нижней границы редокс зоны, где кислород аналитически не выявлялся, радиоизотопным методом была выявлена стимуляция светом процесса окисления метана, а также детектировано одновременное присутствие в этой зоне аэробных метанотрофов рода Methylobacter, метилотрофов рода Methylotenera и цианобактерий родов Synechococcus и Prochlorococcus. Таким образом, значительный прогресс в изучении механизмов окисления метана в гипоксидных и анаэробных условиях связан с изучением стратифицированных/меромиктических водоемов, в водной толще которых на границе аэробных и анаэробных вод развиваются сложные микробные сообщества, часто формирующие многоуровневые трофические связи.
Объектом исследования процессов окисления метана было полярное меромиктическое озеро Большие Хрусломены, расположенное на побережье Кандалакшского залива Белого моря (Краснова и cоавт., 2018). Важной особенностью озера является постоянное поступление морских вод через проницаемые породы, вследствие чего ниже хемоклина происходит значительное нарастание солености (до 22‰ в придонных горизонтах). Отбор образцов воды проводили в начале сентября 2017 г. с борта маломерного судна погружным насосом (координаты точки пробоотбора 66°42′59′′ N, 32°51′29′′ E), позволяющим с высоким разрешением (до 5–10 см) отбирать требуемые горизонты водной толщи (рис. 1). Соленость и температуру измеряли погружным зондом, содержание кислорода в водной толщe озера определяли методом Винклера, сероводорода – калориметрически, метана – газохоматографическим методом по методикам, описанным ранее (Savvichev et al., 2018). Озеро, глубиной около 18 м, характеризовалось четко выраженной стратификацией, наличием хемо- и галоклина на глубине 2–4 м (рис. 2а). Температура воды в озере в период пробоотбора изменялась от 7.3 до 13.5°С, причем температурный максимум располагался в хемоклине на глубине 3.5–3.75 м (рис. 2а). Содержание кислорода в этом интервале глубин падало от 0.7 ммоль л–1 на глубине 2 м до 2.5 мкмоль л–1 на глубине 4 м. Сероводород появлялся на глубине 4 м, и в придонных горизонтах его концентрация составляла 17.8 ммоль л–1 (рис. 2а). Наряду с высоким содержанием Н2S в толще гиполимниона наблюдались также и экстремально высокие концентрации метана (до 1.8 ммоль л–1 на глубине 18 м). В интервале глубин 3.75–5.5 м происходило резкое снижение содержания метана до величин 0.04–1.13 мкмоль л–1 в аэробной зоне (0–3.5 м). Скорости темновой и световой ассимиляции углекислоты, необходимые для получения профиля фотосинтеза, а также эксперименты по определению влияния света на интенсивность окисления метана проводили радиоизотопным методом с использованием NaH14CO3 (специфическая активность 2.04 ГБк ммоль–1, 5 мкКю на пробу) и 14CH4 (2 мкКю на пробу, специфическая активность 1.16 ГБк ммоль–1) по методике, описанной ранее (Kallistova et al., 2019).
Рис. 2.
Физико-химические параметры (а), интенсивность первичной продукции (ПП) (б), скорости окисления метана на свету (С-МО) и в темноте (Т-МО) (в) и доля (%) последовательностей 16S рРНК цианобактерий и метанотрофных гаммапротеобактерий в сравнении со скоростью метанокисления на свету и в темноте в хемоклине озера Большие Хрусломены (г).
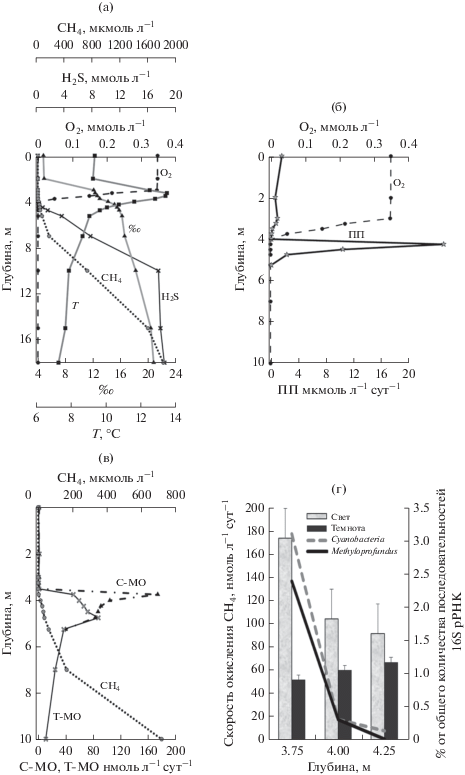
В эпилимнионе (0–2 м) интенсивность оксигенного фотосинтеза составляла 0.7−1.7 мкмоль С л–1 сут–1, в зоне хемоклина (2.5–3.75 м) – 0.2–1.0 мкмоль С л–1 сут–1. На глубине 4.0 м активность фотосинтеза снижалась почти до нулевого значения. Немного ниже границы аэробной и анаэробной зон обнаружен узкий слой с высокой активностью аноксигенного фотосинтеза (АнФС). Максимальная интенсивность АнФС приходилась на горизонт 4.25 м (34 мкмоль С л–1 сут–1). При дальнейшем погружении в слой гиполимниона, по-видимому, из-за недостатка света, интенсивность фотосинтеза резко падала до 2.4–10 мкмоль С л–1 сут–1 в интервале глубин 4.5–4.75 м и 0.13 мкмоль С л–1 сут–1 на глубине 5.25 м.
Профиль распределения скоростей окисления метана свидетельствовал о протекании интенсивных процессов в узком интервале глубин 3.75–4.75 м (на свету до 0.17 мкмоль л–1 сут–1), причем нам удалось обнаружить заметную стимуляцию светом этого процесса (рис. 2в). Зона, где наблюдалось выраженное светозависимое окисление метана, соответствовала нижней границе проникновения кислорода.
Состав микробных сообществ в зоне хемоклина определяли с помощью высокопроизводительного секвенирования вариабельных участков V3−V6 гена 16S рРНК. Для этого клетки микроорганизмов из образцов воды объемом 100 мл, отобранных с трех глубин 3.75, 4 и 4.25 м, концентрировали на фильтрах с диаметром пор 0.22 мкм. Выделение ДНК, амплификацию, секвенирование, анализ фрагментов гена 16S рРНК, кластеризацию последовательностей в оперативные таксономические единицы (ОТЕ), удаление химерных последовательностей и таксономическую идентификацию ОТЕ проводили по методикам, описанным ранее (Кадников и соавт., 2016). Для образцов воды с глубин 3.75, 4 и 4.25 м, было получено 3086, 4600 и 7517 последовательностей соответственно. Полученные нуклеотидные последовательности депонированы в GenBank под номерами SRR8480614–SRR8480616.
Анализ последовательностей генов 16S рРНК выявил в интервале глубин 3.75–4.0 м последовательности, принадлежащие метанотрофным гаммапротеобактериям Methyloprofundus sedimenti семейства Methylococcaceae (100% сходства), доля которых достигала 2.5% от общего количества определенных последовательностей. Эти морские метанокисляющие бактерии, выделенные из поверхностных осадочных отложений каньона Монтерей у побережья Калифорнии (Tavormina et al., 2015), имеют высокое сходство гена 16S рРНК (98%) с некультивируемыми свободно живущими и эндосимбионтными метанотрофами водной толщи, донных осадков и жаберных тканей глубоководных моллюсков, а также с метанотрофами рода Methylobacter (94.6% сходства). Цианобактерии порядка Synechococcales составляли значительную долю сообщества прокариот в аэробной зоне (до 10%). Глубже 3 м их доля снижалась, но в зоне максимальной скорости светозависимого окисления метана (на глубине 3.75 м) доли цианобактерий и метанотрофов в сообществе были близки и составляли около 2.5% (рис. 2г). Результаты радиоизотопных экспериментов в сочетании с молекулярным анализом позволяют рассматривать солоноватоводное полярное меромиктическое оз. Б. Хрусломены в качестве еще одного примера существования в зоне хемоклина светозависимого окисления метана, осуществляемого метанотрофными гаммапротеобактериями в ассоциации с цианобактериями. Следует отметить, что до сих пор светозависимое окисление метана наблюдали исключительно в пресных меромиктических озерах различных климатических зон (Milucka et al., 2015; Oswald et al., 2015, 2016; Kallistova et al., 2019), где в гипоксидных условиях доминировали метанотрофные гаммапротеобактерии. В проницаемом для морских вод озере Б. Хрусломены в зоне хемоклина соленость была примерно в три раза ниже морской воды. Видимо, поэтому, в отличие от пресного меромиктического озера Светлое (соленость в хемоклине около 0.34‰), где преобладали метанотрофы рода Мethylobacter, в хемоклине оз. Б. Хрусломены максимальные скорости окисления метана были выявлены в горизонтах с доминированием среди метанотрофов типичных морских метанокисляющих бактерий рода Methyloprofundus, как и Мethylobacter входящих в семейство Methylococcaceae.
Проникновение морских вод, обогащенных сульфат-ионом, в оз. Б. Хрусломены, последствием которого являются наблюдаемые экстремально высокие концентрации сероводорода, предполагало возможность существования в анаэробном монимолимнионе процесса сульфат-зависимого окисления метана. Однако нам не удалось выявить последовательности 16S рРНК ANME архей. Бактерии группы NC10, окисляющие метан нитритом, также не были обнаружены.
Таким образом, результаты проведенных исследований свидетельствуют о том, что светозависимое окисление метана не ограничивается только пресными стратифицированными озерами, но может вносить существенный вклад в процессы окисления этого важнейшего парникового газа в солоноватоводных континентальных и мелководных стратифицированных морских водоемах.
БЛАГОДАРНОСТИ
Авторы выражают благодарность Н.М. Кокряцкой (ИЭПС УроРАН) за измерение гидрохимических параметров водной толщи озера.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена при финансовой поддержке Российского научного фонда (грант 16-14-10201, радиоизотопные и молекулярно-биологические исследования) и Министерства науки и высшего образования Российской Федерации (биогеохимические исследования). Многолетние экспедиционные исследования оз. Б. Хрусломены финансировались из средств РФФИ (19-05-00377).
Список литературы
Кадников В.В., Ивасенко Д.А., Белецкий А.В., Марданов А.В., Данилова Э.В., Пименов Н.В., Карначук О.В., Равин Н.В. Влияние содержания металлов на состав микробных сообществ кислых дренажных вод месторождения полиметаллических руд // Микробиология. 2016. Т. 85. № 6. С. 732–739. Kadnikov V.V., Ivasenko D.A., Beletsky A.V., Mardanov A.V., Danilova E.V., Pimenov N.V., Karnachuk O.V., Ravin N.V., Effect of metal concentration on the microbial community in acid mine drainage of a polysulfide ore deposit // Microbiology (Moscow), 2016. V. 85. No. 6. P. 745–751.
Краснова Е.Д., Воронов Д.А., Демиденко Н.А., Кокрятская Н.М., Пантюлин А.Н., Рогатых Т.А., Самсонов Т.Е., Фролова Н.Л., Шапоренко С.И. К инвентаризации реликтовых водоемов, отделяющихся от Белого моря // Труды Беломорской биостанции МГУ. 2016. Т. 12. С. 211–241.
Beal E.J., House C.H., Orphan V.J. Manganese- and irondependent marine methane oxidation // Science. 2009. V. 325. P. 184–187.
Boetius A., Ravenschlag K., Schubert C., Rickert D., Widdel F., Gieseke A., Amann R., Jørgensen B.B., Witte U., Pfannkuche O. A marine microbial consortium apparently mediating anaerobic oxidation of methane // Nature. 2000. V. 407. P. 623–626.
Chistoserdova L. Methylotrophs in natural habitats: current insights through metagenomics // Appl. Microbiol. Biotechnol. 2015. V. 99. P. 5763–5779.
Ettwig K.F., Butler M.K., Le Paslier D., Pelletier E., Mangenot S., Kuypers M.M., Schreiber F., Dutilh B.E., Zedelius J., de Beer D., Gloerich J., Wessels H.J., van Alen T., Luesken F., Wu M.L., van de Pas-Schoonen K.T., Op den Camp H.J., Janssen-Megens E.M., Francoijs K.J., Stunnenberg H., Weissenbach J., Jetten M.S., Strous M. Nitrite-driven anaerobic methane oxidation by oxygenic bacteria // Nature. 2010. V. 464. P. 543–548.
Ettwig K.F., Zhu B., Speth D., Keltjens J.T., Jetten M.S.M., Kartal B. Archaea catalyze iron-dependent anaerobic oxidation of methane // Proc. Natl. Acad. Sci. USA. 2016. V. 113. P. 12792–12796.
Haroon M.F., Hu S., Shi Y., Imelfort M., Keller J., Hugenholtz P., Yuan Z., Tyson G.W. Anaerobic oxidation of methane coupled to nitrate reduction in a novel archaeal lineage // Nature. 2013. V. 500. P. 567–570.
Kallistova A., Kadnikov V., Rusanov I., Kokryatskaya N., Beletsky F., Mardanov A., Savvichev A.1., Ravin N., Pimenov N. Microbial communities involved in aerobic and anaerobic methane cycling in a meromictic ferruginous subarctic lake // Aquat. Microb. Ecol. 2019. V. 82. P. 1–18.
Knittel K., Boetius A. Anaerobic oxidation of methane: progress with an unknown process // Ann. Rev. Microbiol. 2009. V. 63. P. 311–334.
Milucka J., Kirf M., Lu L., Krupke A., Lam P., Littmann S., Kuypers M.M., Schubert C.J. Methane oxidation coupled to oxygenic photosynthesis in anoxic waters // ISME J. 2015. V. 9. P. 1991–2002.
Oswald K., Milucka J., Brand A., Littmann S., Wehrli B., Kuypers M.M., Schubert C.J. Light-dependent aerobic methane oxidation reduces methane emissions from seasonally stratified lakes // PLoS One. 2015. V. 10. e0132574.
Oswald K., Jegge C., Tischer J., Berg J., Brand A., Miracle M.R., Soria X., Vicente E., Lehmann M.F., Zopfi J., Schubert C.J. Methanotrophy under versatile conditions in the water column of the ferruginous meromictic lake La Cruz (Spain) // Front. Microbiol. 2016. V. 7. Article 1762.
Savvichev A.S., Babenko V.V., Lunina O.N., Letarova M.A., Boldyreva D.I., Veslopolova E.F., Demidenko N.A., Kokryatskaya N.M., Krasnova E.D., Gaisin V.A., Kostryukova E.S., Gorlenko V.M., Letarov A.V. Sharp water column stratification with an extremely dense microbial population in a small meromictic lake, Trekhtzvetnoe // Environ. Microbiol. 2018. V. 20. № 10. P. 3784–3797.
Tavormina P.L., Hatzenpichler R., Mcglynn S., Chadwick G., Dawson K.S., Connon S.A., Orphan V.J. Methyloprofundus sedimenti gen. nov., sp. nov., an obligate methanotroph from ocean sediment belonging to the “deep sea-1” clade of marine methanotrophs // Int. J. Syst. Evol. Microbiol. 2015. V. 65. P. 251–259.
Дополнительные материалы отсутствуют.