Микробиология, 2019, T. 88, № 3, стр. 272-287
Летучие вещества бактерий: структура, биосинтез, биологическая активность
М. А. Веселова a, В. А. Плюта a, И. А. Хмель a, *
a Институт молекулярной генетики Российской академии наук
123182 Москва, Россия
* E-mail: khmel@img.ras.ru
Поступила в редакцию 02.11.2018
После доработки 10.01.2019
Принята к публикации 01.02.2019
Аннотация
Микроорганизмы выделяют большое количество летучих веществ, в том числе, органические соединения и их сложные смеси. Летучие органические соединения, выделяемые микроорганизмами, могут проявлять антимикробную активность, подавлять или стимулировать рост растений, действовать как сигналы для коммуникации между различными организмами на большом расстоянии (“infochemicals”), распространяясь в воздухе и в водных растворах. Химическое разнообразие летучих органических соединений, выделяемых микроорганизмами, обеспечивает источник новых веществ, которые могут найти применение в медицине, биотехнологии, сельском хозяйстве. В обзоре рассмотрены изученные в настоящее время летучие вещества бактерий, их структура, биосинтез и биологическая активность. Основное внимание уделено летучим органическим соединениям и их действию на бактерии.
Микроорганизмы способны синтезировать большое количество различных летучих веществ. Большинство из них относится к летучим органическим соединениям (ЛОС), характеризующимся низкой температурой кипения и небольшой молекулярной массой, в среднем 300 Да. Летучие вещества бактерий и грибов отвечают за аромат пищевых продуктов, например, сыра, вина, йогурта и других, а также за неприятные запахи при деградации этих продуктов.
Летучие вещества, образуемые микроорганизмами, распространяются в воздушной и жидкой среде, передаются в почве, действуют на коротких и длинных расстояниях. Выяснилось, что ЛОС могут модулировать (подавлять или стимулировать) рост микроорганизмов и растений, вызывать системную резистентность растений, оказывать влияние на насекомых, нематод и другие организмы, действовать как аттрактанты или репелленты. Продукция ЛОС может играть существенную роль в конкурентных отношениях микроорганизмов, занимающих одни и те же экологические ниши (например, в ризосфере растений), в антагонизме ассоциированных с растениями бактерий и фитопатогенных микроорганизмов, а также функциональной микрофлоры человека и животных. В последнее время сформировалось представление о ЛОС как о соединениях, участвующих в новом типе коммуникации микроорганизмов (они получили название “infochemicals”), которые могут передавать информацию дистанционно (Effmert et al., 2012; Bos et al., 2013; Piechulla, Degenhardt, 2014; Audrain et al., 2015; Schmidt et al., 2015; Schulz-Bohm et al., 2017; Volatiles and Food Security, 2017).
Для исследования профиля ЛОС микроорганизмов используют метод газовой хромато-масс-спектрометрии, обеспечивающий эффективное разделение компонентов сложной смеси, их идентификацию и оценку относительного содержания компонентов.
Совокупность всех летучих веществ, синтезируемых организмом или экосистемой, получила название “волатилома” (от volatile – летучий). Опубликована база данных идентифицированных ЛОС (mVOC 2.0 database; http://bioinformatics.charite.de/mvoc/), которая включает в себя около 2000 соединений, выделяемых почти 1000 видами микроорганизмов (Lemfack et al., 2014, 2017). Однако в настоящее время идентифицированы ЛОС лишь относительно небольшого количества видов и штаммов бактерий и грибов. Отмечено, что спектр и количество образуемых микроорганизмами ЛОС зависит от условий их выращивания. Кроме того, ряд ЛОС не могли быть определены из-за отсутствия соответствующих маркеров в базах данных.
ПРИРОДА И БИОСИНТЕЗ ЛЕТУЧИХ ВЕЩЕСТВ БАКТЕРИЙ
Микроорганизмы вырабатывают и выделяют разнообразные органические и неорганические летучие вещества. Среди бактериальных ЛОС преобладают алкены, спирты, кетоны, терпены, бензоиды, пиразины, кислоты и сложные эфиры (Lemfack et al., 2014, 2017; Piechulla, Degenhardt, 2014; Schenkel et al., 2015). Результаты исследований показывают, что катаболические процессы (в том числе гликолиз, протеолиз и липолиз) является основными путями для синтеза ЛОС микроорганизмами (Schulz et al., 2007; Penuelas et al., 2014) (рис. 1). Ниже кратко описаны основные группы ЛОС.
Рис. 1.
Основные метаболические пути, образования летучих веществ микроорганизмов. Использован рисунок из статьи Schmidt et al. (2015) с нашими изменениями. Пунктирные линии указывают на образование летучих веществ, даны примеры летучих веществ бактерий.
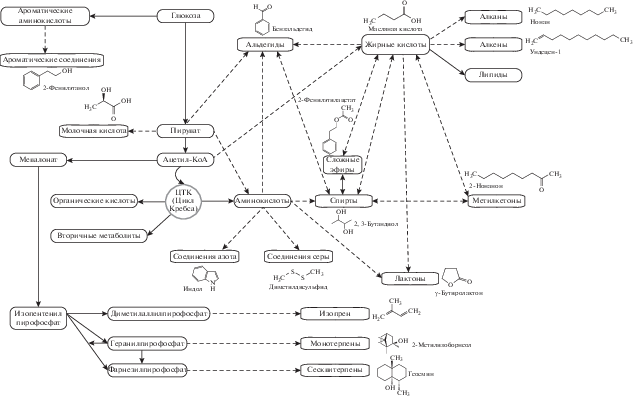
Углеводороды, спирты, кетоны, кислоты, сложные эфиры
Многие смеси ЛОС, выделяемые микроорганизмами, содержат органические соединения с длиной углеродной цепи C6‒C16, относящиеся, главным образом, к алкенам, алифатическим спиртам и кетонам. Предшественниками этих ЛОС обычно являются промежуточные соединения метаболизма жирных кислот. Реакции декарбоксилирования приводят к образованию алканов, 1-алкенов, метилкетонов, а восстановление карбоксильной группы ‒ к синтезу альдегидов и алифатических спиртов (Schulz, Dickschat, 2007; Bos et al., 2013; Penuelas et al., 2014; Schmidt et al., 2015).
Продукцию короткоцепочечных алканов редко обнаруживают у микроорганизмов. Синтез длинноцепочечных углеводородов, например, гексадекана, а также разветвленных углеводородов, встречается у цианобактерий (Tellez et al., 2001). Бактерии (Pseudomonas, Serratia и др.) способны синтезировать ряд алкенов (1-бутен, 3-нонен, 1-децен, 1-ундецен и др.). У Pseudomonas aeruginosa PA14 был идентифицирован ген оксидазы undA, отвечающий за биосинтез 1-ундецена. Эта оксидаза содержит негемовое железо, она способна преобразовывать среднецепочечные (C10‒C14) жирные кислоты в соответствующие им терминальные алкены (Rui et al., 2014).
Длинноцепочечные алифатические спирты (1‑октанол, 1-деканол и 1-додеканол) часто встречаются у бактерий семейства Enterobacteriaceae и образуются путем α- или β-окисления производных жирных кислот (Hamilton-Kemp et al., 2005; Schulz, Dickschat, 2007; Bos et al., 2013). Разветвленные спирты: 3-метил-1-бутанол и 2-метил-1-бутанол, образуются молочнокислыми бактериями путем ферментативного превращения аминокислот с разветвленной цепью (лейцин и изолейцин) с участием трансаминаз, декарбоксилаз и алкогольдегидрогеназ (Marilley, Casey, 2004). Lactobacillus brevis var. hofuensis образует изопропанол из ацетона, с участием изопропанолдегидрогеназы (Forney, Markovetz, 1971). Представители Proteobacteria и Firmicutes продуцируют короткоцепочечные спирты (например, 2,3-бутандиол) в условиях низкого содержания кислорода (мокрота пациентов с муковисцидозом, ризосфера) (Farag et al., 2013; Whiteson et al., 2014). 2,3-Бутандиол и его окисленная форма метилкетонацетоин (3-гидрокси-2-бутанон) ‒ основные ЛОС, синтезируемые бактериями рода Bacillus, являются производными пирувата, образующимися в анаэробных условиях. Ацетолактатсинтаза катализирует конденсацию двух молекул пирувата в ацетолактат, затем происходит его декарбоксилирование до ацетоина и дальнейшее восстановление до 2,3-бутандиола (Ryu et al., 2003; Amavizca et al., 2017).
Кетоны (2-нонанон, 2-ундеканон и др.) синтезируются различными бактериями (Bacillus, Pseudomonas, Serratia, Burkholderia, Xanthomonas и др.) и широко распространены в природе. Летучие кетоны могут действовать как в жидкой, так и в воздушной фазе (Schulz, Dickschat, 2007; Weise et al., 2012; Peñuelas et al., 2014; Popova et al., 2014; Giorgio et al., 2015). Бактерии образуют метилкетоны путем декарбоксилирования β-кетокислот, образующихся в процессе β-окисления жирных кислот; возможно также непосредственное окисление алифатических углеводородов до кетонов (Schulz, Dickschat, 2007; Schmidt et al., 2015). Было показано превращение метилкетонов микроорганизмами, их восстановление до вторичных спиртов с участием алкогольдегидрогеназы и образование путем дегидрирования вторичных спиртов (Forney, Markovetz, 1971).
Кислоты, особенно кето-кислоты, образуются при окислительном дезаминировании аминокислот с участием цитохромоксидаз, NAD(P)-зависимых дегидрогеназ, трансаминаз и/или других специфических ферментов. Последующие реакции декарбоксилирования и восстановления (в зависимости от окислительно-восстановительного статуса микроорганизма) преобразуют эти кислоты в альдегиды/кетоны и спирты. Кислоты также легко превращаются в сложные эфиры, которые являются довольно распространенными в мире микроорганизмов ароматическими летучими веществами (Schulz, Dickschat, 2007; Peñuelas et al., 2014; Schmidt et al., 2015).
Среди ЛОС бактерий представителей органических кислот меньше, чем кетонов и спиртов. Короткоцепочечные кислоты (уксусная, пропионовая, масляная и др.) являются основными побочными продуктами анаэробного метаболизма, они образуются в процессе ферментативного превращения углеводов, присутствуют в кишечнике человека (Schulz, Dickschat, 2007; Giorgio et al., 2015; Amavizca et al., 2017). Глиоксиловая кислота образуется в глиоксилатном цикле, является компонентом многих метаболических путей живых организмов, в том числе метаболизма этиленгликоля или аминокислот, например, глицина, серина, треонина, аргинина и пролина (Lorenz, Fink, 2002; Muckschel et al., 2012).
Терпены
Терпены, класс углеводородов ‒ продуктов микробного биосинтеза, с общей формулой (C5H8)n, в больших количествах содержатся в хвойных растениях, во многих эфирных маслах. В смесях ЛОС бактерий обнаруживают монотерпены (С10), сесквитерпены (С15), их производные или продукты их деградации. Монотерпен лимонен, 1-метил-4-изопропенилциклогексен-1, обладает цитрусовым запахом и синтезируется различными бактериями (Burkholderia, Pseudomonas, Serratia, Staphylococcus и др.) (Giorgio et al., 2015).
Геосмин и 2-метилизоборнеол, циклические третичные спирты терпеновой природы, имеют затхлый и землистый запах, выделяются актиномицетами, миксобактериями и цианобактериями. Антибиотик альбафлавенон сесквитерпеновой природы был найден у Streptomyces albidoflavus и образуется только представителями Streptomyces. Терпены синтезируются в трех различных путях биосинтеза: мевалонатном, 2-метилэритриол-4-фосфатном или лейциновом. Предшественником геосмина является фарнезилдифосфат, предшественником 2-метилизоборнеола — геранилдифосфат (Schulz, Dickschat, 2007; Schmidt et al., 2015). Были описаны два эволюционно отдаленных типа геосминсинтаз: один присутствует у миксобактерий и цианобактерий, а другой ‒ у актиномицетов. Обнаружены также и другие терпеновые синтазы у родов Streptomyces и Nostoc (Schulz, Dickschat, 2007; Peñuelas et al., 2014).
Ароматические соединения
Ароматические ЛОС образуются микроорганизмами и растениями по шикиматному пути и/или при деградации L-фенилаланина или L-тирозина. 2-Фенилэтанол (одно из наиболее распространенных ЛОС) может быть синтезирован из фенилаланина посредством его трансаминирования аминотрансферазой AraT в фенилпируват с последующими окислительным декарбоксилированием до фенилацетальдегида и реакцией восстановления. Соответствующие ферменты были выделены из некоторых видов микроорганизмов (Gonda et al., 2010).
Фенольные производные, такие как 1-фенилнонан-1-он, 1-фенилдекан-1-он и метил-разветвленные производные, образуются в реакциях конденсации “голова к голове” бензил-КоА и алкил-ацил-КоА с последующими реакциями декарбоксилирования. Известны два альтернативных пути получения бензил-КоА: путь аммиаклиазы и путь фенилпируват‒фенилацетат‒фенилглиоксилата. В обоих случаях фермент фенилаланинаммиаклиаза катализирует начальную реакцию (Schulz, Dickschat, 2007; Peñuelas et al., 2014).
Серосодержащие органические соединения
Соединения серы участвуют в создании аромата ферментированных продуктов, в том числе сыра и вина. Бактерии образуют ЛОС ‒ производные метионина, например, диметилсульфид (ДМС), диметилдисульфид (ДМДС), диметилтрисульфид (ДМТС), 1-(метилтио)-3-пентанон, метантиол, метилтиолацетат (Schulz, Dickschat, 2007; Farag et al., 2013; Popova et al., 2014).
Молочнокислые бактерии образуют метантиол, ДМС и ДМДС за счет прямого расщепления L-метионина с помощью L-метионин γ-лиазы, или за счет трансаминирования L-метионина в α-кето-γ-метил-масляную кислоту с последующим восстановительным деметилированием. Два других фермента, цистатионин-β-лиаза и цистатионин-γ-лиаза, также могут быть вовлечены в продукцию ЛОС (Schulz, Dickschat, 2007).
Азотсодержащие органические соединения
Триметиламин (ТМА) – летучее органическое соединение, образуется из четвертичных аминов, придает запах испорченной рыбе. Бактерии Acinetobacter sp. образуют ТМА из L-карнитина с помощью карнитиноксигеназы (Zhu et al., 2014). Сульфатредуцирующие бактерии Desulfovibrio desulfuricans образуют ТМА из холина с помощью холинтриметиламинлиазы (Craciun, Balskus, 2012). ТМА также образуется при превращении триметиламин оксида (TMAO) TMAO-редуктазой. TMAO может использоваться в качестве альтернативного акцептора электронов в анаэробных условиях, однако бактерии способны превращать TMAO в ТМА как в аэробных, так и в анаэробных условиях. ТМА и TMAO много в рыбе, а также в кишечнике животных и человека (McCrindle et al., 2005; Dunn, Stabb, 2008).
2-Амино-ацетофенон (2-АА) обладает запахом, напоминающим запах винограда, продуцируется различными бактериями (Pseudomonas, Burkholderia, Chromobacterium, Serratia и др.), является биосинтетическим предшественником 4‑метилхинолона (Dickschat et al., 2004). Синтез 2-АА находится под контролем транскрипционного активатора, мембранного белка MvfR (Kesarwani et al., 2011; Que et al., 2013).
Индол имеет запах, напоминающий запах гнилой капустной кочерыжки. Было описано около 90 видов бактерий, синтезирующих индол. Биосинтез индола у Escherichia coli осуществляется триптофаназой, кодируемой геном tnaA и отвечающей за превращение триптофана в индол, пируват и аммиак. Биосинтез индола регулируется несколькими факторами окружающей среды: наличием внеклеточного триптофана, клеточной плотностью, катаболитной репрессией, температурой, рН (Lee, Lee, 2010).
Пиразины, шестичленные гетероциклические органические соединения с двумя атомами азота, обладают сильным запахом, используются в качестве ароматизаторов, синтезируются различными бактериями (Pseudomonas, Burkholderia, Serratia, Bacillus и др.). Пути биосинтеза пиразинов изучены недостаточно. Низкомолекулярные метил- и этилпиразины, по-видимому, синтезируются в бактериях из дигидропиразинов, которые являются нестабильными соединениями и легко окисляются до пиразинов. При синтезе высокомолекулярных алкилпиразинов аминокислоты часто выступают в качестве их предшественников (Rajini et al., 2011). Среди других азотсодержащих ЛОС, выделяемых бактериями, можно отметить также триметилоксазолин (Bacillus thuringiensis и B. popilliae) и скатол (род Calothrix) (Schulz, Dickschat, 2007; Peñuelas et al., 2014).
Неорганические соединения
Бактерии образуют различные неорганические летучие вещества, например, сероводород (Н2S), цианистый водород (HCN), аммиак, оксид азота (NО).
Сероводород образуется при ферментативном разложении цистеина (Shatalin et al., 2011). Оксид азота образуется в основном из L-аргинина NO-синтазами (Mattila, Thomas, 2014).
Цианистый водород синтезируют бактерии некоторых видов Pseudomonas, Chromobacterium и Rhizobium. HCN образуется из глицина с участием HCN-синтазы. Образование HCN обычно происходит в конце экспоненциальной фазы роста бактерий в условиях низкой концентрации кислорода (c участием анаэробного регулятора ANR) при высокой клеточной плотности. Продукция HCN у P. aeruginosa PAO1 и Chromobacterium violaceum CV0 находится под контролем системы регуляции Quorum sensing (QS) (Throup et al., 1995; Pessi, Haas, 2000); хотя у P. fluorescens 2P24 QS система, по-видимому, не участвует в регуляции синтеза HCN (Wei, Zhang, 2006).
Аммиак образуется в метаболизме пептидов и аминокислот, главным образом, в катаболизме L‑аспартата; у E. coli К12 преобразование фумарата в аспартат с помощью аспартатаммиаклиазы сопровождается выделением аммиака в качестве побочного продукта (Bernier et al., 2011).
Оксид азота продуцируется ферментом NO-синтазой. Этот фермент катализирует взаимодействие L-аргинина с кислородом, в результате которого образуются L-цитруллин и NO. Процесс осуществляется в две стадии, стабильным интермедиатом является N-гидрокси-L-аргинин (Филиппович, 2010).
Заключая раздел о природе и биосинтезе летучих веществ бактерий, следует отметить, что их количество и состав могут варьировать в зависимости от условий культивирования микроорганизмов-продуцентов. Наиболее важными факторами, влияющими на синтез летучих соединений, являются физиологическое состояние микроорганизма-продуцента, доступность кислорода, состав питательной среды, влажность и температура. На синтез летучих веществ влияют также рН среды, свет, содержание CO2, фаза роста и другие факторы (Schulz, Wheatley, 2002; Dickschat, 2007; Blom et al., 2011b; Audrain et al., 2015; Schmidt et al., 2015; Ratiu et al., 2017; Buszewski et al., 2018; Timm et al., 2018). Показано, что микроорганизмы синтезируют огромное количество летучих соединений различной структуры. Один штамм бактерий может выделять до 100 различных ЛОС. При этом разные неродственные микроорганизмы могут продуцировать одни и те же летучие вещества; в то же время другие летучие вещества являются уникальными для определенных штаммов (Schmidt et al., 2015). Генетическая регуляция синтеза ЛОС и других летучих соединений изучена мало. Было обнаружено, что продукция отдельных ЛОС находится под контролем GacS/GacA двухкомпонентной регуляторной системы (Cheng et al., 2016; Ossowicki et al., 2017).
БИОЛОГИЧЕСКАЯ РОЛЬ ЛЕТУЧИХ ВЕЩЕСТВ БАКТЕРИЙ
Исследования последних лет показали, что летучие вещества, синтезированные одними бактериями, могут влиять на метаболизм других бактерий, и, наоборот, бактерии, окружающие штаммы-продуценты летучих веществ, могут влиять на образование последними летучих веществ. Если раньше летучие вещества считались лишь побочными продуктами первичного метаболизма, то впоследствии выяснилось, что многие из них (если не большинство) обладают биологической активностью (Garbeva et al., 2014a; Schmidt et al., 2015; Schulz-Bohm et al., 2015; Tyc et al., 2015, 2017a; Piechulla et al., 2017).
Все чаще летучие вещества микроорганизмов описываются как переносимые по воздуху потенциальные химические сигналы (“infochemicals”), влияющие на экспрессию генов, проницаемость мембран и/или активность ферментов. В качестве сигнальных молекул летучие вещества могут положительно или отрицательно влиять на соседние организмы, модулировать их ответные реакции (Effmert et al., 2012; Schmidt et al., 2015). Они участвуют во взаимодействии бактерий с бактериями, грибами, растениями, протистами и животными. В отличие от метаболитов, которые действуют лишь в растворенном состоянии, летучие вещества могут передаваться на большие расстояния по воздуху (Tyc et al., 2017b; Westhoff et al., 2017).
Летучие вещества способны воздействовать на Quorum sensing (QS) систему регуляции. У P. aeruginosa при совместном культивировании с Enterobacter aerogenes наблюдают увеличение продукции антибиотиков, которая стимулируется ЛОС 2,3-бутандиолом, выделяемым E. aerogenes. 2,3-Бутандиол влияет на QS систему P. aeruginosa, активирует систему регуляции LasI/LasR, что приводит к увеличению синтеза феназинов, экзотоксинов и усилению образования биопленки (Venkataraman et al., 2014). Пулы летучих веществ ризосферных штаммов P. fluorescens B-4117 и S. plymuthica IC1270 ингибируют QS регуляцию различных бактерий, в том числе Agrobacterium, Chromobacterium, Pectobacterium и Pseudomonas, и подавляют транскрипцию генов ацил-гомосеринлактонсинтазы (Quorum Quenching эффект) (Chernin et al., 2011). Индивидуальные ЛОС, например, ДМДС, образуемый S. plymuthica IC1270, и кетоны (2-нонанон, 2-гептанон), выделяемые штаммами Pseudomonas, ингибировали функционирование QS систем бактерий (Chernin et al., 2011; Плюта и соавт., 2014). Механизмы действия ЛОС на QS регуляцию не изучены. Известно, что QS системы участвуют в регуляции большого количества клеточных процессов, в том числе в контроле антагонистических свойств бактерий, их способности к колонизации определенных экологических ниш, вирулентности. Предполагают, что подавление QS регуляции является еще одной стороной конкурентной борьбы бактерий вместе с ингибиторным действием летучих веществ на их рост и жизнеспособность. Это свойство бактерий может быть важным для взаимодействия бактерий в почве и ризосфере растений, для защиты растений от фитопатогенных бактерий (Chernin et al., 2011; Плюта и соавт., 2014).
Действие летучих веществ на рост и дифференциацию бактерий
Летучие вещества оказывают влияние на рост и дифференциацию бактерий. Для бактерий Streptomyces spp. было показано, что образование ЛОС геосмина штаммом S. albidoflavus AMI 246 коррелирует со споруляцией (Scholler et al., 2002). Было устанолено, что при недостатке в среде глюкозы и повышении pH клетки бактерий S. venezuelae начинают вырабатывать триметиламин (ТМА), в них активируются гены ответа на щелочной стресс. ТМА передается воздушным путем к отдаленным колониям, вызывая повышение рН среды и миграцию клеток. Таким образом, ТМА одновременно способствует росту стрептомицетов и подавляет рост других бактерий (Jones et al., 2017).
Роль индола изменяется в зависимости от условий окружающей среды. Индол индуцирует образование спор у миксобактерий Stigmatella au-rantiaca. В его присутствии происходит активация пируваткиназы, которая требуется для образования плодового тела и образования спор (Stamm et al., 2005). Индол ингибирует репликацию плазмид, рост и деление клеток, ингибирует активность ДНК-гиразы in vitro, действует как протонный ионофор, стимулирует образование клеток-персистеров (Field, Summers, 2012; Chimerel et al., 2012; Vega et al., 2012).
ЛОС бактерий могут проявлять ингибирующее действие в отношении других бактерий. Альбафлавенон, продуцируемый S. albidoflavus, обладает антибактериальной активностью в отношении B. subtilis (Gurtler et al., 1994). ЛОС почвенных бактерий Pseudomonas и Serratia ингибируют рост Agrobacterium tumefaciens и цианобактерий. P. chlororaphis 449 в наибольшем количестве синтезирует 1-ундецен, и, кроме того, кетоны 2-нонанон, 2-ундеканон; S. proteamaculans 94 синтезирует ДМДС и в меньшем количестве 2-гептанон. ДМДС оказывает бактериостатический эффект на A. tumefaciens и бактерицидное действие на цианобактерии Synechococcus sp. 2-Нонанон ингибирует рост A. tumefaciens и Synechococcus sp., 2-ундеканон полностью подавляет рост Synechococcus sp., но не оказывает значительного влияния на A. tumefaciens (Popova et al., 2014). Суммарные пулы ЛОС P. fluorescens и S. plymuthica in vitro оказывают бактериостатическое действие на патогенов растений A. tumefaciens и A. vitis. Основным ЛОС S. plymuthica IC1270 является ДМДС, P. fluorescens B-4117 преимущественно синтезирует 1-ундецен (Dandurishvili et al., 2011).
Разные виды бактерий, относящихся к родам Pseudomonas и Bacillus, обладающие функциями биоконтроля фитопатогенов, продуцируют ЛОС с антибактериальной активностью (Raza et al., 2016a, 2016b, 2016c; Xie et al., 2016; Rajer et al., 2017; Tahir et al., 2017a, 2017b). ЛОС P. fluorescens WR-1, бензотиазол и 1-метилнафтален, обладают бактериостатическим действием, они ингибируют рост, миграцию клеток – сворминг (swarming), свимминг (swimming), и хемотаксическую подвижность патогена томатов Ralstonia solanacearum. Протеомный анализ показал, что ЛОС P. fluorescens WR-1 участвуют в регуляции экспрессии различных клеточных белков R. solanacearum (Raza et al., 2016a).
В связи с изучением механизмов действия ЛОС на белки было исследовано влияние ЛОС на рефолдинг термически инактивированных бактериальных люцифераз в штамме дикого типа E. coli K12 и в мутанте с инактивированным геном, кодирующим шаперон IbpB. Ранее было установлено, что наличие малого шаперона IbpB защищает эти белки от термоденатурации, снижая уровень агрегации и способствуя их рефолдингу. Было показано, что при действии кетонов 2-нонанона и 2-ундеканона ингибируется рефолдинг люцифераз в клетках дикого типа и в то же время наблюдается практически полное отсутствие рефолдинга в клетках мутантного штамма, у которого отсутствует шаперон IbpB. Эти данные продемонстрировали способность кетонов влиять на рефолдинг белков в клетке; шаперон IbpB способствует рефолдингу термически инактивированных люцифераз, защищая их от действия кетонов. Полученные результаты можно объяснить взаимодействием кетонов с гидрофобными участками термоинактивированных люцифераз и конкуренцией с шапероном IbpB за связывание с этими участками (Melkina et al., 2017).
С помощью методов транскриптомики было определено влияние нескольких ЛОС на транскрипцию генов E. coli K-12 в концентрациях, не ингибирующих рост бактерий. Было показано, что изученные ЛОС воздействуют на гены различных функциональных категорий, например, отвечающие на окислительный стресс, синтез транспортных белков, железосерных кластеров (Yung et al., 2016).
ЛОС, синтезируемые Bacillus spp., в том числе бензальдегид, 1,2-бензисотиазол-3(2H)-он и 1,3-бутадиен, проявляли ингибирующую активность в отношении фитопатогена R. solanacearum, снижали размер колоний, влияли на подвижность клеток, хемотаксис, вызывали структурные и морфологические изменения в клетках. ЛОС Bacillus spp. изменяли экспрессию генов R. solanacearum, отвечающих за патогенные свойства этой бактерии (глобальный регулятор вирулентности PhcA, третий и четвертый типы секреторной системы, продукция внеклеточных полисахаридов и др.), а также вызывали системную устойчивость растений к бактериальной гнили (Tahir et al., 2017a). ЛОС почвенных бактерий B. cereus, Brevundimonas sp. и Bacillus sp. оказывали бактерицидное действие на тестерный штамм Bacillus, что связывают с нарушением клеточной стенки бактерии. В деградации клеточной стенки участвует N-ацетилмурамоил-L-аланинамидаза, фермент семейства гидролаз, который наиболее активен при значениях pH 5.5‒6.5. ЛОС понижали pH среды, что приводило к активации работы фермента (Sadiq et al., 2018).
ЛОС способны подавлять рост бактерий Burkholderia cepacia complex (Bcc) (Papaleo et al., 2013; Orlandini et al., 2014). Кишечные бактерии, например, Veillonella sрр., образуют летучие короткоцепочечные жирные кислоты, которые подавляют рост Salmonella enteritidis, S. typhimurium, E. coli и P. aeruginosa, что говорит об участии этих ЛОС в контроле колонизации желудочно-кишечного тракта энтеропатогенами (Hinton, Hume, 1995). Совместное культивирование Bacteroides fragilis, комменсала кишечной флоры, и Clostridium perfringens, патогена, вызывающего пищевое отравление, приводит к ингибированию роста и споруляции C. perfringens под воздействием короткоцепочечных летучих жирных кислот, синтезируемых B. fragilis (уксусной, изомасляной, изовалериановой и янтарной) (Wrigley, 2004).
Бактерии Staphylococcus schleiferi DSMZ 4807, выделенные с поверхности кожи, синтезируют летучие амино/имино кетоны, доминирующие ЛОС получили название шлейферон A и B. Эти соединения ингибируют рост различных грамположительных бактерий, а также воздействуют на накопление пигмента продигиозина у S. plymuthica AS9 и биолюминесценцию у Vibrio harveyi. Реализация указанных фенотипов у грамотрицательных бактерий находится под контролем QS системы (Lemfack et al., 2016).
ЛОС способны влиять на вирулентность бактерий. Например, 2,3-бутандиол и ацетоин необходимы для проявления вирулентных свойств Pectobacterium carotovorum, а также могут увеличивать продукцию факторов вирулентности у P. aeruginosa (Audrain et al., 2015).
ЛОС некоторых бактерий способны стимулировать рост других бактерий. Бактерии Collimonas pratensis и S. plymuthica продуцируют S-метил-тиоацетат, метил тиоционат, бензонитрил, ДМДС, а также ряд других, специфических, ЛОС. Анализ генома с использованием микрочипов показал, что суммарные пулы ЛОС этих бактерий влияют на экспрессию 22 генов у P. fluorescens Pf0-1. Эти гены в основном были связаны с транспортом и метаболизмом аминокислот, производством и конверсией энергии, механизмами передачи сигналов, транспортом и метаболизмом неорганических ионов, секрецией и подвижностью клеток. Среди этих общих дифференциально экспрессируемых генов был ген каталазы Pfl_0064, которая защищает клетку от повреждения активными формами кислорода. С помощью ЛОС была увеличена продукция вторичных метаболитов P. fluorescens Pf0-1 с антибактериальной активностью в отношении бактерий рода Bacillus (Garbeva et al., 2014a). Таким образом, синтез ЛОС почвенными бактериями дает им конкурентные преимущества перед другими бактериями.
Действие летучих веществ, выделяемых бактериями, на чувствительность бактерий к антибиотикам и устойчивость к стрессам
Большой интерес представляет информация о том, что летучие вещества могут изменять чувствительность к антибиотикам (Avalos et al., 2018). Было показано, например, что у грамотрицательных и грамположительных бактерий при достижении высокой плотности популяции биогенный газообразный аммиак увеличивает резистентность бактерий к тетрациклину и ампициллину и снижает резистентность к аминогликозидам (Heal, Parsons, 2002). Авторы полагают, что в основе этого процесса находится индуцированный аммиаком синтез полиаминов, приводящий к изменению проницаемости бактериальной мембраны для различных антибиотиков, а также к повышенной устойчивости бактерий к окислительному стрессу (Bernier et al., 2011; Bernier, Surette, 2013). В работе Cepl et al. (2014) отмечалось, что бактерии, чувствительные к ампициллину, способны расти на среде с этим антибиотиком в присутствии аммиака, что, по-видимому, является результатом инактивации ампициллина при повышении рН среды.
ТМА, который образуют некоторые представители Enterobacteriaceae, определяет резистентность бактерий к тетрациклину и аминогликозидам, повышает устойчивость к хлорамфениколу и снижает устойчивость к окислительному стрессу. Под воздействием ТМА увеличивается pH среды роста, что приводит к снижению проникновения антибиотиков в клетку и повышению резистентности к антибиотикам (Letoffe et al., 2014).
ЛОС 2,3-бутандион и глиоксиловая кислота, образуемые B. subtilis GB03, повышают устойчивость E. coli к ампициллину и тетрациклину (Kim et al., 2013). ЛОС бактерий Burkholderia ambifaria, выделенных из различных мест обитания, увеличивали резистентность E. coli к аминогликозидам гентамицину и канамицину. Такое же действие оказывали чистые ЛОС 1-метилтио-3-пентанон, 2-аминоацетофенон и диметилтрисульфид (Groenhagen et al., 2013).
Индол увеличивает резистентность к антимикробным агентам за счет активации экспрессии генов мультилекарственных транспортеров у E. coli (Hirakawa et al., 2005), S. enterica (Nikaido et al., 2012), P. putida (Molina-Santiago et al., 2014), A. tumefaciens (Lee et al., 2015); кроме того, индол может стимулировать образование клеток-персистеров (Vega et al., 2013). Экзогенный индол увеличивает устойчивость клеток P. putida и P. aeruginosa, не производящих индол, к ампициллину. Резистентность обусловлена индол-зависимой активацией генов эффлюксных насосов и β-лактамазы. Индол участвует также в регуляции экспрессии генов глобальных регуляторов rpoS, recA и mutS и др. (Kim et al., 2017). Обработка газообразным индолом не влияет на устойчивость бактерий к тетрациклину (Letoffe et al., 2014). Устойчивость E. coli к кислотам уменьшается в присутствии индола, происходит репрессия генов gadABCEX, hdeABD и ymgB, отвечающих за устойчивость клеток к действию кислот (Lee, Lee, 2010).
ЛОС 2-аминоацетофенон (2-АА), продуцируемый Pseudomonas aeruginosa, увеличивает резистентность бактерий к антибиотикам, и образование клеток-персистеров. Было показано, что 2-АА влияет на устойчивость к антибиотикам при лечении полимикробных инфекций у продуцирующих и непродуцирующих 2-АА бактерий (Que et al., 2013).
Сероводород повышает резистентность к антимикробным агентам у B. anthracis, P. aeruginosa, S. aureus, E. coli. Инактивация генов, отвечающих за синтез сероводорода, делает клетки бактерий высоко чувствительными ко многим антибиотикам, экзогенный сероводород супрессирует этот эффект. Выяснено, что механизм действия сероводорода связан со снижением окислительного стресса, вызываемого антибиотиками; эндогенный сероводород защищает хромосомную ДНК от повреждений, обусловленных реактивными формами кислорода (Shatalin et al., 2011; Mironov et al., 2017).
Эндогенный NO также защищает некоторые грамположительные бактерии от окислительного стресса и воздействия широкого спектра антибиотиков. Существуют два основных механизма NO-зависимой защиты бактериальных клеток от окислительного стресса. Первый состоит в подавлении оксидом азота реакции Фентона, являющейся источником гидроксильных радикалов. Второй механизм заключается в активации оксидом азота каталазы – фермента, функционирование которого может привести к удалению избытка токсичной для клеток перекиси водорода (Gusarov et al., 2005). Продукт окисления оксида азота NO способен вступать в реакцию с некоторыми антибиотиками, инактивируя их (Gusarov et al., 2009).
Действие летучих веществ бактерий на миграцию клеток и образование биопленок
ЛОС 1-бутанол и индол вызывают уменьшение миграции клеток E. coli и P. aeruginosa по твердым поверхностям, а 2-бутанон и 3-гидрокси-2-бутанон увеличивают миграцию клеток P. aeruginosa (Letoffé et al., 2014). ЛОС, образуемые B. subtilis, негативно воздействуют на сворминг у E. coli, B. glumae, P. aeruginosa и Paenibacillus polymyxa (Kim et al., 2013). У E. coli ЛОС глиоксиловая кислота и 2,3-бутандион уменьшали сворминг. Действие этих ЛОС приводило к глобальному изменению экспрессии генов. Микроматричный (microarray) анализ экспрессии генов E. coli при воздействии ЛОС, образуемых B. subtilis, показал, что ЛОС влияли на фенотип клеток мишеней и изменяли экспрессию более чем 100 генов. Анализ полученных мутантов с нокаутированными генами, не проявлявших изменения фенотипов в присутствии ЛОС, показал, что действие ЛОС было связано с продуктом ранее не охарактеризованного гена ypdB, который был, по-видимому, ключевым регулятором связанных с ЛОС эффектов в E. coli (Kim et al., 2013).
Аммиак стимулирует образование биопленки у B. licheniformis, B. subtilis и S. aureus (Nijland, Burgess, 2010; Letoffe et al., 2014). Индол ингибирует образование биопленок у E. coli и у P. aeruginosa, но стимулирует образование биопленок у S. au-reus (Letoffe et al., 2014). Несколько других ЛОС (1-бутанол, 2-бутанон, ацетоин, этанол, гексадецен, глиоксиловая кислота и ТМА) оказывают незначительное положительное или отрицательное влияние на образование биопленок у одного или нескольких тестируемых видов бактерий, включая E. coli, P. aeruginosa, S. aureus и B. subtilis (Letoffe et al., 2014).
NO в низкой концентрации может вызывать расселение клеток из биопленок и их деградацию у P. aeruginosa, E. coli, V. cholerae, B. licheniformis, S. marcescens, Fusobacterium nucleatum (Barraud et al., 2009), Shewanella woodyi (Liu et al., 2012), S. enterica (Marvasi et al., 2014) и Neisseria gonorrhoeae (Potter et al., 2009). Влияние NO на расселение биопленки, видимо, консервативно у многих видов бактерий, однако в отдельных исследованиях наблюдали положительное влияние NO на образование биопленки у Shewanella oneidensis, Azospirillum brasilense и V. harveyi (Henares et al., 2013; Barraud et al., 2015).
Было установлено, что у штаммов-продуцентов P. chlororaphis 449, P. fluorescens B-4117, S. plymuthica IC1270 и S. proteamaculans 94 общий пул летучих веществ и индивидуальные ЛОС, выделяемые этими бактериями (ДМДС и кетоны 2-гептанон, 2-нонанон и 2-ундеканон), ингибировали образование биопленок фитопатогенных агробактерий различного происхождения (A. tumefaciens штаммы С58, Chry5 и Sh-1) и убивали бактерии в зрелых биопленках. Эти данные могут служить доказательством наличия дополнительного потенциала у некоторых ЛОС, убивающих или ингибирующих рост фитопатогенных бактерий, вирулентность которых связана с образованием биопленок на инфицированных растениях (Plyuta et al., 2016).
Следует отметить еще один интересный феномен, связанный с действием летучих соединений бактерий и, возможно, влияющий на образование биопленок. Было показано, что общий пул летучих веществ, выделяемых P. fluorescens, снижает адгезию клеток этого вида к стеклу и увеличивает время удержания адсорбированных на стекле клеток. Механизм этого явления в настоящее время неясен, и неизвестно, какие летучие вещества ответственны за действие на адгезию клеток (Николаев и соавт., 2000).
Действие летучих веществ бактерий на грибы, протисты, растения, беспозвоночные животные
ЛОС бактерий способны действовать на рост, развитие, дифференциацию, продукцию вторичных метаболитов грибов. Например, суммарные пулы летучих веществ ризосферных штаммов P. chlororaphis 449 (8 штаммов различного происхождения), P. fluorescens B-4117, S. plymuthica IC1270 и штамма S. proteamaculans 94, выделенного из испорченного мяса, оказывают фунгистатическое действие на фитопатогенные грибы Rhizoctonia solani, Helminthоsporium sativum и Sclerotinia sclerotiorum. Наибольший эффект был на R. solani, самое сильное действие оказывали штаммы Pseudomonas. Индивидуальные ЛОС, образуемые этими штаммами, подавляли рост мицелия R. solani.
ЛОС, выделяемые Streptomyces spp., проявляли противогрибковую активность в отношении R. solani (Cordovez et al., 2015). ЛОС P. donghuensis P482, выделенного из ризосферы растений, подавляли рост грибов и оомицетов (Ossowicki et al., 2017). ЛОС других штаммов Pseudomonas также могут проявлять активность против оомицетов (De Vrieze et al., 2015; Hunziker et al., 2015). ЛОС нескольких штаммов Lysobacter при росте на среде, богатой белком, проявляли активность против оомицетов, однако при росте на среде, богатой сахаром, ЛОС не обнаруживали ингибирующего действия, что свидетельствует о влиянии условий роста и наличия определенных питательных веществ на продукцию ЛОС (Lazazzara et al., 2017). ЛОС грибов, в свою очередь, также участвуют в их взаимодействии с бактериями, что приводит к фенотипическим изменениям у бактерий (Schmidt et al., 2016; Schulz-Bohm et al., 2017).
Бактериальные ЛОС могут также взаимодействовать с протистами (Protozoa) на больших расстояниях. Действие различных ЛОС может быть различным. Например, ЛОС терпеновой природы, продуцируемые бактерией Collimonas pratensis, такие, как β-линалоол, β-пинен, гермакрен, δ-кадинен, стимулировали активность и подвижность амeбоподобных протистов и экскаватов. Другие ЛОС бактерий могут защищать бактерии, отпугивая хищников протистов, для которых бактерии являются пищей (Schulz-Bohm et al., 2017). Бактерии родов Pseudomonas и Serratia синтезируют пул летучих веществ, обладающих ингибиторным и убивающим действием на насекомых Drosophila melanogaster и нематоды Caenorhabditis elegans. Подобное действие оказывали также индивидуальные ЛОС, выделяемые этими бактериями – кетоны 2-нонанон, 2-ундеканон, ДМДС, алкен 1-ундецен (Popova et al., 2014). ЛОС могут действовать на насекомых как аттрактанты, медиаторы поведения, сигнальные молекулы с регуляторными функциями (Davis et al., 2013).
Летучие вещества бактерий оказывают воздействие на рост и развитие растений (Blom et al., 2011a; Kai et al., 2016; Berg et al., 2017; Rath et al., 2018). Они способны изменять развитие корневой системы, физиологию и гормональную систему растений, накопление биомассы (Ryu et al., 2004; Blom et al., 2011а; Wenke et al., 2012; Bailly et al., 2014; Piechulla et al., 2017), могут служить для растений источником питательных веществ. Например, ДМДС ускорял рост растений табака, увеличивая содержание серы в среде (Meldau et al., 2013). Летучие вещества бактерий способны индуцировать устойчивость растений к патогенам (D’Alessandro et al., 2014; Song et al., 2015; Wintermans et al., 2016; Nawrocka et al., 2018), влиять на продукцию растениями вторичных метаболитов (Santoro et al., 2011), подавлять инфицирование патогенами растений (Kai et al., 2009; Garbeva et al., 2014b; DeVrieze et al., 2015), стимулировать фунгистазис и супрессивность почвы (Garbeva et al., 2011; Van Agtmaal et al., 2015). Летучие вещества бактерий, в том числе несимбиотических бактерий и патогенов растений, могут стимулировать рост, фотосинтез, накопление крахмала в листьях, воздействуя на процессы в растениях, регулируемые цитокинами. Протеомный анализ показывает, что воздействие летучих веществ плесневого гриба Alternaria alternata приводит к глобальным изменениям экспрессии белков, важных для фотосинтеза, метаболизма крахмала и роста Arabidopsis thaliana (Sánchez-López et al., 2016a, 2016b).
ЛОС растений также способны оказывать влияние на бактерии. ЛОС, выделяемые корнями растений, могут использоваться бактериями в качестве источника углерода, для защиты от антагонистов (Van Dam et al., 2016), способны привлекать к корням бактерии, находящиеся на значительном расстоянии (Schulz-Bohm et al., 2017, 2018).
ПРИКЛАДНЫЕ АСПЕКТЫ ПРИМЕНЕНИЯ ЛЕТУЧИХ ВЕЩЕСТВ БАКТЕРИЙ
Изучение летучих соединений бактерий, и прежде всего, ЛОС, открывает много перспектив их дальнейшего использования в прикладных целях. Возможно применение ЛОС и штаммов, их продуцирующих, в сельском хозяйстве, например, для биологического контроля заболеваний растений, вызванных фитопатогенами, для уменьшения потерь при хранении продуктов, в качестве биостимуляторов роста растений для создания новых эффективных биоудобрений. Отдельные ЛОС могут быть использованы как аттрактанты/репелленты насекомых. На основе ЛОС проводятся разработки пестицидов нового типа, не загрязняющих почву (улетучивающихся после применения). Высказано предположение, что ДМДС действует в качестве природного фумиганта и играет роль в естественной защите растений (Kyung, Lee, 2001). Было проведено тестирование ДМДС в качестве нового предпосевного почвенного фумиганта под торговой маркой PALADIN (по Dandurishvili et al., 2010). Мониторинг летучих веществ может быть использован в качестве потенциального индикатора микробной активности, измерения сдвигов в составе микробного сообщества в окружающей среде и, в конечном счете, для определения состояния здоровья почв сельскохозяйственных земель (Schmidt et al., 2015).
В биотехнологии ЛОС могут быть использованы для получения биотоплива, а также как промежуточные вещества для синтеза полезных для человека продуктов (Kai et al., 2016). ЛОС используются как вкусовые ароматизаторы в пищевой промышленности и как одоранты в косметике и парфюмерии. В медицине анализ летучих веществ микроорганизмов в качестве биомаркеров может быть использован как неинвазивный диагностический инструмент для определения различных заболеваний (Bikov et al., 2015). В различных отраслях промышленности анализ летучих веществ, выделяемых микроорганизмами, может быть применен для быстрого метода контроля качества продуктов, их зараженности патогенными бактериями (Korpi et al., 2009).
Синтез летучих веществ обеспечивает бактериям способность общаться с окружающими их организмами и реагировать на различные условия окружающей среды, повышает конкурентоспособность бактерий. Летучие соединения бактерий играют важную экологическую роль в среде их обитания – в воздухе, воде, почве. Поэтому представляет интерес определение количественного содержания летучих веществ, выделяемых микроорганизмами, суммарных пулов летучих соединений и индивидуальных веществ, в различных природных ареалах.
ЗАКЛЮЧЕНИЕ
Исследование летучих веществ микроорганизмов, их влияния на различные клеточные процессы – это новая, мало изученная область микробиологии, которая открывает новые аспекты жизнедеятельности микроорганизмов, новые пути их метаболизма и закономерности взаимодействия с другими микроорганизмами и высшими организмами. ЛОС, образуемые микроорганизмами, по-видимому, станут ценным арсеналом новых соединений для биотехнологии. Изучение летучих веществ, синтезируемых микроорганизмами, представляет огромное поле деятельности для химиков, микробиологов, биологов разных направлений, биотехнологов; возможности и перспективы использования этих соединений в значительной степени еще не определены.
Сведения о путях синтеза ЛОС, их природе, функциональной роли и возможном потенциале в конкурентной борьбе микроорганизмов в природных условиях получены лишь для небольшого количества видов и штаммов бактерий и грибов и, безусловно, недостаточны для понимания этого феномена и его функциональной роли даже у изученных объектов исследования. Вопросы о роли ЛОС и других летучих соединений, образуемых микроорганизмами, процессах метаболизма, участвующих в их биосинтезе, и их генетической регуляции, механизмах их действия на различные биологические объекты и экологической значимости ЛОС заслуживают глубокого и детального изучения.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа частично финансировалась грантами РФФИ № 18-04-00375-а и № 18-34-00396–мол_а.
Список литературы
Николаев Ю.А., Проссер Дж., Виттли Р.И. Регуляция адгезии клеток Pseudomonas fluorescens к стеклу летучими соединениями, выделяемыми культурой // Микробиология. 2000. Т. 69. № 3. С. 287−290.
Nikolaev Yu.A., Prosser J.I., Wheatley R.E. Regulation of the adhesion of Pseudomonas fluorescens cells to glass by extracellular volatile compounds // Microbiology (Moscow). 2000. V. 69. P. 287−290.
Плюта В.А., Попова А.А., Кокшарова О.А., Кузнецов А.Е., Хмель И.А. Способность природных кетонов взаимодействовать с бактериальными Quorum sensing системами // Мол. генет., микробиол. вирусол. 2014. № 4. С. 10‒13.
Plyuta V.A., Popova A.A., Koksharova O.A., Kuznetsov A.E., Khmel I.A. The ability of natural ketones to interact with bacterial quorum sensing systems // Mol. Genet. Microbiol. Virol. 2014. P. 167‒171.
Филиппович С.Ю. NO-синтазы бактерий // Биохимия. 2010. Т. 75. № 10. С. 1367‒1376. Filippovich S.Iu. Bacterial NO synthases // Biochemistry (Moscow). 2010. V. 75. P. 1217‒1224.
Amavizca E., Bashan Y., Ryu C.M., Farag M.A., Bebout B.M., de-Bashan L.E. Enhanced performance of the microalga Chlorella sorokiniana remotely induced by the plant growth-promoting bacteria Azospirillum brasilense and Bacillus pumilus // Sci. Rep. 2017. V. 7. P. 41310. https://doi.org/10.1038/srep41310
Audrain B., Farag M.A., Ryu C.M., Ghigo J.M. Role of bacterial volatile compounds in bacterial biology // FEMS Microbiol. Rev. 2015. V. 39. P. 222‒233.
Avalos M., van Wezel G.P., Jos M Raaijmakers J.M., Garbeva P. Healthy scents: microbial volatiles as new frontier in antibiotic research? // Curr. Opin. Microbiol. 2018. V. 45. P. 84–91. https://doi.org/10.1016/j.mib.2018.02.011
Bailly A., Groenhagen U., Schulz S., Geisler M., Eberl L., Weisskopf L. The inter-kingdom volatile signal indole promotes root development by interfering with auxin signalling // Plant J. 2014. V. 80. P. 758–771.
Barraud N., Kelso M.J., Rice S.A., Kjelleberg S. Nitric oxide: a key mediator of biofilm dispersal with applications in infectious diseases // Curr. Pharm. Design. 2015. V. 21. P. 31–42.
Barraud N., Schleheck D., Klebensberger J., Webb J.S., Hassett D.J., Rice S.A., Kjelleberg S. Nitric oxide signaling in Pseudomonas aeruginosa biofilms mediates phosphodiesterase activity, decreased cyclic di-GMP levels, and enhanced dispersal // J. Bacteriol. 2009. V. 191. P. 7333–7342.
Berg G., Köberl M., Rybakova D., Müller H., Grosch R., Smalla K. Plant microbial diversity is suggested as the key to future biocontrol and health trends // FEMS Microbiol. Ecol. 2017. V. 93. № 5. https://doi.org/10.1093/femsec/fix050
Bernier S.P., Létoffé S., Delepierre M., Ghigo J.M. Biogenic ammonia modifies antibiotic resistance at a distance in physically separated bacteria // Mol. Microbiol. 2011. V. 81. P. 705‒716.
Bernier S.P., Surette M.G. Concentration-dependent activity of antibiotics in natural environments // Front. Microbiol. 2013. V. 4. № 20. https://doi.org/10.3389/fmicb.2013.00020
Bikov A., Lázár Z., Horvath I. Established methodological issues in electronic nose research: how far are we from using these instruments in clinical settings of breath analysis? // J. Breath. Res. 2015. V. 9. P. 034001. https://doi.org/10.1088/1752-7155/ 9/3/034001
Blom D., Fabbri C., Connor E.C., Schiestl F.P., Klauser D.R., Boller T., Eberl L., Weisskopf L. Production of plant growth modulating volatiles is widespread among rhizosphere bacteria and strongly depends on culture conditions // Environ. Microbiol. 2011b. V. 13. P. 3047‒3058.
Blom D., Fabbri C., Eberl L., Weisskopf L. Volatile-mediated killing of Arabidopsis thaliana by bacteria is mainly due to hydrogen cyanide // Appl. Environ. Microbiol. 2011a. V. 77. P. 1000‒1008.
Bos L.D., Sterk P.J., Schultz M.J. Volatile metabolites of pathogens: a systematic review // PLoS Pathog. 2013. V. 9. № 5. e1003311. https://doi.org/10.1371/journal.ppat.1003311
Buszewski B., Rațiu I.A., Milanowski M., Pomastowski P., Ligor T. The effect of biosilver nanoparticles on different bacterial strains’ metabolism reflected in their VOCs profiles // J. Breath Res. 2018. V. 12. P. 027105. https://doi.org/10.1088/1752-7163/ aa820f
Cepl J., Blahůšková A., Cvrčková F., Markoš A. Ammonia produced by bacterial colonies promotes growth of ampicillin-sensitive Serratia sp. by means of antibiotic inactivation // FEMS Microbiol. Lett. 2014. V. 354. P. 126‒132.
Cheng X., Cordovez V., Etalo D.W., van der Voort M., Raaijmakers J.M. Role of the GacS sensor kinase in the regulation of volatile production by plant growth-promoting Pseudomonas fluorescens SBW25 // Front. Plant Sci. 2016. V. 7. P. 1706. https://doi.org/10.3389/fpls.2016.01706
Chernin L., Toklikishvili N., Ovadis M., Kim S., Ben-Ari J., Khmel I., Vainstein A. Quorum-sensing quenching by rhizobacterial volatiles // Environ. Microbiol. Rep. 2011. V. 3. P. 698‒704.
Chimerel C., Field C.M., Piñero-Fernandez S., Keyser U.F., Summers D.K. Indole prevents Escherichia coli cell division by modulating membrane potential // Biochim. Biophys. Acta. 2012. V. 1818. P. 1590‒1594.
Cordovez V., Carrion V.J., Etalo D.W. Mumm R., Zhu H., van Wezel G.P., Raaijmakers J.M. Diversity and functions of volatile organic compounds produced by Streptomyces from a disease-suppressive soil // Front. Microbiol. 2015. V. 6. P. 1081. https://doi.org/10.3389/fmicb.2015.01081
Craciun S., Balskus E.P. Microbial conversion of choline to trimethylamine requires a glycyl radical enzyme // Proc. Natl. Acad. Sci. USA. 2012. V. 109. P. 21307‒21312.
D’Alessandro M., Erb M., Ton J., Brandenburg A., Karlen D., Zopfi J., Turlings T.C.J. Volatiles produced by soil-borne endophytic bacteria increase plant pathogen resistance and affect tritrophic interactions // Plant Cell Environ. 2014. V. 37. P. 813–826.
Dandurishvili N., Toklikishvili N., Ovadis M., Eliashvili P., Giorgobiani N., Keshelava R., Tediashvili M., Vainstein A., Khmel I., Szegedi E., Chernin L. Broad-range antagonistic rhizobacteria Pseudomonas fluorescens and Serratia plymuthica suppress Agrobacterium crown gall tumours on tomato plants // J. Appl. Microbiol. 2011. V. 110. P. 341‒352.
Davis T.S., Crippen T.L., Hofstetter R.W., Tomberlin J.K. Microbial volatile emissions as insect semiochemicals // J. Chem. Ecol. 2013. V. 39. P. 840‒859. https://doi.org/10.1007/ s10886-013-0306-z
De Vrieze M., Pandey P., Bucheli T.D., Varadarajan A.R., Ahrens C.H., Weisskopf L., Bailly A. Volatile organic compounds from native potato-associated Pseudomonas as potential anti-oomycete agents // Front. Microbiol. 2015. V. 6. P. 1295. https://doi.org/10.3389/fmicb.2015.01295
Dickschat J.S., Wenzel S.C., Bode H.B., Müller R. Schulz S. Biosynthesis of volatiles by the myxobacterium Myxococcus xanthus // Chembiochem. 2004. V. 5. P. 778‒787.
Dunn A.K., Stabb E.V. Genetic analysis of trimethylamine N-oxide reductases in the light organ symbiont Vibrio fischeri ES114 // J. Bacteriol. 2008. V. 190. P. 5814‒5823.
Effmert U., Kalderas J., Warnke R., Piechulla B. Volatile mediated interactions between bacteria and fungi in the soil // J. Chem. Ecol. 2012. V. 38. P. 665–703.
Farag M.A., Zhang H., Ryu C.M. Dynamic chemical communication between plants and bacteria through airborne signals: induced resistance by bacterial volatiles // J. Chem. Ecol. 2013. V. 39. P. 1007‒1018.
Field C.M., Summers D.K. Indole inhibition of ColE1 replication contributes to stable plasmid maintenance // Plasmid. 2012. V. 67. P. 88‒94.
Forney F.W., Markovetz A.J. The biology of methyl ketones // J. Lipid Res. 1971. V. 12. P. 383‒395.
Garbeva P., Hol W.H.G., Termorshuizen A.J., Kowalchuk G.A., de Boer W. Fungistasis and general soil biostasis ‒ a new synthesis // Soil Biol. Biochem. 2011. V. 4. P. 469–477.
Garbeva P., Hordijk C., Gerards S., de Boer W. Volatile-mediated interactions between phylogenetically different soil bacteria // Front. Microbiol. 2014a. V. 11. P. 289. https://doi.org/10.3389/fmicb.2014.00289
Garbeva P., Hordijk C., Gerards S., de Boer W. Volatiles produced by the mycophagous soil bacterium Collimonas // FEMS Microbiol. Ecol. 2014b. V. 8. P. 639–649.
Giorgio A., De Stradis A., Lo Cantore P., Iacobellis N.S. Biocide effects of volatile organic compounds produced by potential biocontrol rhizobacteria on Sclerotinia sclerotiorum // Front. Microbiol. 2015. V. 6. P. 1056. https://doi.org/10.3389/ fmicb.2015.01056
Gonda I., Bar E., Portnoy V., Lev S., Burger J., Schaffer A.A., Tadmor Y., Gepstein S., Giovannoni J.J., Katzir N., Lewinsohn E. Branched-chain and aromatic amino acid catabolism into aroma volatiles in Cucumis melo L. fruit // J. Exp. Bot. 2010. V. 61. P. 1111‒1123.
Groenhagen U., Baumgartner R., Bailly A., Gardiner A., Eberl L., Schulz S., Weisskopf L. Production of bioactive volatiles by different Burkholderia ambifaria strains // J. Chem. Ecol. 2013. V. 39. P. 892‒906.
Gürtler H., Pedersen R., Anthoni U., Christophersen C., Nielsen P.H., Wellington E.M., Pedersen C., Bock K. Albaflavenone, a sesquiterpene ketone with a zizaene skeleton produced by a streptomycete with a new rope morphology // J. Antibiot. (Tokyo). 1994. V. 47. P. 434‒439.
Gusarov I., Nudler E. NO-mediated cytoprotection: Instant adaptation to oxidative stress in bacteria // Proc. Natl. Acad. Sci. USA. 2005. V. 102. P. 13855‒13860.
Gusarov I., Shatalin K., Starodubtseva M., Nudler E. Endogenous nitric oxide protects bacteria against a wide spectrum of antibiotics // Science. 2009. V. 325. № 5946. P. 1380‒1384.
Hamilton-Kemp T., Newman M., Collins R., Elgaali H., Yu K., Archbold D. Production of the long-chain alcohols octanol, decanol, and dodecanol by Escherichia coli // Curr. Microbiol. 2005. V. 51. P. 82‒86.
Heal R.D., Parsons A.T. Novel intercellular communication system in Escherichia coli that confers antibiotic resistance between physically separated populations // J. Appl. Microbiol. 2002. V. 92. P. 1116‒1122.
Henares B.M., Xu Y., Boon E.M. A nitric oxide-responsive quorum sensing circuit in Vibrio harveyi regulates flagella production and biofilm formation // J. Mol. Sci. 2013. V. 14. P. 16473–16484.
Hinton A., Jr., Hume M.E. Synergism of lactate and succinate as metabolites utilized by Veillonella to inhibit the growth of Salmonella typhimurium and Salmonella enteritidis in vitro // Avian Dis. 1995. V. 39. P. 309‒316.
Hirakawa H., Inazumi Y., Masaki T., Hirata T., Yamaguchi A. Indole induces the expression of multidrug exporter genes in Escherichia coli // Mol. Microbiol. 2005. V. 55. P. 1113‒1126.
Hunziker L., Bonisch D., Groenhagen U., Bailly A., Schulz S., Weisskopf L. Pseudomonas strains naturally associated with potato plants produce volatiles with high potential for inhibition of Phytophthora infestans // Appl. Environ. Microbiol. 2015. V. 81. P. 821–830.
Jones S.E., Ho L., Rees C.A., Hill J.E., Nodwell J.R., Elliot M.A. Streptomyces exploration is triggered by fungal interactions and volatile signals // ELife. 2017. V. 6. e21738. https://doi.org/10.7554/eLife.21738
Kai M., Haustein M., Molina F., Petri A., Scholz B., Piechulla B. Bacterial volatiles and their action potential // Appl. Microbiol. Biotechnol. 2009. V. 81. P. 1001–1012.
Kai M., Effmert U., Piechulla B. Bacterial-plant interactions: approaches to unravel the biological function of bacterial volatiles in the rhizosphere // Front. Microbiol. 2016. V. 7. P. 108. https://doi.org/10.3389/fmicb.2016.00108
Kesarwani M., Hazan R., He J., Que Y.A., Apidianakis Y., Lesic B., Xiao G., Dekimpe V., Milot S., Deziel E., Lépine F., Rahme L.G. A quorum sensing regulated small volatile molecule reduces acute virulence and promotes chronic infection phenotypes // PLoS Pathog. 2011. V. 7. № 8. e1002192. https://doi.org/10.1371/journal.ppat.1002192
Kim J., Shin B., Park C., Park W. Indole-induced activities of β-lactamase and efflux pump confer ampicillin resistance in Pseudomonas putida KT2440 // Front. Microbiol. 2017. V. 8. P. 433. https://doi.org/10.3389/fmicb.2017.00433
Kim K.S., Lee S., Ryu C.M. Interspecific bacterial sensing through airborne signals modulates locomotion and drug resistance // Nat. Commun. 2013. V. 4. P. 1809. https://doi.org/10.1038/ ncomms2789
Korpi A., Järnberg J., Pasanen A. L. Microbial volatile organic compounds // Crit. Rev. Toxicol. 2009. V. 39. P. 139‒193. https://doi.org/10.1080/10408440802291497
Kyung K.H., Lee Y.C. Antimicrobial activities of sulfur compounds derived from S-alk(en)yl-L-cysteine sulfoxides in Allium and Brassica // Food Rev. Int. 2001. V. 17. P. 183‒198.
Lazazzara V., Perazzolli M., Pertot I., Biasioli F., Puopolo G., Cappellin L. Growth media affect the volatilome and antimicrobial activity against Phytophthora infestans in four Lysobacter type strains // Microbiol. Res. 2017. V. 201. P. 52–62.
Lee J.H., Kim Y.G., Baek K.H., Cho M.H., Lee J. The multifaceted roles of the interspecies signalling molecule indole in Agrobacterium tumefaciens // Environ. Microbiol. 2015. V. 17. P. 1234‒1244.
Lee J.H., Lee J. Indole as an intercellular signal in microbial communities // FEMS Microbiol. Rev. 2010. V. 34. P. 426‒444.
Lemfack M.C., Gohlke B.O., Toguem S.M.T., Preissner S., Piechulla B., Preissner R. mVOC 2.0: a database of microbial volatiles // Nucl. Acids Res. 2017. https://doi.org/10.1093/nar/gkx1016
Lemfack M.C., Nickel J., Dunkel M., Preissner R., Piechulla B. mVOC: a database of microbial volatiles // Nucl. Acid Res. 2014. V. 42. https://doi.org/10.1093/nar/gkt1250
Lemfack M.C., Ravella S.R., Lorenz N., Kai M., Jung K., Schulz S., Piechulla B. Novel volatiles of skin-borne bacteria inhibit the growth of Gram-positive bacteria and affect quorum-sensing controlled phenotypes of Gram-negative bacteria // Syst. Appl. Microbiol. 2016. V. 39. P. 503‒515.
Letoffé S., Audrain B., Bernier S.P., Delepierre M., Ghigo J.M. Aerial exposure to the bacterial volatile compound trimethylamine modifies antibiotic resistance of physically separated bacteria by raising culture medium pH // MBio. 2014. V. 5. e00944-13. https://doi.org/10.1128/mBio.00944-13
Liu N., Xu Y., Hossain S., Huang N., Coursolle D., Gralnick J.A., Boon E.M. Nitric oxide regulation of cyclic di-GMP synthesis and hydrolysis in Shewanella woodyi // Biochemistry. 2012. V. 51. P. 2087–2099.
Lorenz M.C., Fink G.R. Life and death in a macrophage: role of the glyoxylate cycle in virulence // Eukaryot. Cell. 2002. V. 1. P. 657‒662.
Marilley L., Casey M.G. Flavours of cheese products: metabolic pathways, analytical tools and identification of producing strains // J. Food Microbiol. 2004. V. 90. P. 139‒159.
Marvasi M., Chen C., Carrazana M., Durie I.A., Teplitski M. Systematic analysis of the ability of nitric oxide donors to dislodge biofilms formed by Salmonella enterica and Escherichia coli O157:H7 // AMB Express. 2014. V. 4. P. 42. https://doi.org/10.1186/s13568-014-0042-y
Mattila J.T., Thomas A.C. Nitric oxide synthase: non-canonical expression patterns // Front. Immunol. 2014. V. 5. P. 478. https://doi.org/10.3389/fimmu.2014.00478
McCrindle S.L., Kappler U., McEwan A.G. Microbial dimethylsulfoxide and trimethylamine-N-oxide respiration // Adv. Microb. Physiol. 2005. V. 50. P. 147‒198.
Meldau D.G., Meldau S., Hoang L.H., Underberg S., Wunsche H., Baldwin I.T. Dimethyl disulfide produced by the naturally associated bacterium Bacillus sp B55 promotes Nicotiana attenuata growth by enhancing sulfur nutrition // Plant Cell. 2013. V. 25. P. 2731–2747.
Melkina O.E., Khmel I.A., Plyuta V.A., Koksharova O.A., Zavilgelsky G.B. Ketones 2-heptanone, 2-nonanone, and 2‑undecanone inhibit DnaK-dependent refolding of heat-inactivated bacterial luciferases in Escherichia coli cells lacking small chaperon IbpB // Appl. Microbiol. Biotechnol. 2017. V. 101. P. 5765‒5771.
Mironov A., Seregina T., Nagornykh M., Luhachack L.G., Korolkova N., Lopes L.E., Kotova V., Zavilgelsky G., Shakulov R., Shatalin K., Nudler E. Mechanism of H2S-mediated protection against oxidative stress in Escherichia coli // Proc. Natl. Acad. Sci. USA. 2017. V. 114. P. 6022‒6027.
Molina-Santiago C., Daddaoua A., Fillet S., Duque E., Ramos J.L. Interspecies signalling: Pseudomonas putida efflux pump TtgGHI is activated by indole to increase antibiotic resistance // Environ. Microbiol. 2014. V. 16. P. 1267‒1281.
Mückschel B., Simon O., Klebensberger J., Graf N., Rosche B., Altenbuchner J., Pfannstiel J., Huber A., Hauer B. Ethylene glycol metabolism by Pseudomonas putida // Appl. Environ. Microbiol. 2012. V. 78. P. 8531‒8539. https://doi.org/10.1128/ AEM.02062-12
Mueller R.S., Beyhan S., Saini S.G., Yildiz F.H., Bartlett D.H. Indole acts as an extracellular cue regulating gene expression in Vibrio cholerae // J. Bacteriol. 2009. V. 191. P. 3504‒3516.
Nawrocka J., Małolepsza U., Szymczak K., Szczech M. Involvement of metabolic components, volatile compounds, PR proteins, and mechanical strengthening in multilayer protection of cucumber plants against Rhizoctonia solani activated by Trichoderma atroviride TRS25 // Protoplasma. 2018. V. 255. P. 359‒373.
Nijland R., Burgess J.G. Bacterial olfaction // Biotechnol. J. 2010. V. 5. P. 974‒977.
Nikaido E., Giraud E., Baucheron S., Yamasaki S., Wiedemann A., Okamoto K., Takagi T., Yamaguchi A., Cloeckaert A., Nishino K. Effects of indole on drug resistance and virulence of Salmonella enterica serovar Typhimurium revealed by genome-wide analyses // Gut Pathog. 2012. V. 4. P. 5. https://doi.org/10.1186/1757-4749-4-5
Orlandini V., Maida I., Fondi M., Perrin E., Papaleo M.C., Bosi E., de Pascale D., Tutino M.L., Michaud L., Lo Giudice A., Fani R. Genomic analysis of three sponge-associated Arthrobacter Antarctic strains, inhibiting the growth of Burkholderia cepacia complex bacteria by synthesizing volatile organic compounds // Microbiol. Res. 2014. V. 169. P. 593‒601.
Ossowicki A., Jafra S., Garbeva P. The antimicrobial volatile power of the rhizospheric isolate Pseudomonas donghuensis P482 // PLoS One. 2017. V. 12. e0174362. https://doi.org/10.1371/journal.pone.0174362
Papaleo M.C., Romoli R., Bartolucci G., Maida I., Perrin E., Fondi M., Orlandini V., Mengoni A., Emiliani G., Tutino M.L., Parrilli E., de Pascale D., Michaud L., Lo Giudice A., Fani R. Bioactive volatile organic compounds from Antarctic (sponges) bacteria // N. Biotechnol. 2013. V. 30. P. 824‒838.
Peñuelas J., Asensio D., Tholl D., Wenke K., Rosenkranz M., Piechulla B., Schnitzler J.P. Biogenic volatile emissions from the soil // Plant Cell Environ. 2014. V. 37. P. 1866‒1891.
Pessi G., Haas D. Transcriptional control of the hydrogen cyanide biosynthetic genes hcnABC by the anaerobic regulator ANR and the quorum-sensing regulators LasR and RhlR in Pseudomonas aeruginosa // J. Bacteriol. 2000. V. 182. P. 6940‒6949.
Piechulla B., Degenhardt J. The emerging importance of microbial volatile organic compounds // Plant Cell Environ. 2014. V. 37. P. 811‒812.
Piechulla B., Lemfack M. C., Kai M. Effects of discrete bioactive microbial volatiles on plants and fungi // Plant Cell Environ. 2017. V. 40. P. 2042–2067.
Plyuta V., Lipasova V., Popova A., Koksharova O., Kuznetsov A., Szegedi E., Chernin L., Khmel I. Influence of volatile organic compounds emitted by Pseudomonas and Serratia strains on Agrobacterium tumefaciens biofilms // APMIS. 2016. V. 124. P. 586‒594.
Popova A.A, Koksharova O.A, Lipasova V.A, Zaitseva J.V, Katkova-Zhukotskaya O.A, Eremina S.Iu., Mironov A.S, Chernin L.S, Khmel I.A. Inhibitory and toxic effects of volatiles emitted by strains of Pseudomonas and Serratia on growth and survival of selected microorganisms, Caenorhabditis elegans, and Drosophila melanogaster // Biomed Res. Int. 2014. P. 125704. https://doi.org/10.1155/2014/125704
Potter A.J., Kidd S.P., Edwards J.L., Falsetta M.L., Apicella M.A., Jennings M.P., McEwan A.G. Thioredoxin reductase is essential for protection of Neisseria gonorrhoeae against killing by nitric oxide and for bacterial growth during interaction with cervical epithelial cells // J. Infect. Dis. 2009. V. 199. P. 227–235.
Que Y.A., Hazan R., Strobel B., Maura D., He J., Kesarwani M., Panopoulos P., Tsurumi A., Giddey M., Wilhelmy J., Mindrinos M.N., Rahme L.G. A quorum sensing small volatile molecule promotes antibiotic tolerance in bacteria // PLoS One. 2013. V. 8. e80140. https://doi.org/10.1371/journal.pone.0080140
Rajer F.U., Wu H., Xie Y., Xie S., Raza W., Tahir H.A.S., Gao X. Volatile organic compounds produced by a soil-isolate, Bacillus subtilis FA26 induce adverse ultra-structural changes to the cells of Clavibacter michiganensis ssp. sepedonicus, the causal agent of bacterial ring rot of potato // Microbiology (SGM). 2017. V. 163. P. 523–530.
Rajini K.S., Sasikala Ch., Ramana Ch.V. Reductive degradation of pyrazine-2-carboxylate by a newly isolated Stenotrophomonas sp. HCU1 // Biodegradation. 2010. V. 21. P. 801‒813.
Rath M., Mitchell T.R., Gold S.E. Volatiles produced by Bacillus mojavensis RRC101 act as plant growth modulators and are strongly culture-dependent // Microbiol. Res. 2018. V. 208. P. 76‒84.
Ratiu I.A., Ligor T., Bocos-Bintintan V., Al-Suod H., Kowalkowski T., Rafińska K., Buszewski B. The effect of growth medium on an Escherichia coli pathway mirrored into GC/MS profiles // J. Breath. Res. 2017. V. 11. P. 036012. https://doi.org/10.1088/1752-7163/aa7ba2
Raza W., Ling N., Liu D., Wei Z., Huang Q., Shen Q. Volatile organic compounds produced by Pseudomonas fluorescens WR-1 restrict the growth and virulence traits of Ralstonia solanacearum // Microbiol. Res. 2016a. V. 192. P. 103–113.
Raza W., Ling N., Yang L., Huang Q., Shen Q. Response of tomato wilt pathogen Ralstonia solanacearum to the volatile organic compounds produced by a biocontrol strain Bacillus amyloliquefaciens SQR-9 // Sci. Rep. 2016b. V. 6. P. 24856. https://doi.org/10.1038/srep24856
Raza W., Wang J., Wu Y., Ling N., Wei Z., Huang Q., Shen Q. Effects of volatile organic compounds produced by Bacillus amyloliquefaciens on the growth and virulence traits of tomato bacterial wilt pathogen Ralstonia solanacearum // A-ppl. Microbiol. Biotechnol. 2016c. V. 100. P. 7639–7650.
Rui Z., Li X., Zhu X., Liu J., Domigan B., Barr I., Cate J.H., Zhang W. Microbial biosynthesis of medium-chain 1‑alkenes by a nonheme iron oxidase // Proc. Natl. Acad. Sci. USA. 2014. V. 111. P. 18237‒18242.
Ryu C.M., Farag M.A., Hu C.H., Reddy M.S., Kloepper J.W., Pare P.W. Bacterial volatiles induce systemic resistance in Arabidopsis // Plant Physiol. 2004. V. 134. P. 1017–1026.
Ryu C.M., Farag M.A., Hu C.H., Reddy M.S., Wei H.X., Paré P.W., Kloepper J.W. Bacterial volatiles promote growth in Arabidopsis // Proc. Natl. Acad. Sci. USA. 2003. V. 100. P. 4927‒4932.
Sadiq H., Jamil N. Antagonistic behaviour of organic compounds from Bacillus species and Brevundimonas specie // Pak. J. Pharm. Sci. 2018. V. 31. P. 919‒926.
Sánchez-López Á.M., Bahaji A., De Diego N., Baslam M., Li J., Muñoz F.J., Almagro G., García-Gómez P., Ameztoy K., Ricarte-Bermejo A.Novák O., Humplík J.F., Spíchal L., Doležal K., Ciordia S., Mena M.C., Navajas R., Baroja-Fernández E., Pozueta-Romero J. Arabidopsis responds to Alternaria alternata volatiles by triggering plastid phosphoglucose isomerase-independent mechanisms // Plant. Physiol. 2016a. V. 172. P. 1989‒2001.
Sánchez-López Á.M., Baslam M., De Diego N., Muñoz F.J., Bahaji A., Almagro G., Ricarte-Bermejo A., García-Gómez P., Li J., Humplík J.F., Novák O., Spíchal L., Doležal K., Baroj-a-Fernández E., Pozueta-Romero J. Volatile compounds emitted by diverse phytopathogenic microorganisms promote plant growth and flowering through cytokinin action // Plant Cell Environ. 2016b. V. 39. P. 2592‒2608.
Santoro M.V., Zygadlo J., Giordano W., Banchio E. Volatile organic compounds from rhizobacteria increase biosynthesis of essential oils and growth parameters in peppermint (Mentha piperita) // Plant Physiol. Biochem. 2011. V. 49. P. 1177‒1182.
Schenkel D., Lemfack M.C., Piechulla B., Splivallo R. A meta-analysis approach for assessing the diversity and specificity of belowground root and microbial volatiles // Front. Plant. Sci. 2015. V. 6. P. 707. https://doi.org/10.3389/fpls.2015.00707
Schmidt R., Cordovez V., de Boer W., Raaijmakers J., Garbeva P. Volatile affairs in microbial interactions // ISME J. 2015. V. 9. P. 2329‒2335.
Schmidt R., Etalo D.W., de Jager V., Gerards S., Zweers H., de Boer W., Garbeva P. Microbial small talk: volatiles in fungal-bacterial interactions // Front. Microbiol. 2016. V. 6. P. 1495. https://doi.org/10.3389/fmicb.2015.01495
Schöller C.E., Gürtler H., Pedersen R., Molin S., Wilkins K. Volatile metabolites from actinomycetes // J. Agric. Food Chem. 2002. V. 50. P. 2615‒2621.
Schulz S., Dickschat J.S. Bacterial volatiles: the smell of small organisms // Nat. Prod. Rep. 2007. V. 24. P. 814‒842.
Schulz-Bohm K., Gerards S., Hundscheid M., Melenhorst J., de Boer W., Garbeva P. Calling from distance: attraction of soil bacteria by plant root volatiles // ISME J. 2018. V. 12. P. 1252‒1262.
Schulz-Bohm K., Martín-Sánchez L., Garbeva P. Microbial volatiles: small molecules with an important role in intra- and inter-kingdom interactions // Front. Microbiol. 2017. V. 8. P. 2484. https://doi.org/10.3389/fmicb.2017.02484
Schulz-Bohm K., Zweers H., de Boer W., Garbeva P. A fragrant neighborhood: volatile mediated bacterial interactions in soil // Front. Microbiol. 2015. V. 6. P. 1212. https://doi.org/0.3389/fmicb.2015.01212
Shatalin K., Shatalina E., Mironov A., Nudler E. H2S: a universal defense against antibiotics in bacteria // Science. 2011. V. 334. № 6058. P. 986‒990.
Song C., Schmidt R., de Jager V., Krzyzanowska D., Jongedijk E., Cankar K., Beekwilder J., van Veen A., de Boer W., van Veen J.A., Garbeva P. Exploring the genomic traits of fungus-feeding bacterial genus Collimonas // BMC Genomics. 2015. V. 16. P. 1103. https://doi.org/10.1186/s12864-015-2289-3
Stamm I., Lottspeich F., Plaga W. The pyruvate kinase of Stigmatella aurantiaca is an indole binding protein and essential for development // Mol. Microbiol. 2005. V. 56. P. 1386‒1395.
Tahir H.A., Gu Q., Wu H., Niu Y., Huo R., Gao X. Bacillus volatiles adversely affect the physiology and ultrastructure of Ralstonia solanacearum and induce systemic resistance in tobacco against bacterial wilt // Sci. Rep. 2017a. V. 7. P. 40481. https://doi.org/10.1038/srep40481
Tahir H.A., Gu Q., Wu H., Raza W., Hanif A., Wu L., Colman M.V., Gao X. Plant growth promotion by volatile organic compounds produced by Bacillus subtilis SYST2 // Front. Microbiol. 2017b. V. 8. P. 171. https://doi.org/10.3389/fmicb.2017.00171
Tellez M.R., Schrader K.K., Kobaisy M. Volatile components of the cyanobacterium Oscillatoria perornata (Skuja) // J. Agric. Food Chem. 2001. V. 49. P. 5989‒5992.
Throup J., Winson M.A., Bainton N.J., Bycroft B.W., Williams P., Stewart G.S.A.B. Signaling in bacteria beyond luminescence // in Bioluminescence and Chemiluminescence: Fundamental and Applied Aspects, 1995, (Campbell A., Kricka L., and Stanley P., eds.) pp. 89−92, Wiley, Chichester.
Timm C.M., Lloyd E.P., Egan A., Mariner R., Karig D. Direct growth of bacteria in headspace vials allows for screening of volatiles by gas chromatography mass spectrometry // Front. Microbiol. 2018. V. 9. P. 491. https://doi.org/10.3389/ fmicb.2018.00491
Tyc O., de Jager V.C.L., van den Berg M., Gerards S., Janssens T.K.S., Zaagman N., Kai M., Svatos A., Zweers H., Hordijk C., Besselink H., de Boer W., Garbeva P. Exploring bacterial interspecific interactions for discovery of novel antimicrobial compounds // Microb. Biotechnol. 2017a. V. 10. P. 910–925.
Tyc O., Song C.X., Dickschat J.S., Vos M., Garbeva P. The ecological role of volatile and soluble secondary metabolites produced by soil bacteria // Trends Microbiol. 2017b. V. 25. P. 280–292.
Tyc O., Wolf A.B., Garbeva P. The effect of phylogenetically different bacteria on the fitness of Pseudomonas fluorescens in sand microcosms // PLoS One. 2015. V. 10. e0119838. https://doi.org/10.1371/journal.pone.0119838
Van Agtmaal M., Van Os G.J., Hol W.H., Hundscheid M.P., Runia W.T., Hordijk C.A., de Boer W. Legacy effects of anaerobic soil disinfestation on soil bacterial community composition and production of pathogen-suppressing volatiles // Front. Microbiol. 2015. V. 6. P. 701. https://doi.org/10.3389/ fmicb.2015.00701
Van Dam N.M., Weinhold A., Garbeva P. Calling in the dark: the role of volatiles for communication in the rhizosphere // Deciphering Chemical Language of Plant Communication / Eds. Blande J.D., Glinwood R. Cham: Springer International Publishing, 2016. P. 175–210.
Vega N.M., Allison K.R., Khalil A.S., Collins J.J. Signaling-mediated bacterial persister formation // Nat. Chem. Biol. 2012. V. 8. P. 431‒433.
Vega N.M., Allison K.R., Samuels A.N., Klempner M.S., Collins J.J. Salmonella typhimurium intercepts Escherichia coli signaling to enhance antibiotic tolerance // Proc. Natl. Acad. Sci. USA. 2013. V. 110. P. 14420‒14425.
Venkataraman A., Rosenbaum M.A., Werner J.J., Winans S.C., Angenent L.T. Metabolite transfer with the fermentation product 2,3-butanediol enhances virulence by Pseudomonas aeruginosa // ISME J. 2014. V. 8. P. 1210–1220.
Volatiles and Food Security. Role of Volatiles in Agro-Ecosystems // Eds. Choudhary D.K., Sharma A.K., Agarwal P., Varma A., Tuteja N. Singapore: Springer, 2017. P. 373. https://doi.org/10.1007/978-981-10-5553-9
Wei H.L., Zhang L.Q. Quorum-sensing system influences root colonization and biological control ability in Pseudomonas fluorescens 2P24 // Antonie Van Leeuwenhoek. 2006. V. 89. P. 267‒280.
Weise T., Kai M., Gummesson A., Troeger A., von Reuß S., Piepenborn S., Kosterka F., Sklorz M., Zimmermann R., Francke W., Piechulla B. Volatile organic compounds produced by the phytopathogenic bacterium Xanthomonas campestris pv. vesicatoria 85-10 // Beilstein J. Org. Chem. 2012. V. 8. P. 579‒596.
Wenke K., Wanke D., Kilian J., Berendzen K., Harter K., Piechulla, B. Volatiles of two growth-inhibiting rhizobacteria commonly engage AtWRKY18 function // Plant J. 2012. V. 70. P. 445–459.
Westhoff S., van Wezel G.P., Rozen D.E. Distance-dependent danger responses in bacteria // Curr. Opin. Microbiol. 2017. V. 36. P. 95–101.
Wheatley R.E. The consequences of volatile organic compound mediated bacterial and fungal interactions // Antoni-e Van Leeuwenhoek. 2002. V. 81. № 1‒4. P. 357‒364.
Whiteson K.L., Meinardi S., Lim Y.W., Schmieder R., Maughan H., Quinn R., Blake D.R., Conrad D., Rohwer F. Breath gas metabolites and bacterial metagenomes from cystic fibrosis airways indicate active pH neutral 2,3-butanedione fermentation // ISME J. 2014. V. 8. P. 1247‒1258.
Wintermans P.C.A., Bakker P.A.H.M., Pieterse C.M.J. Natural genetic variation in Arabidopsis for responsiveness to plant growth-promoting rhizobacteria // Plant Mol. Biol. 2016. V. 90. P. 623–634.
Wrigley D.M. Inhibition of Clostridium perfringens sporulation by Bacteroides fragilis and short-chain fatty acids // Anaerobe. 2004. V. 10. P. 295‒300.
Xie S., Zang H., Wu H., Uddin Rajer F.U., Gao X. Antibacterial effects of volatiles produced by Bacillus strain D13 against Xanthomonas oryzae pv. oryzae // Mol. Plant Pathol. 2016. V. 19. P. 49‒58.
Yung P.Y., Grasso L.L., Mohidin A.F., Acerbi E., Hinks J., Seviour T., Marsili E., Lauro F.M. Global transcriptomic responses of Escherichia coli K-12 to volatile organic compounds // Sci. Rep. 2016. V. 6. P. 19899. https://doi.org/10.1038/srep19899
Zhu Y., Jameson E., Crosatti M., Schäfer H., Rajakumar K., Bugg T.D., Chen Y. Carnitine metabolism to trimethylamine by an unusual Rieske-type oxygenase from human microbiota // Proc. Natl. Acad. Sci. USA. 2014. V. 111. P. 4268‒4273.
Дополнительные материалы отсутствуют.


