Микробиология, 2019, T. 88, № 4, стр. 479-489
Микробиомы целинных почв тропических лесов южного Вьетнама
Т. И. Чернов a, b, *, А. Д. Железова a, А. К. Тхакахова a, Н. А. Бгажба a, А. О. Зверев c
a ФГБНУ Почвенный институт им. В.В. Докучаева
119017 Москва, Россия
b Российско-Вьетнамский Тропический научно-исследовательский и технологический центр
Хошимин, Вьетнам
c Всероссийский научно-исследовательский институт сельскохозяйственной микробиологии
196608 Санкт-Петербург, Россия
* E-mail: chern-off@mail.ru
Поступила в редакцию 23.12.2018
После доработки 18.02.2019
Принята к публикации 20.03.2019
Аннотация
Оценено число копий рибосомальных генов бактерий, архей и грибов и таксономическая структура прокариотных сообществ в целинных тропических почвах под слабонарушенными муссонными лесами на территории заповедника Кат Тьен (Южный Вьетнам), а также их связь с основными физико-химическими свойствами данных почв. Исследовали образцы генетических горизонтов профилей бурой тропической и темноцветной почв на вулканических отложениях, красно-желтой тропической почвы на метаморфических сланцах и аллювиальной супесчаной почвы. Число рибосомальных генов микроорганизмов в целинных почвах тропических лесов южного Вьетнама достигало порядка 1011–1012 копий гена на 1 г и сравнимо с наиболее богатыми почвами умеренной зоны. Наибольшая численность микробных генов сосредоточена в поверхностных (верхние 4–10 см) горизонтах. Вулканические почвы обладают более высокой численностью микробных рибосомальных генов, чем красно-желтые тропические и аллювиальные. Доминирующими филумами прокариот являлись Proteobacteria и Acidobacteria (группы Acidobacteriales (подгруппа 1), подгруппа 2 и Solibacterales). Доля Acidobacteria в изученных почвах кореллировала с pH и была максимальна в наиболее кислой красно-желтой тропической почве. Доля филума Verrucomicrobia максимальна в поверхностных слоях почвы и уменьшалась с глубиной. Доля Chloroflexi увеличивалась с глубиной. Выявлены представители недавно описанного бактериального филума Rokubacteria. Разница в почвообразующих породах – вулканических отложениях, метаморфических сланцах и аллювии – определяла различия химических свойств данных почв и особенности таксономической структуры их прокариотных сообществ. Основным фактором, определяющим как число микробных рибосомальных генов, так и таксономическую структуру прокариотных сообществ целинных лесных тропических почв, по всей видимости, является содержание органического углерода.
Тропические экосистемы отличаются высоким разнообразием флоры и фауны, высокой биологической продуктивностью и интенсивным круговоротом веществ. Однако почвенное биоразнообразие не так велико, как надземное: согласно некоторым оценкам, разнообразие как почвенной фауны (Bardgett, Putten, 2014), так и прокариотных сообществ (Miyashita et al., 2013) в тропиках не выше, чем в почвах умеренного климата. Тропические почвы при сведении естественных лесов часто склонны к деградации и потере плодородия. На нарушенных территориях, даже если они не превращаются в агроценозы, возникают отличающиеся по составу вторичные леса, травянистые сообщества и пустоши. При сведении тропических лесов происходит коренная перестройка таксономической структуры и разнообразия почвенных микробных сообществ (Navarrete et al., 2015; Schneider et al., 2015; Kroeger et al., 2018). Учитывая интенсивное сокращение площади лесов в тропических регионах и вовлечение тропических почв в сельскохозяйственное использование, остается все меньше времени для исследования микробного разнообразия целинных тропических почв под нативной растительностью.
Площадкой настоящего исследования являлся национальный парк Донг Най, сектор Кат Тьен (Южный Вьетнам), на территории которого распространены относительно слабо нарушенные человеком муссонные леса (Blanc et al., 2000). Для заповедника Кат Тьен показано высокое разнообразие и численность почвенной мезофауны (Аничкин, 2011), А.В. Александровой и соавт. показано высокое разнообразие культивируемых почвенных грибов с абсолютным доминированием анаморф аскомицетов, выявлены существенные различия в видовом составе почвенных грибов аллювиальных и ферраллитных почв, а также почв под равнинными и горными лесами (Александрова и соавт., 2011; Калашникова, Александрова, 2015; Калашникова и соавт., 2016). Разнообразие культивируемых актиномицетов в почвах и растительном опаде, оцененное в пяти различных локусах на территории Вьетнама, практически не различается (Hop et al., 2011). Методом прямого учета (люминесцентной микроскопии) в целинных почвах Кат Тьена показана достаточно высокая (до 8 × 109 клеток/г) численность бактерий, но невысокая (200–600 м/г) по сравнению с лесными почвами умеренного климата длина мицелия почвенных грибов (Лысак и соавт., 2017). Оценка таксономической структуры и разнообразия почвенных прокариотных сообществ (в т.ч. молекулярно-биологическими методами) для данной территории ранее не проводилась.
Почвенный покров заповедника Кат Тьен представлен несколькими основными типами почв, расположение которых зависит прежде всего от почвообразующих пород и положения в рельефе: на грядах, сложенных метаморфическими сланцами, локализованы красно-желтые тропические почвы (Regosol); на вулканических отложениях – бурые тропические (Cambisol) и темногумусовые (Umbrisol); на речном аллювии – суглинистые или супесчаные аллювиальные почвы (Fluvisol) (Хохлова и соавт., 2017). Эти четыре типа почв были взяты в качестве объектов исследования в данной работе.
Целью работы являлась оценка численности архей, бактерий и грибов (на основе определения числа копий их рибосомальных генов), а также таксономической структуры и разнообразия прокариотных сообществ в профилях основных типов целинных почв муссонных лесов заповедника Кат Тьен.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования являлись образцы почв из опорных почвенных разрезов на территории заповедника Кат Тьен, описанных в статье Хохловой и соавт. (2017):
1) темноцветная глинистая на вулканических отложениях или Skeletic Greyzemic Umbrisol (Clayic), далее – “темноцветная” (11°25′40″ N, 107°25′32″ E);
2) бурая тропическая маломощная глинистая на вулканических отложениях или Distric Skeletic Rhodic Cambisol (Clayic), далее – “бурая тропическая” (11°25′43″ N, 107°25′39″ E);
3) красно-желтая тропическая маломощная слаборазвитая глинистая на метаморфических сланцах или Dystric Regosol (Clayic), далее – “красно-желтая тропическая” (11°26′56″ N, 107°26′29″ E);
4) аллювиальная супесчаная почва или Dystric Fluvisol (Arenic, Drainic), далее – “аллювиальная” (11°26′48″ N, 107°26′26″ E).
Все почвы вскрыты под пологом слабонарушенного тропического муссонного леса. Темноцветная и бурая тропическая почвы локализованы на водораздельном пространстве, сложенном вулканическими отложениями – базальтами и туфами; красно-желтая тропическая почва локализована на вершине гряды, сложенной метаморфическими глинистыми сланцами; аллювиальная почва – на прирусловом валу реки Донг Най. Физические и химические свойства почв представлены в табл. 1.
Таблица 1.
Физико-химические свойства исследованных почв (согласно Хохловой и соавт., 2017): содержание углерода и азота, pH водной и солевой вытяжки, содержание физической глины и ила
| № | Название почвы | Горизонт | Глубина, см | С, % | N, % | pH (H2O) | pH (KCl) | Физ. глина, % | Ил, % |
|---|---|---|---|---|---|---|---|---|---|
| I | Темноцветная | A1 | 0–6 (10) | 3.18 | 0.45 | 4.9 | 4.2 | 53.7 | 27.0 |
| AB | 6 (10)–20 (25) | 1.54 | 0.25 | 4.7 | 3.8 | 78.5 | 55.0 | ||
| BC (C) | 55 (60)–115 | 1.01 | 0.21 | 4.9 | 3.9 | 78.0 | 58.0 | ||
| II | Бурая тропическая | A1 | 0–6 (10) | 3.11 | 0.48 | 5.4 | 4.1 | 52.8 | 19.4 |
| AB | 6 (10)–25 (35) | 1.07 | 0.13 | 5.5 | 4.4 | 53.1 | 21.5 | ||
| BmC | 4 (55)–85 (105) | 0.61 | 0.22 | 5.6 | 4.7 | 72.9 | 57.9 | ||
| III | Красно-желтая тропическая | A1 | 0–4 (6) | 1.90 | 0.32 | 3.8 | 3.2 | 68.9 | 25.3 |
| A1C | 4 (6)–50 (60) | 0.60 | 0.19 | 3.7 | 3.1 | 80.5 | 29.1 | ||
| C1 | 50 (60)–80 | 0.43 | 0.21 | 4.6 | 3.7 | 82.3 | 25.6 | ||
| IV | Аллювиальная | A1 | 0–6 (8) | 0.59 | 0.16 | 5.0 | 4.3 | 14.0 | 5.0 |
| AB | 6 (8)–15 | 0.27 | 0.09 | 5.2 | 4.6 | 10.0 | 4.9 | ||
| C2 | 45 (50)–75 | 0.22 | 0.05 | 5.4 | 4.3 | 14.6 | 7.1 |
Пробоотбор и выделение ДНК. Образцы почвы для микробиологических анализов отбирали в ноябре 2015 г. Отбор образцов производили в трехкратной повторности из стенки почвенного разреза, из поверхностного (A), подповерхностного (AB или AC) и минерального (BС или C) горизонтов почвенных профилей (табл. 1). До анализа образцы хранили при температуре –70°С.
Выделение тотальной ДНК проводили из навески почвы массой 0.5 г при помощи набора реагентов FastDNA SPIN Kit for soil (“MP Biomedicals”) по методике производителя с модификацией на этапе гомогенизации. Гомогенизацию образца проводили на гомогенизаторе Precellus 24 в течение 30 с при 6500 об./мин. Качество выделения ДНК проверяли с помощью электрофореза в агарозном геле (1% раствор в TAE) с последующей визуализацией под ультрафиолетом.
Оценка числа рибосомальных генов микроорганизмов. Оценку численности бактерий, архей и грибов в почве осуществляли с помощью количественной полимеразной цепной реакции (ПЦР) их рибосомальных генов в амплификаторе iCycler (Bio-Rad). Для учета бактерий использовали праймеры на бактериальный ген 16S рРНК (Eub338 и Eub518 (Fierer et al., 2005)), для учета архей – на архейный ген 16S рРНК (915f и 1059r (Yu et al., 2005)), для учета грибов – на регион ITS1 (ITS1f и 5.8s (Fierer et al., 2005)). Реакцию проводили в амплификаторе Real-Time CFX96 Touch (“Bio-Rad”) с измерением интенсивности флуоресценции реакционной смеси на каждом цикле. Реакционную смесь готовили из препарата BioMaster HS-qPCR SYBR Blue (“Biolabmix”, Россия). В качестве количественных стандартов генов 16S рРНК для бактерий использовали растворы клонированных фрагментов рибосомального оперона Escherichia coli, для архей – штамма FG-07 Halobacterium salinarum, для грибов – штамма дрожжей Saccharomyces cerevisiae Meyen 1B-D1606. Начальное число копий генов рассчитывали с помощью программного обеспечения CFX Manager. Число копий генов в препаратах ДНК пересчитывали на содержание в 1 г почвы полевой влажности с учетом разведений и массы навески.
Подготовка библиотек и секвенирование ампликонов генов 16S рРНК. Для приготовления библиотек гена 16S рРНК в каждой пробе ДНК проводили амплификацию с универсальными праймерами на вариабельный участок гена 16S рРНК V3–V4: F515 (GTGCCAGCMGCCGCGGTAA) и R806 (GGACTACVSGGGTATCTAAT) (Bates et al., 2011) с добавлением служебных последовательностей по технологии “Illumina”, содержащих линкеры и баркоды. ПЦР проводили в 15 мкл реакционной смеси, содержащей 0.5–1 единицу активности полимеразы Phusion Hot Start II High-Fidelity polymerase и 1× Phusion buffer (“Thermo Fisher Scientific”), по 5 пкМ прямого и обратного праймеров, 10 нг ДНК-матрицы и 2 нМ каждого dNTP (“Life Technologies”). Смесь денатурировали при 94°С в течение 1 мин, после чего следовало 35 циклов: 94°С – 30 с, 50°С – 30 с, 72°С – 30 с. Финальную элонгацию проводили при 72°С в течение 3 мин. ПЦР-продукты очищали по рекомендованной “Illumina” методике с использованием AM Pure XP (“Beckman Coulter”). Дальнейшую подготовку библиотек проводили в соответствии с инструкцией производителя MiSeq Reagent Kit Preparation Guide (“Illumina”). Библиотеки секвенировали в соответствии с инструкцией изготовителя на приборе Illumina MiSeq c использованием набора реактивов MiSeq Reagent Kit v3 (600 cycle) с двусторонним чтением.
Статистическая и биоинформатическая обработка данных. Обработку данных секвенирования осуществляли при помощи программного пакета QIIME (Caporaso et al., 2010). Тримминг (фильтрацию последовательностей по параметрам качества прочтения) проводили при помощи программы Trimmomatic (Bolger et al., 2014), прямые и обратные чтения объединяли при помощи алгоритма fastq-join (Aronesty, 2013). Для поиска и фильтрации химерных последовательностей использовали алгоритм vsearch (Rognes et al., 2016). Объединение последовательностей в операционные таксономические единицы (ОТЕ) на основе критерия 97% сходства нуклеотидного состава проводили с использованием базы данных SILVA версии № 132 от 2018 года (https://www.arb-silva.de/download/archive/qiime). Удаляли синглтоны (ОТЕ, содержащие только одну нуклеотидную последовательность), ОТЕ хлоропластов и митохондрий. После обработки данных получено от 8606 до 23 265, в среднем – 15 186 последовательностей гена 16S рРНК на каждый почвенный образец. При оценке таксономической структуры микробиомов использовали средние значения по трем повторностям каждого образца почвы.
Для оценки общего разнообразия (альфа-разнообразия) микробных сообществ рассчитывали следующие показатели: количество обнаруженных ОТЕ, индекс Chao1 (оценка реального числа ОТЕ в микробиоме) (Collwell, Coddington, 1994) и индекс Шеннона. Для оценки сходства микробиомов друг с другом (бета-разнообразия) использовали метрику weighted UniFrac (Lozupone, 2011). Визуализацию результатов анализа бета-разнообразия проводили при помощи неметрического многомерного шкалирования (NMDS) в двумерном пространстве. При оценке альфа- и бета-разнообразия проводили нормализацию выборок по образцу с наименьшей глубиной секвенирования (8606 последовательностей).
Связь различных микробиологических показателей (число рибосомальных генов микроорганизмов, альфа-разнообразия, доли отдельных филумов прокариот) с физико-химическими свойствами почвы оценивали при помощи коэффициента ранговой корреляции Спирмена с оценкой достоверности при уровне значимости p = 0.05 в программе STATISTICA. При расчете корреляций с долями филумов прокариот вычисляли медианную долю по трем повторностям каждого образца.
Для оценки корреляции филогенетической структуры сообщества (по методу weighted UniFrac) со свойствами почвы (глубиной, pH водной и солевой вытяжки, содержанием углерода и азота, физической глины и ила) использовали тест Мантеля, рассчитанный в программном пакете QIIME при количестве перестановок (permutations) равный 999.
РЕЗУЛЬТАТЫ
Количество рибосомальных генов микроорганизмов. Во всех исследованных профилях почв число копий рибосомальных генов бактерий, архей и грибов убывало вниз по профилю (табл. 2).
Таблица 2.
Число копий рибосомальных генов микроорганизмов (млрд на 1 г почвы) и показатели альфа-разнообразия прокариотных сообществ изученных почв: индекс Шеннона, количество обнаруженных ОТЕ и индекс Chao1 (диапазон значений по трем повторностям)
| Почва | Глубина, см | 16S рРНК гены бактерий, 109/г | 16S рРНК гены архей, 109/г | ITS гены грибов, 109/г | Разнообразие прокариот | ||
|---|---|---|---|---|---|---|---|
| индекс Шеннона | кол-во ОТЕ | индекс Chao1 | |||||
| I Темноцветная | 4 | 297–354 | 219–373 | 13–17 | 8.0–9.0 | 1272–1716 | 2053–2711 |
| 16 | 112–302 | 68–126 | 9–12 | 7.2–8.6 | 773–1430 | 1205–2184 | |
| 90 | 31–169 | 31–67 | 6–10 | 7.7–7.9 | 997–1170 | 1530–1927 | |
| II Бурая тропическая | 4 | 854–1347 | 231–375 | 11–17 | 7.8–8.2 | 1343–1430 | 2175–2407 |
| 19 | 259–869 | 98–134 | 14–17 | 8.0–8.2 | 1131–1253 | 1935–2167 | |
| 68 | 7–12 | 9–14 | 3–4 | 7.7–7.8 | 930–1006 | 1347–1413 | |
| III Красно-желтая тропическая | 3 | 197–218 | 96–195 | 18–21 | 8.3–8.5 | 1040–1144 | 1572–1687 |
| 30 | 22–80 | 30–66 | 6 | 7.4–8.0 | 676–1062 | 956–1627 | |
| 68 | 11–14 | 19–34 | 4–5 | 6.9–7.2 | 536–610 | 711–847 | |
| IV Аллювиальная | 4 | 136–418 | 104–131 | 18–21 | 8.7–9.0 | 1357–1515 | 2035–2353 |
| 11 | 94–252 | 58–76 | 11–13 | 8.1–8.7 | 1086–1356 | 1593–2026 | |
| 60 | 7–9 | 11–28 | 3–4 | 7.5–7.7 | 690–784 | 892–1130 | |
Наибольшим количеством генов бактерий (1.1 × 1012 копий гена 16S рРНК в 1 г почвы в верхнем горизонте) обладает бурая тропическая почва на базальтовых отложениях. Меньшим количеством генов (3.3 × 1011/г в A горизонте) характеризуется темноцветная почва на базальтах и туфах. Еще более низким (2.6 × 1011/г в A горизонте) – аллювиальная почва. Красно-желтая тропическая почва на метаморфических сланцах характеризуется наиболее низким содержанием копий бактериальных генов 16S рРНК (2 × 1011/г в A горизонте).
В верхних горизонтах всех почв содержание рибосомальных генов архей достигает порядка 1011/г. При этом в вулканических почвах содержание генов архей в 2–3 раза выше, чем в красно желтой и аллювиальной.
Количество рибосомальных генов грибов в верхних горизонтах достигает 1010/г и слабо различается в исследованных почвах (табл. 2).
Согласно значениям коэффициента Спирмена, содержание генов микроорганизмов положительно коррелирует с содержанием углерода и отрицательно – с глубиной (табл. 3).
Таблица 3.
Значения коэффициентов ранговой корреляции Спирмена для свойств почвы (глубины, pH водной и солевой вытяжки, содержания углерода и азота, физической глины и ила) и показателей микробиома (числа копий рибосомальных генов бактерий, архей и грибов, доли отдельных филумов прокариот, показателей альфа-разнообразия). Жирным шрифтом показанa статистически значимая корреляция (p < 0.05)
| Показатель | Глубина | pH (H2O) | pH (KCl) | C | N | Физ. глина | Ил |
|---|---|---|---|---|---|---|---|
| Число копий 16S рРНК генов бактерий | –0.73 | 0.08 | 0.01 | 0.71 | 0.42 | –0.35 | –0.28 |
| Число копий 16S рРНК генов архей | –0.85 | –0.13 | –0.14 | 0.73 | 0.52 | 0.34 | –0.27 |
| Число копий ITS генов грибов | –0.84 | –0.12 | –0.02 | 0.53 | 0.29 | –0.41 | –0.36 |
| Thaumarchaeota | 0.00 | 0.59 | 0.45 | –0.04 | –0.13 | –0.41 | –0.36 |
| Acidobacteria | 0.31 | –0.61 | –0.51 | –0.63 | –0.46 | 0.37 | –0.05 |
| Actinobacteria | –0.22 | 0.64 | 0.50 | 0.63 | 0.47 | –0.23 | 0.17 |
| Bacteroidetes | –0.83 | –0.01 | 0.02 | 0.58 | 0.47 | –0.50 | –0.32 |
| Chloroflexi | 0.83 | 0.22 | 0.14 | –0.08 | –0.12 | 0.49 | 0.70 |
| Firmicutes | –0.20 | 0.71 | 0.71 | 0.13 | –0.16 | –0.68 | –0.36 |
| Gemmatimonadetes | 0.63 | 0.59 | 0.53 | –0.23 | –0.42 | –0.08 | 0.18 |
| Nitrospirae | 0.94 | 0.16 | 0.09 | –0.50 | –0.39 | 0.39 | 0.45 |
| Planctomycetes | –0.83 | –0.39 | –0.20 | 0.13 | 0.11 | –0.35 | –0.57 |
| Proteobacteria | –0.88 | –0.02 | 0.05 | 0.59 | 0.38 | –0.44 | –0.32 |
| Rokubacteria | 0.85 | 0.29 | 0.13 | –0.43 | –0.27 | 0.42 | 0.34 |
| Verrucomicrobia | –0.79 | 0.23 | 0.21 | 0.67 | 0.43 | –0.54 | –0.33 |
| Индекс Шеннона | –0.79 | 0.10 | 0.29 | 0.40 | 0.15 | –0.62 | –0.41 |
| Количество ОТЕ | –0.73 | 0.22 | 0.31 | 0.52 | 0.28 | –0.62 | –0.36 |
| Индекс Chao1 | –0.64 | 0.28 | 0.31 | 0.59 | 0.32 | –0.56 | –0.28 |
Таксономическая структура и разнообразие микробиомов. Полученные нуклеотидные последовательности генов 16S рРНК депонированы в проект BioProject базы данных NCBI и доступны по идентификационному номеру PRJNA518023 (https://www.ncbi.nlm.nih.gov/bioproject/PRJNA518023). После обработки данных секвенирования и удаления синглтонов в сумме во всех образцах выявлено 6070 операционных таксономических единиц (ОТЕ). Видовое богатство микробиомов в образцах исследованных почв для выборки в 8850 нуклеотидных последовательностей оценивается в 536–1716 обнаруженных ОТЕ, оценка реального количества ОТЕ по индексу Chao1 составляет от 762 до 2711 (табл. 2). Наименьшее разнообразие прокариот выявлено в горизонтах красно-желтой тропической почвы, наибольшее – в темноцветной и бурой тропической почвах на вулканических отложениях. Во всех почвах наибольшее разнообразие характерно для поверхностных горизонтов. Все показатели разнообразия прокариот (количество ОТЕ, индекс Шеннона, индекс Chao1) отрицательно коррелируют с глубиной (табл. 3).
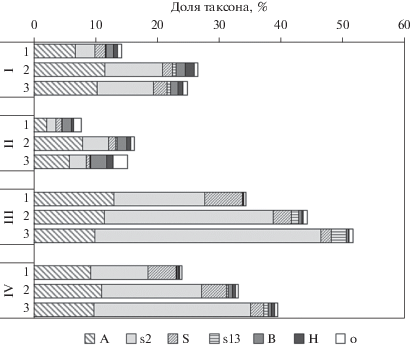
На основе таксономической базы данных SILVA в исследованных микробиомах выявлены представители 38 различных филумов прокариот. Однако большая часть филумов представлена не во всех образцах и имеет низкое относительное обилие (доли процента от общего числа последовательностей гена 16S рРНК). Долю более 1% имеют бактериальные филумы Acidobacteria, Proteobacteria, Verrucomicrobia, Chloroflexi, Actinobacteria, Firmicutes, Planctomycetes, Rokubacteria, Nitrospirae, Gemmatimonadetes, Bacteroidetes, а также филум архей Thaumarchaeota (рис. 1). Acidobacteria и Proteobacteria доминировали во всех исследуемых микробиомах: в сумме к ним относятся от 33 до 65% нуклеотидных последовательностей. Доля Acidobacteria в нижних горизонтах выше, чем в поверхностных, и достаточно сильно различается в почвах разных типов: она минимальна в бурой тропической (8–16%) и максимальна в красно-желтой почве (34–52%). Изученные почвы значительно отличались по таксономическому составу Acidobacteria: в красно-желтой и аллювиальной почве наиболее обильными являлись представители не имеющей культивируемых представителей подгруппы 2 (до 36%), Acidobacteriales (до 13%) и Solibacterales (до 6%) (рис. 2). В бурой тропической и темноцветной почвах преобладали Acidobacteriales, доля подгруппы 2 не так велика, и общее разнообразие ацидобактерий выше. Достаточно высокую долю (11–22%) в верхних горизонтах исследованных почв занимали бактерии филума Verrucomicrobia, представленные преимущественно порядками Chthoniobacterales и Pedosphaerales. С глубиной доля Verrucomicrobia снижалась, в нижних горизонтах она составляла лишь 2–7%. Доля Actinobacteria составляла от 3–6% (красно-желтая почва) до 12–15% (бурая тропическая почва). От 1 до 6% прокариотного сообщества представлено недавно описанным филумом Rokubacteria, их доля выше в нижних горизонтах всех почв (рис. 1).
Рис. 1.
Таксономическая структура микробиомов (на уровне филумов прокариот) в поверхностных (1), подповерхностных (2) и минеральных (3) горизонтах изученных почв: темноцветной (I), бурой тропической (II), красно-желтой тропической (III) и аллювиальной (IV) почв. Представлены филумы, имеющие долю выше 1%: Acidobacteria (A), Pro-teobacteria (Pr), Verrucomicrobia (V), Chloroflexi (C), Actinobacteria (Act), Firmicutes (F), Thaumarchaeota (T), Planctomycetes (Pl), Rokubacteria (R), Nitrospirae (N), Gemmatimonadetes (G), Bacteroidetes (B) и другие (o). Даны усредненные значения по трем повторностям образцов.

Рис. 2.
Таксономическая структура филума Acidobacteria в поверхностных (1), подповерхностных (2) и минеральных (3) горизонтах темноцветной (I), бурой тропической (II), красно-желтой тропической (III) и аллювиальной (IV) почв. Показана доля Acidobacteriales (A), подгруппы 2 (s2), Solibacterales (S), подгруппы 13 (s13), Blastocatellia (B), Holophagae (H) и других ацидобактерий (o).
Глубина является наиболее значимым фактором, определяющим долю прокариотных филумов в микробиоме (табл. 3). С увеличением глубины уменьшается доля филумов Bacteroidetes, Planctomycetes, Proteobacteria и Verrucomicrobia; увеличивается доля филумов Chloroflexi, Gemmatimonadetes, Nitrospirae и Rokubacteria. Также значимая корреляция доли некоторых филумов наблюдалась с содержанием углерода, pH, содержанием физической глины и ила (табл. 3).
По результатам анализа сходства филогенетической структуры прокариотных сообществ по методу weighted UniFrac сообщества двух вулканических почв формируют кластер, отдельный от микробиомов красно-желтой и аллювиальной почв (рис. 3). Микробиомы аллювиальной песчаной почвы характеризуются структурой, наиболее отличной от вулканических почв. В табл. 4 представлены результаты теста Мантеля – связь химических и физических свойств почвы с различиями структуры прокариотного сообщества, оцененными по методу weighted UniFrac. Структура почвенного микробиома прежде всего зависит от содержания углерода, другими значимыми (p < 0.05) факторами являются содержание азота и глубина.
Рис. 3.
Двумерные диаграммы сходства микробиомов поверхностных (1), подповерхностных (2) и минеральных (3) горизонтов темноцветной (I), бурой тропической (II), красно-желтой тропической (III) и аллювиальной (IV) почв. Диаграммы построены по методу NMDS на основе метрики сходства weighted UniFrac.
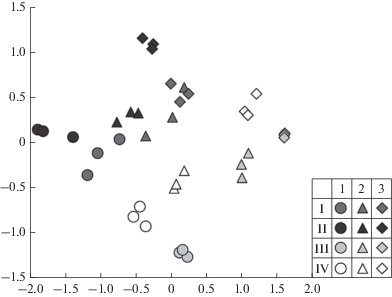
Таблица 4.
Коэффициент корреляции матриц попарных расстояний (R) и уровень значимости корреляции (p) различий структуры сообщества по методу weighted UniFrac и свойств почвы (глубины, pH водной и солевой вытяжки, содержания углерода и азота, физической глины и ила) по тесту Мантеля
| Свойства почвы | R | p |
|---|---|---|
| C | 0.39 | 0.006 |
| N | 0.33 | 0.021 |
| Глубина | 0.27 | 0.044 |
| pH (H2O) | 0.16 | 0.315 |
| pH (KCl) | 0.07 | 0.657 |
| Ил | –0.08 | 0.694 |
| Физ. глина | –0.03 | 0.967 |
ОБСУЖДЕНИЕ
Согласно оценке числа копий рибосомальных генов, тропические почвы под слабонарушенными муссонными лесами заповедника Кат Тьен характеризуются высокой численностью микроорганизмов, сравнимой с наиболее богатыми почвами умеренных широт, например, черноземами (Semenov et al., 2018). Однако наибольшее число рибосомальных генов микроорганизмов обнаруживается в поверхностных гумусированных горизонтах, которые в данных почвах составляют лишь 4–10 см. Примечательна высокая численность архей, число копий генов 16S рРНК которых достигало порядка 1011/г в верхних горизонтах всех почв. Число копий ITS генов грибов было не так велико, как 16S рРНК генов бактерий и архей, и слабо различалось в четырех типах почв. Ранее было показано, что длина грибного мицелия в почвах Кат Тьена в 2–3 раза ниже, чем в лесных почвах умеренного пояса (Лысак и соавт., 2017), что может быть связано с отсутствием на поверхности тропических почв лесной подстилки. В отличие от лесов умеренного пояса, в тропическом лесу древесный опад быстро перерабатывался фауной, в частности термитами, которые поглощали до 50% опада (Matsumoto, Abe, 1979; Brauman, 2000), таким образом, сапротрофные почвенные грибы получали меньше растительной биомассы, доступной для разложения. Вулканические почвы, более богатые органическим веществом и макроэлементами, с более высоким pH, характеризовались более высоким числом 16S рРНК генов бактерий и архей по сравнению с обедненными питательными веществами красно-желтой тропической и аллювиальной почвами. Состав древостоя слабо различался на исследованных площадках, а различия в химических свойствах данных почв, согласно Хохловой и соавт. (2017), в первую очередь определялись типом почвообразующих пород – вулканическими отложениями, аллювием или глинистыми сланцами. Таким образом, количество микроорганизмов в данных почвах, по всей видимости, определяется содержанием органического углерода, которое, в свою очередь, зависит от литологической основы и, возможно, водного режима.
Выявленный в данных почвах состав прокариотных филумов с доминированием Acidobacteria, Proteobacteria, Verrucomicrobia и Actinobacteria в верхних горизонтах, как правило, отмечался и в других исследованиях: при помощи секвенирования 16S рРНК гена показано доминирование в тропических почвах различных регионов филумов Acidobacteria и Proteobacteria, в отдельных работах также демонстрировалась высокая представленность Verrucomicrobia, Actinobacteria, Planctomycetes и Firmicutes (Miyashita et al., 2013; Navarrete et al., 2015; Schneider et al., 2015; Kroeger et al., 2018). Примечательна высокая (до 52%) доля Acidobacteria, как правило, характерная для кислых почв (Lauber et al., 2009; Jones et al., 2009). Преобладание Acidobacteria отличает кислые почвы влажного климата от аридных почв с нейтральной и щелочной реакцией среды, в которых доля Acidobacteria значительно ниже, а доля Actinobacteria – выше (Lauber et al., 2009; Chernov et al., 2018; Тихонович и соавт., 2018). Наибольшей представленностью среди ацидобактерий отличались группы Acidobacteriales (подгруппа 1), подгруппа 2 и Solibacterales. Подгруппа 1 представлена ацидофилами, в основном облигатными аэробами, способными к гидролитической активности по отношению к широкому спектру биополимеров (Dedysh, Sinninghe Damsté, 2018). Solibacterales – также ацидофильные и олиготрофные бактерии. Согласно метагеномным исследованиям почв Германии, Solibacterales и Acidobacteriales обладают большим набором генов, отвечающих за мобилизацию минерального фосфора (Bergkemper et al., 2016). Способность к мобилизации фосфора может давать этим бактериям преимущество в красно-желтой и аллювиальной почвах, где содержание подвижного фосфора очень мало (Хохлова и соавт., 2017). Высокое относительное обилие ацидобактерий подгруппы 2 обнаруживалось в почвах Бразилии под тропическими лесами (Navarrete et al., 2015) и саваннами (Catão et al., 2014). Была выявлена корреляция их доли с концентрацией Al3+, высокое содержание которого характерно для многих тропических почв (Kielak et al., 2016). В исследованных нами почвах подгруппа 2 доминировала среди ацидобактерий в бедных невулканических почвах – красно-желтой и аллювиальной. Вероятно, ацидобактерии подгруппы 2 можно считать характерными для бедных органическим веществом кислых тропических почв различного генезиса.
Доля филума Verrucomicrobia – распространенных почвенных бактерий с малоисследованной экологией – уменьшалась с глубиной. Низкое относительное обилие Verrucomicrobia в глубоких минеральных слоях почвы отмечалось и в других типах почв (Semenov et al., 2018; Чернов и соавт., 2018). При этом в некоторых исследованиях максимальная доля Verrucomicrobia отмечалась в подповерхностных горизонтах почвы, на глубине 10–50 см (Eilers et al., 2012; Zhang et al., 2017), на основе чего сделано предположение о том, что представители филума Verrucomicrobia являются олиготрофами, приспособленными к недостатку органического вещества. В исследованных тропических почвах максимума Verrucomicrobia в подповерхностных слоях не отмечалось, вероятно из-за малой глубины гумусированных горизонтов (4–10 см).
Заметными представителями прокариотных сообществ данных почв являлись Rokubacteria – группа малоисследованных бактерий, недавно выделенных в качестве отдельного филума (Becraft et al., 2017). Есть свидетельства о приуроченности Rokubacteria в Амазонии к почвам под дождевыми тропическими лесами (Kroeger et al., 2018). В этой работе использовалась таксономическая база данных SILVA 2018 года, в предыдущей версии за 2017 год Rokubacteria не выделены в качестве самостоятельного филума и не имеют референтных последовательностей. Таким образом, продолжающееся развитие систематики и неустойчивость таксономии прокариот ставит экспериментальные исследования в большую зависимость от используемой таксономической системы и затрудняет сравнение результатов работ в области метагеномики и метабаркодинга, использующих разные версии таксономических баз данных.
Оценка сходства таксономической структуры прокариотных сообществ показала сходство микробиомов вулканических почв – темноцветной и бурой тропической. Таксономическая структура микробиомов красно-желтой тропической и аллювиальной почв отличаются как от вулканических почв, так и друг от друга. На диаграммах NMDS (рис. 3) отчетливо видны два направления изменения структуры прокариотных сообществ: по типу почвы (от бурой тропической до аллювиальной супесчаной) и по глубине (от поверхностных гумусированных до нижних минеральных горизонтов). Ключевую роль в различии структуры прокариотных сообществ тропических почв заповедника Кат Тьен, как и обилия микроорганизмов, по всей видимости, играет содержание органического углерода, значительно различающееся в разных горизонтах почвенных профилей и в почвах на разных материнских породах.
Список литературы
Александрова А.В., Сидорова И.И., Тиунов А.В. Микроскопические грибы почв и листового опада национального парка Кат Тиен (Южный Вьетнам) // Микология и фитопатология. 2011. Т. 45. № 1. С. 12–25.
Аничкин А.Е. Животное население почв: структура и сезонная динамика // Структура и функции почвенного населения тропического муссонного леса (Национальный парк Кат Тьен, Южный Вьетнам) / Под ред. А.В. Тиунова. М.: Товарищество научных изданий КМК, 2011. С. 44–75.
Калашникова К.А., Александрова А.В. Почвообитающие микроскопические грибы предгорного тропического леса (лесхоз Лок Бак, Южный Вьетнам) // Микология и фитопатология. 2015. Т. 49. № 2. С. 91–101.
Калашникова К.А., Коновалова О.П., Александрова А.В. Почвообитающие микроскопические грибы муссонного диптерокарпового леса (заповедник Донг Най, Южный Вьетнам) // Микология и фитопатология. 2016. Т. 50. № 2. С. 97–107.
Лысак Л.В., Лапыгина Е.В., Столетов Г.А., Грачева Т.А., Дорченкова Ю.А., Чернов Т.И. Характеристика микробных сообществ почв и растительного опада муссонных тропических лесов национальных парков Вьетнама // J. Tropic. Sci. Technol. 2017. V. 14. P. 132–142.
Тихонович И.А., Чернов Т.И., Железова А.Д., Тхакахова А.К., Андронов Е.Е., Кутовая О.В. Таксономическая структура прокариотных сообществ почв разных биоклиматических зон // Бюл. Почв. ин-та им. В.В. Докучаева. 2018. Вып. 95. С. 125–153. https://doi.org/10.19047/0136-1694-2018-95-125-153
Хохлова О.С., Мякшина Т.Н., Кузнецов А.Н., Губин С.В. Морфогенетические особенности почв национального парка Кат Тьен, Южный Вьетнам // Почвоведение. 2017. Т. 50. С. 176–194.
Khokhlova O.S., Myakshina T.N., Kuznetsov A.N., Gubin S.V. Morphogenetic features of soils in the Cat Tien National Park, southern Vietnam // Euras. Soil Sci. 2017. V. 50. P. 158–175.
Чернов Т.И., Железова А.Д., Кутовая О.В., Макеев А.О., Тхакахова А.К., Бгажба Н.А., Курбанова Ф.Г., Русаков А.В., Пузанова Т.А., Хохлова О.С. Сравнительная оценка структуры микробиомов погребенных и современных почв при помощи анализа микробной ДНК // Микробиология. 2018. Т. 87. № 6. С. 737–746.
Chernov T.I., Zhelezova A.D., Kutovaya O.V., Makeev A.O., Tkhakakhova A.K., Bgazhba N.A., Kurbanova F.G., Rusakov A.V., Puzanova T.A., Khokhlova O.S. Comparative analysis of the structure of buried and surface soils by analysis of microbial DNA // Microbiology (Moscow). 2018. V. 87. P. 833–841.
Aronesty E. Comparison of sequencing utility programs // Open Bioinform. J. 2013. V. 7. P. 1–8.https://doi.org/10.2174/1875036201307010001
Bardgett R.D., van der Putten W.H. Belowground biodiversity and ecosystem functioning // Nature. 2014. V. 515. № 7528. P. 505–511.
Bates S., Berg-Lyons D., Caporaso J.G., Walters W.A., Knight R., Fierer N. Examining the global distribution of dominant archaeal populations in soil // ISME J. 2011. V. 5. P. 908–917.
Becraft E.D., Woyke T., Jarett J., Ivanova N., Godoy-Vitorino F., Poulton N., Brown J.M., Brown J., Lau M.C.Y., Onstott T., Eisen J.A., Moser D., Stepanauskas R. Rokubacteria: Genomic giants among the uncultured bacterial phyla // Front. Microbiol. 2017. V. 8. P. 1–12. https://doi.org/10.3389/fmicb.2017.02264
Bergkemper F., Kublik S., Lang F., Krüger J., Vestergaard G., Schloter M., Schulz S. Novel oligonucleotide primers reveal a high diversity of microbes which drive phosphorous turnover in soil // J. Microbiol. Methods. 2016. V. 125. P. 91–97.
Blanc L., Maury-Lechon G., Pascal J.-P. Structure, floristic composition and natural regeneration in the forests of Cat Tien National Park, Vietnam: an analysis of the successional trends // J. Biogeogr. 2000. V. 27. P. 141–157.
Bolger A.M., Lohse M., Usadel B. Trimmomatic: a flexible trimmer for Illumina sequence data // Bioinformatics. 2014. V. 30. P. 2114–2120.
Brauman A. Effect of gut transit and mound deposit on soil organic matter transformations in the soil feeding termite: a review // Eur. J. Soil Biol. 2000. V. 36. P. 117–125.
Caporaso J.G., Kuczynski J., Stombaugh J., Bittinger K., Bushman F.D., Costello E.K., Fierer N., Peña A.G., Goodrich J.K., Gordon J.I., Huttley G.A., Kelley S.T., Knights D., Koenig J.E., Ley R.E., Lozupone C.A., McDonald D., Muegge B.D., Pirrung M., Reeder J., Sevinsky J.R., Turnbaugh P.J., Walters W.A., Widmann J., Yatsunenko T., Zaneveld J., Knight R. QIIME allows analysis of high-throughput community sequencing data // Nat. Methods. 2010. V. 7. P. 335–336.
Catão E.C.P., Lopes F.A.C., Araújo J.F., De Castro A.P., Barreto C.C., Bustamante M.M.C., Quirino B.F., Krüger R.H. Soil acidobacterial 16S rRNA gene sequences reveal subgroup level differences between savanna-like cerrado and atlantic forest brazilian biomes // Int. J. Microbiol. 2014. Article ID 156341. P. 1–12.
Chernov T.I., Tkhakakhova A.K., Lebedeva M.P., Zhelezova A.D., Bgazhba N.A., Kutovaya O.V. Microbiomes of the soils of solonetzic complex with contrasting salinization on the Volga–Ural interfluve // Euras. Soil Sci. 2018. V. 51. P. 1057–1066.
Collwell R.K., Coddington J.A. Estimating terrestrial biodiversity through extrapolation // Philos. Trans. R. Soc. Lond. B. Biol. Sci. 1994. V. 345. № 1311. P. 101–118.
Dedysh S.N., Sinninghe Damsté J.S. Acidobacteria // eLS. John Wiley & Sons, Ltd: Chichester, 2018. P. 1–10. https://doi.org/10.1002/9780470015902.a0027685
Eilers K.G., Debenport S., Anderson S., Fierer N. Digging deeper to find unique microbial communities: the strong effect of depth on the structure of bacterial and archaeal communities in soil // Soil Biol. Biochem. 2012. V. 50. P. 58–65.
Fierer N., Jackson J.A., Vilgalys R., Jackson R.B. Assessment of soil microbial community structure by use of taxon-specific quantitative PCR assays // Appl. Environ. Microbiol. 2005. V. 71. P. 4117–4120.
Hop D.V., Sakiyama Y., Thi C., Binh T., Otoguro M., Hang D.T., Miyadoh S., Luong D.T., Ando K. Taxonomic and ecological studies of actinomycetes from Vietnam: isolation and genus-level diversity // J. Antibiotics. 2011. V. 6440. P. 599–606.
Jones R.T., Robeson M.S., Lauber C.L., Hamady M., Knight R., Fierer N. A comprehensive survey of soil acidobacterial diversity using pyrosequencing and clone library analyses // ISME J. 2009. V. 3. P. 442–453.
Kielak A.M., Barreto C.C., Kowalchuk G.A., van Veen J.A., Kuramae E.E. The ecology of Acidobacteria: Moving beyond genes and genomes // Front. Microbiol. 2016. V. 7. P. 744. https://doi.org/10.3389/fmicb.2016.00744
Kroeger M.E., Delmont T.O., Eren A.M., Meyer K.M., Guo J., Khan K., Rodrigues J.L.M., Bohannan B.J.M., Tringe S.G., Borges C.D., Tiedje J.M., Tsai S.M., Nüsslein K. New biological insights into how deforestation in Amazonia affects soil microbial communities using metagenomics and metagenome-assembled genomes // Front. Microbiol. 2018. V. 9. P. 1635. https://doi.org/10.3389/fmicb.2018.01635
Lauber C.L., Hamady M., Knight R., Fierer N. Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale // Appl. Environ. Microbiol. 2009. V. 75. P. 5111–5120.
Lozupone C., Lladser M.E., Knights D., Stombaugh J., Knight R. UniFrac: an effective distance metric for microbial community comparison // ISME J. 2011. V. 57. P. 169–172.
Matsumoto T., Abe T. The role of termites in an equatorial rain forest ecosystem of west Malaysia // Oecologia. 1979. V. 38. P. 261–274.
Miyashita N.T., Iwanaga H., Charles S., Diway B., Sabang J., Chong L. Soil bacterial community structure in five tropical forests in Malaysia and one temperate forest in Japan revealed by pyrosequencing analyses of 16S rRNA gene sequence variation // Genes Genet. Syst. 2013. V. 88. P. 93–103.
Navarrete A.A., Tsai S.M., Mendes L.W., Faust K., De Hollander M., Cassman N.A., Raes J., Van Veen J.A., Kuramae E.E. Soil microbiome responses to the short-term effects of Amazonian deforestation // Mol. Ecol. 2015. V. 24. P. 2433–2448.
Rognes T., Flouri T., Nichols B., Quince C., Mahé F. VSEARCH: a versatile open source tool for metagenomics // PeerJ. 2016. V. 4. P. e2584. https://doi.org/10.7717/peerj.2584
Schneider D., Engelhaupt M., Allen K., Kurniawan S., Krashevska V., Heinemann M., Nacke H., Wijayanti M., Meryandini A., Corre M.D., Scheu S., Daniel R. Impact of lowland rainforest transformation on diversity and composition of soil prokaryotic communities in Sumatra (Indonesia) // Front. Microbiol. 2015. V. 6. P. 1339. https://doi.org/10.3389/fmicb.2015.01339
Semenov M.V., Chernov T.I., Tkhakakhova A.K., Zhelezova A.D., Ivanova E.A., Kolganova T.V., Kutovaya O.V. Distribution of prokaryotic communities throughout the Chernozem profiles under different land uses for over a century // Appl. Soil Ecol. 2018. V. 127. P. 8–18.
Yu Y., Lee C., Hwang S. Analysis of community structures in anaerobic processes using a quantitative real-time PCR method // Water Sci. Technol. 2005. V. 52. P. 85–91.
Zhang B., Penton C.R., Xue C., Quensen J.F., Roley S.S., Guo J., Garoutte A., Zheng T., Tiedje J.M. Soil depth and crop determinants of bacterial communities under ten biofuel cropping systems // Soil Biol. Biochem. 2017. V. 112. P. 140–152.
Дополнительные материалы отсутствуют.


