Микробиология, 2019, T. 88, № 4, стр. 401-416
Циклический метаболизм как способ существования микроорганизмов
А. Г. Дорофеев a, b, *, Ю. А. Николаев a, А. В. Марданов c, Н. В. Пименов a
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
b АО “Мосводоканал”
105005 Москва, Россия
c Институт биоинженерии, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: Dorofeevag@mail.ru
Поступила в редакцию 05.02.2019
После доработки 11.03.2019
Принята к публикации 29.03.2019
Аннотация
Обзор посвящен особым физиологическим группам бактерий, развивающимся в условиях периодической смены внешних условий и характеризующихся циклическим типом метаболизма (ЦТМ). Для ЦТМ характерен обусловленный циклической сменой внешних условий развития несбалансированный двухфазный рост на отрезке времени меньшем, чем время генерации клеток. В течение первой фазы происходит накопление источника углерода и (или) энергии, во второй фазе осуществляется биосинтез полноценной биомассы с использованием накопленного субстрата. В работе описаны известные представители организмов с ЦТМ, относящиеся к группам фосфат-аккумулирующих и гликоген-аккумулирующих бактерий, кратко изложены их основные биохимические модели. Предполагается, что развитие организмов с облигатным ЦТМ невозможно или существенно затруднено в неизменных внешних условиях, чем объясняется некультивируемость основных представителей ЦТМ при использовании традиционных способов периодического или непрерывного выращивания и успешное получение высокообогащенных культур при циклическом культивировании. Обсуждаются экологические аспекты ЦТМ, определены возможные местообитания микроорганизмов с ЦТМ в естественных экосистемах.
При выделении микроорганизмов и в ходе их последующего культивирования, как правило, заранее предполагается, что для получения стабильного роста микробных культур необходимо соблюдение определенной совокупности неизменных (или меняющихся в узком физиологическом диапазоне) специфических факторов: концентрации субстратов, внеклеточных продуктов метаболизма, температуры, рН, солевого состава среды, концентрации кислорода и др. Поддержание этих факторов в заданном физиологическом диапазоне гарантирует сколь угодно продолжительный стабильный рост популяции, о чем свидетельствуют руководства по выращиванию микроорганизмов (Методы общей бактериологии, 1983).
Соблюдение постоянства поддерживающих рост условий необходимо для выполнения закона экспоненциального роста, характерного для культур одноклеточных микроорганизмов и являющегося фундаментом современной теории и практики микробного роста (Перт, 1978). При экспоненциальном росте физиологические свойства культуры неизменны и он характеризуется как “сбалансированный”. Этим термином в 1957 г. Кэмпбел определил такой рост, при котором все экстенсивные свойства растущей системы за один и тот же промежуток времени увеличиваются в одинаковой пропорции (“growth is balanced over a time interval if, during that interval, every extensive property of the growing system increases by the same factor”) (Campbell, 1957). Другими словами, при сбалансированном росте в равной пропорции за определенный интервал времени увеличиваются все клеточные компоненты культуры. В несинхронной культуре этот интервал времени может быть ничтожным, в синхронной – кратным интервалу времени удвоения биомассы. Культуро-зависимые исследования физиологии микроорганизмов в значительной степени связаны именно cо сбалансированным экспоненциальным ростом, позволяющим работать сколь угодно длительный период с культурой, находящейся в неизменном физиологическом состоянии, и легко воспроизводить результаты экспериментов. Этот тип роста, характерный для логарифмической фазы периодической культуры, лежит в основе непрерывного культивирования (Перт, 1978, Schaechter, 2006).
Вместе с тем, анализ литературы в области физиологии микробного роста свидетельствует о том, что: во-первых, в ряде случаев для получения стабильно растущей микробной культуры правило постоянства внешних условий не соблюдается; во-вторых, непрерывный сбалансированный рост – не обязательный признак “нормального” физиологического состояния; в-третьих, наоборот, выращивание микроорганизмов оказывается успешным только при циклически меняющихся условиях, причем с продолжительностью циклов меньшей или равной времени удвоения биомассы.
Так, в активных илах промышленных биореакторов, осуществляющих очистку муниципальных сточных вод от фосфатов, были обнаружены микроорганизмы, рост которых сопряжен с циклическими изменениями условий существования, обязательными для технологического процесса очистки: периодическим чередованием анаэробного и аэробного периодов и периодическим наличием и отсутствием легкодоступных источников углерода и энергии (Barnard, 1976; Wentzel et al., 1988). К таким микроорганизмам относятся представители физиологической группы “фосфат-аккумулирующих организмов” (ФАО, фенотип ФАО) и “гликоген-аккумулирующих организмов” (ГАО, фенотип ГАО). ФАО обеспечивают биологическое удаление фосфора из сточных вод и характеризуются периодическим накоплением внутри клеток полифосфатов, гликогена и полигидроксиалканоатов (ПГА) (McMahon et al., 2010; Wentzel et al., 2008). ГАО считаются основными конкурентами ФАО в удаляющих фосфор активных илах (Liu et al., 1997) и характеризуются периодическим накоплением внутри клеток гликогена и ПГА, но не обладают способностью к внутриклеточному накоплению полифосфатов (Wentzel et al., 2008; McMahon et al., 2010).
Известно, что способность к внутриклеточному накоплению полифосфатов и гликогена широко распространена среди про- и эукариот, включая археи, цианобактерии, эубактерии, грибы, растения и животные (Kulaev et al., 2004; Rehm, 2010). Однако не все микроорганизмы, способные к накоплению этих полимеров, могут быть отнесены соответственно к ФАО или ГАО. Понятия “ФАО” и “ГАО” сформировались в результате исследования технологии биологического удаления фосфора, и к этим группам отнесены лишь микроорганизмы, участвующие в этом процессе.
В соответствии с устоявшейся терминологией, к фенотипу ФАО относят аэробные микроорганизмы, характеризующиеся следующими свойствами (Van Loosdrecht et al., 1997; Mino et al., 1998; Seviour et al., 2003). 1) Способностью в анаэробных условиях поглощать легкоусваиваемые органические соединения и запасать их в форме внутриклеточных полимеров, одновременно с деградацией внутриклеточных полифосфатов и выбросом ортофосфата в среду. Основные органические субстраты для ФАО – летучие жирные кислоты (ацетат и пропионат), трансформируемые, как правило, в полигидроксиалканоаты (ПГА). 2) Способностью в аэробных условиях и (или) при наличии альтернативного акцептора электронов (нитратов или нитритов) поглощать ортофосфаты и синтезировать внутриклеточные полифосфаты, используя для этих процессов накопленные в анаэробных условиях внутриклеточные полимерные источники углерода и энергии. В этих условиях происходит рост биомассы клеток.
Аналогичные процессы, но без цикла “фосфаты/полифосфаты” служат критерием для фенотипа ГАО. Вместо цикла фосфатов, циклическим источником энергии ГАО служит гликоген, используемый в анаэробных условиях и синтезируемый в аэробных.
В настоящее время основные представители фенотипов ФАО и ГАО (соответственно, “Candidatus Accumulibacter phosphatis” и “Candidatus Competibacter phosphatis”) считаются некультивируемыми микроорганизмами, и публикации о выращивании их в “обычных” постоянных условиях культивирования нам неизвестны. Вместе с тем, результаты многочисленных работ свидетельствуют об успешном выращивании этих бактерий в лабораторных и пилотных установках типа SBR (sequencing batch reactor), а также в промышленных системах очистки стоков от фосфора при циклических изменениях условий выращивания (EBPR, Enchanced Bilological Phosphorus Recovery). В таких установках степень обогащения культур представителями ФАО и ГАО достигает 90–99% (Lopez-Vazquez et al., 2007, 2009b; Walles et al., 2015; Saad et al., 2017). Ранее подобные способы выращивания в переменных условиях мы объединили в группу “циклических культур” (Dorofeev et al., 2014). Основной признак такого способа выращивания – культивирование в периодически изменяющихся условиях с продолжительностью циклов, меньшей или равной среднему времени генерации клеток. Анализ существующей в настоящее время ситуации свидетельствует, что рост в циклических условиях – широко распространенное явление, а для некоторых представителей ФАО и ГАО он является единственным, или, по крайней мере, оптимальным вариантом существования.
В контексте настоящего обзора считаем необходимым более четко определить некоторую условность термина “некультивируемый” организм применительно к обсуждаемой группе бактерий, выращиваемых в масштабах промышленных очистных сооружений. Мы имеем в виду некультивируемость только в чистых культурах в лабораторных условиях.
Для понимания основных метаболических событий, связанных с циклическими условиями развития культур, целесообразно рассмотреть основные биохимические модели обмена ФАО и ГАО и обозначить круг представителей микроорганизмов, относящихся к этим группам.
ОСНОВНЫЕ БИОХИМИЧЕСКИЕ МОДЕЛИ И ПРЕДСТАВИТЕЛИ ФАО И ГАО
Основные биохимические модели
На основании многочисленных экспериментальных исследований, выполненных на уровнях от лабораторных моделей до промышленных сооружений по удалению фосфора, были разработаны биохимические модели ФАО и ГАО, отличающиеся особенностями анаэробного и аэробного периодов метаболизма, включая спектры используемых субстратов, способность к брожению, денитрификации и пр. (см. обзоры Oehmen et al., 2007, 2010; Zhang et al., 2008; Marques et al., 2017). Основу всех моделей составляет способность ФАО и ГАО запасать доступный источник углерода и энергии в условиях отсутствия акцепторов электронов (невозможности функционирования электрон-транспортной цепи) и затем использовать его для роста биомассы в последующих аэробных условиях.
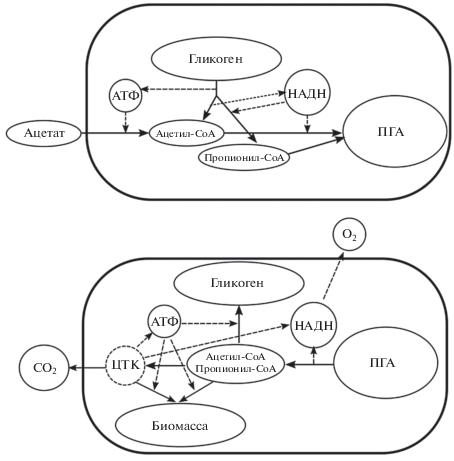
Доминирующей биохимической моделью метаболизма ФАО признана модель Мино (Mino et al., 1987; Arun et al., 1988), в наибольшей степени соответствующая результатам большинства экспериментальных исследований, выполненных на полномасштабных очистных сооружениях и в лабораторных условиях с использованием обогащенных ФАО культур (рис. 1). Согласно этой модели, ФАО относятся к аэробным гетеротрофным организмам, способным в анаэробных условиях с высокой скоростью поглощать летучие жирные кислоты, прежде всего, ацетат и пропионат, и запасать их в виде ПГА. Основной источник энергии для этих процессов – гидролиз внутриклеточных полифосфатов с образованием АТФ. Выброс образующегося ортофосфата в анаэробных условиях происходит параллельно с выходом контр-ионов (Mg2+ и K+). Необходимый для внутриклеточного синтеза ПГА НАДН образуется при гликолитическом распаде гликогена, катаболизм которого также является дополнительным источником энергии в анаэробной стадии.
Рис. 1.
Основная биохимическая модель ФАО (модель Мино): внеклеточным источником углерода и энергии служит ацетат, в анаэробный период накапливаемый в клетках в виде полиалканоата (поли-β-гидроксибутирата).
В аэробной фазе происходит рост биомассы ФАО за счет использования ПГА в качестве источника углерода и энергии, поглощение ортофосфата, сопряженное с переносом ионов Mg2+ и K+ в клетку, и восстановление внутриклеточного пула полифосфатов.
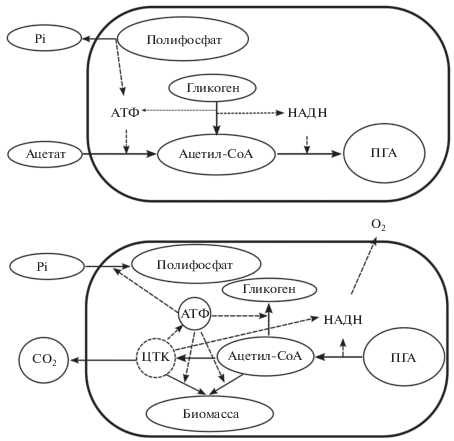
Исследования активных илов, осуществляющих биологическое удаление фосфатов, привели к открытию не только ФАО, но и другой уникальной группы микроорганизмов, существующих в циклически меняющихся условиях – гликоген-аккумулирующих организмов. К ГАО относятся аэробные микроорганизмы, способные к потреблению и накоплению органического субстрата в виде ПГА в анаэробных условиях с последующим его использованием для синтеза биомассы и получения энергии в аэробных условиях (Cech, Hartman, 1990; Cech et al., 1993; Mino et al., 1995). В первом приближении биохимические модели ФАО и ГАО близки, однако у ГАО отсутствует цикл “фосфаты–полифосфаты”. В отличие от фенотипа ФАО, для которого в анаэробных условиях основным источником энергии служит распад полифосфатов, ГАО в качестве основного источника энергии используют реакцию гликолиза – распада гликогена до пирувата. Образующееся при этом избыточное количество восстановительных эквивалентов утилизируется при восстановлении части пирувата до пропионил-CoA и используется для синтеза ПГА (рис. 2) (Liu et al., 1994; Filipe et al., 2001; Zeng et al., 2003).
Представители ФАО
Несмотря на общую метаболическую способность ФАО в определенных циклических условиях аккумулировать фосфор и запасать органическое вещество, филогенетически ФАО неоднородны, и в результате исследования микрофлоры активных илов обнаруживаются все новые и новые кандидаты на принадлежность к ФАО (Stokholm-Bjerregaard et al., 2017; Tarayre et al., 2017). Основными представителями ФАО считаются некультивируемые бактерии “Candidatus Accumulibacter phosphatis”, обладающие “классической” метаболической моделью ФАО, а также микроорганизмы, обмен которых отклоняется от этой модели, но также характеризуется циклическим поглощением и окислением органического вещества и сопряженным с этим циклом синтеза и распада полифосфатов. К таким микроорганизмам относятся представители актинобактерий Tetrasphaera и Microlunatus, Thiothrix caldifontis, некультивируемые бактерии “Candidatus Halomonas phosphatis”.
“Candidatus Accumulibacter phosphatis”. Неоспоримым представителем фенотипа ФАО в настоящее время считается “Ca. Accumulibacter phosphatis”, входящий в cемейство Rhodocyclacea класса Betaproteobacteria, (Hesselmann et al., 1999). Результаты исследований микробных сообществ активного ила и обогащенных ФАО лабораторных культур указывают на то, что в большинстве случаев именно “Ca. Accumulibacter phosphatis” осуществляет биологический процесс удаления фосфора на промышленных очистных сооружениях, и метаболизм этих бактерий полностью соответствует основной биохимической модели ФАО (Bond et al., 1995; Crocetti et al., 2000; Zilles et al., 2002a, 2002b; Kong et al., 2004; Lu et al., 2006; He et al., 2008).
Филогенетические и экопопуляционные исследования “Ca Accumulibacter phosphatis” были проведены с использованием в качестве маркера гена 16S рРНК, а также гена полифосфаткиназы 1 (ppk1), причем последний оказался более эффективным, учитывая его центральную роль в образовании полифосфатов и высокую вариабельность (McMahon et al., 2002; He et al., 2007). Исследования разнообразия этих прокариот выявили наличие двух основных филогенетических групп (тип I и тип II), каждая из которых в свою очередь подразделяется на клады (у типа I – клады от IА до IЕ, у типа II – клады от IIA до II I) (McMahon et al., 2002; He et al., 2007; Peterson et al., 2008; Kim et al., 2010; Mao et al., 2015).
В связи с отсутствием изолятов, исследования метаболических и генетических особенностей “Сa. Accumulibacter phosphatis” в значительной степени связаны с физиолого-биохимическим и молекулярно-биологическим анализами высокообогащенных ФАО смешанных культур (Martin et al., 2006; Mino, Satoh, 2006; He, McMahon, 2011). В соответствии с результатами исследований, представители “Сa. Accumulibacter phosphatis” имеют как общие пути центрального метаболизма углерода и фосфора, свойственные ФАО (системы транспорта фосфатов, синтеза и гидролиза полифосфатов, синтеза полиалканоатов, гликолиза и ЦТК), так и кладоспецифические, связанные со спектром используемых органических субстратов и акцепторов электронов (Skennerton et al., 2015). Результаты исследований зачастую противоречивы, что может быть объяснено как метаболической неоднородностью, так и варьированием свойств бактерий при изменении внешних условий (Welles et al., 2016). Трудность при исследовании смешанных культур представляет также интерпретация результатов, степень достоверности которых прямо зависит от степени обогащенности этих культур “Ca. Accumulibacter”. Например, в работе (Martin et al., 2006) на основе анализа метагеномной ДНК, выделенной из биомассы, обогащенной “Сa. Accumulibacter phosphatis”, был обнаружен полный набор генов фиксации азота и фиксации CO2. Однако позднее эти гены были выявлены только у штамма, принадлежащего к типу II, но не типу I (Flowers, 2013). При этом совершенно очевидно, что “Сa. Accumulibacter phosphatis” не способен к автотрофии. Исследования экспрессии генов цикла трикарбонновых кислот выявили значительные расхождения в анаэробном и аэробном метаболизме различных популяций “Сa. Accumulibacter phosphatis” (Wexler et al., 2009). Результаты исследований изменения метатранскриптома в ходе анаэробно/аэробного цикла показали первостепенное значение для “Сa. Accumulibacter phosphatis” регуляции на уровне транскрипции и возможность использовать более широкий спектр источников углерода, чем предполагалось ранее (Oyserman et al., 2016). Однако на сегодняшний день экспериментально показано только использование ацетата и пропионата.
Род Tetrasphaera. К ФАО ряд исследователей относят грамположительные аэробные актинобактерии Tetrasphaera, повсеместно обнаруживаемые в фосфор-удаляющих активных илах, метаболизм которых не полностью соответствует основной метаболической модели ФАО (Maszenan et al., 2000; Kong et al., 2005; Nguyen et al., 2011; Muszynski, Zaleska-Radziwill, 2015). Как и “Сa. Accumulibacter phosphatis”, эти бактерии в аэробных условиях способны потреблять ортофосфаты и накапливать их в виде внутриклеточного полифосфата при условии, что в предыдущей анаэробной фазе в среде содержался легко усваиваемый органический субстрат. Однако, в отличие от “классической” биохимической модели ФАО, бактерии Tetrasphaera в анаэробных условиях ассимилируют целый спектр органических соединений, включая глюкозу и аминокислоты, и не образуют ПГА (Kong et al., 2008; Nielsen et al., 2012; Kristiansen et al., 2013). Группой Kristiansen и соавт. было проведено исследование генома нескольких изолятов Tetrasphaera, и создана метаболическая модель этой группы, существенно отличающаяся от “классической” модели ФАО (Kristiansen et al., 2013). Согласно этой модели, в анаэробных условиях Tetrasphaera синтезирует гликоген в качестве запасного вещества, используя энергию гидролиза полифосфатов и ферментации субстрата. Часть потребляемой глюкозы ферментируется с образованием сукцината и других метаболитов. В течение аэробного периода запасенный гликоген катаболизируется, обеспечивая энергией процессы роста и восстановления запасов полифосфатов, необходимых для следующего анаэробного цикла развития.
Показано, что бактерии группы Tetrasphaera в анаэробных условиях способны к поглощению и внутриклеточному накоплению глицина и продуктов его ферментации, которые в аэробных условиях служит источником энергии для биосинтеза, поглощения ортофосфатов и синтеза полифосфатов (Nguyen et al., 2015). В настоящее время из активного ила выделено несколько изолятов представителей рода Tetrasphaera: T. australiensis, T. japonica (Maszenan et al., 2000), T. elongata (Hanada et al., 2002; Onda, Takii, 2002), T. jenkinsii, T. vanveenii и T. veronensis (McKenzie et al., 2006).
Род Microlunatus. Еще одним кандидатом в группу ФАО считаются актинобактерии Microlunatus. Группа Nakamura и соавт. выделила из активного ила новый вид Microlunutus phosphovorus – грамположительных кокковидных неподвижных и не образующих споры прокариот, характеризующихся строго аэробным хемоорганотрофным типом обмена. Как и изоляты Tetrasphaera, новый вид использовал в анаэробных условиях не ацетат, а сахара, отличаясь от основной модели метаболизма ФАО неспособностью к накоплению ПГА (Nakamura et al., 1995; Kawakoshi et al., 2012). В аэробный период цикла M. phosphovorus аккумулирует фосфор до 166 мг/г массы сухих клеток без внешнего органического источника углерода и энергии (Nakamura et al., 1991).
“Candidatus Halomonas phosphatis” (“Candidatus Accumulimonas spp.”). В работах группы Nguyen и соавт. (Nguyen et al., 2012) показана высокая вероятность ФАО-метаболизма у некультивируемых бактерий “Candidatus Halomonas phosphatis” (в настоящее время “Candidatus Accumulimonas spp.”), относящихся к гаммапротеобактериям. Авторами показано, что эти мелкие палочковидные клетки запасают органическое вещество в виде ПГА в бескислородных условиях, а в аэробных поглощают ортофосфат и синтезируют полифосфаты. “Ca. Halomonas phosphatis” был обнаружен во всех фосфат-аккумулирующх активных илах из 30 обследованных сооружений Дании, причем в количествах, сопоставимых с количеством “Ca. Accumulibacter phosphatis”. “Ca. Halomonas phosphatis” поглощал в анаэробных и аэробных условиях не только ацетат и пропионат, но и этанол, и, в отличие от “Ca. Accumulibacter phosphatis”, к денитрификации не способен.
Thiothrix caldifontis. Вероятным кандидатом в группу ФАО являются сульфидокисляющие миксотрофные бактерии Thiothrix caldifontis. Как показано Rubio-Rincón и соавт. (Rubio-Rincón et al., 2017), Т. caldifontis может вести себя как ФАО с миксотрофным типом метаболизма, используя внутриклеточный пул серы (в дополнение к ПГА) в качестве источника энергии при аэробном росте. В циклических аэробно/анаэробных условиях T. caldifontis способен в анаэробной фазе запасать углерод в форме ПГА и генерировать требуемую для этого энергию за счет гидролиза полифосфата. В аэробный период происходят поглощение фосфатов с образованием полифосфатов, утилизация ПГА для получения углерода и энергии для роста, окисление серы и образования полифосфата и гликогена. Авторы предполагают, что дополнительным источником энергии в этой фазе может быть окисление внутриклеточной серы до сульфата. Культура, обогащенная T. caldifontis, была способна акумулировать до 100 мг P/г сухого беззольного вещества.
С использованием молекулярно-биологических и экофизиологических методов показана возможная принадлежность к ФАО и других микроорганизмов из родов Dechloromonas (Kong et al., 2007; Terashima et al., 2016), Gemmatimonas (Zhang et al., 2003), Malikia (Spring et al., 2005), а также некультивируемых цианобактерий “Candidatus Obscuribacter phosphatis” (Soo et al., 2014) и др. Среди новых кандидатов в ФАО выделяют как облигатно аэробные, так и денитрифицирующие микроорганизмы, поглощающие ортофосфат в аноксидных условиях (Sun et al., 2015). Однако участие этих бактерий в циклическом удалении фосфора и их принадлежность к группе ФАО требует более весомой доказательной базы.
Представители ГАО
“Candidatus Competibacter phosphatis”. С использованием методов молекулярной биологии удалось изучить предполагаемые ГАО “in situ”. Наиболее подходящими кандидатами на роль типичных ГАО оказались представители Gammaproteobacteria, описанные как 2 кандидатных рода Competibacter и Contendobacter, входящие в семейство Competibacteraceae, широко распространенные в активном иле сооружений биологического удаления фосфора и выращиваемые в лабораторных установках с циклическим режимом культивирования, где их содержание может достигать 50% (Crocetti et al., 2002; Zeng et al., 2003; Oehmen et al., 2004; Kong et al., 2006; Gu et al., 2008; Mcilroy et al., 2015). Метаболизм этой группы в полной степени соответствует основной модели ГАО-метаболизма. В отсутствие чистых культур, исследования физиологии и экологии Competibacter проводили с использованием обогащенных лабораторных культур методами микрорадиоавтографии и молекулярной биологии. Показано высокое филогенетическое и фенотипическое разнообразие представителей Competibacteraceae. Первоначально был описан некультивируемый вид “Ca. Competibacter phosphatis”, затем McIlroy и соавт. (McIlroy et al., 2014) в результате расшифровки и анализа метагеномов из обогащенных культур удалось получить полные геномы двух новых видов: “Candidatus Competibacter denitrificans” и “Candidatus Contendobacter odensis”. Генетический анализ показал наличие у представителей Competibacteraceae разных путей гликолиза, метаболизма азота (способности к денитрификации, фиксации азота) и запасных питательных веществ.
Род Defluviicoccus. Принадлежность к ГАО-фенотипу показана для бактерий группы Defluviicoccus (типовой вид – Defluviicoccus vanus), относящихся к роду Rhodospirillales класса Alphaproteobacteria. Defluviicoccus – хемогетеротрофные неспоровые неподвижные аэробные кокки/коккобациллы, часто образующие тетрады. Выделенный из активного ила типовой вид Defluviicoccus vanus в чистой культуре характеризуется чрезвычайно медленным ростом (Maszenan et al., 2005). Defluviicoccus-родственые бактерии филогенетически разнообразны, объединены в четыре кластера и зачастую детектируются как ГАО, доминирующие в популяции микроорганизмов активного ила в лабораторных установках и на очистных сооружениях биологического удаления фосфора (Dai et al., 2007; McIlroy, Seviour, 2009). Исследования единственного выделенного в чистую культуру штамма Defluviicoccus vanus показали его способность в анаэробных условиях потреблять глюкозу, одновременно расходовать внутриклеточный гликоген и образовывать ПГА, а в аэробных условиях использовать ПГА для восстановления гликогена. Ни в аэробной, ни в анаэробной фазах не было отмечено заметного поглощения или выделения фосфатов (Wong, Liu, 2007). Авторы работы сделали вывод о соответствии штамма Defluviicoccus vanus фенотипу ГАО.
Род Micropruina. Кандидатами на фенотип ГАО рассматриваются представители рода Micropruina, относящегося к Propionibacteriaceae: бактерии Micropruina в значительном количестве обнаруживаются в активном иле сооружений биологической очистки, а также в лабораторных системах при росте на ацетате и глюкозе (Kong et al., 2001; Stokholm-Bjerregaard et al., 2017; Mcllroy et al., 2018). Показано, что выделенный из активного ила изолят Micropruina glycogenica в анаэробных условиях частично ферментирует сахара и аминокислоты до молочной кислоты, ацетата и аминокислот, частично запасает их в форме гликогена при отсутствии синтеза полифосфатов (Shintani et al., 2000).
В работе (Stokholm-Bjerregaard et al., 2017) сообщается о новом представителе ГАО – “Candidatus Propionivibrio aalborgensis”, принадлежащем к бета-протеобактериям и состоящем в близком родстве с ФАО “Ca. Accumulibacter phosphatis” (Albertsen et al., 2016).
ПОНЯТИЕ ЦИКЛИЧЕСКОГО МЕТАБОЛИЗМА
Для метаболизма микроорганизмов групп ФАО и ГАО в условиях технологического процесса удаления фосфора характерно чередование накопления внутриклеточных запасных веществ и их использования. Для лучшего понимания специфики обмена веществ этих микроорганизмов, целесообразно ввести понятие “метаболического цикла” (МЦ), состоящего из периода накопления запасного вещества и периода его утилизация. Следует отметить, что в микробной физиологии термин “цикл” широко используется для обозначения замкнутых путей метаболизма (цикл трикарбоновых кислот, цикл Кальвина и др.), событий, связанных с делением клеток (цикл деления), развитием периодических культур (цикл развития культуры). Рассматриваемое в настоящей работе понятие “метаболического цикла” относится к осцилляциям метаболизма культуры во времени, напрямую не связанным с клеточным циклом или с изменениями свойств культуры при выращивании в периодических условиях.
Как было отмечено выше, метаболический цикл ФАО и ГАО состоит из двух фаз: в первой фазе МЦ (фазе накопления) происходит накопление лимитирующего компонента конструктивного или энергетического обмена, а во второй фазе (фазе роста) – его использование, сопряженное с биосинтезом и ростом биомассы. Использование такого компонента для нужд роста в первой фазе невозможно или ограничено (по сравнению с последующей фазой). Накапливаемыми компонентами являются вещества, запасающиеся внутри клеток и служащие источниками энергии и (или) биогенных элементов. Для образования запасных веществ в фазе накопления могут потребоваться вспомогательные источники энергии и (или) соединения, регенерирующиеся в фазе роста (полифосфаты и гликоген, соответственно, для ФАО и ГАО). Метаболизм, для которого характерны описанные изменения направления основных биохимических потоков с продолжительностью метаболического цикла меньшей, чем время удвоения биомассы, мы назвали циклическим типом метаболизма (ЦТМ).
На отрезке времени, меньшем, чем продолжительность МЦ, рост культур с ЦТМ характеризуется как несбалансированный, и физиологические свойства таких культур воспроизводятся через интервалы времени, кратные одному метаболическому циклу. Обычно продолжительность МЦ у ФАО и ГАО в лабораторных экспериментах или на полномасштабных сооружениях составляет несколько часов, тогда как время удвоения культуры – несколько суток (Kuba et al., 1997; Erdal et al., 2006; Biological Nutrient Removal (BNR) Operation in Wastewater Treatment Plants: WEF Manual of Practice, No. 29, 2006; Chan et al., 2017). В известных в настоящее время примерах ЦТМ смена направленности путей метаболизма происходит в результате циклических изменений в окружающей среде и рассматривается большинством исследователей как адаптация, позволяющая получать бактериям с ЦТП конкурентные преимущества при попадании в такие “необычные” условия. Однако авторы настоящей публикации полагают, что ЦТМ может иметь не только факультативный, но и облигатный характер. Смена направленности метаболических путей представляется обязательной для существования микроорганизмов с облигатным ЦТМ. Вероятно, к таким микроорганизмам можно отнести “Candidatus Accumulibacter phosphatis” и “Candidatus Competibacter phosphatis”, выращивание которых до сих пор возможно лишь в циклических культурах. При факультативном ЦТМ рост культур происходит как при циклических, так и при постоянных внешних условиях. Примером служат ФАО Tetrasphaera и Microlunatus, изоляты которых получены традиционным выращиванием в периодических условиях. Для решения вопроса о существовании облигатного ЦТМ необходимо получить чистые культуры ФАО и ГАО и исследовать их в циклических и (или) непрерывных условиях выращивания. Метаболический цикл и особенности, характерные для ЦТМ, приведены на рис. 3 и в табл. 1.
Рис. 3.
Обобщенная схема метаболического цикла у микроорганизмов с ЦТМ. S – внеклеточные вещества, используемые для накопления и роста. X – прирост биомассы. Пунктирные стрелки указывают на образование (справа) и расход (слева) вспомогательного источника энергии и вещества. Пунктирной линией обозначена граница между фазами накопления и роста.
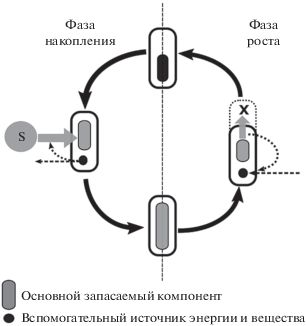
Таблица 1.
Характеристики фаз роста микроорганизмов с облигатным ЦТМ
| Показатель | Фаза накопления | Фаза роста |
|---|---|---|
| Внешние условия для сбалансированного роста | Отсутствие | Отсутствие |
| Внеклеточные вещества, используемые для накопления и роста биомассы | Наличие | Отсутствие |
| Биомасса клеток (за вычетом массы запасаемых внутриклеточных веществ) | Отсутствие роста | Рост |
| Основной запасаемый источник энергии и (или) биогенных элементов, расходуемых в фазе роста для биосинтеза биомассы | Накопление | Расход |
| Вспомогательные источники энергии и (или) вещества, необходимые для накопления основного запасаемого источника углерода и (или) энергии | Расход | Регенерация (синтез) |
Из описания особенностей циклического метаболизма следует, что выращивание микроорганизмов с облигатным ЦТМ в традиционных постоянных условиях невозможно или крайне затруднено, и для получения накопительных культур и выделения новых представителей ЦТМ необходимо использовать циклические методы культивирования (Dorofeev et al., 2014).
Очевидно, обнаружения ЦТМ следует ожидать у микроорганизмов, обладающих способностью к запасанию в больших количествах веществ, используемых в фазе роста в качестве источника энергии и (или) необходимых биогенных элементов. ФАО и ГАО в метаболическом цикле используют в качестве основного или вспомогательного субстратов такие известные запасные биополимеры как полисахариды (гликоген), полигидроксиалканоаты, полифосфаты. В литературе имеются сведения о накоплении у представителей этих групп в анаэробных условиях и последующем окислении в аэробных условиях γ-аминомасляной кислоты, аминокислот, трегалозы (Satoh et al., 1998; Santos et al., 1999; Nguyen et al., 2015). Можно ожидать, что к ЦТМ способны микроорганизмы, накапливающие не только соединения углерода и фосфора, но также и соединения серы и азота, служащие потенциальным источником энергии.
ДРУГИЕ КАНДИДАТЫ НА ОБЛАДАНИЕ ЦИКЛИЧЕСКИМ ТИПОМ МЕТАБОЛИЗМА
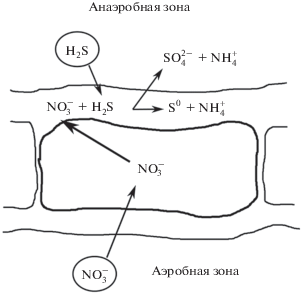
Кроме ФАО и ГАО, признаками облигатного ЦТМ обладают бактерии Thioploca, Thiomargarita и другие представители Beggiatoaceae, способные к внутриклеточному накоплению нитратов и до сих пор не выделенные в чистые культуры (Schulz, 2006; Mußmann et al., 2007; Salman et al., 2013). Thioploca – многоклеточные нитчатые бесцветные серобактерии, относящиеся к группе Gammaproteobacteria, обитающие в сульфидсодержащих пресноводных и морских отложениях на границе аэробной/анаэробной зон (Jørgensen, Gallardo, 1999; Zopfi et al., 2001). Местообитания этих микроорганизмов характеризуются низким содержанием кислорода при обогащении нитратами. Клетки Thioploca способны накапливать в вакуолях, занимающих до 80% внутриклеточного объема, нитраты в концентрации до 500 мМ. Попадая из нитрат-обогащенной зоны в анаэробную сульфид-содержащую зону, эти бактерии способны к литоавтотрофному (или миксотрофному) метаболизму, окисляя сульфиды накопленным в вакуолях нитратом (с образованием аммония). Признаки ЦТМ проявляются в способности Thioploca аккумулировать нитраты как ключевой компонент для получения энергии (акцептор электронов), когда его использование невозможно в связи с отсутствием донора электронов (фаза накопления), а затем использовать нитраты для окисления сульфидов при попадании клеток в зону, богатую сульфидами, но обедненную нитратами (фаза роста) (рис. 4).
Рис. 4.
Схематическое изображение клетки Thioploca. Показан процесс накопления нитратов в вакуоле в аэробный период и реакции окисления сульфидов нитратами в цитоплазме в анаэробный период (на основании Fossing et al., 1995; Teske, Salman, 2014).
Еще более сложными взаимосвязанными циклами серы, азота и фосфора характеризуются хемолитоавтотрофные серные бактерии Thiomargarita – обитатели придонных осадков прибрежной морской зоны апвеллинга с низким содержанием кислорода. Установлено, что Thiomargarita namibiens окисляет сульфиды и накапливает внутри клеток нитраты, элементную серу и полифосфаты (Schulz, Schulz, 2005; Schulz, 2006). Происходящая в естественных условиях смена аэробных и бескислородных условий приводит к циклическому накоплению и расходу этих внутриклеточных полимеров. Авторами показано, что в бескислородных условиях Thiomargarita namibiens окисляет сульфиды запасенными в вакуолях нитратами до элементарной серы. Источником энергии также служит гидролиз полифосфатов. В аэробных условиях бактерии получают энергию окислением накопленной элементной серы и, возможно, гликогена. В то же время энергия запасается в виде полифосфатов и происходит накопление нитратов в центральной вакуоле до концентрации 0.8 М (Schulz et al., 1999). По мнению авторов, механизм фосфатного цикла у Thiomargarita namibiens может быть подобен механизму ФАО и включать потребление ацетата в анаэробных условиях и цикл синтеза и распада гликогена.
ЭКОЛОГИЧЕСКИЕ АСПЕКТЫ ЦИКЛИЧЕСКОГО ТИПА МЕТАБОЛИЗМА
Исследования экологии микроорганизмов с ЦТМ (ФАО и ГАО) в настоящее время сводится, главным образом, к изучению микробного консорциума активных илов в лабораторных установках и на полномасштабных сооружениях очистки сточных вод от фосфора. Многочисленный экспериментальный материал позволяет сделать вывод о существенном (в некоторых случаях – основном) вкладе этих бактерий в циклы превращения углерода, фосфора, азота и серы, а также их тесной взаимосвязи с другими микроорганизмами консорциума активных илов (Rubio-Rincón et al., 2017; Zeng et al., 2017; Zhang et al., 2017; Vieira et al., 2018).
В настоящее время общепринято считать, что циклический метаболизм ФАО и ГАО дает им конкурентные преимущества перед “обычными” аэробными гетеротрофными микроорганизмами в условиях циклической смены условий окружения. В анаэробный период ФАО и ГАО осуществляют процесс, несвойственный обычным аэробам – извлекают из среды основную часть доступного органического вещества, а затем, в аэробный период, осуществляют синтез биомассы за счет запасенных органических биополимеров (McMahon et al., 2010). На успешность такой стратегии указывает простота получения в лабораторных нестерильных условиях высокообогащенных культур ФАО и ГАО: для этого достаточно создать характерные для технологии удаления фосфора циклические условия выращивания, чередуя “богатый питанием” анаэробиоз с “голодными” аэробными условиями.
Несмотря на близкий тип метаболизма, а также способность ФАО “переключаться” на ГАО-метаболизм (Acevedo et al., 2017), для этих групп с ЦТМ характерно сосуществование в активных илах, о чем свидетельствует их повсеместное обнаружение на сооружениях биологической очистки сточных вод. В этих экосистемах ФАО и ГАО могут занимать различные экологические ниши в соответствии с их физиологическими особенностями, различаясь: спектрами потребляемых субстратов, способностями к денитрификации и сбраживанию, отношением к условиям голодания, рН и температуре (Lopez-Vazquez et al., 2009; Carvalheira et al., 2014; Stokholm-Bjerregaard et al., 2017). В работе (Rubio-Rincón et al., 2017) показана возможность синтрофных взаимоотношений между ФАО и ГАО. Так, бактерии, относящиеся к типу I “Ca. Accumulibacter phosphatis”, неспособны к нитратному дыханию и в качестве акцептора электронов могут использовать только нитриты. Однако в смешанной культуре ФАО–ГАО в бескислородных условиях с нитратом наблюдается рост как ГАО, так и ФАО микроорганизмов: ГАО осуществляют восстановление нитратов до нитритов, используемых затем как ГАО, так и ФАО.
Существенное физиологическое разнообразие среди представителей типов I и II “Ca. Accumulibacter phosphatis” по способности использовать в качестве акцепторов электронов различные соединения азота и усваивать различные органические соединения (Skennerton et al., 2015; Camejo et al., 2016) может объяснять длительное сосуществование этих бактерий в одних и тех же экосистемах. Так, результаты исследования многолетней сезонной динамики микробного сообщества активного ила на полномасштабных сооружениях биологической очистки сточных вод выявили отсутствие прямой конкуренции за одинаковые ресурсы среди представителей разных кладов “Ca. Accumulibacter phosphatis” (Flowers et al., 2013).
Преимущества ЦТМ в переменных условиях внешней среды прослеживаются и для потенциальных представителей ЦТМ, обитателей донных отложений на границах аэробной/аноксидной зон. Считается, что способность к внутриклеточному накоплению акцептора электронов – нитратов позволяет Thioploca эффективно конкурировать с другими сульфид-окисляющими микроорганизмами, для существования которых необходимо одновременное наличие как донора, так и акцептора электронов (Fossing et al., 1995). Для этих же бактерий в условиях in situ прослежена симбиотическая связь с бактериями анаммокс (Prokopenko et al., 2013). В бескислородной зоне Thioploca поставляет анаммокс-бактериям нитрит и аммоний в результате диссимиляторной нитратредукции до аммония, окисляя сульфиды внутриклеточным нитратом.
Несмотря на то, что в настоящее время микроорганизмы с ЦТМ обнаружены, главным образом, в активном иле искусственных экосистем, и, в меньшей степени, в осадках водоемов (Peterson et al., 2008), исследователи считают, что микроорганизмы с ЦТМ могут иметь широкое распространение во многих естественных экосистемах, характеризующихся циклическим изменениями рост-определяющих факторов. На это указывают многочисленные примеры подобных циклических изменений, имеющих место в естественных местообитаниях микроорганизмов. Например, для почв характерны циклические изменения выброса легко усваиваемых органических веществ с корневыми экссудатами в ризосфере растений, связанные с цикличностью фотосинтеза (Badri, Vivanco, 2009), а также периодические изменения температуры, влажности, газового состава поверхностных горизонтов почв; суточные колебания концентрации неорганических ионов (Почвоведение, 1988). Для водных экосистем характерен суточный цикл активности фитопланктона и интенсивности выделения ими экссудатов (Herndl, Malacic, 1987). Существуют и другие экосистемы с регулярными циклическими изменениями условий существования, вызванными, например, периодичностью выбросов термальных вод и газов, приливов и отливов, периодичностью активности животных и т.п.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена при частичной поддержке Российского фонда фундаментальных исследований (проект №18-29-25016 (мк)).
Список литературы
Методы общей бактериологии. Т. 1 / Под ред. Герхардт Ф. и др. М.: Мир, 1983. 536 с.
Manual of Methods for General Bacteriology / Editor-in-chief Gerhardt P. Washington DC: American Society for Microbiology, 1981. 524 p.
Перт С.Дж. Основы культивирования микроорганизмов и клеток. М.: Мир, 1978. 330 с.
Pirt S.J. Principles of Microbe and Cell Cultivation. Oxford: Blackwell Science, 1975. 274 p.
Почвоведение. Учеб. для ун-тов. В 2 ч. / Под ред. Ковды В.А., Розанова Б.Г. М.: Высшая школа, 1988. 400 с.
Acevedo B., Murgui M., Borrás L., Barat R. New insights in the metabolic behaviour of PAO under negligible poly-P reserves // Chem. Eng. J. 2017. V. 311. P. 82–90.
Albertsen M., McIlroy S.J., Stokholm-Bjerregaard M., Karst S.M., Nielsen P.H. “Candidatus Propionivibrio aalborgensis”: a novel glycogen accumulating organism abundant in full-scale enhanced biological phosphorus removal plants // Front. Microbiol. 2016. V. 7. Article 1033. https://www.frontiersin.org/articles/10.3389/fmicb.2016.01033/full.
Arun V., Mino T., Matsuo T. Biological mechanisms of acetate uptake mediated by carbohydrate consumption in excess phosphorus removal systems // Water Res. 1988. V. 22. P. 565–570.
Badri D.V., Vivanco J.M. Regulation and function of root exudates // Plant Cell Environ. 2009. V. 32. P. 666–681.
Barnard L. A review of biological phosphorus removal in the activated sludge process // Water SA. 1976. V. 2. P. 136–144.
Biological Nutrient Removal (BNR) Operation in Wastewater Treatment Plants: WEF Manual of Practice, No. 29. WEF Press, Alexandria, VA. 2005. 597 p.
Bond P.L., Hugenholtz P., Keller J., Blackall L.L. Bacterial community structures of phosphate-removing and non-phosphate-removing activated sludges from sequencing batch reactors // Appl. Environ. Microbiol. 1995. V. 61. P. 1910–1916.
Camejo P.Y., Owen B.R., Martirano J., Ma J., Kapoor V., Santo Domingo J., McMahon K.D., Noguera D.R. Candidatus Accumulibacter phosphatis clades enriched under cyclic anaerobic and microaerobic conditions simultaneously use different electron acceptors // Water Res. 2016. V. 102. P. 125–137.
Campbell A. Synchronization of cell division // Bacteriol. Revs. 1957. V. 21. P. 263–272.
Carvalheira M., Oehmen A., Carvalho G., Reis M.A.M. Survival strategies of polyphosphate accumulating organisms and glycogen accumulating organisms under conditions of low organic loading // Biores. Technol. 2014. V. 172. P. 290–296.
Cech J.S., Hartman P. Glucose induced break down of enhanced biological phosphate removal // Environ. Technol. 1990. V. 11. P. 651–656.
Cech J.S., Hartman P., Wanner J. Competition between polyP and non-polyP bacteria in an enhanced phosphate removal system // Water Environ. Res. 1993. V. 65. P. 690–692.
Chan C., Guisasola A., Baeza J.A. Enhanced biological phosphorus removal at low sludge retention time in view of its integration in A-stage systems // Water Res. V. 118. P. 217–226.
Crocetti G.R., Hugenholtz P., Bond P.L., Schuler A., Keller J., Jenkins D., Blackall L.L. Identification of polyphosphate-accumulating organisms and design of 16S rRNA directed probes for their detection and quantitation // Appl. Environ. Microbiol. 2000. V. 66. P. 1175–1182.
Crocetti G.R., Banfield J.F., Keller J., Bond P.L., Blackall L.L. Glycogen-accumulating organisms in laboratory-scale and full-scale wastewater treatment processes // Microbiology (SGM). 2002. V. 148. P. 3353–3364.
Dai Y., Yuan Z., Wang X., Oehmen A., Keller J. Anaerobic metabolism of Defluviicoccus vanus related glycogen accumulating organisms (GAOs) with acetate and propionate as carbon sources // Water Res. 2007. V. 41. P. 1885–1896.
Dorofeev A.G., Grigor’eva N.V., Kozlov M.N., Kevbrina M.V., Aseeva V.G. Nikolaev Yu.A. Approaches to cultivation of “nonculturable” bacteria: cyclic cultures // Microbiology (Moscow). 2014. V. 83. P. 450–461.
Erdal U.G., Erdal Z.K., Randall C.W. The mechanism of enhanced biological phosphorus removal washout and temperature relationship // Water Environ. Res. 2006. V. 78. P. 710–715.
Filipe C.D.M., Daigger G.T., Grady C.P.L. A metabolic model for acetate uptake under anaerobic conditions by glycogen accumulating organisms: stoichiometry, kinetics, and the effect of pH // Biotechnol. Bioeng. 2001. V. 76. P. 17–31.
Flowers J.J., He S., Malfatti S., del Rio T.G., Tringe S.G., Hugenholtz P., McMahon K.D. Comparative genomics of two “Candidatus Accumulibacter” clades performing biological phosphorus removal // ISME J. 2013. V. 7. P. 2301–2314.
Flowers J.J., Cadkin T.A., McMahon K.D. Seasonal bacterial community dynamics in a full-scale enhanced biological phosphorus removal plant // Water Res. 2013. V. 47. P. 7019–7031.
Fossing H., Gallardo V.A., Jørgensen B.B., Hüttel M., Nielsen L.P., Schulz H., Canfield D.E., Forster S., Glud R.N., Gundersen J.K., Küver J., Ramsing N.B., Teske A., Thamdrup B., Ulloa O. Concentration and transport of nitrate by the mat-forming sulphur bacterium Thioploca // Nature. 1995. V. 374. P. 713–715.
Gu A.Z., Saunders A., Neethling J.B., Stensel H.D., Blackall L. Functionally relevant microorganisms to enhanced biological phosphorus removal performance at full-scale wastewater treatment plants in the United States // Water Environ. Res. 2008. V. 80. P. 688–698.
Hanada S., Liu W.T., Shintani T., Kamagata Y., Nakamura K. Tetrasphaera elongata sp. nov., a polyphosphate-accumulating bacterium isolated from activated sludge // Int. J. Syst. Evol. Microbiol. 2002. V. 52. P. 883–887.
He S., McMahon K.D. Microbiology of “Candidatus Accumulibacter” in activated sludge // Microb. Biotechnol. 2011. V. 4. P. 603–619.
He S., Gall D.L., McMahon K.D. “Candidatus Accumulibacter” population structure in enhanced biological phosphorus removal sludges as revealed by polyphosphate kinase genes // Appl. Environ. Microbiol. 2007. V. 73. P. 5865–5874.
He S., Gu A.Z., McMahon K.D. Progress toward understanding the distribution of Accumulibacter among full-scale enhanced biological phosphorus removal systems // Microbial Ecol. 2008. V. 55. P. 229–236.
Herndl G.J., Malacic V. Impact of the pycnocline layer on bacterioplankton: die1 and spatial variations in microbial parameters in the stratified water column of the Gulf of Trieste (Northern Adriatic Sea) // Mar. Ecol. Prog. Ser. 1987. V. 38. P. 295–303.
Hesselmann R.P. X., Werlen C., Hahn D., van der Meer J.R., Zehnder A.J.B. Enrichment, phylogenetic analysis and detection of a bacterium that performs enhanced biological phosphate removal in activated sludge // Syst. Appl. Microbiol. 1999. V. 22. P. 454–465.
Jørgensen B.B., Gallardo V.A. Thioploca spp: filamentous sulfur bacteria with nitrate vacuoles // FEMS Microbiol. Ecol. 1999. V. 28. P. 301–313.
Kawakoshi A., Nakazawa H., Fukada J., Sasagawa M., Katano Y., Nakamura S., Hosoyama A., Sasaki H., Ichikawa N., Hanada S., Kamagata Y., Nakamura K., Yamazaki S., Fujita N. Deciphering the genome of polyphosphate accumulating actinobacterium Microlunatus phosphovorus // DNA Res. 2012. V. 19. P. 383–394.
Kim J.M., Lee H.J., Kim S.Y., Song J.J., Park W., Jeon C.O. Analysis of the fine-scale population structure of “Candidatus Accumulibacter phosphatis” in enhanced biological phosphorus removal sludge, using fluorescence in situ hybridization and flow cytometric sorting // Appl. Environ. Microbiol. 2010. V. 76. P. 3825–3835.
Kong Y., Nielsen J.L., Nielsen P.H. Identity and ecophysiology of uncultured actinobacterial polyphosphate-accumulating organisms in full-scale enhanced biological phosphorus removal plants // Appl. Environ. Microbiol. 2005. V. 71. P. 4076–4085.
Kong Y., Xia Y., Nielsen J.L., Nielsen P.H. Structure and function of the microbial community in a full-scale enhanced biological phosphorus removal plant // Microbiology (SGM). 2007. V. 153. P. 4061–4073.
Kong Y., Xia Y., Nielsen P.H. Activity and identity of fermenting microorganisms in full-scale biological nutrient removing wastewater treatment plants // Environ. Microbiol. 2008. V. 10. P. 2008–2019.
Kong Y.H., Beer M., Seviour R.J., Lindrea K.C., Rees, G.N. Structure and functional analysis of the microbial community in an aerobic anaerobic sequencing batch reactor (SBR) with no phosphorus removal // Syst. Appl. Microbiol. 2001. V. 24. P. 597–609.
Kong Y.H., Nielsen J.L., Nielsen P.H. Microautoradiographic study of Rhodocyclus-related polyphosphate accumulating bacteria in full-scale enhanced biological phosphorus removal plants // Appl. Environ. Microbiol. 2004. V. 70. P. 5383–5390.
Kong Y.H., Xia Y., Nielsen J.L., Nielsen P.H. Ecophysiology of a group of uncultured Gammaproteobacterial glycogen-accumulating organisms in full-scale enhanced biological phosphorus removal wastewater treatment plants // Environ. Microbiol. 2006. V. 8. P. 479–489.
Kristiansen R., Nguyen H.T.T., Saunders A.M., Nielsen J.L., Wimmer R., Le V.Q., McIlroy S.J., Petrovski S. Seviour R.J., Calteau A., Nielsen K.L., Nielsen P.H. A metabolic model for members of the genus Tetrasphaera involved in enhanced biological phosphorus removal // ISME J. 2013. V. 7. P. 543–554.
Kuba T., Van Loosdrecht M.C.M., Murnleitner E., Heijnen J.J. Kinetics and stoichiometry in the biological phosphorus removal process with short cycle times // Water Res. 1997. V. 31. P. 918–928.
Kulaev I.S., Vagabov V.M., Kulakovskaya T.V. The Biochemistry of Inorganic Polyphosphates. 2nd ed. John Wiley & Sons, Ltd. 2004. 273 p.
Liu W.-T., Mino T., Nakamura K., Matsuo T. Role of glycogen in acetate uptake and polyhydroxyalkanoate synthesis in anaerobic-aerobic activated sludge with a minimized polyphosphate content // J. Ferm. Bioeng. 1994. V. 77. P. 535–540.
Liu W.-T., Nakamura K., Matsuo T., Mino T. Internal energy-based competition between polyphosphate- and glycogen-accumulating bacteria in biological phosphorus removal reactors effect of P/C feeding ratio // Water Res. 1997. V. 31. P. 1430–1438.
Lopez-Vazquez C.M., Song Y.I., Hooijmans C.M., Brdjanovic D., Moussa M.S., Gijzen H.J., van Loosdrecht M.M. Short-term temperature effects on the anaerobic metabolism of glycogen accumulating organisms // Biotechnol. Bioeng. 2007. V. 97. P. 483–495.
Lopez-Vazquez C.M., Oehmen A., Hooijmans C.M., Brdjanovic D., Gijzen H.J., Yuan Z., van Loosdrecht M.C.M. Modeling the PAO-GAO competition: effects of carbon source, pH and temperature // Water Res. 2009a. V. 43. P. 450–462.
Lopez-Vazquez C.M., Hooijmans C.M., Brdjanovic D., Gijzen H.J., van Loosdrecht M.C.M. Temperature effects on glycogen accumulating organisms // Water Res. 2009b. V. 43. P. 2852–2864.
Lu H., Oehmen A., Virdis B., Keller J., Yuan Z. Obtaining highly enriched cultures of “Candidatus Accumulibacter phosphatis” through alternating carbon sources // Water Res. 2006. V. 40. P. 3838–3848.
Mao Y., Graham D.W., Tamaki H., Zhang T. Dominant and novel clades of “Candidatus Accumulibacter phosphatis” in 18 globally distributed full-scale wastewater treatment plants // Sci. Rep. 2015. V. 5. P. 11857. https://www.nature.com/articles/srep11857
Marques R., Santos J., Nguyen H., Carvalho G., Noronha J.P., Nielsen P.H., Reis M.A.M., Oehmen A. Metabolism and ecological niche of Tetrasphaera and Ca. Accumulibacter in enhanced biological phosphorus removal // Water Res. 2017. V. 122. P. 159–171.
Martín G.H., Ivanova N., Kunin V., Warnecke F., Barry K.W., McHardy A.C., Yeates C., He S., Salamov A.A., Szeto E., Dalin E., Putnam N.H., Shapiro H.J., Pangilinan J.L., Rigoutsos I., Kyrpides N.C., Blackall L.L., McMahon K.D., Hugenholtz P. Metagenomic analysis of two enhanced biological phosphorus removal (EBPR) sludge communities // Nat. Biotechnol. 2006. V. 24. P. 1263–1269.
Maszenan A.M., Seviour R.J., Patel B.K.C., Janssen P.H., Wanner J. Defluvicoccus vanus gen. nov., sp. nov., a novel Gram-negative coccus/coccobacillus in the ‘Alphaproteobacteria’ from activated sludge // Int. J. Syst. Evol. Microbiol. 2005. V. 55. P. 2105–2111.
Maszenan A.M., Seviour R.J., Patel B.K.C., Schumann P., Burghardt J., Tokiwa Y., Stratton H.M. Three isolates of novel polyphosphate-accumulating Gram-positive cocci, obtained from activated sludge, belong to a new genus, Tetrasphaera gen. nov., and description of two new species, Tetrasphaera japonica sp. nov. and Tetrasphaera australiensis sp. nov. // Int. J. Syst. Evol. Microbiol. 2000. V. 50. P. 593–603.
McIlroy S., Seviour R.J. Elucidating further phylogenetic diversity among the Defluviicoccus-related glycogen-accumulating organisms in activated sludge // Environ. Microbiol. Rep. 2009. V. 1. P. 563–568.
McIlroy S.J., Nittami T., Kanai E., Fukuda J., Saunders A.M., Nielsen P.H. Re-appraisal of the phylogeny and fluorescence in situ hybridization probes for the analysis of the Competibacteraceae in wastewater treatment systems // Environ. Microbiol. Rep. 2015. V. 7. P. 166–174.
McIlroy S.J., Albertsen M., Andresen E.K., Saunders A.M., Kristiansen R., Stokholm-Bjerregaard M., Nielsen K.L., Nielsen P.H. ‘Candidatus Competibacter’-lineage genomes retrieved from metagenomes reveal functional metabolic diversity // ISME J. 2014. V. 8. P. 613–624.
McKenzie C.M., Seviour E.M., Schumann P., Maszenan A.M., Liu J.-R., Webb R.I., Monis P., Saint C.P., Steiner U., Seviour R.J. Isolates of ‘Candidatus Nostocoida limicola’ Blackall et al. (2000) should be described as three novel species of the genus Tetrasphaera, as Tetrasphaera jenkinsii sp. nov. Tetrasphaera vanveenii sp. nov. and Tetrasphaera veronensis sp. nov. // Int. J. Syst. Evol. Microbiol. 2006. V. 56. P. 2279–2290.
McIlroy S.J., Onetto C.A., McIlroy B., Herbst F.A., Dueholm M.S., Kirkegaard R.H., Fernando E., Karst S.M., Nierychlo M., Kristensen J.M., Eales K.L., Grbin P.R., Wimmer R., Nielsen P.H. Genomic and in situ analyses reveal the Micropruina spp. as abundant fermentative glycogen accumulating organisms in enhanced biological phosphorus removal systems // Front. Microbiol. 2018.https://doi.org/10.3389/fmicb.2018.01004
McMahon K.D., Dojka M.A., Pace N.R., Jenkins D., Keasling J.D. Polyphosphate kinase from activated sludge performing enhanced biological phosphorus removal // Appl. Environ. Microbiol. 2002. V. 68. P. 4971–4978.
McMahon K.D., He S., Oehmen A. The microbiology of phosphorus removal // Microbial Ecology of Activated Sludge / Eds. Seviour R., Nielsen P.H. London: IWA, 2010. Ch. 10. P. 281–319.
Mino T., Satoh H. Wastewater genomics // Nat. Biotechnol. 2006. V. 24. P. 1229–1230.
Mino T., Arun V., Tsuzuki Y., Matsuo T. Effect of phosphorus accumulation on acetate metabolism in the biological phosphorus removal // Biological Phosphate Removal from Wastewaters / Ed. Ramadori R. Oxford: Pergamon Press, 1987. P. 27–38.
Mino T., Van Loosdrecht M.C.M., Heijnen J.J. Microbiology and biochemistry of the enhanced biological phosphate removal process // Water Res. 1998. V. 32. P. 3193–3207.
Mino T., Liu W.-T., Kurisu F., Matsuo T. Modelling glycogen storage and denitrification capability of microorganisms in enhanced biological phosphate removal processes // Water Sci. Technol. 1995. V. 31. P. 25–34.
Mußmann M., Hu F.Z., Richter M., de Beer D., Preisler A., Jørgensen B.B., Huntemann M., Glockner F.O., Amann R., Koopman W.J.H., Lasken R.S., Janto B., Hogg J., Stoodley P., Boissy R., Ehrlich G.D. Insights into the genome of large sulfur bacteria revealed by analysis of single filaments // PLoS Biol. 2007. V. 5. P. 1923–1937.
Muszynski A., Zaleska-Radziwill M. Polyphosphate accumulating organisms in treatment plants with different wastewater composition // Architecture Civil Engineering Environment. 2015. V. 8. № 4. P. 99–105.
Nakamura K., Hiraishi A., Yoshimi Y., Kawaharasaki M., Masuda K., Kamagata Y. Microlunatus phosphovorus gen. nov., sp. nov., a new gram-positive polyphosphate-accumulating bacterium isolated from activated sludge // Int. J. Syst. Bacteriol. 1995. V. 45. P. 17–22.
Nakamura K., Masuda K., Mikami E. Isolation of a new type of polyphosphate accumulating bacterium and its phosphate removal characteristics // J. Ferment. Bioeng. 1991. V. 4. P. 258–263.
Nguyen H.T., Le V.Q., Hansen A.A., Nielsen J.L., Nielsen P.H. High diversity and abundance of putative polyphosphate-accumulating Tetrasphaera-related bacteria in activated sludge systems // FEMS Microbiol. Ecol. 2011. V. 76. P. 256–267.
Nguyen H.T., Kristiansen R., Vestergaard M., Wimmer R., Nielsen P.H. Intracellular accumulation of glycine in polyphosphate-accumulating organisms in activated sludge, a novel storage mechanism under dynamic anaerobic-aerobic conditions // Appl. Environ. Microbiol. 2015. V. 81. P. 4809–4818.
Nguyen H.T., Nielsen J.L., Nielsen P.H. “Candidatus Halomonas phosphatis”, a novel polyphosphate-accumulating organism in full-scale enhanced biological phosphorus removal plants // Environ. Microbiol. 2012. V.14. P. 2826–2837.
Nielsen J.L., Nguyen H., Meyer R.L., Nielsen P.H. Identification of glucose-fermenting bacteria in a full-scale enhanced biological phosphorus removal plant by stable isotope probing // Microbiology (SGM). 2012. V. 158. P. 1818–1825.
Oehmen A., Carvalho G., Lopez-Vazquez C.M., van Loosdrecht M.C.M., Reis M.A.M. Incorporating microbial ecology into the metabolic modelling of polyphosphate accumulating organisms and glycogen accumulating organisms // Water Res. 2010. V. 44. P. 4992–5004.
Oehmen A., Lemos P.C., Carvalho G., Yuan Z., Keller J., Blackall L.L., Reis M.A.M. Advances in enhanced biological phosphorus removal: From micro to macro scale // Water Res. 2007. V. 41. P. 2271–2300.
Oehmen A., Yuan Z., Blackall L.L., Keller J. Short-term effects of carbon source on the competition of polyphosphate accumulating organisms and glycogen accumulating organisms // Water Sci. Technol. 2004. V. 50. P. 139–144.
Onda S., Takii S. Isolation and characterization of a Gram-positive polyphosphate-accumulating Bacterium // J. Gen. Appl. Microbiol. 2002. V. 48. P. 125–133.
Oyserman B.O., Noguera D.R., del Rio T.G., Tringe S.G., McMahon K.D. Metatranscriptomic insights on gene expression and regulatory controls in Candidatus Accumulibacter phosphatis // ISME J. 2016. V. 10. P. 810–822.
Peterson S.B., Warnecke F., Madejska J., McMahon K.D., Hugenholtz P. Environmental distribution and population biology of Candidatus Accumulibacter, a primary agent of biological phosphorus removal // Environ. Microbiol. 2008. V. 10. P. 2692–2703.
Prokopenko M.G., Hirst M.B., De Brabandere L., Lawrence D.J., Berelson W.M., Granger J., Chang B.X., Dawson S., Crane E.J., Chong L., Thamdrup B., Townsend-Small A., Sigman D.M. Nitrogen losses in anoxic marine sediments driven by Thioploca–anammox bacterial consortia // Nature. 2013. V. 500. P. 194–198.
Rehm B.H.A. Bacterial polymers: biosynthesis, modifications and applications // Nature Rev. Microbiol. 2010. V. 8. P. 578–592.
Rubio-Rincón F.J., Lopez-Vazquez C.M., Welles L., van Loosdrecht M.C.M., Brdjanovic D. Cooperation between Candidatus Competibacter and Candidatus Accumulibacter clade I, in denitrification and phosphate removal processes // Water Res. 2017. V. 120. P. 156–164.
Rubio-Rincón F.J., Welles L., Lopez-Vazquez C.M., Nierychlo M., Abbas B., Geleijnse M., Nielsen P.H., van Loosd-recht M.C.M., Brdjanovic D. Long-term effects of sulphide on the enhanced biological removal of phosphorus: The symbiotic role of Thiothrix caldifontis // Water Res. 2017. V. 116. P. 53–64.
Saad A.S., Welles L., Lopez C.M, van Loosdrecht M.C.M., Brdjanovic D. Sulfide effects on the anaerobic metabolism of polyphosphate-accumulating organisms // Chem. Engin. J. 2017. V. 326. P. 68–77.
Salman V., Bailey J.V., Teske A. Phylogenetic and morphologic complexity of giant sulphur bacteria // Antonie Van Leeuwenhoek. 2013. V. 104. P. 169–186.
Santos M.M., Lemos P.C., Reis M.A., Santos H. Glucose metabolism and kinetics of phosphorus removal by the fermentative bacterium Microlunatus phosphovorus // Appl. Environ. Microbiol. 1999. V. 65. P. 3920–3928.
Satoh H., Mino T., Matsuo T. Anaerobic uptake of glutamate and aspartate by enhanced biological phosphorus removal activated sludge // Water Sci. Technol. 1998. V. 37. P. 579–582.
Schaechter M. From growth physiolog to systems biology // Int. Microbiol. 2006. V. 9. P. 157–161.
Schulz H.N. The genus Thiomargarita // The Prokaryotes. 3rd ed. / Eds. Dworkin M., Falkow S., Rosenberg E., Schleifer K.-H., Stackebrandt E. New York: Springer, 2006. V. 6. P. 1156–1163.
Schulz H.N., Brinkhoff T., Ferdelman T.G., Marine M.H., Teske A., Jørgensen B.B. Dense populations of a giant sulfur bacterium in Namibian shelf sediments // Science. 1999. V. 284. P. 493–495.
Schulz H.N., Schulz H.D. Large sulfur bacteria and the formation of phosphorite // Science. 2005. V. 307. P. 416–418.
Seviour R.J., Mino T., Onuki M. The microbiology of biological phosphorus removal in activated sludge systems // FEMS Microbiol. Rev. 2003. V. 27. P. 99–127.
Shintani T., Liu W.T., Hanada S., Kamagata Y., Miyaoka S., Suzuki T., Nakamura K. Micropruina glycogenica gen. nov., sp. nov., a new Gram-positive glycogen-accumulating bacterium isolated from activated sludge // Int. J. Syst. Evol. Microbiol. 2000. V. 50. P. 201–207.
Skennerton C.T., Barr J.J., Slater F.R., Bond P.L., Tyson G.W. Expanding our view of genomic diversity in Candidatus Accumulibacter clades // Environ. Microbiol. 2015. V. 17. P. 1574–1585.
Soo R.M., Skennerton C.T., Sekiguchi Y., Imelfort M., Paech S.J., Dennis P.G., Steen J.A., Parks D.H., Tyson G.W., Hugenholtz P. An expanded genomic representation of the phylum Cyanobacteria // Genome Biol. Evol. 2014. V. 6. P. 1031–1045.
Spring S., Wagner M., Schumann P., Kämpfer P. Malikia granosa gen. nov., sp. nov., a novel polyhydroxyalkanoate- and polyphosphate-accumulating bacterium isolated from activated sludge, and reclassification of Pseudomonas spinosa as Malikia spinosa comb. nov. // Int. J. Syst. Evol. Microbiol. 2005. V. 55. P. 621–629.
Stockholm-Bjerregaard M., McIlroy S.J., Nierychlo M., Karst S.M., Albertsen M., Nielsen P.H.A Critical assessment of the microorganisms proposed to be important to enhanced biological phosphorus removal in full-scale wastewater treatment systems // Front Microbiol. 2017. V. 8. P. 718.https://doi.org/10.3389/fmicb.2017.00718
Sun L., Zhao X., Zhang H., Zhang Y. Biological characteristics of a denitrifying phosphorus-accumulating bacterium // Ecol. Engin. 2015. V. 81. P. 82–88.
Tarayre C., Charlier R., Delepierre A., Brognaux A., Bauwens J., Francis F., Dermience M., Lognay G., Taminiau B., Daube G., Compère P., Meers E., Michels E., Delvigne F. Looking for phosphate-accumulating bacteria in activated sludge processes: a multidisciplinary approach // Environ. Sci. Pollut. Res. 2017. V. 24. P. 8017–8032.
Terashima M., Yama A., Sato M., Yumoto I., Kamagata Y., Kato S. Culture-dependent and -independent identification of polyphosphate-accumulating Dechloromonas spp. predominating in a full-scale oxidation ditch wastewater treatment plant // Microbes Environ. 2016. V. 31. P. 449–455.
Teske A., Salman V. The Family Beggiatoaceae // The Prokaryotes. Gammaproteobacteria / Ed.-in-chief: Rosen-berg E. Eds. DeLong E.F., Lory S., Stackebrandt E., Thompson F. Berlin–Heidelberg: Springer-Verlag, 2014. P. 93–134.
Van Loosdrecht M.C.M., Hooijmans C.M., Brdjanovic D., Heijnen J.J. Biological phosphate removal processes // A-ppl. Microbiol. Biotechnol. 1997. V. 48. P. 289–296.
Vieira A., Ribera-Guardia A., Marques R., Barreto Crespo M.T., Oehmen A., Carvalho G. The link between the microbial ecology, gene expression, and biokinetics of denitrifying polyphosphate-accumulating systems under different electron acceptor combinations // Appl. Microbiol. Biotechnol. 2018. V. 102. P. 6725–6737.
Welles L., Abbas B., Sorokin D.Y., Lopez-Vazquez C.M., Hooijmans C.M., van Loosdrecht M.C.M., Brdjanovic D. Metabolic response of ‘Candidatus Accumulibacter phosphatis’ clade II to changes in the influent P/C ratio // Front. Microbiol. 2016. V. 7. P. 2121.https://doi.org/10.3389/fmicb.2016.02121
Welles L., Tian W.D., Saad S., Abbas B., Lopez-Vazquez C.M., Hooijmans C.M., van Loosdrecht M.C.M., Brdjanovic D. Accumulibacter clades Type I and II performing kinetically different glycogen-accumulating organisms metabolisms for anaerobic substrate uptake // Water Res. 2015. V. 83. P. 354–366.
Wentzel M.C., Comeau Y., Ekama G.A., van Loosdrecht M.C.M., Brdjanovic D. Enhanced biological phosphorus removal // Biological Wastewater Treatment: Principles, Modelling and Design / Eds. Henze M., van Loosdrecht M.C.M., Ekama G.A., Brdjanovic D. London: IWA Pub., 2008. P. 155–220.
Wentzel M.C., Loewenthal R.E., Ekama G.A., Marais G.V.R. Enhanced polyphosphate organism cultures in activated sludge systems. Part 1: Enhanced culture development // Water S.A. 1988. V. 14. P. 81–92.
Wexler M., Richardson D.J., Bond P.L. Radiolabelled proteomics to determine differential functioning of Accumulibacter during the anaerobic and aerobic phases of a bioreactor operating for enhanced biological phosphorus removal // Environ. Microbiol. 2009. V. 11. P. 3029–3044.
Wong M.-T., Liu W.-T. Ecophysiology of Defluviicoccus-related tetrad-forming organisms in an anaerobic-aerobic activated sludge process // Environ. Microbiol. 2007. V. 9. P. 1485–1496.
Zeng R.J., van Loosdrecht M.C.M., Yuan Z.G., Keller J. Metabolic model for glycogen-accumulating organisms in anaerobic/aerobic activated sludge systems // Biotechnol. Bioeng. 2003. V. 81. P. 92–105.
Zeng W., Bai X., Guo Y., Li N., Peng Y. Interaction of “Candidatus Accumulibacter” and nitrifying bacteria to achieve energy-efficient denitrifying phosphorus removal via nitrite pathway from sewage // Enzyme Microb. Technol. 2017. V. 105. P. 1–8.
Zeng W., Li B., Wang X., Bai X., Peng Y. Integration of denitrifying phosphorus removal via nitrite pathway, simultaneous nitritation-denitritation and anammox treating carbon-limited municipal sewage // Bioresource Technol. 2014. V. 172. P. 356–364.
Zeng R.J., Yuan Z., Keller J. Model-based analysis of anaerobic acetate uptake by a mixed culture of polyphosphate-accumulating and glycogen-accumulating organisms // Biotechnol. Bioeng. 2003. V. 83. P. 293–302.
Zhang H., Sekiguchi Y., Hanada S., Hugenholtz P., Kim H., Kamagata Y., Nakamura K. Gemmatimonas aurantiaca gen. nov., sp. nov., a Gram-negative, aerobic, polyphosphate-accumulating microorganism, the first cultured representative of the new bacterial phylum Gemmatimonadetes phyl. nov. // Int. J. Syst. Evol. Microbiol. 2003. V. 53. P. 1155–1163.
Zhang Y., Yu M., Guo J., Wu D., Hua Z.-S., Chen G.-H., Lu H. Spatiotemporal heterogeneity of core functional bacteria and their synergetic and competitive interactions in denitrifying sulfur conversion-assisted enhanced biological phosphorus removal // Sci. Rep. 2017. V. 7. Article 10927.https://doi.org/10.1038/s41598-017-11448-x
Zhang C., Chen Y.G., Randall A.A., Gu G.W. Anaerobic metabolic models for phosphorus- and glycogen-accumulating organisms with mixed acetic and propionic acids as carbon sources // Water Res. 2008. V. 42. P. 3745–3756.
Zilles J.L., Hung C.H., Noguera D.R. Presence of Rhodocyclus in a full-scale wastewater treatment plant and their participation in enhanced biological phosphorus removal // Water Sci. Technol. 2002a. V. 46. P. 123–128.
Zilles J.L., Peccia J., Kim M., Hung C., Noguera D.R. Involvement of Rhodocyclus-related organisms in phosphorus removal in full-scale wastewater treatment plants // Appl. Environ. Microbiol. 2002b. V. 68. P. 2763–2769.
Zopfi J., Kjaer T., Nielsen L.P., Jørgensen B.B. Ecology of Thioploca spp.: nitrate and sulfur storage in relation to chemical microgradients and influence of Thioploca spp. on the sedimentary nitrogen cycle // Appl. Environ. Microbiol. 2001. V. 67. P. 5530–5537.
Дополнительные материалы отсутствуют.