Микробиология, 2019, T. 88, № 5, стр. 583-595
Бактерии рода Shewanella из загрязненных радионуклидами подземных вод
Т. Л. Бабич a, А. В. Сафонов b, Д. С. Груздев a, Н. Д. Андрющенко b, Е. В. Захарова b, Т. Н. Назина a, *
a Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской академии наук
117312 Москва, Россия
b Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Россия
* E-mail: nazina@inmi.ru
Поступила в редакцию 26.12.2018
После доработки 25.02.2019
Принята к публикации 29.03.2019
Аннотация
Поверхностные хранилища жидких радиоактивных отходов (РАО), выведенные из эксплуатации, остаются потенциальным источником загрязнения подземных вод. Создание биогеохимических барьеров, позволяет снижать миграцию как радиоактивных, так и токсичных макрокомпонентов отходов. В статье приведены результаты изучения состава микробного сообщества подземных вод, отобранных в районе поверхностного хранилища жидких радиоактивных отходов. Методом высокопроизводительного секвенирования генов 16S рРНК выявлены доминирующие и минорные компоненты сообщества, среди которых присутствовали бактерии рода Shewanella. Выделенные чистые культуры Shewanella putrefaciens J1-6-2-2 и А-4-3 и Shewanella xiamenensis DCB2-1 способны восстанавливать нитрат-ионы до молекулярного азота, что приводит к снижению окислительно-восстановительного потенциала среды и способствует восстановлению пертехнетат-, уранил- и хромат-ионов и их осаждению. В присутствии органических субстратов штаммы формируют биопленки на поверхности ряда природных материалов (вермикулита, перлита, шунгита и др.), характеризующихся высокими сорбционными характеристиками для цезия, стронция, урана и технеция. При анализе генома штамма DCB2-1 обнаружен кластер генов, гомологичных таковым известного штамма S. oneidensis MR-1, детерминирующих формирование биопленок. Выделенные штаммы могут быть использованы для интродукции в подземные горизонты и обогащения природного микробного сообщества с целью создания биогеохимического барьера для очистки подземных вод от нитрат-ионов и иммобилизации радиоактивных компонентов отходов.
Проблема загрязнения водоносных горизонтов разной глубины залегания токсичными соединениями на сегодняшний день стоит крайне остро и не имеет эффективных решений. Актуальность проблемы обусловлена риском неуправляемой миграции загрязнителей с подземными водами на большие расстояния от источника загрязнения как в области разгрузки – открытые крупные водоемы, так и в зоны, используемые для водозабора. В перечень наиболее опасных загрязнителей входят тяжелые металлы, радионуклиды, некоторые органические вещества (галогенсодержащие, пестициды, гербициды и др.), а также анионы кислот в высоких концентрациях (например, нитраты и сульфаты) (Rybal’chenko et al., 1998; Wall, Krumholz, 2006).
Причинами масштабных загрязнений подземных вод являются глубинные и поверхностные хранилища жидких радиоактивных отходов (РАО), шламо- и хвостохранилища горно-добывающих предприятий, подземные ядерные взрывы, аварийные ситуации на предприятиях ядерно-топливного цикла. Высокие уровни загрязнения водоносных горизонтов наблюдаются в районах “исторических хранилищ” жидких радиоактивных отходов, расположенных на территориях ПО “Маяк”, АО “Сибирский химический комбинат” (АО “СХК”) и ФГУП “Горно-химический комбинат” (ФГУП “ГХК”), созданных в период гонки вооружений в середине XX века. Даже после окончания их эксплуатации, вплоть до полной консервации, хранилища являются источником загрязнения водоносных горизонтов средне- и долгоживущими радиоактивными элементами (U, Tc, Sr, Cs, Pu, Am) и макрокомпонентами жидких РАО, к которым, в первую очередь, относятся соли азотной кислоты. Вымываясь из зоны хранилищ (с концентрацией до 300 г/л), они попадают в подземные воды и в определенных участках пласта образуют зоны с концентрацией до 5–7 г/л (Rybal’chenko et al., 1998; Сафонов и соавт., 2015).
Для предотвращения миграции токсичных соединений в водоносных горизонтах применяются разные подходы: откачка подземных вод и их очистка на поверхности (Chang et al., 2007); создание на пути движения подземных вод непроницаемых инженерных барьеров из глин, бетона или полифункциональных материалов (Sellin, Leupin, 2013). В ряде случаев такие методы являются технически сложными и дорогостоящими, а при масштабных загрязнениях практически не осуществимыми. Альтернативным подходом могут служить методы, основанные на закачке в пласт через серию скважин растворов или суспензий восстановителей (коллоидного железа, сероводорода, аммиака, органических соединений) для стимулирования развития аборигенной микрофлоры водоносного пласта, приводящего к иммобилизации загрязнителей с переменными степенями окисления и снижению их миграции (Ortiz-Bernad et al., 2004; Michalsen et al., 2009; Xu et al., 2010; Noubactep et al., 2012). Как правило, в этом случае стоимость работ существенно снижается, однако применение этих методов ограничено составом загрязнителя. Так, наибольшая эффективность наблюдается по отношению к технецию, урану, нитрат-ионам, а минимальная – при загрязнении цезием и стронцием. Отметим, что использование непроницаемых барьеров осложнено изменением гидрогеологических параметров пласта и образованием со временем локальных зон протечки загрязненных растворов по краям сооружения. Таким образом, главным преимуществом фильтрационных инженерных барьеров является возможность их закладки без нарушения гидрогеологических параметров пласта.
Принцип микробиологической in situ биоремедиации загрязненных водоносных горизонтов заключается в стимулировании органическими субстратами, нагнетаемыми в пласт, микробного сообщества, использующего основные загрязнители в качестве окислителей. Рост микроорганизмов сопровождается изменением физико-химических параметров подземных вод (рН, Eh), состава минеральных фаз (железо, сульфиды, карбонаты), сорбционных характеристик минералов за счет образования микробного экзополисахаридного матрикса.
В России были проведены испытания биотехнологии in situ биоремедиации подземных вод от нитрат-ионов в районе законсервированного поверхностного хранилища радиоактивных отходов на территории АО “Сибирский химический комбинат” (Сафонов и соавт., 2015). Нагнетание молочной сыворотки в сочетании с ацетатом натрия способствовало временному локальному удалению нитрат-ионов микробным сообществом подземных вод. Однако проблема снижения миграции радионуклидов остается нерешенной. Известно, что радионуклиды переходят из высокорастворимой окисленной формы в восстановленную малорастворимую форму после удаления нитратов и снижения окислительно-восстановительного потенциала среды (Senko et al., 2002; Wu et al., 2010). В этой связи большой интерес представляют факультативно-анаэробные бактерии рода Shewanellа, способные не только восстанавливать нитраты и металлы с переменной валентностью, но и выделять экзополисахариды и изменять геохимические параметры подземного горизонта (Wildung et al., 2000; Gibert et al., 2008; Sheng, Fein, 2014). Эти свойства шеванелл обусловливают возможность их использования для биотехнологических целей в качестве компонента проницаемого барьера в подземных водах, загрязненных нитратами и радионуклидами.
Целью работы было изучить состав микробного сообщества загрязненных подземных вод, отобранных в районе поверхностного хранилища жидких радиоактивных отходов, выделить бактерии рода Shewanellа, способные восстанавливать нитрат-ионы и радионуклиды, исследовать их планктонный рост и формирование биопленок на разных минеральных носителях и выявить гены, связанные с формированием биопленок.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объект исследования. Объектом исследования были микроорганизмы подземных вод, отобранных в районе бассейна Б-2 – поверхностного хранилища жидких РАО. С 1964 г. бассейн используется для сбора и длительного хранения жидких радиоактивных отходов на территории АО “Сибирский химический комбинат” (Сафонов и соавт., 2015). Бассейн представляет собой специальное гидротехническое сооружение, площадью 51 400 м2, по дну и откосам которого уложен глиняный экран и сверху нанесен защитный слой песка. В 2012 г. бассейн был выведен из эксплуатации. Однако длительное его использование привело к загрязнению нитратами и радионуклидами подземных вод в районе хранилища. Температура песчаного водоносного горизонта в районе бассейна Б-2 составляет ~10°С, при этом ее среднегодовые различия не превышают 0.14°С.
Микробиологические методы. В работе исследовали чистые культуры бактерий Shewanella putrefaciens J1-6-2-2 и А-4-3 из коллекции лаборатории нефтяной микробиологии ФИЦ Биотехнологии РАН. Штамм J1-6-2-2 был выделен из пробы подземных вод, отобранных в районе поверхностного хранилища жидких РАО – озера Карачай (ПО “Маяк”, г. Озерск, Челябинская обл.); штамм А-4-3 – из глубинного хранилища жидких РАО (АО “СХК”, г. Северск, Томская обл.) (Nazina et al., 2010).
Накопительные культуры железоредуцирующих бактерий получали путем посева проб подземных вод на среду с ацетатом и цитратом железа(III) (Lovley, Phillips, 1988). Бактерии рода Shewanella культивировали аэробно в жидкой минеральной среде (MM – mineral medium, г/л): K2HPO4 – 1.5; KH2PO4 – 0.75; NH4Cl – 0.3; NaCl – 5.0; MgSO4 · · 7H2O – 0.1; KCl – 0.1; CaCl2 – 0.02, рН 7.0. В среду вносили микроэлементы (1 мл/л), как указано ранее (Safonov et al., 2018). В качестве субстратов использовали: D-глюкозу (5.0 г/л), D-сахарозу (5.0 г/л), этанол (0.2 об. %), лактат (2.5 г/л), ацетат (2.8 г/л), глицерин (0.1 об. %), формиат (2.8 г/л), сукцинат (2.8 г/л), оксалат (2.8 г/л), молочную сыворотку (2.5 об. %). Способность штаммов к денитрификации исследовали по образованию молекулярного азота на среде MM с добавлением ацетата натрия (2.8 г/л) и нитрат-ионов (0.85 г/л) в качестве акцептора электронов, с аргоном в качестве газовой фазы. Бактерии инкубировали при комнатной температуре (20°С), если не оговорены иные условия эксперимента.
Формирование биопленок на минеральных (цеолит, перлит, вермикулит, шунгит, керамзит) и органическом (опилки) носителях и рост планктонной культуры определяли методом окрашивания с МТТ (3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2Н-тетразолия бромид) с последующей экстракцией образованного формазана с помощью ДМСО (диметилсульфоксида) и измерением оптической плотности экстракта в области 500–600 нм, как предложено ранее (Wang et al., 2010; Plakunov et al., 2016). В работе использовали вермикулит (2.5% вес/об., фракция 1–4 мм, производство ООО “Росвермикулит”), перлит (2.5% вес/об., 1–3 мм, ООО “РесурсТехнологии”), цеолит Трейд (10.0% вес/об., 3–5 мм, Кондопожское месторождение), шунгит (12.5% вес/об., 1–3 мм, Максовское месторождение) и сосновые опилки (1.5% вес/об., 3–5 мм).
Микроскопию биопленок осуществляли с использованием сканирующего электронного микроскопа TESCANVEGA-IIXMU c микроанализатором Inca Energy (“Oxford Instruments Analytical”) при увеличении ×2000. После роста биопленок на образцах вермикулита и перлита их помещали на прободержатель и высушивали при комнатной температуре в течение 1 сут, после чего создавали токопроводящее покрытие сплавом золота и пал-ладия методом термического вакуумного напыления.
Аналитические методы. Прирост биомассы в жидкой среде оценивали спектрофотометрически по величине оптической плотности при длине волны 590 или 540 нм на приборе Ultrospec 2100 pro (“Amersham Biosciences”, Великобритания). Величину pH определяли с помощью pH-метра-иономера S220 SevenCompact (“MettlerToledo”, Швейцария), снабженного комбинированным электродом. Величину Еh определяли с помощью ионометра АНИОН 4100 (Россия). Содержание нитрат-ионов определяли с помощью ионометра АНИОН 4100 (Россия) с использованием комбинированного ионселективного электрода фирмы “Ионикс альфа”. Нитрит-ионы определяли колориметрическим способом с помощью реактива Грисса на спектрофотометре Ultrospec 2100 pro (“Amersham Biosciences”, Великобритания) при длине волны 540 нм. Молекулярный азот определяли на хроматографе ЛХМ 80, снабженном детектором по теплопроводности, на колонке размером 2.0 м × 0.2 см, заполненной молекулярным ситом 5A. Температура колонки составляла 40°C, испарителя – 70°C, детектора – 90°C. Газ-носитель аргон подавали со скоростью 100 мл/мин. Хроматограф снабжен программно-аппаратным комплексом, состоящим из аналого-цифрового преобразователя (блок АЦП-4) и программы обработки хроматографической информации “Z-Хром”.
Эксперименты по восстановлению металлов проводили в пенициллиновых флаконах в 10 мл питательной среды, содержащей 5 × 10–4 M 238U в виде уранил нитрата и 10–3 М 99Tc в виде пертехнетата натрия или хромата (30 мг/л), ино-кулированной 1 мл суспензии клеток. Анализ восстановления технеция и хрома проводили с дифенилкарбазидом (Al-Kayssi et al., 1962), урана – с использованием арсеназоIII после жидкостной экстракции 1-(2-теноил)-3,3,3-трифторацетоном (ТТА) (Onishi, Sekine, 1972).
Сорбционные эксперименты проводили в полипропиленовых виалах, в которые вносили определенный объем раствора, содержащего радионуклид в концентрации моль/л (Бк/л): 137Cs – 2.6 × 10–10 (1.2 × 105); 90Sr – 1.4 × 10–10 (6.5 × 104), 99Tc (${\text{TcO}}_{4}^{ - }$) – 1.2 × 10–6 (7.5 × 104) и 233U (${\text{UO}}_{2}^{{2 + }}$) – 4.8 × 10–7 (4.0 × 104). Через 28 сут инкубации при комнатной температуре отбирали аликвоты жидкой фазы для определения концентрации радионуклидов. По уменьшению активности в растворе оценивали степень сорбции радионуклида (S, %) и рассчитывали коэффициент распределения радионуклида между твердой и жидкой фазами (Кd) по формуле:
где Ств – концентрация радионуклида на твердой фазе; Сж – концентрация радионуклида в жидкой фазе; V – объем жидкой фазы, см3; m – масса твердой фазы, г.Содержание радионуклидов определяли жидкосцинтилляционным методом с применением радиометра Tri-Carb-3180 TR/SL (“Perkin-Elmer”, США).
Выделение ДНК, амплификация и секвенирование генов 16S рРНК микроорганизмов подземных вод. Пробы подземных вод, отобранные в районе поверхностного хранилища РАО, фиксировали на месте отбора этанолом (1 : 1, об.), затем в лаборатории фильтровали через мембранные фильтры с размером пор 0.22 мкм (“Millipore”, США). Биомассу клеток смывали с фильтров лизирующим раствором, содержащим 0.15 M NaCl и 0.1 M Na2EDTA (pH 8.0), и использовали для выделения ДНК стандартным методом (Maniatis et al., 1984). Для получения библиотеки фрагментов генов 16S рРНК был амплифицирован V3–V4 гипервариабельный регион гена, и на основе двойного баркодирования были приготовлены библиотеки, как описано ранее (Fadrosh et al., 2014). Смысловые участки праймеров были взяты в соответствии с парой праймеров Pro341F–Pro805R (Takahashi et al., 2014). Условия амплификации приведены ранее (Safonov et al., 2018). Секвенирование проводили на платформе MiSeq (“Illumina”, США) c использованием набора реагентов MiSeq Reagent Kit v3 (600 cycles) (“Illumina”, США) в соответствии с рекомендациями производителя.
Биоинформатический анализ. Полученные фрагменты гена 16S рРНК (риды) были обрезаны с помощью программы trimmomatic-0.36 по алгоритму SLIDINGWINDOW:4:15 (Bolger et al., 2014); правосторонние и левосторонние прочтения объединены с помощью программы SeqPrep (https://github.com/jstjohn/SeqPrep). Демультиплексирование и фильтрацию химерных последовательностей проводили при помощи программы Qiime (Caporaso et al., 2010). Библиотеки фрагментов генов 16S рРНК бактерий и архей создавали по результатам первичной идентификации последовательностей сообщества с помощью ресурсов RDP и SILVA. В дальнейшем каждую из библиотек анализировали раздельно. Для этих целей последовательности объединяли в операционные таксономические единицы (OTE) c уровнем сходства >98% с последующей их таксономической идентификацией. При анализе библиотеки бактерий учитывали только OTE, содержащие не менее 10 последовательностей.
Геномы штаммов S. oneidensis MR-1 и S. xiamenensis DCB2-1 сравнивали с использованием BLASTP анализа (Altschul et al., 1997). Филогенетический анализ последовательностей генов 16S рРНК выделенных штаммов проводили с использованием программы BLAST сервера NCBI (www.ncbi.nlm.nih.gov/blast/).
Последовательности генов 16S рРНК штаммов S. putrefaciens J1-6-2-2 и А-4-3 и S. xiamenensis DCB2-1 депонированы в Генбанк под номерами MG205616, MH456877 и MG051295 соответственно. Библиотека фрагментов гена 16S рРНК микроорганизмов подземных вод депонирована в NCBI SRA под номером SRP119496.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Физико-химическая характеристика подземных вод в районе поверхностного хранилища РАО. Пробы подземных вод отбирали из наблюдательных скважин, расположенных в зоне загрязнения растворами из законсервированного поверхностного хранилища радиоактивных отходов (скважины B, C, D и E) и вне этой зоны (скважина А). Подземные воды имеют рН близкий к нейтральному (от 6.2 до 7.5). Значения Eh варьируют от –20 до +150 мВ при среднем значении от +50 до +70 мВ, что характеризует окислительно-восстановительные условия этого горизонта как микроаэрофильные с переходом в бескислородную область. Значения окислительно-восстановительного потенциала пластовых вод не препятствуют протеканию микроаэробных процессов и способствуют миграции металлов в их высшей степени окисления. В пластовой жидкости, отобранной из наблюдательных скважин в районе бассейна Б-2, наблюдалось значительное увеличение содержания нитрат-ионов, стронция, трития и урана по сравнению с фоновыми значениями (табл. 1). Превышение ПДК по цезию и технецию не наблюдалось, однако в водоносном горизонте присутствуют локальные зоны с заметным увеличением концентрации обоих радионуклидов.
Таблица 1.
Характеристика химического и радиохимического состава проб пластовой жидкости из скважин в районе бассейна Б-2
| рH | ХПК*, мг О/дм3 | Содержание, мг/л | Активность, Бк/л | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ∑Fe | Na+ | K+ | ${\text{NH}}_{4}^{ + }$ | ${\text{NO}}_{3}^{ - }$ | ${\text{SO}}_{4}^{{2 - }}$ | 137Cs | 90Sr | ∑U | ||
| 6.2–7.5 | 2.2–12.0 | 0.1–4.3 | 245–506 | 4.8–6.0 | 1.8–6.2 | 0.1–1567 | 41–152 | <0.01 | 396–1364 | 0.1–1.8 |
Филогенетическое разнообразие Bacteria в пробах подземных вод, отобранных в районе поверхностного хранилища РАО. Методом высокопроизводительного секвенирования ампликонов V3–V4 региона гена 16S рРНК был исследован состав микробного сообщества проб подземных вод, отобранных из скважин A, B, E и D, и созданы библиотеки (gwA, gwB, gwE и gwD соответственно; gw – groundwater). Библиотеки содержали от 30 тыс. до 54 тыс. последовательностей (ридов) Bacteria. Последовательности архей не превышали 0.002% в библиотеках и не были включены в анализ. В библиотеке подземной воды из скважины А, расположенной вне зоны загрязнения, доминировали последовательности представителей Firmicutes (45.6%), Bacteroidetes (29.4%) и Proteobacteria (15.9%). В библиотеках воды из зоны загрязнения (скважины B, D и E) доминирующими компонентами сообщества были Proteobacteria (61.4–96.8%), филотипы которых принадлежали бактериям родов Acidovorax, Thiobacillus, Gaiella, Thermomonas, Rhodoferax, Simplicispira, Rhodanobacter и др. (табл. 2). В предыдущей публикации было показано, что представители этих родов, выделенные в чистую культуру, были способны осуществлять денитрификацию и могли участвовать в очистке подземных вод от нитрат ионов (Safonov et al., 2018).
Таблица 2.
Разнообразие филотипов представителей Bacteria и минорных филотипов бактерий рода Shewanella в библиотеках генов 16S рРНК микробных сообществ загрязненных подземных вод* (он-лайн ресурс Silva)
| Таксономическая группа** | % от общего количества последовательностей в библиотеке из скважины | |||
|---|---|---|---|---|
| Скважины | А | B | D | E |
| Библиотека | gwA-16 | gwB-17 | gwD-17 | gwE-17 |
| Количество ридов в библиотеке | 30 152 | 54 138 | 50 089 | 41 540 |
| Доминантные филотипы* | ||||
| Proteobacteria | 15.98 | 64.91 | 61.44 | 96.86 |
| Alphaproteobacteria | 6.44 | 1.53 | 6.91 | 4.75 |
| Magnetovibrio | 0 | 0 | 0.02 | 2.44 |
| Phyllobacterium | 2.61 | 0.05 | 0.01 | 0.01 |
| Betaproteobacteria | 2.25 | 44.85 | 51.45 | 91.50 |
| Acidovorax | 0.16 | 0.20 | 9.91 | 87.93 |
| Polaromonas | 0.06 | 0.39 | 3.79 | 0.08 |
| Rhodoferax | 0.06 | 0.82 | 9.52 | 0.30 |
| Simplicispira | 0.06 | 4.58 | 8.90 | 2.46 |
| Thiobacillus | 0.01 | 21.89 | 1.88 | 0.03 |
| Uncultured Gallionellaceae | 0.01 | 7.71 | 5.14 | 0.34 |
| Gammaproteobacteria | 6.83 | 16.85 | 2.19 | 0.60 |
| Thermomonas | 0 | 11.13 | 0.12 | 0.02 |
| Actinobacteria | 2.17 | 7.60 | 22.90 | 1.19 |
| Gaiella | 0.01 | 1.73 | 16.81 | 0.54 |
| Firmicutes | 45.60 | 2.35 | 0.93 | 0.09 |
| Faecalibacterium | 13.07 | 0.04 | 0.04 | 0.01 |
| Roseburia | 3.17 | 0.01 | 0.01 | 0 |
| Bacteroidetes | 29.45 | 6.14 | 6.81 | 0.36 |
| Bacteroides | 12.04 | 0.03 | 0.04 | 0.03 |
| Prevotella | 8.94 | 0.02 | 0.03 | 0.01 |
| Uncultured Prolixibacteraceae | 0 | 1.45 | 3.68 | 0.03 |
| Минорные филотипы | ||||
| Gammaproteobacteria | ||||
| Shewanella OTU107 | 0.068 | 0.029 | 0 | 0.003 |
| Shewanella OTU1328 | 0.003 | 0 | 0.003 | 0 |
| Shewanella OTU1369 | 0.098 | 0.003 | 0 | 0 |
Было необходимо выяснить присутствие в составе подземного микробного сообщества бактерий, способных восстанавливать радионуклиды. Наиболее известными представителями группы уран- и металл-редуцирующих прокариот являютcя бактерии родов Shewanella, Geobacter и Desulfovibrio (Wall, Krumholz, 2006). Последовательности этих бактерий присутствовали в полученных библиотеках в минорных количествах. Особое внимание было уделено бактериям рода Shewanella, которых ранее выделяли из подобных местообитаний (Nazina et al., 2010). В библиотеках gwA, gwB, gwD и gwE были выявлены три филотипа (OTU107, OTU1328 и OTU1369), принадлежащие бактериям рода Shewanella. Последовательность OTU107 имеет 98.8% сходства с соответствующим фрагментом генов 16S рРНК пяти видов шеванелл, в том числе, S. xiamenensis S4 (NR_116732.1), S. oneidensis MR-1 (NR_074798.1) и S. putrefaciens NBRC 3908 (NR_113582.1). Последовательность OTU1328 имеет 100% сходства с генами S. baltica 63 (NR_025267.1) и S. hafniensis NBRC 100 975 (NR_113967.1), а OTU1369 идентична генам трех видов, в том числе, S. arctica IR12 (NR_117528.1).
Выделение и физиологические характеристики бактерий рода Shewanella. Накопительные культуры, полученные путем посева проб подземных вод в среду для железоредуцирующих бактерий (Lovley, Phillips, 1988), были использованы для выделения чистых культур. Учитывая способность шеванелл к аэробному росту, эти бактерии получали из накопительных культур методом посева на среду PCA (Plate count agar, “Sigma”). Изолированный в чистую культуру штамм DCB2-1 был выделен из подземной воды из скважины B. Фрагмент гена 16S рРНК штамма DCB2-1 был идентичен последовательности OTU107 из gwA, gwB и gwE библиотек. На основании анализа гена 16S рРНК штамм DCB2-1 был отнесен к виду Shewanella xiamenensis (Huang et al., 2010), выделенному из прибрежных морских осадков и способному восстанавливать нитраты, нитриты, селенит, фумарат и оксид железа в анаэробных условиях. Выделенные штаммы S. xiamenensis DCB2-1 и S. putrefaciens J1-6-2-2 и А-4-3 росли на индивидуальных органических соединениях и на многокомпонентных субстратах, продуктах многотоннажного производства. Штамм DCB2-1 накапливал большую биомассу в средах с лактатом, сукцинатом, этанолом и глюкозой, штамм А-4-3 рос на лактате, глюкозе и сахарозе, штамм J1-6-2-2 – на лактате и глюкозе. Все три штамма накапливали большую биомассу в среде с молочной сывороткой, содержащей как легкодеградируемые (сахара, белки), так и сложнодеградируемые молекулы (жиры и высокополимерные компоненты), и не использовали глицерин, формиат и оксалат. Использование молочной сыворотки может быть перспективным для активации микробных процессов при создании фильтрационного барьера в загрязненных подземных горизонтах.
Штаммы росли в диапазоне температуры от 5 до 35°С с максимумом роста при 13°С (шт. DCB2-1 и А-4-3) и при 9°С (шт. J1-6-2-2). Рост наблюдали в интервале солености от 0 до 50 г NaCl/л с оптимумом при 10 г NaCl/л (шт. A-4-3 и DCB2-1) и 5 г NaCl/л (шт. J1-6-2-2). Бактерии росли в интервале pH среды от 5–6 до 9.5 с оптимумом при pH 6–6.5 (шт. A-4-3) и pH 7.0 (шт. J1-6-2-2 и DCB2-1). Таким образом, оптимальные значения температуры, pH и концентрации NaCl исследованных штаммов рода Shewanella соответствуют условиям загрязненных подземных вод, из которых они были выделены.
Исследовано воздействие шеванелл на нитраты и радионуклиды, присутствующие в загрязненных подземных водах, и образование биопленок на разных минеральных носителях, что может быть использовано при создании фильтрационного барьера в подземном горизонте.
Восстановление пертехнетат-, уранил- и хромат-ионов. Известно, что технеций в окисленном состоянии обладает высокой растворимостью (до 100 г в 100 г воды) и легко мигрирует с током подземных вод, при этом растворимость восстановленных соединений четырехвалентного технеция уменьшается в среднем на 2.5–3 порядка. При росте исследованных штаммов шеванелл на минеральной среде с добавлением пертехнетата (Tc(VII), 5 × 10–3 моль/л) в качестве акцептора электронов и сахарозы (2.5 г/л) в качестве донорa электронов зарегистрировано восстановление от 80 до 98% внесенного технеция через 7 сут инкубирования (рис. 1). При этом в среде появлялся характерный черно-коричневый осадок восстановленного технеция (ориентировочно диоксида технеция в гидратной форме). Рост штаммов в среде с шестивалентным ураном в начальной концентрации 50 мг/л сопровождался восстановлением 70–83% U(VI) до U(IV) за 14 сут инкубирования (рис. 1). В среде отмечено образование серого осадка, характерного для аморфных диоксидов урана. Штаммы восстанавливали также хромат-ионы в концентрации 30 мг/л в течение 14 сут (рис. 1). Трехвалентный хром в виде гидроксида образовывал мелкодисперсный зеленоватый осадок.
Рис. 1.
Восстановление пертехнетата (Tc(VII) – 1), уранила (U(VI) – 2) и хромата (Сr(VI) – 3) бактериями рода Shewanella J1-6-2-2, A-4-3 и DCB2-1.

Присутствие окислителей в системе определяет величину окислительно-восстановительного потенциала (Eh) и влияет на формы существования металлов с переменными степенями окисления. При значениях Eh более +50…+100 мВ, большинство металлов и металлоидов находятся в состоянии высшей степени окисления: технеций – в виде пертехнетата, уран – в виде уранила, хром – в виде хромата, которые характеризуются наивысшей растворимостью и повышенной мобильностью в окружающей среде. Восстановление уранил-ионов может быть обусловлено прямым восстановлением (диссимиляционное восстановление урана), как это было показано выше, а также микробно-опосредованным редокс-зависимым восстановлением при изменении окислительно-восстановительного потенциала в системе. Уменьшение концентрации нитратов в среде приводит к значительному снижению Eh среды и может способствовать снижению миграции радионуклидов.
Восстановление нитрат-ионов бактериями рода Shewanella в присутствии минеральных носителей и изменение Eh среды. Нитрат является одним из основных загрязнителей подземных вод в районе поверхностного хранилища жидких РАО. Штамм S. xiamenensis DCB2-1 восстанавливал нитрат-ионы до молекулярного азота, при этом в первые сутки роста наблюдалось накопление нитрит-ионов, которые далее полностью восстанавливались за 3–5 сут (данные не представлены). Процесс денитрификации проходил с близкой интенсивностью в присутствии всех используемых носителей, кроме цеолита. На 15 сут роста штамма DCB2-1 в среде с цеолитом концентрация нитрат-ионов также опускалась до значений ниже ПДК (рис. 2а). Добавление нитратов в высокой концентрации заметно подавляло процесс их восстановления. При содержании более 2.5 г нитратов в 1 л рост бактерий рода Shewanella практически прекращался, при этом в среде обнаруживались высокие концентрации нитрита.
Рис. 2.
Восстановление нитрат-ионов (а) и окислительно-восстановительный потенциал среды (б) в динамике при росте S. xiamenensis DCB2-1 в среде с нитратом, ацетатом и сахарозой в присутствии минеральных носителей – цеолита (1), перлита (2), вермикулита (3), шунгита (4), керамзита (5) и в контроле (6) без бактерий.

Рост штамма DCB2-1 в среде с добавлением ацетата натрия (2.5 г/л) и сахарозы (2.5 г/л) в присутствии керамзита, шунгита, вермикулита или перлита сопровождался снижением Eh среды с +160 до –100…–210 мВ (рис. 2б). Рост на цеолите приводил к наименьшему снижению редокс-потенциала, что может объясняться наличием нанопор в материале и медленной диффузией воздуха из него во время роста штамма.
Планктонный и биопленочный рост бактерий рода Shewanella в аэробных условиях. Исследован рост бактерий рода Shewanella в средах с ацетатом и молочной сывороткой в присутствии минеральных и органических носителей (рис. 3а, 3б). В среде с ацетатом натрия штамм А-4-3 рос в виде планктонной культуры в присутствии цеолита и перлита, штаммы DCB2-1 и J1-6-2-2 – в присутствии перлита и опилок. Рост штаммов в виде биопленок наблюдался, в основном, на поверхности опилок, вермикулита и перлита. В среде с молочной сывороткой штамм DCB2-1 лучше рос в виде планктонной культуры в присутствии перлита и вермикулита; штаммы А-4-3 и J1-6-2-2 – в присутствии перлита. Показатели роста в виде биопленок в среде с молочной сывороткой соответствовали таковым в среде с ацетатом натрия. В этих экспериментах показана совместимость исследованных штаммов рода Shewanella с минеральными сорбентами и опилками и их способность образовывать стабильные биопленки на поверхности носителя. Биопленки лучше всего формировались на перлите, вермикулите и опилках, при этом не подавлялся рост планктонной культуры (рис. 4).
Рис. 3.
Рост бактерий рода Shewanella штаммы J1-6-2-2, A-4-3 и DCB2-1 в среде с ацетатом натрия (а) и молочной сывороткой (б) в присутствии минеральных носителей в биопленках (1) и в планктонной культуре (2).

Рис. 4.
Микрофотографии керамзита (а) и перлита (в) в стерильной среде и с биопленками S. xiamenensis штамм DCB2-1 на керамзите (б) и перлите (г) (сканирующий электронный микроскоп TESCANVEGA-IIXMU). Масштабная линейка: для (а) и (б) – 100 мкм; для (в) и (г) – 10 мкм.
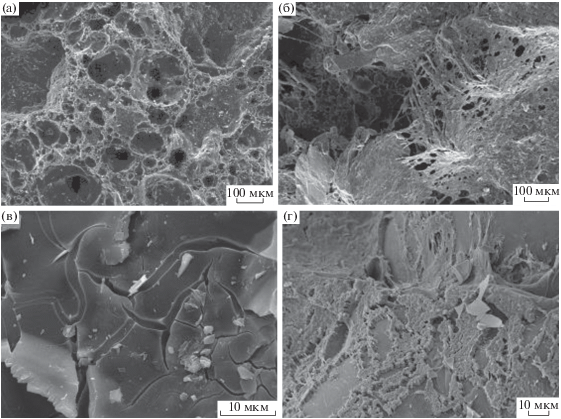
Исследован рост бактерии S. xiamenensis DCB2-1 в присутствии минеральных носителей в динамике. Для этого использовали жидкую питательную среду ММ с добавлением ацетата (2.5 г/л) и сахарозы (2.5 г/л) в качестве органических субстратов. Минеральной фазой служили цеолит, перлит, вермикулит и шунгит. Для сравнения использовали также керамзит как носитель, широко применяемый для загрузки биореакторов различного типа при очистке отходов и сточных вод. Посев произведили аэробно во флаконы так, чтобы каждой точке отбора соответствовал отдельный флакон с посевом. По мере роста бактерий отбирали пробы и измеряли рост планктонной культуры и биопленок по описанной выше методике.
Максимальное образование биопленок штаммом S. xiamenensis DCB2-1 отмечено на керамзите на 5 сут культивирования, на остальных носителях – на 13–15 сут инкубации (рис. 4, 5). На вермикулите образовывалось больше биопленок, чем на других носителях, что коррелирует с результатами предыдущих экспериментов. Слабый рост штамма отмечен в присутствии цеолита. Динамика планктонного и биопленочного роста штамма в целом совпадали.
Рис. 5.
Рост бактерий S. xiamenensis штамм DCB2-1 в биопленках (а) и в планктонной культуре (б) в присутствии цеолита (1), перлита (2), вермикулита (3), шунгита (4) и керамзита (5). На рис. 5б по оси ординат – оптическая плотность культуры, разведенной в 10 раз.

Поиск генов, ответственных за формирование биопленок, в геноме штамма S. xiamenensis DCB2-1. У штамма S. xiamenensis DCB2-1 был секвенирован геном (acc. number QFLG00000000) (Grouzdev et al., 2018). Геном имеет размер 4.74 млн. п.н., Г + Ц – 46.3% и включает 4216 генов, в том числе гены, детерминирующие деградацию ароматических соединений, аминокислот и сахаров, денитрификацию, сборку сидерофоров, восстановление Fe(III) и мышьяка, устойчивость к тяжелым металлам и металлоидам, в том числе кобальту, цинку, кадмию, хрому и мышьяку.
В публикации (Zhou et al., 2015) описан молекулярный механизм, обеспечивающий образование биопленок бактерией Shewanella oneidensis MR-1, в геноме которой обнаружен кластер генов, кодирующий семь белков, связанных с этим процессом. Детально исследованы три ключевых белка BpfA, BpfG, и BpfD. Белок BpfA – адгезин отвечает за образование внеклеточного матрикса биопленки, BpfG необходим для экспорта BpfA при формировании биопленки и выполняет функции по превращению BpfA в форму, активную для диспергирования биопленки. Белок BpfD регулирует развитие биопленки, взаимодействуя как с BpfA, так и с BpfG в ответ на изменение концентрации сигнальной молекулы бис-(3',5')-цикло-ди-гуанозинмонофосфата (цикло-ди-ГМФ).
При сравнении геномов S. oneidensis MR-1 и S. xiamenensis DCB2-1 с использованием BLASTP анализа (Altschul et al., 1997) у штамма DCB2-1 был также выявлен высокогомологичный кластер генов, детерминирующий образование семи белков, ответственных за формирование биопленок (табл. 3, рис. 6).
Таблица 3.
Результат BLASTP анализа белков, ответственных за формирование биопленок у штаммов S. oneidensis MR-1 и S. xiamenensis DCB2-1
| S. oneidensis MR-1 | S. xiamenensis DCB2-1 |
Аннотация белков в геноме S. xiamenensis DCB2-1 | Сходство, % |
|---|---|---|---|
| BpfA | BpfA (DIY08_04315) | Adhesin | 58.2 |
| AggC | AggC (DIY08_04320) | Type I secretion system permease/ATPase | 97.8 |
| AggB | AggB (DIY08_04325) | HlyD family type I secretion periplasmic adaptor subunit | 97.4 |
| AggA | AggA (DIY08_04330) | Channel protein TolC | 97.7 |
| SO_4321 | DIY08_04335 | OmpA family protein | 91.5 |
| BpfG | BpfG (DIY08_04340) | Hypothetical protein | 95.3 |
| BpfD | BpfD (DIY08_04345) | GGDEF domain-containing protein | 95.3 |
Рис. 6.
Схема расположения локусов, детерминирующих образование белков, связанных с формированием биопленок, в геномах штаммов S. oneidensis MR-1 и S. xiamenensis DCB2-1.

Сорбция радионуклидов на природных материалах. В связи с важностью проблемы снижения миграции радионуклидов в литературе уделяется большое внимание удерживанию радионуклидов разными природными минералами. Так адсорбция стронция глинистыми минералами убывала в ряду каолинит < иллит < вермикулит, и значения коэффициента распределения (Kd) Sr2+ зависели от его концентрации в растворе и присутствия NaCl (Ning et al., 2018). Сорбция ионов цезия убывала в ряду цеолит > бентонит > каолинит (Yildiz et al., 2011). Показано, что оксиды и гидроксиды железа, присутствующие даже в низких концентрациях, оказывают большое влияние на сорбцию Np(V) (Verma et al., 2017).
Для оценки сорбционных характеристик минеральной составляющей фильтрационного барьера нами были определены коэффициенты распределения радионуклидов на различных природных материалах. Определение коэффициентов проводили при достижении псевдоравновесного состояния в процессе сорбции. Максимальные значения коэффициентов распределения цезия и стронция получены на вермикулите и цеолите (табл. 4). На перлите и шунгите значения Kd цезия были выше, чем стронция. Коэффициенты распределения урана на вермикулите и цеолите были значительно ниже, чем стронция и цезия. Сорбционные свойства керамзита были невысоки, однако за счет его высокопористой структуры он является перспективным материалом для роста биопленок – биологической составляющей барьера (рис. 4). Технеций не сорбировался ни на одном из исследованных материалов, кроме шунгита.
Таблица 4.
Значения коэффициентов распределения радионуклидов на материалах, см3/г
| Материал | 137Cs | 90Sr | 99Tc | 238U |
|---|---|---|---|---|
| Вермикулит | 2.0 × 105 | 2.0 × 104 | 0.2 | 179 |
| Перлит | 840 | 8 | 0.2 | 64 |
| Цеолит “Трейд” | 2.2 × 105 | 6.2 × 103 | 0.3 | 67 |
| Опилки | 24 | 25 | 0.2 | 522 |
| Шунгит | 306 | 7 | 206 | 2 |
Таким образом, продемонстрирована возможность использования в проницаемом биогеохимическом барьере бактерий рода Shewanella, выделенных из пластовых вод, загрязненных жидкими РАО. Результаты изучения физиологии, планктонного и биопленочного роста на разных минеральных носителях, а также подтверждение результатов биоинформатического анализа генома S. xiamenensis DCB2-1 данными фенотипических исследований свидетельствуют о высоком метаболическом и биотехнологическом потенциале бактерий рода Shewanella для очистки загрязненных радиоактивными отходами экосистем от нитрат-ионов и снижения миграции радионуклидов.
Идея фильтрационного барьера заключается в поверхностном (на глубину до 5–7 м), траншейном, изолированном от воздушной среды заложении на фронте движения загрязненных нитрат-ионами и радионуклидами подземных вод различных материалов, имеющих высокие адсорбционные характеристики в отношении радионуклидов. При этом денитрифицирующие бактерии восстанавливают нитрат-ионы и создают условия для последующего восстановления и иммобилизации радионуклидов с переменными степенями окисления (U, Tc и др.). Поддержание активной жизнедеятельности бактерий обычно осуществляется за счет нагнетания органических субстратов через систему скважин, которые также используются для отбора проб и мониторинга микробиологических и физико-химических процессов.
Исследованные бактерии рода Shewanella были способны расти в физико-химических условиях, характерных для верхних водоносных горизонтов на территории АО “СХК”, использовали в качестве доноров электронов и источника углерода дешевые органические субстраты, в том числе отходы молочного производства. Выявлено образование биопленок на природных материалах, с высокой эффективностью сорбирующих цезий и стронций. Исследованные штаммы могут быть использованы в качестве биологического компонента проницаемого биогеохимического барьера для удаления из подземных вод нитрат-ионов и иммобилизации высокотоксичных хромат-, пертехнетат- и уранил-ионов за счет снижения окислительно-восстановительного потенциала среды и ферментативного восстановления металлов и металлоидов в малорастворимые формы.
Список литературы
Плакунов В.К., Мартьянов С.В., Тетенева Н.А., Журина М.В. Универсальный метод количественной характеристики роста и метаболической активности микробных биопленок в статических моделях // Микробиология. 2016. Т. 85. № 4. С. 484–489.
Plakunov V.K., Mart’yanov S.V., Teteneva N.A., Zhurina M.V. A universal method for quantitative characterization of growth and metabolic activity of microbial biofilms in static models // Microbiology (Moscow). 2016. V. 85. P. 509–513.
Сафонов А.В., Ильин В.А., Трегубова В.Е., Захарова Е.В., Ершов Б.Г., Бабич Т.Л., Назина Т.Н. Биологические противомиграционные барьеры в подземных водоносных горизонтах при консервации хранилищ ЖРО // Вопросы радиационной безопасности. 2015. № 3. С. 99–105.
Al-Kayssi M., Magee R.J., Wilson C.L. Spectrophotometric studies on technetium and rhenium // Talanta. 1962. V. 9. P. 125–132.
Altschul S.F., Madden T.L., Schäffer A.A., Zhang J., Zhang Z., Miller W., Lipman D.J. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs // Nucl. Acids Res. 1997. V. 25. P. 3389–3402.
Bolger A.M., Lohse M., Usadel B. Trimmomatic: a flexible trimmer for Illumina sequence data // Bioinformatics. 2014. V. 30. P. 2114–2120. https://doi.org/10.1093/bioinformatics/btu170
Caporaso J.G., Kuczynski J., Stombaugh J., Bittinger K., Bushman F.D., Costello E.K., Fierer N., Peña A.G., Goodrich J.K., Gordon J.I., Huttley G.A., Kelley S.T., Knights D., Koenig J.E., Ley R.E., Lozupone C.A., McDonald D., Muegge B.D., Pirrung M., Reeder J., Sevinsky J.R., Turnbaugh P.J., Walters W.A., Widmann J., Yatsunenko T., Zaneveld J., Knight R. QIIME allows analysis of high-throughput community sequencing data // Nat. Methods. 2010. V. 7. P. 335–336.
Chang L.C., Chu H.J., Hsiao C.T. Optimal planning of a dynamic pump-treat-inject groundwater remediation system // J. Hydrol. 2007. V. 342. P. 295–304.
Fadrosh D.W., Ma B., Gajer P., Sengamalay N., Ott S., Brotman R.M., Ravel J. An improved dual-indexing approach for multiplexed 16S rRNA gene sequencing on the Illumina MiSeq platform // Microbiome. 2014. V. 2. P. 6. https://doi.org/10.1186/2049-2618-2-6
Gibert O., Pomierny S., Rowe I., Kalin R.M. Selection of organic substrates as potential reactive materials for use in a denitrification permeable reactive barrier (PRB) // Bioresour. Technol. 2008. V. 99. P. 7587–7596.
Grouzdev D.S., Safonov A.V., Babich T.L., Tourova T.P., Krutkina M.S., Nazina T.N. Draft genome sequence of a dissimilatory U(VI)-reducing bacterium, Shewanella xiamenensis strain DCB2-1, isolated from nitrate- and radionuclide-contaminated groundwater in Russia // Genome Announc. 2018. V. 6. Article e00555-18. https://doi.org/10.1128/genomeA.00555-18
Huang J., Sun B., Zhang X. Shewanella xiamenensis sp. nov., isolated from coastal sea sediment // Int. J. Syst. Evol. Microbiol. 2010. V. 60. P. 1585–1589.
Lovley D.R., Phillips E.J.P. Novel mode of microbial energy metabolism: organic carbon oxidation coupled to dissimilatory reduction of iron or manganese // Appl. Environ. Microbiol. 1988. V. 54. P. 1472–1480.
Maniatis T., Frich E., Sambruk G. Methods in Genetic Engineering: Molecular Cloning. Moscow: Mir, 1984. 479 p.
Michalsen M.M., Peacock A.D., Smithgal A.N., White D.C., Spain A.M., Sanchez-Rosario Y., Krumholz L.R., Kelly Sh.D., Kemner K.M., McKinley J., Heald S.M., Bogle M.A., Watson D.B., Istok J.D. Treatment of nitric acid-, U(VI)-, and Tc(VII)-contaminated groundwater in intermediate-scale physical models of an in situ biobarrier // Environ. Sci. Technol. 2009. V. 43. P. 1952–1961.
Nazina T.N., Luk’yanova E.A., Zakharova E.V., Konstantinova L.I., Kalmykov S.N., Poltaraus A.B., Zubkov A.A. Microorganisms in a disposal site for liquid radioactive wastes and their influence on radionuclides // Geomicrobiol. J. 2010. V. 27. P. 473–486.
Ning Z., Ishiguro M., Koopal L.K., Sato T., Kashiwagi J. Comparison of strontium retardation for kaolinite, illite, vermiculite and allophane // J. Radioanal. Nucl. Chem. 2018. V. 317. P. 409–419.
Noubactep C., Caré S., Crane R. Nanoscale metallic iron for environmental remediation: prospects and limitations // Water Air & Soil Pollution. 2012. V. 223. P. 1363–1382.
Ortiz-Bernad I., Anderson R.T., Vrionis H.A., Lovley D.R. Resistance of solid-phase U(VI) to microbial reduction during in situ bioremediation of uranium-contaminated groundwater // Appl. Environ. Microbiol. 2004. V. 70. P. 7558–7560.
Onishi H., Sekine K. Spectrophotometric determination of zirconium, uranium, thorium and rare earths with arsenazo III after extractions with thenoyltrifluoroacetone and tri-n-octylamine // Talanta. 1972. V. 19. P. 473–478.
Rybal’chenko A.I., Pimenov M.K., Kostin P.P., Balukova V.D., Nosukhin A.V., Mikerin E.I., Egorov N.N., Kaimin E.P., Kosareva I.M., Kurochkin V.M. Deep injection disposal of liquid radioactive waste in Russia / Eds. Foley M.G., Ballou L.M.G. Columbus, Ohio: Battelle Press, 1998. 206 p.
Safonov A.V., Babich T.L., Sokolova D.S, Grouzdev D.S., Tourova T.P., Poltaraus A.B., Zakharova E.V., Merkel A.Y., Novikov A.P., Nazina T.N. Microbial community and in situ bioremediation of groundwater by nitrate removal in the zone of a radioactive waste surface repository // Front. Microbiol. 2018. V. 9. Article 1985.https://doi.org/10.3389/fmicb.2018.01985
Sellin P., Leupin O.X. The use of clay as an engineered barrier in radioactive-waste management – a review // Clays and Clay Minerals. 2013. V. 61. P. 477–498.
Senko J.M., Istok J.D., Suflita J.M., Krumholz L.R. In-situ evidence for uranium immobilization and remobilization // Environ. Sci. Technol. 2002. V. 36. P. 1491–1496.
Sheng L., Fein J.B. Uranium reduction by Shewanella oneidensis MR-1 as a function of NaHCO3 concentration: surface complexation control of reduction kinetics // Environ. Sci. Technol. 2014. V. 48. P. 3768–3775.
Takahashi S., Tomita J., Nishioka K., Hisada T., Nishijima M. Development of a prokaryotic universal primer for simultaneous analysis of Bacteria and Archaea using next-generation sequencing // PLoS One. 2014. V. 9. Article e105592.
Verma P.K., Romanchuk A.Yu., Vlasova I.E., Krupskaya V.V., Kalmykov S.N. Np(V) uptake by bentonite clay: Effect of accessory Fe oxides/hydroxides on sorption and speciation // Appl. Geochem. 2017. V. 78. P. 74–82.
Wall J.D., Krumholz L.R. Uranium reduction // Annu. Rev. Microbiol. 2006. V. 60. P. 149–166.
Wang H., Cheng H., Wang F., Wei D., Wang X. An improved 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide (MTT) reduction assay for evaluating the viability of Escherichia coli cells // J. Microbiol. Meth. 2010. V. 82. P. 330–333.
Wildung R.E., Gorby Y.A., Krupka K.M., Hess N.J., Li S.W., Plymale A.E., McKinley J.P., Fredrickson J.K. Effect of electron donor and solution chemistry on products of dissimilatory reduction of technetium by Shewanella putrefaciens // Appl. Environ. Microbiol. 2000. V. 66. P. 2451–2460.
Wu W.-M., Carley J., Green S.J., Luo J., Kelly S.D., Nostrand J., Lowe K., Mehlhorn T., Carroll S., Boonchayanant B., Löfller F.E., Watson D., Kemner K.M., Zhou J., Kitanidis P.K., Kostka J.E., Jardine P.M., Criddle C.S. Effects of nitrate on the stability of uranium in a bioreduced region of the subsurface // Environ. Sci. Technol. 2010. V. 44. P. 5104–5111.
Xu M., Wu W.M., Wu L., He Z., Van Nostrand J.D., Deng Y., Luo J., Carley J., Ginder-Vogel M., Gentry T.J., Gu B., Watson D., Jardine Ph.M., Marsh T.L., Tiedje J.M., Hazen T., Criddle C.S., Zhou J. Responses of microbial community functional structures to pilot-scale uranium in situ bioremediation // ISME J. 2010. V. 4. P. 1060–1070.
Yildiz B., Erten H.N., Kis M. The sorption behavior of Cs+ ion on clay minerals and zeolite in radioactive waste management: sorption kinetics and thermodynamics // J. Radioanal. Nucl. Chem. 2011. V. 288. P. 475–483.
Zhou G., Yuan J., Gao H. Regulation of biofilm formation by BpfA, BpfD, and BpfG in Shewanella oneidensis // Front. Microbiol. 2015. V. 6. Article 790. https://doi.org/10.3389/fmicb.2015.00790
Дополнительные материалы отсутствуют.


