Микробиология, 2019, T. 88, № 5, стр. 568-582
Бактериальные сообщества микробных матов супралиторали Белого моря и литорали отделившихся от моря озер
Е. И. Бурганская a, *, Д. С. Груздев a, М. С. Круткина a, В. М. Горленко a
a Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской академии наук
119071 Москва, Россия
* E-mail: kateburganskaya@gmail.com
Поступила в редакцию 01.04.2019
После доработки 15.04.2019
Принята к публикации 15.05.2019
Аннотация
Исследовали условия образования и филогенетический состав пигментированных биопленок и микробных матов в супралиторали Кандалакшского залива Белого моря и литорали отделившихся от моря озер. В период проведения работ соленость в местах отбора проб была от 15 до 26 г/л за исключением нескольких распресненных участков солевых маршей (соленость 4–11 г/л), температура составляла 9–12°C. Суровые климатические условия – низкая среднегодовая температура и промерзание литоральных зон – оказывали влияние на видовой состав и структуру бентосных фототрофных сообществ. Биоразнообразие микробных сообществ определяли высокопроизводительным секвенированием области V3–V4 гена 16S рРНК в сочетании с микроскопией природных образцов и выросших культур, что дало возможность расширить имеющиеся ранее представления о разнообразии как оксигенных, так и аноксигенных фототрофных бактерий литоральной зоны Кандалакшского залива Белого моря. Видовые составы микробных матов соляных маршей и мелководных участков озер морского происхождения не имели заметных отличий друг от друга. Основу матов и биопленок составляли представители филумов Bacteroidetes (до 36%) и Proteobacteria (до 67%). Доля фототрофных бактерий была 0.3–18%. Среди фототрофов преобладали оксигенные фототрофы: цианобактерии родов Phormidium, Oscillatoria, Spirulina, Anabaena и диатомовые водоросли. Количество аноксигенных фототрофных бактерий не превышало 5% от всех прокариот. В основном это мезофильные морские виды пурпурных серобактерий родов Thiorhodococcus и Thiocapsa. Отличительной особенностью приполярных матов являлось отсутствие бактерий семейства Ectothiorhodospiraceae, характерных для микробных матов южных морей. Несерные пурпурные бактерии и аэробные аноксигенные фототрофные бактерии в основном были близки к известным морским видам. Зеленые серобактерии обнаружены в двух пробах прибрежных матов меромиктических озер. Это соленоводные виды родов Prosthecochloris и Сhlorobium. Аноксигенные нитчатые фототрофные бактерии присутствовали почти во всех бентосных фототрофных сообществах и были представлены новыми филотипами.
Микробные маты господствовали на планете Земля на протяжении более миллиарда лет (Awramik, 1992; Nealson, Berelson, 2003; Seckbach, Oren, 2010). Об этом свидетельствуют строматолиты – окаменевшие слоистые структуры, сложенные нитчатыми фототрофами (Krumbein, 1983; Walter, 1983). Древние маты развивались при умеренных температурах в атмосфере, практически не содержащей кислород. Весьма вероятно, что именно аноксигенные фототрофные бактерии (АФБ) составляли основу докембрийских цианобактериальных матов (Kappler и др., 2005).
Современные бентосные фототрофные сообщества являются модельными объектами реликтов, их исследование позволяет лучше понять историю развития жизни на нашей планете. Фототрофные маты в мелководных морских лагунах и солевых маршах южных широт наиболее продуктивны и сохраняют черты древних матов теплого архейского океана (Walter, 1983). Арктические и Антарктические микробные маты наиболее хорошо моделируют специфику микробных сообществ в постледниковый период (Kirschvink, Kopp, 2008). Такие сообщества могли формироваться после глобальных оледенений, начавшихся 2.4 млрд. лет назад и приведших к разрушению первичных структур прокариотных бентосных сообществ и охлаждению вод мирового океана. Сегодня полярные микробные маты распространены в Арктике и Антарктике (Herbert, Tanner, 1977; Wharton Jr., Parker, Simmons Jr., 1983; Vincent et al., 2000; de los Ríos et al., 2015; Tahon et al., 2016). Определенный интерес представляют также микробные маты приполярных районов, отличающихся суровым климатом (Горленко, Пучков, Демчев, 1985).
Целью настоящего исследования было изучение условий формирования и микробного разнообразия литоральных фототрофных сообществ акватории Кандалакшского залива Белого моря.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Отбор проб, физико-химические характеристики мест их отбора. Пробы отбирали в первую декаду сентября 2016 года. Микробный мат (биопленку) вырезали скальпелем с площади 2 см2 и помещали в стерильный пластиковый флакон объемом 50 мл, который доверху заполняли водой из места отбора пробы. Образцы хранили в темноте при температуре 4°С. Отобранный образец использовали для микроскопии, анализа пигментов и извлечения тотальной ДНК. Общая характеристика образцов и физико-химические параметры воды в местах отбора проб, а также их координаты представлены в табл. 1.
Таблица 1.
Значения координат и описания образцов
| Образец | Координаты отбора | Соленость, г/л | pH | T, °C | Описание образца |
|---|---|---|---|---|---|
| Er1 | 66.55404 с.ш. 33.04268 в.д. | 24 | 7.9 | – | По поверхности гниющих растений развивались пурпурные бактерии в виде красно-бурых пятен и зеленые пятна водорослей с признаками развития бесцветных серобактерий |
| Er2 | 66.55215 с.ш. 33.04892 в.д. | 27 | 7.91 | – | Многолетний мат. Верхняя часть – цианобактерии, затем – темно-зеленая зона деструкции, далее следует слой пурпурных бактерий, а ниже располагается гомогенная черная масса гниющих органических остатков |
| Er5 | 66.55276 с.ш. 33.04924 в.д. | 4 | 6.6 | – | На глубине находилась тонкая пленка, в которой просматриваются пурпурные вкрапления |
| Gub1 | 66.54655 с.ш. 33.14352 в.д. | 15 | 7.1 | – | Достаточно обширные обрастания пурпурного цвета с зелеными пятнами. Интенсивное развитие АФБ (в основном пурпурных) происходило в результате интенсивного поступления сульфида из нижних слоев осадков |
| Gub3 | 66.54655 с.ш. 33.14352 в.д. | 26 | 6.97 | – | Поверхность бактериальных обрастаний в основном зеленого цвета с признаками выпадения элементной серы. По краям микробных обрастаний прослеживалось присутствие пурпурных бактерий |
| KS4 | 66.54922 с.ш. 33.13393 в.д. | 11 | 6.8 | 9 | Образец представлял собой пурпурные пятна на поверхности гниющих водорослей (до дна 5 см), имел рыхлую структуру с отдельными хлопьями пурпурных бактерий |
| KS5 | 66.54922 с.ш. 33.13393 в.д. | 15 | 7.1 | 9 | Образец был отобран на расстоянии 20 см от дна. АФБ развивались по рыхлому слою разлагающихся водорослей, имели буро-зеленый цвет с пурпурными пятнами |
| Nil2 | 66.50345 с.ш. 33.12741 в.д. | 26 | 7.9 | 15 | АФБ, преимущественно ПСБ, развивались на сульфидсодержащем грунте, образованном в результате гниения водорослей |
| Nil3 | 66.50404 с.ш. 33.11926 в.д. | 28 | 6.76 | 14 | Отобран из небольших углублений, в которых обнаружен многослойный цианобактериальный мат, толщиной около 1 см. Верхние слои состояли из нескольких слоев цианобактерий. На глубине 0.3–0.5 см прослеживался слой пурпурных бактерий, ниже мат имел темный цвет |
| Nil4 | 66.50477 с.ш. 33.11857 в.д. | 20 | 6.77 | 14 | Мат отрывался от дна и всплывал в виде кожистых пленок розового цвета толщиной 2–3 мм |
| ZM2 | 66.53042 с.ш. 33.09309 в.д. | 25 | 7.2 | 13 | Возвышающийся, увлажненный во время прилива тонкий мат оливкового цвета, имеющий слоистость с розовыми прослоями, сформированными ПСБ |
| ZM3 | 66.5295 с.ш., 33.094 в.д. | 15 | 6.6 | 12 | Мат серо-зеленого цвета, обнажающийся во время отлива |
| ZM4 | 66.52955 с.ш. 33.09567 в.д. | 15 | 6.86 | – | Многослойный мат, имеющий определенные морфологические особенности. Пурпурные бактерии располагались под слоем нитчатых цианобактерий |
Температуру и значение рН среды в местах отбора проб измеряли с помощью портативного рН-метра с температурным датчиком (HANNA HI 8314, Румыния). Соленость определяли с помощью рефрактометра FG-211 (“Comecta”, Испания).
Микроскопия. Морфологию клеток фототрофных микроорганизмов изучали в световом микроскопе Olympus BX 41 (“Olympus Corp.”, Япония) с фазовым контрастом.
Фотосинтезирующие пигменты. Для анализа общего состава пигментов в природных образцах и клетках выделенных культур бактерий использовали спектрофотометр СФ 56А (“ЛОМО”, Россия). Спектры поглощения фрагментов клеточных мембран, полученных при разрушении биомассы ультразвуком частотой 14.5 кГц, регистрировали в диапазоне длин волн 400–1100 нм.
Выделение аноксигенных фототрофных бактерий. Образцы микробных матов смешивали с придонной водой, гомогенизировали растиранием и 1 мл гомогената использовали в качестве посевного материала для выделения АФБ. Культивирование АФБ проводили на модифицированной агаризованной среде Пфеннига с добавлением 500 мг/л сульфида натрия (Pfennig, 1965) при рН 7.8. Выросшие колонии микроскопировали и пересевали с разведением до получения монокультур различных видов АФБ. Предварительную идентификацию фототрофных микроорганизмов осуществляли по фенотипическим признакам.
Молекулярно-генетическая идентификация бактерий. Филогенетическое разнообразие микробных сообществ определяли с использованием высокопроизводительного секвенирования ПЦР-фрагментов гена 16S рРНК, извлеченной из образцов ДНК микробного мата. ДНК выделяли с помощью набора PowerMax Soil DNA Isolation Kit (“MO BIO Laboratories, Inc.”, США) согласно инструкции производителя.
Сравнительный анализ полученных последовательностей с последовательностями базы данных GenBank проводили с помощью программы BLAST [http://www.ncbi.nlm.nih.gov/blast]. Дендрограммы были построены по методу Maximum Likelihood с помощью программного пакета MEGA 6.1.
Амплификацию и секвенирование вариабельного участка V3−V4 (с использованием стандартных праймеров Illumina 5'-CCTACGGGGGGGGGCGC-3' и 5'-GACTACHVGGGTATCTAATCC-3') гена 16S рРНК проводили с помощью секвенатора Illumina MiSeq (парные чтения 2 × 250 bp) при использовании в качестве матрицы той же ДНК, выделенной из матов для ПЦР. Последовательности депонированы в Sequence Read Archive (SRA) в NCBI под номерами SRX5561573–SRX5561585. Обработку данных проводили при помощи программы QIIME (версия 1.9.1) (Caporaso et al., 2010). Все предполагаемые химеры проверяли с помощью инструмента поиска при использовании справочной бесхимерной базы в соответствии с алгоритмом UCHIME (Edgar et al., 2011). Полученные чтения группировали в ряд OTU (operational taxonomic unit, операционных таксономических единиц) на основе 97%-ого порога сходства. Таксономическое положение OTU определяли с использованием базы данных RDP (http://rdp.cme.msu.edu) (Wang et al., 2007). Относительную численность каждой группы на разных таксономических уровнях (тип, класс, порядок, семейство и род) использовали для последующего анализа.
РЕЗУЛЬТАТЫ
Условия образования микробных матов и окрашенных биопленок. Изученные местообитания бентосных фототрофных бактерий разделили на три типа. К первому типу отнесли солевые марши (супралитораль), в углублениях дна которых стабильно сохранялись небольшие лужи с гниющими водорослями, по поверхности которых формировались многослойные микробные маты. Распреснение отдельных участков маршей (образец Er5) происходило под воздействием береговых стоков. К этому типу принадлежали мелководные участки Ермолинской губы (образцы Er 1, 2, 5) и Нильма-губы (образцы Nil 2–4) Кандалакшского залива. Температура в них колебалась от 9 до 15°С, соленость 15–28 г/л, рН 6.7–7.2 (табл. 1).
К второму типу отнесли прибрежные участки стратифицированных озер, полностью или частично отделенных от Кандалакшского залива. В этот тип вошли литораль Кисло-Сладкого озера (пробы KS 4, 5) и прибрежные участки озера Зеленый мыс (пробы ZM 2–4). В литоральной зоне озер наблюдали развитие окрашенных в пурпурный или зеленый цвет биопленок, реже – микробного мата. Эти водоемы в разной степени находились под воздействием морских приливов и пресных береговых стоков. Температура в них колебалась от 9 до 12°С, соленость изменялась в пределах 11–28 г/л, рН – от 6.8 до 8.0.
К третьему типу отнесли Вонючую губку (ВГ), являющуюся небольшим водоемом (30 × 40 м), соединенным через узкую протоку с безымянной лагуной Кандалакшского залива. Обрывки морских водорослей заносило приливными волнами в ВГ, где они концентрировались, что приводило к ее обогащению органическим веществом. Анаэробная деструкция вызывала интенсивное образование сероводорода и развитие фототрофных и бесцветных серобактерий в этом водоеме. Глубина ВГ не превышала 20 см, при отливах поверхность микробных обрастаний обнажалась. Распреснение вод в ВГ происходило за счет обильного поступления прибрежных болотистых вод. Температура колебалась от 9 до 15°С, соленость 15–26 г/л, рН 6.9–7.1.
Все перечисленные фототрофные сообщества относились к категории “сульфурета”, в которых доминируют микробные процессы круговорота серы.
В исследованных водоемах было выделено две разновидности бентосных сообществ: первая – однолетние биопленки, окрашенные в зеленый или пурпурный цвет. Вторая – многолетние маты толщиной около 1 см с четкими слоями зеленого (оксигенные фототрофы), пурпурного (пурпурные серные бактерии – ПСБ) и черного цвета (сульфидогены). У многолетних матов прослеживались погребенные окрашенные слои фототрофов, где особенно заметны чередующиеся пурпурные микрозоны.
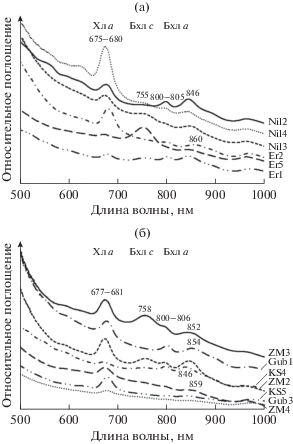
Состав пигментов. Анализ тотальных препаратов пигментов из природных образцов (рис. 1) выявил, что доминирующим пигментом во всех исследованных микробных сообществах являлся хлорофилл а, характерный для цианобактерий (максимум поглощения in vivo составил 675–681 нм). Во всех образцах, кроме Gub3 и KS5 были заметны пики поглощения бактериохлорофилла а с максимумами in vivo при 800–806 и 846–856 нм. Присутствие бактериохлорофилла а указывало на наличие в микробных сообществах пурпурных бактерий. В образцах Nil3, Nil4, Er1, Er5, ZM2 и ZM3 обнаружен заметный пик бактериохлорофилла c с максимумом 755–758 нм, что указывало на присутствие хлоросом-содержащих зеленых серобактерий (ЗСБ) или аноксигенных нитчатых фототрофных бактерий (АНФБ).
Рис. 1.
Спектры поглощения целых клеток в природных образцах в солевых маршах (а) и озерах лагунного типа (б).
Основные морфотипы в микробных матах и биопленках. На рис. 2 и 3 представлены микрофотографии фототрофных микроорганизмов литорали Кандалакшского залива, солевых маршей и озер лагунного типа.
Рис. 2.
Морфотипы фототрофных бактерий в природных образцах: (а) – Gloecapsa sp.; (б) – Synechocystis sp.; (в )– диатомовые водоросли; (г) – диатомовая водоросль и АНФБ (Chl.); (д )– Phormidium sp.; (е) – Oscillatoria sp. (Osc.) и АНФБ (Cfl.); (ж) – Oscillatoria sp.; (з) – Phormidium sp. и АНФБ (Chl.); (и) – Lyngbya sp.; (к) – Synechococcus sp.; (л) – Thiocapsa rosea (Tca.1) и Thiorhodococcus sp. (Trc.); (м) – АНФБ (Cfl.), Thiocapsa sp. (Tca.2) и Thiorhodococcus sp. (Trc.); (н) – АНФБ (Cfl.) и Thiocapsa litoralis (Tca.3); (о) – Thiocapsa rosea (Tca.1); (п) – АНФБ (Cfl.). Масштабная метка – 10 мкм.
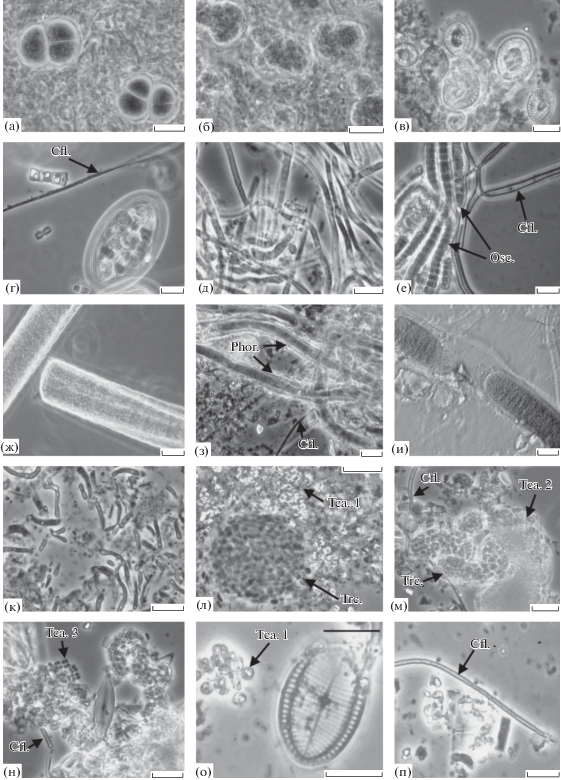
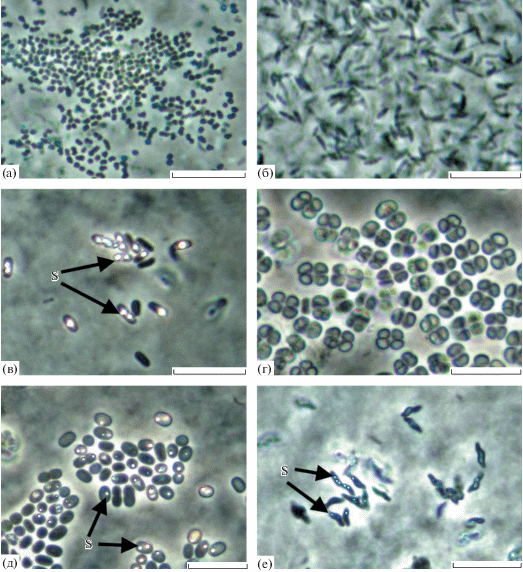
Рис. 3.
Морфотипы фототрофных бактерий, выросших на селективных средах: (а) – Prosthecochloris sp.; (б) – Rhodovulum sp.; (в) – мелкие формы Chromatium-подобных бактерий; (г) – Thiocapsa litoralis; (д) – Thiorhodococcus sp.; (е) – Thiorhodovibrio sp. Масштабная метка – 10 мкм.
Основу матов и биопленок составляли: нитчатые цианобактерии морфотипов Oscillatoria, Phormidium, Spirulina; одноклеточные цианобактерии, морфологически сходные с видами Synechococcus и Synechocystis (рис. 2). Среди АФБ преобладали пурпурные бактерии: родов Thiocapsa и Thiorhodococcus, мелкие формы Chromatium-подобных бактерий и Thiorhodovibrio sp. Во всех матах и биопленках были обнаружены АНФБ.
Оценка разнообразия бактерий с помощью высокопроизводительного секвенирования. Состав микроорганизмов в биопленках и многолетних матах существенно не различался. Было обнаружено большое филогенетическое разнообразие в исследованных образцах. Больше всего OTU присутствовало в образце Nil3 (соленость 14 г/л, 6313 OTU), а менее разнообразным оказался образец Er5 (1846 OTU) отобранный в распресненной части Ермолинской губы (табл. 2).
Таблица 2.
Распределение бактериальных OTU в филогенетических группах (в %), количество парных чтений и количество OTU (в единицах) в исследованных образцах микробных матов
| Филум | Er1 | Er2 | Er5 | Gub1 | Gub3 | KS4 | KS5 | Nil2 | Nil3 | Nil4 | ZM2 | ZM3 | ZM4 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Bacteroidetes | 30.79 | 34.08 | 25.56 | 36.75 | 22.37 | 35.20 | 30.79 | 39.61 | 22.61 | 29.70 | 26.69 | 29.93 | 15.92 |
| Chlorobi | 17.30 | 0.00 | 0.00 | 0.06 | 4.45 | 0.01 | 0.03 | 0.00 | 0.01 | 0.00 | 0.00 | 0.00 | 0.01 |
| Chloroflexi | 1.26 | 1.06 | 1.42 | 0.60 | 1.02 | 0.67 | 0.33 | 0.32 | 1.40 | 0.32 | 0.34 | 1.93 | 0.62 |
| Fusobacteria | 0.02 | 0.01 | 0.06 | 0.28 | 0.15 | 0.14 | 0.14 | 0.14 | 0.10 | 0.39 | 0.01 | 0.10 | 0.35 |
| Proteobacteria | 29.77 | 42.87 | 46.44 | 35.98 | 47.44 | 29.62 | 30.31 | 31.77 | 48.17 | 38.39 | 59.45 | 24.21 | 67.97 |
| Spirochaetes | 1.29 | 2.11 | 3.20 | 1.72 | 1.88 | 1.83 | 1.41 | 1.33 | 1.19 | 1.21 | 2.08 | 3.88 | 0.82 |
| Verrucomicrobia | 1.64 | 1.33 | 0.94 | 1.41 | 0.87 | 2.54 | 3.45 | 9.10 | 4.70 | 5.39 | 0.81 | 1.68 | 1.25 |
| Cyanobacteria | 0.78 | 1.31 | 0.46 | 0.74 | 0.05 | 2.07 | 1.92 | 2.06 | 2.79 | 4.08 | 0.98 | 12.47 | 5.27 |
| Firmicutes | 1.42 | 1.96 | 2.45 | 9.67 | 4.15 | 1.71 | 2.40 | 2.01 | 1.98 | 2.49 | 1.85 | 6.24 | 1.20 |
| Parcubacteria | 0.55 | 0.41 | 0.34 | 0.27 | 0.30 | 1.56 | 1.00 | 0.37 | 0.55 | 0.91 | 0.09 | 0.54 | 0.23 |
| Tenericutes | 0.32 | 0.06 | 6.45 | 0.93 | 1.23 | 1.03 | 1.09 | 0.49 | 0.16 | 0.49 | 0.42 | 1.05 | 0.55 |
| SR1 | 0.14 | 0.10 | 0.28 | 0.75 | 0.42 | 0.52 | 0.52 | 0.29 | 0.27 | 0.15 | 0.63 | 1.89 | 0.10 |
| Неклассифицируемые бактерии | 7.48 | 10.35 | 7.99 | 4.87 | 10.21 | 10.63 | 11.03 | 6.92 | 10.60 | 7.00 | 2.63 | 9.80 | 2.74 |
| Archaea | 1.98 | 0.70 | 2.07 | 1.54 | 1.70 | 3.63 | 3.30 | 1.83 | 2.48 | 3.41 | 1.15 | 3.47 | 1.13 |
| Другие филумы | 5.25 | 3.63 | 2.33 | 4.43 | 3.78 | 8.85 | 12.28 | 3.76 | 2.98 | 6.05 | 2.88 | 2.82 | 1.86 |
| Всего парных чтений | 144 372 | 89 156 | 34 572 | 177 593 | 133 160 | 33 752 | 53 574 | 136 685 | 217 840 | 83 751 | 276 184 | 158 858 | 156 521 |
| Количество OTU | 3831 | 2553 | 1846 | 3196 | 3214 | 2871 | 3385 | 3825 | 6313 | 3929 | 2835 | 3893 | 3516 |
| Все фототрофные бактерии (%) | 18.17 | 1.68 | 7.13 | 1.02 | 4.96 | 2.38 | 2.05 | 2.37 | 3.45 | 4.14 | 1.13 | 14.04 | 5.38 |
Одним из наиболее представленных во всех образцах филумов являлся филум Proteobacteria, который составлял от 24.21 до 59.45% от общего числа бактерий (табл. 2). Бактерии второго по представленности филума Bacteroidetes присутствовали в количестве от 15.92 до 39.61%.
Члены филума Chlorobi в значительном количестве присутствовали в двух образцах – Er1 и Gub3 (4.45 и 17.30%), тогда как практически отсутствовали в других образцах (табл. 2). В небольшом количестве присутствовали представители филумов: Fusobacteria – от 0.01 до 0.39%, Parcubacteria – от 0.09 до 1.56%, SR1 – от 0.1 до 1.89%, Chloroflexi – от 0.32 до 1.93%, Spirochaetes – от 0.82 до 3.88%, Verrucomicrobia – от 0.81 до 9.1%, Firmicutes – от 1.2 до 9.67%. Количество Cyanobacteria варьировало в образцах от 0.98 до 12.47%, а Tenericutes – от 0.06 до 6.45%. К неклассифицируемым бактериям отнесли от 2.63 до 11.03% от общего числа бактерий. Archaea составляли от 0.7 до 3.63%. Оставшиеся OTU были представлены другими малочисленными филумами (от 1.86 до 12.28%).
Цианобактерии представлены в сообществе 38 филотипами (рис. 4). В трех образцах они составляли небольшую часть фототрофного сообщества – Er1 (3.93%), Er5 (6.49%) и Gub3 (1.00%) (табл. 3). В трех образцах цианобактерии являлись доминирующими фототрофами – KS5 (93.62%), Nil4 (98.56%) и Zm4 (97.53%). В остальных образцах цианобактерии занимали 71.94–88.56% от общего количества фототрофных бактерий (ОКФ). Самым представленным филотипом являлась OTU9, близкая к Planktothricoides raciborskii. Также в большом количестве присутствовали два филотипа OTU47 и OTU50, относящиеся к роду Phormidium, и OTU9, близкая к Coleofasciculus chthonoplastes (ранее Microcolius chthonoplastes).
Рис. 4.
Филогенетическое дерево, показывающее филогенетическое разнообразие OTU, относящихся к цианобактериям. Дендрограмма построена на основании анализа последовательностей гена 16S рРНК с использованием алгоритма максимального подобия (Maximum Likelihood). Достоверность ветвления рассчитана по результатам анализа 500 альтернативных дендрограмм. Длина сравниваемых последовательностей составляла 440 пар нуклеотидов.
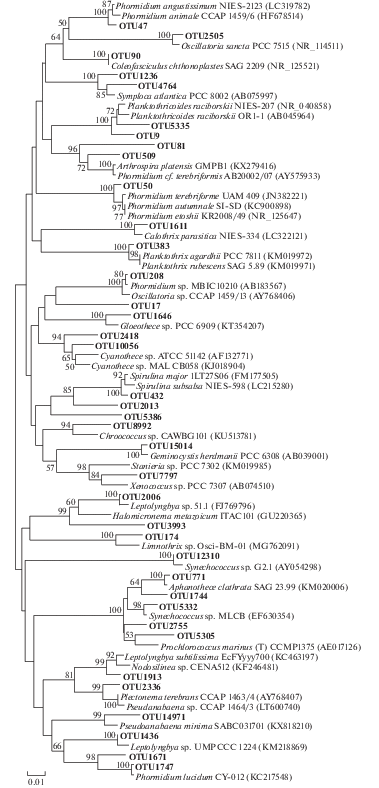
Таблица 3.
Распределение бактериальных OTU, принадлежащим фототрофным бактериям, в филогенетических группах (в %)
| Филум | Er1 | Er2 | Er5 | Gub1 | Gub3 | KS4 | KS5 | Nil2 | Nil3 | Nil4 | ZM2 | ZM3 | ZM4 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Цианобактерии | 3.93 | 77.65 | 6.49 | 71.94 | 1.00 | 86.41 | 93.62 | 83.58 | 80.52 | 98.56 | 85.97 | 88.56 | 97.53 |
| АНФБ | 0.51 | 0.00 | 3.08 | 0.28 | 0.00 | 3.24 | 1.64 | 3.56 | 13.37 | 0.20 | 10.03 | 11.06 | 1.09 |
| Зеленые серобактерии | 95.20 | 0.27 | 0.04 | 5.46 | 89.56 | 0.50 | 1.55 | 0.00 | 0.29 | 0.00 | 0.00 | 0.00 | 0.11 |
| Пурпурные серные бактерии | 0.27 | 15.48 | 22.76 | 5.51 | 7.46 | 4.24 | 0.64 | 0.62 | 0.19 | 0.29 | 0.22 | 0.04 | 0.05 |
| Несерные пурпурные бактерии | 0.02 | 0.27 | 67.59 | 16.04 | 1.88 | 2.99 | 0.46 | 0.65 | 2.01 | 0.09 | 1.82 | 0.04 | 1.13 |
| Аэробные АФБ | 0.07 | 6.34 | 0.04 | 0.77 | 0.11 | 2.62 | 2.10 | 11.60 | 3.63 | 0.87 | 1.95 | 0.30 | 0.09 |
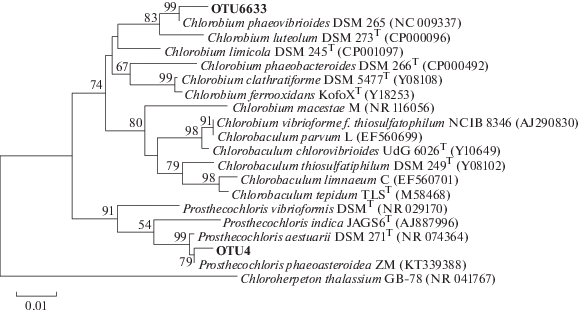
Среди ЗСБ обнаружено два филотипа – OTU4, OTU6633 (рис. 5). Наибольшее количество ЗСБ, в частности OTU4, присутствовали в образцах Er1 и Gub3 (17.3 и 4.45%) (табл. 3). OTU4 близка к Prosthecochloris phaeoasteroidea ZM и Prosthecochloris aestuaria. Она составляла 95.2% от ОКФ в образце Er1 и 89.56% в образце Gub3. OTU6633, близкая к Chlorobium phaeovibrioides DSM 265, обнаружена только в сообществе KS5 в количестве менее, чем 0.01%. В образцах Nil2, Nil4, Zm2 и Zm3 ЗСБ не выявлены.
Рис. 5.
Филогенетическое дерево, показывающее филогенетическое разнообразие OTU, относящихся к зеленым серобактериям. Дендрограмма построена на основании анализа последовательностей гена 16S рРНК с использованием алгоритма максимального подобия (Maximum Likelihood). Достоверность ветвления рассчитана по результатам анализа 500 альтернативных дендрограмм. Длина сравниваемых последовательностей составляла 440 пар нуклеотидов.
ПСБ были представлены 7 филотипами (рис. 6). Наибольшее содержание ПСБ отмечено в образцах Er5 и Er2 – 22.76 и 15.48% от ОКФ соответственно (табл. 3). Наиболее представленным филотипом являлась OTU666, близкая к бактерии Chromatium okenii. В минорных количествах также из семейства Chromatiaceae в сообществах присутствовали: филотип OTU9535, близкая к Thiocystis gelatinosa; OTU2028, близкая к бактерии Lamprobacter modestohalophilus; OTU2169, близкая к Thiocapsa marina; OTU4275, близкая к Thiohalocapsa halophila; OTU4836, близкая к Thiorhodococcus mannitoliphagus, и OTU368, близкая к Thiorhodococcus kakinadensis. В образцах KS5, Nil2−4, Zm2−4 и Er1 содержание ПСБ от ОКФ было менее 1%. Представители семейства Ectothiorhodospiraceae не были обнаружены ни в одном из образцов.
Рис. 6.
Филогенетическое дерево, показывающее филогенетическое разнообразие OTU, относящихся к пурпурным серобактериям. Дендрограмма построена на основании анализа последовательностей гена 16S рРНК с использованием алгоритма максимального подобия (Maximum Likelihood). Достоверность ветвления рассчитана по результатам анализа 500 альтернативных дендрограмм. Длина сравниваемых последовательностей составляла 440 пар нуклеотидов.

Несерные пурпурные бактерии были представлены 5 филотипами и больше всего их обнаружено в образце Er5 (67.59%), тогда как в остальных образцах их было не более 2% (рис. 7). Наиболее представленным филотипом являлась OTU190, близкая к Rhodoferax antarcticus. Также в сообществе присутствовали минорные филотипы: OTU5604, близкая к Rhodoferax ferrireducens; OTU2630, относящаяся к роду Roseospira; OTU15736, относящаяся к роду Rhodobacter, и OTU12442, близкая к бактерии Rhodovulum bhavnagarense.
Рис. 7.
Филогенетическое дерево, показывающее филогенетическое разнообразие OTU, относящихся к несерным пурпурным бактериям и аэробным аноксигенным фототрофным бактериям. Дендрограмма построена на основании анализа последовательностей гена 16S рРНК с использованием алгоритма максимального подобия (Maximum Likelihood). Достоверность ветвления рассчитана по результатам анализа 500 альтернативных дендрограмм. Длина сравниваемых последовательностей составляла 440 пар нуклеотидов.
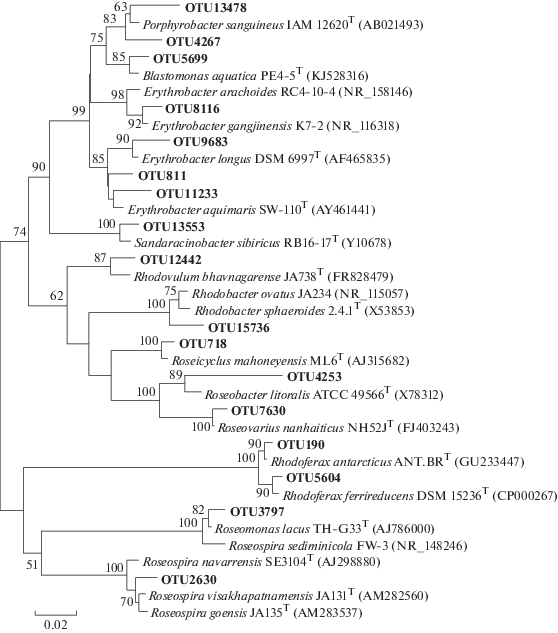
Аэробные АФБ были представлены 16 филотипами (рис. 7). Больше всего аэробных АФБ было в образце Nil2 – 11.6% от ОКФ (табл. 3). Наиболее представленным филотипом была OTU718, близкая к Roseicyclus mahoneyensis. В минорных количествах в сообществах присутствовало 5 филотипов, относящихся к роду Erythrobacter, а также филотипы, относящиеся к родам: Roseomonas (OTU3797), Roseobacter (OTU4253), Porphyrobacter (OTU4267 и OTU13478), Blastomonas (OTU5699), Sandaracinobacter (OTU13553), Roseovarius (OTU7630).
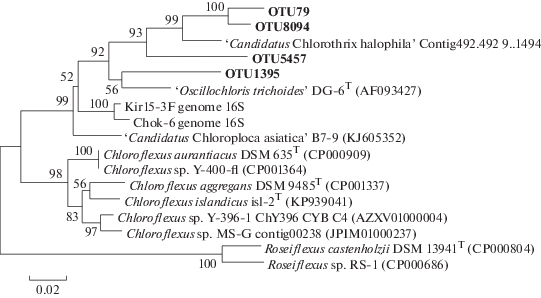
АНФБ были представлены четырьмя филотипами: OTU79, OTU1395, OTU5457, OTU8094 (рис. 8). Все четыре АНФБ присутствовали в образце KS4 и составляли 3.24% от ОКФ в образце (табл. 3). Наиболее близким организмом к филотипам OTU79 и OTU8094 являлась бактерия “Candidatus Chlorothrix halophila”. OTU1395 образовывала одну кладу с бактерией Oscillochloris trichoides DG-6 с уровнем сходства 93%, в то время как OTU5457 формировала отдельную кладу сре-ди мезофильных представителей порядка Chloroflexales, отличаясь от ближайшего родственного организма, “Candidatus Chlorothrix halophila”, на 9%. Наибольшее количество АНФБ отмечено в образцах Nil3, Zm2 и Zm3, содержащих 13.37, 10.03 и 11.06% от ОКФ соответственно. В образцах Er2 и Gub3 АНФБ не обнаружены.
Рис. 8.
Филогенетическое дерево, показывающее филогенетическое разнообразие OTU, относящихся к АНФБ. Дендрограмма построена на основании анализа последовательностей гена 16S рРНК с использованием алгоритма максимального подобия (Maximum Likelihood). Достоверность ветвления рассчитана по результатам анализа 500 альтернативных дендрограмм. Длина сравниваемых последовательностей составляла 440 пар нуклеотидов.
ОБСУЖДЕНИЕ
Белое море относится к типу приполярных внутренних морей с низкой среднегодовой температурой, низкой соленостью (23–26 г/л в поверхностных водах) по сравнению с водами мирового океана (средняя соленость 35 г/л). В солевых маршах и лагунных озерах Кандалакшского залива соленость еще ниже за счет береговых стоков. Температура воды в Кандалакшском заливе колеблется от –1.5°С зимой до 8–17°С летом. В донных осадках литорали присутствует сульфид.
Комплекс условий в литорали Кандалакшского залива и связанных с ним озер и солевых маршей по некоторым оценкам приближается к состоянию океана среднего Протерозоя в постледниковый период 2.4 млрд лет назад (Habicht et al., 2002; Olson, 2006). В это время Мировой океан стал обогащаться сульфатами, в результате чего в гидросфере появился биогенный сероводород и микробные сообщества приобрели характер “сульфурета”, в котором доминировал круговорот серы.
В исследованных нами приполярных фототрофных сообществах преобладали однолетние пигментированные биопленки, инициированные сульфидогенезом. В редких случаях в углублениях грунта в соленых маршах или в литорали озер обнаруживался многолетний мат толщиной около 1 см с четкими зелеными и пурпурными микрозонами, который был подвержен промерзанию в зимний период. Микроорганизмы, входящие в состав бентосных сообществ, переживали сезонный цикл замерзания–оттаивания.
Видовые составы исследованных приполярных микробных матов и биопленок соляных маршей и мелководных участков озер лагунного типа не имели заметных отличий между собой.
Большинство идентифицированных нами видов АФБ были представлены известными видами, являющимися мезофилами. Единственная обнаруженная истинно психрофильная фототрофная бактерия – Rhodoferax antarcticus, впервые была выделена из планктона покрытого льдом меромиктического озера в Антарктиде (Madigan et al., 2000). Следует отметить, что АФБ, ранее изолированные из донных осадков антарктических вод, принадлежали к известным мезофильным видам пурпурных и зеленых серобактерий (Herbert, Tanner, 1977). Очевидно, способность к психрофилии развивалась постепенно в результате становления холодноводного глубоководного океана.
Климатические и гидрологические условия приполярных районов Беломорья были неблагоприятны для существования экстремальных галофилов. Большинство обнаруженных нами видов являлись умеренными галофилами или галотолерантами.
Одним из факторов толерантности к внешним воздействиям является гликокаликс (слизистый матрикс), который скрепляет все микроорганизмы в бентосных сообществах в единое целое и обладает криопротекторными свойствами (Саралов, 2019). Доминирующие в матах виды цианобактерий, АНФБ, пурпурных и зеленых серобактерий развиваются в природе в виде микроколоний, окруженных слизью или имеющих защитный слизистый чехол.
В исследованных нами приполярных микробных матах обитали как космополитные виды пурпурных бактерий (Chromatium sp., Thiocapsa rosea, Thiocapsa marina, Thiorhodovibrio sp.), так и виды, обнаруженные только в приполярных районах. Среди них ПСБ Thiorhodococcus mannitoliphagus, Thiocapsa litoralis, Thiocapsa bogorovii (Puchkova et al., 2000; Rabold et al., 2006; Tourova et al., 2009) и неизвестные ранее АНФБ. Отличительной особенностью приполярных матов являлось отсутствие ПСБ семейства Ectothiorhodospiraceae, характерных для микробных матов южных морей. Космополитами являлись ЗСБ родов Prosthecochloris aestuarii (Prosthecochloris phaeoasteroidea), Prosthecochloris indica, Chlorobium phaeovibrioides. Последний вид, образующий коричневые и зеленые фенотипы, доминировал в планктоне меромиктических озер приполярья (Grouzdev et al., 2018; Krasnova et al., 2018; Лунина и соавт., 2019). Этот же вид встречался также в средних и южных широтах (van Gemerden, Mas, 1995). Присутствие коричневых ЗСБ в бентосных сообществах отмечали и ранее, но это исключение из правила (Martínez-Alonso et al., 2005). Обычно обогащенные каротиноидами ЗСБ доминируют только в планктоне глубоководных меромиктических озер. Специфичными для исследованных сообществ являлись также АНФБ, которые относятся к новым филотипам (рис. 8). Следует отметить, что применение высокопроизводительного секвенирования дало возможность расширить имеющиеся ранее представления о разнообразии как оксигенных, так и аноксигенных фототрофных бактерий литоральной зоны Кандалакшского залива Белого моря.
Список литературы
Горленко В.М., Пучков А.Н., Демчев В.В. Фотосинтезирующие микроорганизмы супралиторальных ванн Белого моря // Биологические науки. 1985. Т. 5. С. 66–72.
Лунина О.Н., Саввичев А.С., Бабенко В.В., Болдырева Д.И., Колганова Т.В. Краснова Е.Д., Кокрятская Н.М., Веслополова Е.Ф., Воронов Д.А., Демиденко Н.А., Летарова М.А., Летаров А.В., Горленко В.М. Сезонные изменения структуры сообщества аноксигенных фототрофных бактерий меромиктического озера Трехцветное (Кандалакшский залив Белого моря) // Микробиология. 2019. Т. 88. № 1. С. 100–115.
Lunina O.N., Savvichev A.S., Babenko V.V., Boldyreva D.I., Kuznetsov B.B., Krasnova E.D., Kolganova T.V., Kokryatskaya N.M., Veslopolova E.F., Voronov D.A., Demidenko N.A., Letarova M.A., Letarov A.V., Gorlenko V.M. Seasonal variations in community structure of anoxygenic phototrophic bacteria from the meromictic Lake Trekhtsvetnoe (Kandalaksha Bay, White Sea) // Microbiology (Moscow). 2019. V. 88. P. 71–85.
Саралов А.И. Адаптивность экстремофилов Archaea и Bacteria // Микробиология. 2019. Т. 88. № 4. С. 377–400.
Awramik S.M. The oldest records of photosynthesis // Photosynth. Res. 1992. V. 33. P. 75–89.
Caporaso J.G., Kuczynski J., Stombaugh J., Bittinger K., Bushman F.D., Costello E.K., Fierer N., Peña A.G., Goodrich J.K., Gordon J.I. QIIME allows analysis of high-throughput community sequencing data // Nat. Methods. 2010. V. 7. P. 335–336.
de los Ríos A., Ascaso C., Wierzchos J., Vincent W.F., Quesada A. Microstructure and cyanobacterial composition of microbial mats from the High Arctic // Biodivers. Conserv. 2015. V. 24. P. 841–863.
Edgar R.C., Haas B.J., Clemente J.C., Quince C., Knight R. UCHIME improves sensitivity and speed of chimera detection // Bioinformatics. 2011. V. 27. P. 2194–2200.
Grouzdev D.S., Gaisin V.A., Krutkina M.S., Bryantseva I.A., Lunina O.N., Savvichev A.S., Gorlenko V.M. Genome sequence of Prosthecochloris sp. strain ZM and Prosthecochloris sp. strain ZM-2, isolated from an Arctic meromictic lake // Microbiol. Resour. Announc. 2018. V. 7. № 21. P. 1–3.
Habicht K.S., Gade M., Thamdrup B., Berg P., Canfield D.E. Calibration of sulfate levels in the Archean ocean // Science. 2002. V. 298. P. 2372–2374.
Herbert R.A., Tanner A.C. The isolation and some characteristics of photosynthetic bacteria (Chromatiaceae and Chlorobiaceae) from Antarctic marine sediments // J. Appl. Bacteriol. 1977. V. 43. P. 437–445.
Kappler A., Pasquero C., Konhauser K.O., Newman D.K. Deposition of banded iron formations by anoxygenic phototrophic Fe(II)-oxidizing bacteria // Geology. 2005. V. 33. P. 865–868.
Kirschvink J.L., Kopp R.E. Palaeoproterozoic ice houses and the evolution of oxygen-mediating enzymes: the case for a late origin of photosystem II // Philos. Trans. R. Soc. B Biol. Sci. 2008. V. 363. P. 2755–2765.
Krasnova E.D., Matorin D.N., Belevich T.A., Efimova L.E., Kharcheva A.V. Kokryatskaya N.M., Losyuk G.N., Todorenko D.A., Voronov D.A., Patsaeva S.V. The characteristic pattern of multiple colored layers in coastal stratified lakes in the process of separation from the White Sea // J. Oceanol. Limnol. 2018. V. 36. P. 1962–1977.
Krumbein W.E. Stromatolites – the challenge of a term in space and time // Precambrian Res. 1983. V. 20. P. 493–531.
Madigan M.T., Jung D.O., Woese C.R., Achenbach L.A. Rhodoferax antarcticus sp. nov., a moderately psychrophilic purple nonsulfur bacterium isolated from an Antarctic microbial mat // Arch. Microbiol. 2000. V. 173. P 269–277.
Martínez-Alonso M., Bleijswijk J., Gaju N., Muyzer G. Diversity of anoxygenic phototrophic sulfur bacteria in the microbial mats of the Ebro Delta: a combined morphological and molecular approach // FEMS Microbiol. Ecol. 2005. V. 52. P. 339–350.
Nealson K., Berelson W. Layered microbial communities and the search for life in the universe // Geomicrobiol. J. 2003. V. 20. P. 451–462.
Olson J.M. Photosynthesis in the Archean era // Photosynth. Res. 2006. V. 88. P. 109–117.
Pfennig N. Anreicherungskulturen für rote und grüne Schwefelbakterien. Zb. Bakt., 1 // Abt. Orig. Suppl. 1965. V. 1. P. 503–504.
Puchkova N.N., Imhoff J.F., Gorlenko V.M. Thiocapsa litoralis sp. nov., a new purple sulfur bacterium from microbial mats from the White Sea // Int. J. Syst. Evol. Microbiol. 2000. V. 50. P. 1441–1447.
Rabold S., Gorlenko V.M., Imhoff J.F. Thiorhodococcus mannitoliphagus sp. nov., a purple sulfur bacterium from the White Sea // Int. J. Syst. Evol. Microbiol. 2006. V. 56. P. 1945–1951.
Schloss P.D., Westcott S.L., Ryabin T., Hall J.R., Hartmann M., Hollister E.B. Lesniewski R.A., Oakley B.B., Parks D.H. Robinson C.J. Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities // Appl. Environ. Microbiol. 2009. V. 75. P. 7537–7541.
Seckbach J., Oren A. Microbial Mats / Eds. Seckbach J., Oren A. Dordrecht: Springer Netherlands, 2010. 606 p.
Tahon G., Tytgat B., Stragier P., Willems A. Analysis of cbbL, nifH, and pufLM in soils from the Sør Rondane Mountains, Antarctica, reveals a large diversity of autotrophic and phototrophic bacteria // Microb. Ecol. 2016. V. 71. P. 131–149.
Tourova T.P., Keppen O.I., Kovaleva O.L., Slobodova N.V., Berg I.A., Ivanovsky R.N. Phylogenetic characterization of the purple sulfur bacterium Thiocapsa sp. BBS by analysis of the 16S rRNA, cbbL, and nifH genes and its description as Thiocapsa bogorovii sp. nov., a new species // Microbiology (Moscow). 2009. V. 78. P. 339–349.
van Gemerden H., Mas J. Ecology of phototrophic sulfur bacteria // Anoxygenic photosynthetic bacteria / Eds. Blankenship R.E., Madigan M.T., Bauer C.E. Dordrecht: Kluwer Academic Press, 1995. P. 49–85.
Vincent W.F., Gibson J.A.E., Pienitz R., Villeneuve V., Broady P.A., Hamilton P.B., Howard-Williams C. Ice shelf microbial ecosystems in the high Arctic and implications for life on Snowball Earth // Naturwissenschaften. 2000. V. 87. P. 137–141.
Walter M.R. Archean stromatolites: evidence of the Earth’s earliest benthos // Earth’s Earliest Biosphere – Its Origin and Evolution / Ed. Schopf J.W. Princeton: Princeton Univ. Press, 1983. P. 187–213.
Wang Q., Garrity G.M., Tiedje J.M., Cole J.R. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy // Appl. Environ. Microbiol. 2007. V. 73. P. 5261–5267.
Wharton R.A., Jr., Parker B.C., Simmons G.M., Jr., Distribution, species composition and morphology of algal mats in Antarctic dry valley lakes // Phycologia. 1983. V. 22. P. 355–365.
Дополнительные материалы отсутствуют.


