Микробиология, 2019, T. 88, № 6, стр. 740-743
Количественное определение бактериохлорофиллов d и e в экстрактах при совместном присутствии зелено- и коричнево-окрашенных зеленых серобактерий в образцах природной воды
О. Н. Лунина a, *, А. А. Жильцова b, П. С. Емельянцев b, А. С. Саввичев a, С. В. Пацаева b
a Институт микробиологии им. С.Н. Виноградского, ФИЦ
“Фундаментальные основы биотехнологии” РАН
117312 Москва, Россия
b Физический факультет МГУ имени М.В. Ломоносова
119234 Москва, Россия
* E-mail: onlun@yandex.ru
Поступила в редакцию 26.06.2019
После доработки 02.07.2019
Принята к публикации 29.07.2019
Аннотация
В работе представлены первые попытки найти метод разделения и количественной оценки содержания в пробах озерной воды бактериохлорофиллов d и е зеленых серобактерий (ЗСБ). Разработанный метод позволяет показать соотношение зелено- и коричнево-окрашенных ЗСБ в природной воде при их совместном развитии с помощью измерения спектров поглощения экстрактов пигментов из взятой пробы.
Анализ пигментного состава микробного сообщества по глубине водоема дает представление о распределении различных групп фотосинтезирующих микроорганизмов в слоях воды, что является важной характеристикой водоема, прямо связанной с происходящими в нем процессами продукции и деструкции органического вещества, влияющими, в целом, на всю водную экосистему. Особый интерес вызывает исследование аноксигенных фототрофных бактерий (АФБ), обитающих чаще всего в нижних бескислородных слоях меромиктических водоемов. Используемая методика была нами разработана для стратифицированных водоемов, отделяющихся от Белого моря, где в водной толще в сообществах АФБ доминируют зеленые серобактерии (ЗСБ) (Krasnova et al., 2015; Savvichev et al., 2018). Основными фотосинтетическими пигментами ЗСБ являются бактериохлорофиллы (Бхл) d и е. В слое воды с зелено- или коричнево-окрашенными ЗСБ могут в значительном количестве развиваться и пурпурные бактерии, содержащие в качестве основного пигмента Бхл а. При анализе природных проб нужно учитывать состав сообщества оксигенных и аноксигенных фотосинтетиков в исследуемом горизонте и, как следствие, состав пигментов в полученном экстракте. На сегодняшний день количественное определение бактериохлорофиллов в водных образцах проводят при помощи экстрагирования пигментов различными растворителями и детектирования спектров поглощения экстрактов. Для этого пробу воды объемом V фильтруют или центрифугируют; пигменты из клеток экстрагируют в органическом растворителе объема v (часто в ацетоне или ацетон-метанольной смеси), регистрируют спектры поглощения экстрактов и с помощью значений оптической плотности на определенных длинах волн проводят количественный расчет содержания пигментов по эмпирическим формулам. В табл. 1 приведены длины волн максимумов поглощения света пигментами в экстрактах для выделенных культур и проб воды из различных водоемов, отделяющихся от Белого моря. Если сообщество АФБ в водоеме представлено микроорганизмами с одним преобладающим типом пигмента (только пурпурные бактерии с Бхл а, только зелено-окрашенные зеленые серобактерии с Бхл d или только коричнево-окрашенные зеленые серобактерии с Бхл е), то концентрацию Бхл в экстракте можно рассчитать с помощью следующих из закона Бугера–Ламберта–Бера формул (Намсараев, 2009). В обобщенном виде формулу для расчета концентрации (СБхлx, мкг/л) преобладающего Бхл x (Бхл а, d или е) можно записать:
Таблица 1.
Усредненные данные для длины волны длинноволнового максимума поглощения света в экстрактах пигментов, приготовленных в 2013–2019 гг. из выделенных культур и проб воды водоемов, отделяющихся от Белого моря
| Фототрофные микроорганизмы | Пигмент | Длина волны максимума длинноволнового пика, нм | |
|---|---|---|---|
| в ацетоне | ацетон–метанол (7 : 2) |
||
| Фитопланктон, цианобактерии | Хл а | 660–663 | 663–667 |
| Пурпурные бактерии | Бхл а | 770–775 | 774–778 |
| Зелено-окрашенные зеленые серобактерии | Бхл d | 651–653 | 653–659 |
| Коричнево-окрашенные зеленые серобактерии | Бхл е | 650–652 | 651–654 |
Однако чаще в природной воде развиваются АФБ разного пигментного состава, и на определенных глубинах их клетки могут присутствовать одновременно. Из табл. 1 видно, что присутствие Бхл а не будет мешать определению Бхл d и е, поскольку пики поглощения Бхл а и Бхл d и е не перекрываются. Определение содержания Бхл d при совместном присутствии с хлорофиллом (Хл) а проводилось в работе (Overmann, Tilzer, 1989). Предпринимались попытки определения содержания Бхл d в присутствии нескольких Хл (Хл а, b и c) (Горбунов, Уманская, 2003). Отметим, что в слоях массового развития АФБ в отделяющихся водоемах Белого моря обычно отсутствуют хлорофилл-содержащие микроорганизмы (водоросли, цианобактерии). Формулы (Overmann, Tilzer, 1989) с определенными ограничениями могут применяться для определения суммарной концентрации Бхл (d + e) для водных горизонтов с разными типами ЗСБ, но при сильном доминировании зелено-окрашенных ЗСБ. Если же доля коричнево-окрашенного типа бактерий возрастает, и концентрации Бхл d и е становятся сопоставимы, расчеты по таким формулам не дают возможности корректно оценить вклад зеленых и коричнево-окрашенных ЗСБ в пробе из-за значительного отличия коэффициентов поглощения Бхл d и Бхл е. Для разделения вкладов Бхл d и Бхл е в природной воде можно использовать флуоресцентный анализ водных образцов (Kharcheva et al., 2016; Жильцова и соавт., 2018). Методика спектрофотометрического разделения Бхл d и е при их совместном присутствии отсутствует, и, насколько нам известно, попытки разделить эти два пигмента из смеси по спектрам поглощения экстрактов до сих пор не предпринимались.
Мы предлагаем методику разделения Бхл d и Бхл е с помощью анализа одновременно длинноволнового и коротковолновых пиков в спектрах поглощения экстрактов. Объектами исследования были пробы природной воды и монокультуры зеленых и коричневых ЗСБ, выделенные из оз. Большие Хрусломены (о. Олений, Губа Ковда, Кандалакшский залив, Белое море). В качестве эталонных образцов для моделирования различных соотношений Бхл d и Бхл е были взяты жидкие монокультуры зелено-окрашенного штамма GrKhr-17 и коричнево-окрашенного штамма BrKhr-17. Штаммы бактерий были выращены в анаэробных условиях в жидкой культуре во флаконах. Геномы этих штаммов отличались друг от друга только наличием или отсутствием кластера, кодирующего синтез коричневого каротиноида изорениератина и Бхл е, а клетки штаммов различались только составом пигментов (Grouzdev et al., 2019). В качестве экстрагирующей смеси применяли ацетон : метанол в пропорции 7 : 2, поскольку эта смесь наиболее полно экстрагирует не только Бхл, но и каротиноиды (Ruivo et al., 2014). Для приготовления эталонных образцов – экстрактов Бхл d или Бхл е – монокультуры зелено- и коричнево-окрашенного штаммов осаждали на фильтре и осадок экстрагировали в ацетон-метанольной смеси, при этом в образце с Бхл d отсутствовал Бхл е, а в образце с Бхл е отсутствовал Бхл d. Экстракты хранили в холодильнике в темноте и все манипуляции с ними проводили в затененном помещении. Измерение спектров оптической плотности экстрактов проводили на спектрофотометре Solar 2201 в спектральном диапазоне 200–900 нм в кварцевых кюветах с длиной оптического пути 1 см.
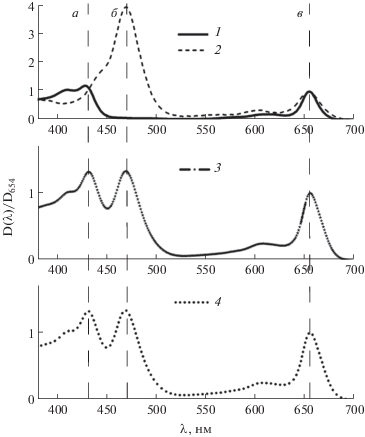
Мы использовали предположение об аддитивности вкладов Бхл d и е в суммарный спектр оптической плотности экстракта с коэффициентами, пропорциональными содержанию каждого пигмента. Для определения вкладов разных Бхл спектры поглощения экстрактов нормировали таким образом, чтобы оптическая плотность в максимуме длинноволнового пика составляла 1. Далее составляли последовательный ряд модельных спектров – суммы двух эталонных спектров с весами, изменяя доли компонентов от 0 до 1 с шагом 0.001. На рис. 1 показан нормированный спектр поглощения экстракта природной воды из оз. Б. Хрусломены (глубина 3.75 м) и пример его моделирования с помощью эталонных спектров. Сравнение модельного спектра с реальным спектром поглощения экстракта в коротковолновой области спектра от 400 до 500 нм позволило найти наилучшее соотношение пиков зелено-окрашенной (427 нм) и коричнево-окрашенной культуры (469 нм) и, соответственно, значения вкладов αd и αe для разных пигментов в спектр поглощения, при которых наблюдается наилучшее согласие по форме реального и модельного спектров экстрактов. Концентрации отдельно для Бхл d и Бхл е в исходных водных пробах рассчитывали по формулам:
Рис. 1.
Иллюстрация метода разделения вкладов Бхл d и Бхл e в спектр поглощения экстракта. Сверху вниз: эталонные спектры для зелено-окрашенной (1) и коричнево-окрашенной (2) культур ЗСБ; спектр поглощения экстракта воды из оз. Б. Хрусломены (глубина 3.75 м) (3); результат его моделирования с помощью эталонных спектров с весовыми коэффициентами αd = 0.727 и αe = 0.273 (4). Все спектры поглощения нормированы к 1 в длинноволновом пике. а − Характерный пик для зелено-окрашенных ЗСБ, б − характерный пик для коричнево-окрашенных ЗСБ, в − характерный длинноволновый пик для ЗСБ.
Список литературы
Горбунов М.Ю., Уманская М.В. Аноксигенные фототрофные бактерии в водоемах особо охраняемых территорий Самарской области // Экологические проблемы заповедных территорий России / Под ред. д.б.н. Саксонова С.В. Тольятти: ИЭВБ РАН, 2003. С. 136–144.
Жильцова А.А., Харчева А.В., Краснова Е.Д., Лунина О.Н., Воронов Д.А., Саввичев А.С., Горшкова О.М., Пацаева С.В. Спектральное исследование зеленых серных бактерий в стратифицированных водоемах Кандалакшского залива Белого моря // Оптика атмосферы и океана. 2018. Т. 31. С. 233–239.
Zhiltsova A.A., Kharcheva A.V., Krasnova E.D., Lunina O.N., Voronov D.A., Savvichev A.S., Gorshkova O.M., Patsaeva S.V. Spectroscopic study of green sulfur bacteria in stratified water bodies of the Kandalaksha gulf of the White Sea // Atmosph. Ocean Optics. 2018. V. 31. P. 390–396.
Намсараев З.Б. Использование коэффициентов поглощения для расчета концентрации хлорофиллов и бактериохлорофиллов // Микробиология. 2009. Т. 78. С. 836–839.
Namsaraev Z.B. Application of extinction coefficients for quantification of chlorophylls and bacteriochlorophylls // Microbiology (Moscow). 2009. V. 78. P. 794–797. https://doi.org/10.1134/S0026261709060174
Borrego C.M., Arellano J.B., Abella C.A., Gillbro T., Garcia-Gil L.J. The molar extinction coefficient of bacteriochlorophyll e and the pigment stoichiometry in Chlorobium phaeobacteroides // Photosynth. Res. 1999. V. 60. P. 257–264.
Feick R.G., Fitzpatrick M., Fuller R.C. Isolation and characterization of cytoplasmic membranes and chlorosomes from the green bacterium Chloroflexus aurantiacus // J. Bacteriol. 1982. V. 150. P. 905–915.
Grouzdev D.S., Lunina O.N., Gaisin V.A., Krutkina M.S., Baslerov R.V., Savvichev A.S., Gorlenko V.M. Sequence of green- and brown-colored strains of Chlorobium phaeovibrioides with gas vesicles // Microbiol. Resour. Announc. 2019. B пeчaти.
Kharcheva A.V., Zhiltsova A.A., Lunina O.N., Savvichev A.S., Patsaeva S.V. Quantification of two forms of green sulfur bacteria in their natural habitat using bacteriochlorophyll fluorescence spectra // Proc. SPIE. 2016. V. 9917. P. 99170P–1–99170P–8.
Krasnova E.D., Kharcheva A.V., Milyutina I.A., Voronov D.A., Patsaeva S.V. Study of microbial communities in redox zone of meromictic lakes isolated from the white sea using spectral and molecular methods // J. Marine Biol. Assoc. UK. 2015. V. 95. P. 1579–1590.
Montesinos E., Guerrero R., Abella C., Esteve I. Ecology and physiology of the competition for light between Chlorobium limicola and Chlorobium paeobacteroides in natural habitats // Appl. Environ. Microbiol. 1983. V. 46. P. 1008.
Overmann J., Tilzer M.M. Control of primary productivity and the significance of photosynthetic bacteria in a meromictic kettle lake Mittlerer Buchensee, West-Germany // Aquat. Sci. 1989. V. 51. P. 4.
Ruivo M., Cartaxana P., Cardoso M.I., Tenreiro A., Tenreiro R., Jesus B. Extraction and quantification of pigments in aerobic anoxygenic phototrophic bacteria // Limnol. Oceanogr.: Methods. 2014. V. 12. P. 338–350.
Savvichev A.S., Babenko V.V., Lunina O.N., Letarova M.A., Boldyreva D.I., Veslopolova E.F., Demidenko N.A., Kokryatskaya N.M., Krasnova E.D., Gaisin V.A., Kostryukova E.S., Gorlenko V.M., Letarov A.V. Sharp water column stratification with an extremely dense microbial population in a small meromictic lake Trekhtzvetnoe // Environ. Microbiol. 2018. V. 20. P. 3784–3797.
Stanier R.Y., Smith J.H.C. The chlorophylls of green bacteria // Biochim. Biophys. Acta. 1960. V. 41. P. 478–484.
Дополнительные материалы отсутствуют.


