Микробиология, 2019, T. 88, № 6, стр. 685-694
Определение общей численности микроорганизмов в донных осадках черного моря методом проточной цитометрии
О. А. Рылькова a, *, С. Б. Гулин a, Н. В. Пименов b
a Институт биологии южных морей имени А.О. Ковалевского, Федеральный исследовательский центр
Российской академии наук
299011 Севастополь, Россия
b Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: olga.rylkova@gmail.com
Поступила в редакцию 22.05.2019
После доработки 31.05.2019
Принята к публикации 21.06.2019
Аннотация
С целью более полного выявления микроорганизмов в донных осадках Черного моря усовершенствованы методы подготовки проб и применен метод проточной цитометриии после окраски клеток флуорохромом SYBR Green I. Показано, что наиболее универсальными приемами пробоподготовки донных отложений различного типа являются: применение пирофосфата натрия; параллельное с этим использование плавиковой кислоты для глубоководных восстановленных осадков; обработка проб метанолом как предпочтительная при исследованиях грунтов в прибрежных акваториях с нормальной степенью аэрации придонного слоя. Для образцов различного типа предложены оптимальные варианты пробоподготовки, включая выбор химического реагента, режим ультразвуковой обработки и центрифугирования, дополнительные промывочные процедуры. Предложенные комплексы методов обработки донных отложений позволили существенно повысить эффективность учета клеток бактерий, а использование проточной цитометрии после окраски клеток флуорохромом обеспечило быстроту определения общей численности микроорганизмов в донных осадках. Диапазон общей численности микроорганизмов составил 0.03–1.54 × 108 кл. г–1 и 0.002–1.24 × 108 кл. г–1 сухого веса образцов, отобранных из шельфовых и глубоководных осадков соответственно. Это сопоставимо с данными, описанными ранее для различных акваторий Мирового океана, включая Черное море.
Черное море – крупнейший в мире меромиктический водоем, отличительной особенностью водной толщи которого является наличие стабильного галоклина, который отделяет солоноватый кислородный слой от бескислородного. Микробиологические исследования в черноморских осадках чаще проводились в шельфовых (Миронов, 1979; Сорокин, 1982; Thamdrup et al., 2000; Lein et al., 2002; Pimenov et al., 2013; Tarnovetskii et al., 2018), реже – в глубоководных участках моря (Leloup et al., 2007; Schippers et al., 2012). Показатели общей численности бактерий в донных отложениях Черного моря обычно приводятся в контексте исследований отдельных групп микроорганизмов (метаноокисляющих, сульфатредуцирующих и др.) и их роли в биогеохимических циклах (Thamdrup et al., 2000; Lein et al., 2002; Leloup et al., 2007; Egorov et al., 2011; Schippers et al., 2012; Pimenov et al., 2013; Malakhova et al., 2015; Tarnovetskii et al., 2018).
Основной проблемой при определении общей численности микроорганизмов в образцах, содержащих большое количество взвешенного вещества (например, лиманы, приливно-отливные зоны, донные осадки и др.), является сложность отделения бактериальных клеток от небиологической фракции из-за прочного связывания. Кроме того, неорганические и органические частицы, присутствующие в пробах, обладают способностью к неспецифическому связыванию с флуоресцентными красителями и/или автофлуоресценции, что сильно затрудняет распознавание бактериальных клеток при любом способе их регистрации (Weinbauer et al., 1998; Danovaro et al., 2001; Kallmeyer et al., 2008; Morono et al., 2009).
В последние десятилетия были предложены несколько методов отделения клеток микроорганизмов от осадочных частиц. Наиболее часто для обработки донных осадков использовали различные поверхностно-активные вещества: неионные (Tween 80), ионные (пирофосфат натрия) (Frischer et al., 2000; Danovaro et al., 2001, 2010). Известно о применении в качестве химического реагента метилового спирта, разрушающего полисахаридные экзополимеры, которые удерживают клетки микроорганизмов, ассоциированные с различными небиологическими частицами (Lunau et al., 2005; Kallmeyer et al., 2008). Для исследования глубоководных донных осадков был предложен комбинированный метод двустадийной обработки образца плавиковой кислотой с последующей остановкой реакции смесью, содержащей метанол. При этом способе обработки проб растворяются аморфные силикаты и внеклеточные биомолекулы, что приводит к снижению небиологической флуоресценции сигнала после окраски анализируемого материала флуорохромами. При этом влияние на внутриклеточную ДНК оказывалось минимальным (Morono et al., 2009). В дополнение к химическим способам обработки донных отложений предлагалась последующая механическая обработка осадков: встряхивание, использование ультразвука или блендера, центрифугирование (Lindahl, Bakken 1995; Kallmeyer et al., 2008). Однако, как отмечали авторы, с повышением эффективности выделения клеток из субстрата может увеличиваться их лизис. Таким образом, каждый из использованных методов обладал своими преимуществами и недостатками, подходил для тех или иных водоемов, окисленных или восстановленных осадков.
В большинстве исследований по выявлению клеток в донных отложениях прямыми микроскопическими методами использовали флуоресцентную микроскопию. Метод проточной цитометрии наиболее часто применяется для исследования численности микроорганизмов почв (Porter et al., 1997), сравнительно недавно он был использован для анализа донных осадков в озерах и реках (Duhamel, Jacquet, 2006; Amalfitano, Fazi, 2008). Для анализа морских отложений подобные работы отсутствуют.
Целью данной работы было повысить эффективность определения общей численности прокариот в донных осадках из различных районов Черного моря путем сочетания химических и физических способов пробоподготовки и использования метода проточной цитометрии.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты. В работе исследовали осадочные отложения из Севастопольской бухты (44°37.53′ с.ш., 33°31.32′ в.д.; глубина 14 м) и глубоководной зоны западной части Черного моря (44°40.70′ с.ш., 31°51.70′ в.д.; глубина 756 м). Пробы донных осадков отбирали коробчатым дночерпателем (“EPA”, США) и/или акриловой грунтовой трубкой с вакуумным затвором. Непосредственно после отбора осадочный керн вертикально разделяли на слои толщиной 1–2 см и помещали в стерильные чашки Петри. Образцы хранили не более 6 мес. при температуре –20°С и размораживали непосредственно перед определениями.
Подготовка суспензии пробы и фиксирование материала. Репрезентативные образцы (в двух повторностях) готовили смешиванием трех порций грунта с соответствующего слоя. Полученную навеску (0.2–1.0 г) предварительно разбавляли отфильтрованной морской водой, интенсивно перемешивали вручную и фиксировали 40% формальдегидом (50 мкл мл–1 пробы). Общий объем суспензии грунта, в зависимости от метода, составлял 2–7 мл. Для стерилизации рабочих растворов и морской воды непосредственно перед анализом проводили их фильтрацию с использованием фильтров с диаметром пор 0.2 мкм (“Sartorius”, Германия).
Химическая обработка осадка пирофосфатом натрия. В пробирку с суспензией грунта (после процесса разведения и фиксации) добавляли 50 мМ рабочего раствора пирофосфата натрия (Na4P2O7) до конечной концентрации 5 мМ и инкубировали 15 мин в темноте при комнатной температуре. После инкубации все образцы встряхивали вручную в течение 1 мин, а затем обрабатывали от 1 до 15 мин на ультразвуковой (УЗ) установке (Unitra unima 01SZTYN UM-4, VA140, V220, Hz50). Для окончательного отделения клеток от частиц осадка и увеличения объема надосадочной жидкости пробы центрифугировали (1–5 мин, 700 g) (Danovaro et al., 2001, 2010). Для получения качественного сигнала при цитометрических измерениях время УЗ обработки было увеличено до 30 мин. Для предотвращения перегрева пробы УЗ обработку проводили в ледяной бане, через 15 мин пробирки встряхивали вручную, а в конце обработки – 1 мин с помощью вортекса (Microspin FV-2400, “Biosan”, Латвия). Аликвоты супернатанта (1 мл) использовали для микроскопического и цитометрического анализов.
Обработка метанолом. В пробирку с 6 мл суспензии осадка (без фиксации пробы) добавляли 0.6 мл 10% метанола (СН3ОН) и встряхивали вручную. Образцы выдерживали в УЗ установке в течение 15 мин при 35°С, затем пробы встряхивали c помощью вортекса в течение 1 мин. Для удаления детритных и неорганических частиц суспензии центрифугировали (1 мин, 190 g) (Lunau et al., 2005; Kallmeyer et al., 2008). Для последующих анализов отбирали 1 мл супернатанта.
Обработка плавиковой кислотой. К 0.5 мл суспензии донных осадков (после разведения и фиксации) добавляли 0.7 мл раствора плавиковой кислоты (1% HF в 3% NaCl) и инкубировали 20 мин при комнатной температуре. После инкубации все образцы встряхивали вручную и обрабатывали 4 мл смешанного раствора (1 М Tris-HCl, pH 8.0; 0.125 М CaCl2 и 25% СH3OH), затем в течение 1 мин проводили УЗ обработку на ледяной бане и центрифугировали (1 мин, 100 g) (Morono et al., 2009); 1 мл супернатанта использовали для анализа.
Серия промывочных поцедур (аналогична для всех методов). Для более точного выявления количества клеток микроорганизмов, остающихся в осадке после химической и механической обработок, поводили серию промывочных процедур. После отбора аликвоты для анализа супернатант аккуратно сливали, в осадок добавляли фильтрованную морскую воду, перемешивали и центрифугировали в необходимом для данного метода режиме. В каждой аликвоте супернатаната (1 мл) определяли количество клеток микроорганизмов с 3–10-кратной повторностью.
Окраска клеток SYBR Green I. Окраску микроорганизмов SYBR Green I проводили в соответствии с протоколами Marie et al. (1997) и Noble, Fuhrman (1998). Рабочие растворы флуорохромов готовили из расчета 10 мкл мл–1 стерильной Milli-Q воды и хранили при температуре –20°С. Образцы прокрашивали с добавленем 10 мкл рабочего раствора на 1 мл пробы с последующей инкубацией в темноте в течение 1 ч.
Эпифлуоресцентрная микроскопия. Для концентрирования бактериальных клеток использовали ядерные фильтры производства ОИЯИ (г. Дубна, Россия) с диаметром пор 0.2 мкм и фильтровальную установку (“Sartorius”, Германия). Для равномерного распределения клеток фильтр помещали на влажную подложку из обеззоленного бумажного фильтра с диаметром пор 1.5–2.5 мкм. Разрежение в процессе фильтрации не превышало 150 мм рт. ст. Для гашения собственной флуоресценции фильтры предварительно окрашивали в насыщенном растворе судана черного в 50% этаноле в течение 1 сут (Hobbie et al., 1977). Подсчет клеток бактерий проводили в трех повторностях с помощью микроскопа Jenalumar-a/d (“Carl Zeiss”, Германия), оснащенного ртутной лампой HBO-202, при увеличении ×1000. При подсчете клеток после окраски SYBR Green I были использованы наборы оптических фильтров: синий возбуждающий от 465 до 505 нм, барьерный 510 нм; эмиссионный от 515 до 565 нм (Marie et al., 1997; Noble, Fuhrman, 1998). Измерения проводили в двух повторностях, на каждом фильтре просчитывали не менее 200 клеток в 10–20 полях зрения для получения данных с ошибкой не более 20% при 95%-ном уровне значимости (Лебедева и соавт., 1969).
Проточная цитометрия. Пробы анализировали с помощью проточного цитометра (CytomicsTM FC 500; “Beckman Coulter”, США), содержащего в качестве источника света синий (488 нм) аргоновый лазер, и программного обеспечения CXP. Данные обрабатывали с помощью программного обеспечения Flowing Software v. 2.5.0 (Perttu Terho, Turku Centre for Biotechnology, University of Turku, Finland, www.flowingsoftware.com).
Численность микроорганизмов определяли в пробах, окрашенных флуорохромом, выделяя флуоресцирующую фракцию, соответствующую размерам бактериальных клеток, на 2-параметрических цитограммах прямого светорассеивания (FS) и флуоресценции SYBR Green I в зеленой области спектра (канал FL1, 525 нм) на безразмерных логарифмических шкалах (Gasol et al., 2000). Концентрацию клеток рассчитывали с учетом скорости протока пробы (15 мкл мин–1), времени счета (60 с) и количества клеток, зарегистрированных в этот промежуток времени. Контроль качества измерений проводили с помощью калибровочных разноразмерных (0.2–10 мкм) флуоресцентных микросфер (“Beckman Coulter”, “Molecular Probes”, США). Навески для приготовления суспензии готовили таким образом, чтобы с учетом разбавления фильтрованной морской водой и вводимых реагентов разведение пробы составляло 10–30 раз. Для анализа использовали 1 мл пробы, измерения проводили в двух повторностях. Количество частиц, просчитываемых за 1 с, не превышало 103–104.
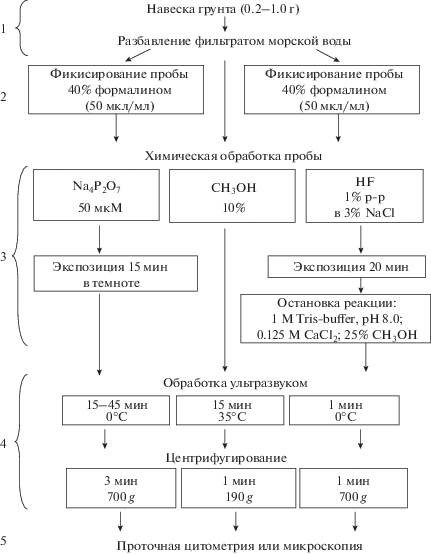
Окончательные варианты методических протоколов с нашей модификацией приведены на рис. 1. Для всех методов были использованы общие этапы обработки проб: 1) приготовление суспензии грунта разбавлением фильтрованной морской водой; 2) в случае необходимости, фиксирование пробы; 3) обработка химическим реагентом; 4) механическая обработка ультразвуком; 5) учет численности клеток с использованием проточной цитометрии и/или микроскопических подсчетов.
Рис. 1.
Обобщенный протокол, иллюстрирующий этапы сепарации бактериальных клеток от частиц грунта при обработке черноморских проб. Использованы оригинальные протоколы, приведенные в работах Danovaro et al., 2001, 2008, 2010 (для Na4P2O7); Lunau et al., 2005; Kallmeyer et al., 2008 (для СH3OH); Morono et al., 2009 (для комбинированного способа с HF и СH3OH).
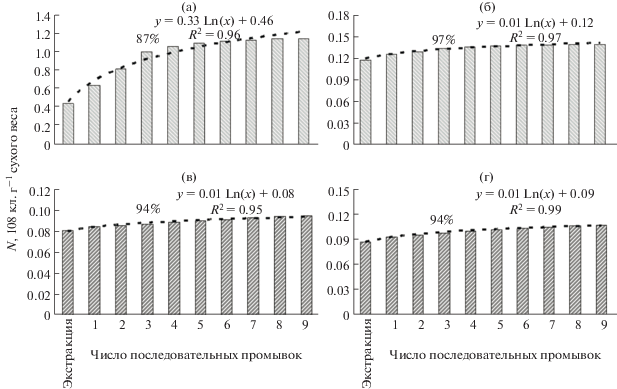
Расчет численности бактерий. При расчетах общей численности бактерий учитывали объемы растворов: фиксатора, вводимых реактивов и фильтрованной морской воды, использованной для приготовления суспензии образца и промывок. Поскольку для каждой пробы кроме экстракции после химической и механической обработок проводили серию промывок, полученные после каждого этапа обработки результаты суммировали. По полученным данным строили кумулятивные кривые, за 100% десорбированных из осадков клеток принимали результаты, полученные после 10 промывок. Общую численность микроорганизмов выражали числом клеток на 1 г сухого образца (кл. г–1).
Статистический анализ проводили в пакете STATISTICA (data analysis software system), версия 10 (“StatSoft, Inc.”, www.statsoft.com), построение графиков – в программах SigmaPlot 10.0 (“SYSTAT Software, Inc.”) и Grapher 8 (“Golden Software, Inc.”).
РЕЗУЛЬТАТЫ
Цитометрический анализ суспензий, полученных после инкубации образца донных отложений из Севастопольской бухты в растворе пирофосфата натрия (5 мМ), ультразвуковой обработки (3–30 мин), отделения крупных частиц при быстром центрифугировании и прокрашенных SYBR Green I, показал существенные различия в оценках численности клеток, зависящие от режима пробоподготовки. При краткосрочной обработке УЗ (3 мин) и центрифугировании (700 g, 1 мин), была выявлена малочисленная фракция частиц с диапазоном размеров и интенсивности флуоресценции, соответствующим бактериальным клеткам (0.03–0.10 × 108 кл. г–1 сухого образца); большая часть частиц обладала крупными размерами и низкой флуоресценцией (рис. 2а, табл. 1). Увеличение времени обработки УЗ до 15 мин с тем же режимом центрифугирования обеспечило вдвое большую эффективность выявления клеток (0.25 ± 0.004 × 108 кл. г–1 сухого образца), однако фракция неклеточных частиц была многочисленной (рис. 2б, табл. 1). Относительно высокое количество микробных клеток (0.50 ± 0.02 × 108 кл. г–1 сухого образца) и практическое отсутствие крупноразмерной фракции было выявлено после 30 мин ультразвуковой обработки в ледяной бане и центрифугирования в течение 3 мин при 700 g (рис. 2в, табл. 1). Именно этот режим обработки использовали в дальнейшем для определения численности микроорганизмов в донных пробах из Севастопольской бухты и глубоководных районов Черного моря (табл. 1).
Рис. 2.
Цитограммы, полученные после обработки проб донных осадков из Севастопольской бухты (слой 2–3 см) пирофосфатом натрия, последующей механической обработки и окраски SYBR Green I: а – УЗ обработка (3 мин), центрифугирование (700 g, 1 мин); б – УЗ обработка (15 мин), центрифугирование (700 g, 1 мин); в – УЗ обработка (30 мин), центрифугирование (700 g, 3 мин). Обозначения: FS – размеры клеток; FL1 – интенсивность флуоресценции в зеленой области спектра; N – численность бактерий.
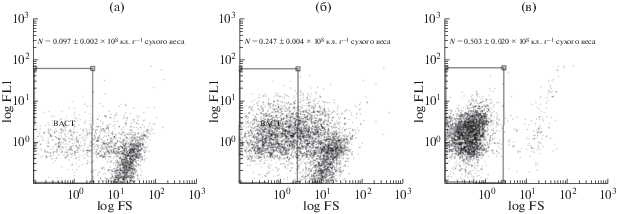
Таблица 1.
Численность бактерий в различных слоях донных осадков Севастопольской бухты Черного моря по результатам цитометрического анализа после химической обработки различными реагентами и окраски флуорохромом SYBR Green I
| Слой исследования, см | Способ пробоподготовки | Численность бактерий (×108 кл. г–1 сухого образца) |
|---|---|---|
| 0–2 | Обработка ПФ, 3 мин УЗ, ЦФ (700 g, 1 мин) | 0.03 ± 0.002 |
| 2–3 | Обработка ПФ, 3 мин УЗ, ЦФ (700 g, 1 мин) Обработка ПФ, 15 мин УЗ, ЦФ (700 g, 1 мин) Обработка ПФ, 30 мин УЗ, ЦФ (700 g, 3 мин) |
0.10 ± 0.002 0.25 ± 0.004 0.50 ± 0.02 |
| 3–4 | Обработка ПФ, 30 мин УЗ, ЦФ (700 g, 3 мин) Обработка МТ, 15 мин УЗ, ЦФ (190 g, 1 мин) |
1.54 ± 0.26 1.07 ± 0.38 |
| 4–5 | Обработка ПФ, 30 мин УЗ, ЦФ (700 g, 3 мин) | 0.56 ± 0.02 |
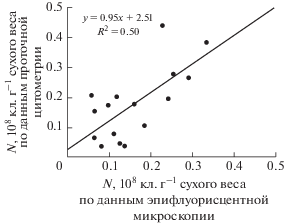
Контроль цитометрических измерений проводили с помощью эпифлуоресцентной микроскопии. В обоих случаях образцы обрабатывали пирофосфатом натрия (15 мин) с УЗ обработкой (30 мин, при 0°С), центрифугированием (700 g, 3 мин) и окраской флуорохромом SYBR Green I. Показано, что полученные величины численности бактерий для донных отложений Севастопольской бухты находились в пределах одного порядка и достоверно не различались: (0.18 ± 0.12) и (0.16 ± 0.09) × 108 кл. г–1 сухого образца (цитометрия и микроскопия соответственно; парный t‑тест, р > 0.05). Нами была обнаружена положительная корреляция c заметной степенью связи между полученными величинами (r = 0.7), уравнение регрессии и степень детерминации указаны на рис. 3.
Рис. 3.
Сопоставление численности бактерий (N) из различных слоев донных осадков Севастопольской бухты после обработки пирофосфатом натрия (15 мин), УЗ обработки (30 мин), центрифугирования (700 g, 3 мин), окраски флуорохромом SYBR Green I и при подсчете клеток с помощью проточной цитометрии и эпифлуоресцентной микроскопии. Обозначения: FS – размеры клеток; FL1 – интенсивность флуоресценции в зеленой области спектра; N – численность бактерий.
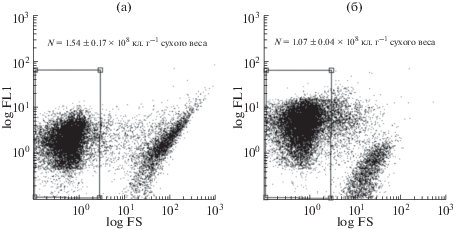
Цитометрический анализ проб донных осадков Севастопольской бухты (слой 3–4 см), проведенный после экстракции образца метанолом (10%), обработки УЗ (15 мин, при 35°С), центрифугирования (190 g, 1 мин), показал высокое количество обнаруживаемых микробных клеток (1.07 ± 0.04 × 108 кл. г–1 сухого образца). Фракции неклеточных, крупных частиц с большей вероятностью можно отнести к небиологическим частицам из-за очень низкого уровня FL1 сигнала (рис. 4б). Сопоставление двух методов химической обработки (Na4P2O7 и СH3OH) показало сходство полученных величин, хотя при обработке пирофосфатом натрия выявляемая численность микроорганизмов была в 1.5 раза выше (1.54 ± 0.04 × 108 кл. г–1 сухого образца) (рис. 4а).
Рис. 4.
Цитограммы, полученные после обработки проб донных осадков Севастопольской бухты (слой 3–4 см): а – пирофосфатом натрия; б – метанолом. Обозначения: FS – размеры клеток; FL1 – интенсивность флуоресценции в зеленой области спектра; N – численность бактерий.
При цитометрическом анализе проб из различных слоев донных отложений глубоководной аноксической зоны Черного моря (западная часть, свал глубин, 756 м), обработанных метанолом, величины численности бактерий оказались очень низкими и варьировали от 0.002 до 0.16 × 108 кл. г–1 сухого образца (табл. 2). После центрифугирования в пробе оставались частицы взвеси, которые засоряли проточную систему цитометра. При микроскопическом анализе была выявлена низкая численность клеток. Кроме того, сильная засветка фона на фильтре, обусловленная автофлуоресценцией взвеси, значительно затрудняла подсчет клеток. Вероятно, этот метод имеет ограничения для глубоководных черноморских проб. Поэтому для осадков такого типа мы опробовали комбинированный метод с применением в качестве химического реагента плавиковой кислоты с последующей обработкой пробы смесью, содержащей метанол (Morono et al., 2009). Для различных слоев образца из глубоководностй части Черного моря при такой обработке выявленная численность клеток микроорганизмов стала выше, до 0.02–1.24 × 108 кл. г–1 сухого образца (табл. 2). В качестве контроля для тех же образцов была применена обработка проб пирофосфатом натрия, успешно использованная другими авторами (Danovaro et al., 2001, 2008, 2010). При таком способе обработки проб численность микроорганизмов в них составила 0.01–0.93 × 108 кл. г–1 сухого образца (табл. 2). Таким образом, при использовании метанола величины численности бактерий (из одинаковых слоев донных отложений глубоководной части Черного моря) были в 4–20 раз ниже, чем при обработке пирофосфатом натрия и комбинированном способе с использованием плавиковой кислоты. Это согласуется с данными Schippers et al. (2012), полученными также для глубоководных черноморских осадков.
Таблица 2.
Численность бактерий в донных осадках глубоководной части Черного моря по результатам цитометрического анализа после химической обработки различными реагентами и окраски флуорохромом SYBR Green I
| Слой исследования, см | Способ пробоподготовки | Численность бактерий (×108 кл. г–1 сухого образца) |
|---|---|---|
| 0–1 | Обработка МТ, 15 мин УЗ, ЦФ (190 g, 1 мин) Обработка ПФ, 30 мин УЗ, ЦФ (700 g, 3 мин) Обработка ПК, 1 мин УЗ, ЦФ (700 g, 1 мин) |
0.01 ± 0.002 0.06 ± 0.01 0.09 ± 0.01 |
| 1–2 | Обработка МТ, 15 мин УЗ, ЦФ (190 g, 1 мин) Обработка ПФ, 30 мин УЗ, ЦФ (700 g, 3 мин) |
0.02 ± 0.002 0.08 ± 0.01 |
| 2–3 | Обработка МТ, 15 мин УЗ, ЦФ (190 g, 1 мин) Обработка ПФ, 30 мин УЗ, ЦФ (700 g, 3 мин) |
0.02 ± 0.01 0.24 ± 0.02 |
| 3–4 | Обработка МТ, 15 мин УЗ, ЦФ (190 g, 1 мин) Обработка ПФ, 30 мин УЗ, ЦФ (700 g, 3 мин) |
0.03 ± 0.01 0.333 ± 0.06 |
| 4–5 | Обработка МТ, 15 мин УЗ, ЦФ (190 g, 1 мин) Обработка ПФ, 30 мин УЗ, ЦФ (700 g, 3 мин) Обработка ПК, 1 мин УЗ, ЦФ (700 g, 1 мин) |
0.002 ± 0.0001 0.01 ± 0.002 0.02 ± 0.002 |
| 5–6 | Обработка МТ, 15 мин УЗ, ЦФ (190 g, 1 мин) Обработка ПФ, 30 мин УЗ, ЦФ (700 g, 3 мин) Обработка ПК, 1 мин УЗ, ЦФ (700 g, 1 мин) |
0.16 ± 0.01 0.93 ± 0.03 1.24 ± 0.12 |
Эффективность высвобождения бактерий сразу после их экстракции из донных образцов (на примере проб из Севастопольской бухты) варьировала в зависимости от применяемых химических реагентов и режима УЗ обработки: 62 ± 32 и 74 ± 17%, при использовании пирофосфата натрия и метанола соответственно. Оказалось, что это количество клеток было достоверно ниже кумулятивной численности микроорганизмов после трех промывок (парный t-тест; p < 0.05). При увеличении числа промывочных процедур до 4–10, суммарное количество бактерий, вымываемых из образца, продолжало увеличиваться, однако разница между кумулятивной численностью клеток в последующих промывках была недостоверной (парный t-тест; p > 0.05). Несомненно, что даже после 10 промывочных процедур не все клетки вымывались из осадка, часть оставалась связанной с частицами. Однако после этапа химической и УЗ обработок и последовательных трех промывок количество бактериальных клеток, перешедших в супернатант, при использовании пирофосфата натрия достигало 92 ± 6% (рис. 5а, 5б), метанола – 95 ± 2% (рис. 5в, 5г). Таким образом, количество клеток, связанных с частицами, оставалось незначительным (менее 5–8%), и им можно было пренебречь.
ОБСУЖДЕНИЕ
Универсальным методом для обработки черноморских осадков любого типа оказалось применение в качестве химического реагента пирофосфата натрия. Этот способ наиболее часто использовали в исследованиях донных осадков с различных глубин Мирового океана при определении в них общей численности бактерий (Weinbauer et al., 1998; Danovaro et al., 2008, 2010; Schippers et al., 2012). Однако оптимальное время ультразвуковой обработки (30 мин), использованное нами, намного превышало кратковременную обработку УЗ (3 мин), предложенную в оригинальном протоколе (Danovaro et al., 2001, 2008, 2010). В исследованиях Buesing, Gessner (2002) отмечено, что возможно повышение времени УЗ обработки от 3–10 до 90 мин, однако при длительной обработке наблюдали небольшое (до 15%) снижение численности бактерий.
Обработка проб метанолом оказалась наиболее удобным методом при исследованиях осадков в прибрежных акваториях с нормальной степенью аэрации придонного слоя. Несомненным преимуществом этого способа обработки проб было отсутствие этапа фиксирования клеток, что делает возможным его применение для таких последующих анализов, где наличие фиксатора неприемлемо (определение АТФ, молекулярные методы и др.) (Lunau et al., 2005; Kallmeyer et al., 2008).
Для глубоководных восстановленных осадков Черного моря, наряду с обработкой пирофосфатом натрия, оказалось целесообразным использование комбинированного метода с использованием плавиковой кислоты и последующей обработки пробы смесью, содержащей метанол. В отличие от обработки соляной кислотой, предложенной ранее для отмывки обогащенных карбонатами проб (Kallmeyer et al., 2008), инкубация с плавиковой кислотой была более эффективной для глубоководных проб, содержащих в большом количестве силикаты (Morono et al., 2009).
В целом, порядок полученных нами величин общей численности бактерий в осадках (0.03–1.54 × × 108 и 0.002–1.24 × 108 кл. г–1 сухого образца для Севастопольской бухты и глубоководной части Черного моря соответственно) сопоставим с результатами других исследователей (Leloup et al,. 2007; Schippers et al., 2012; Thamdrup et al., 2018; Tarnovetskii et al., 2018) для Черного моря (табл. 3), и других акваторий Мирового океана (Weinbauer et al., 1998; Danovaro et al., 2008). Некоторые расхождения в абсолютных величинах (табл. 3), вероятно, связаны с различиями в методах обработки образцов, используемого красителя, способов регистрации и расчета численности клеток (кл. г–1 сухого образца или кл. мл–1 суспензии осадка).
Таблица 3.
Численность бактерий в донных отложениях из различных прибрежных и глубоководных районов Черного моря
| Район исследований | Глубина, м | Численность бактерий | Ссылка |
|---|---|---|---|
| Прибрежные и шельфовые районы | |||
| Каламитский залив (западное побережье Крыма, Черное море) | 4 | 54–116* | Tarnovetskii et al., 2018 (окраска DAPI; эпифлуоресцентная микроскопия) |
| Шельф Румынии (Черное море) | 62–130 | 9–36* | Thamdrup et al., 2018 (окраска DAPI; эпифлуоресцентная микроскопия) |
| Севастопольская бухта (Черное море) | 14 | 0.03–1.6 | Собственные данные (обработка ПФ, МТ; окраска SYBR Green I; проточная цитометрия) |
| Глубоководные районы | |||
| Глубоководная часть, западная и восточная части Черного моря | 840–2048 | 0.1–100* | Schippers et al., 2012 (обработка ПФ; окраска SYBR Green I; эпифлуоресцентная микроскопия) |
| Глубоководная западная часть Черного моря | 1024 | 0.13–7.2 | Leloup et al., 2007 (окраска АО; эпифлуоресцентная микроскопия) |
| 756 | 0.02–1.35 | Собственные данные (обработка ПФ, МТ, ПК; окраска SYBR Green I; проточная цитометрия) |
|
Для обеспечения максимально полного учета бактериальных клеток в донных осадках необходимым этапом подготовки образцов стало проведение последовательных промывочных процедур. Исследования Danovaro et al. (2010) показали, что изначально из осадка и при последующих трех промывках извлекается 95% вирусов, однако данные для бактерий не приводятся. По данным Siem-Jørgensen et al. (2008), процент извлечения клеток из донных осадков был ниже: для вирусов и бактерий – 60 и 40% соответственно. Наши исследования показали, что в зависимости от применяемого реагента, бактериальные клетки изначально извлекались из грунта с разной эффективностью (62–74%). Несмотря на то, что последующие обязательные три промывочные процедуры, несомненно, увеличивали время обработки одной пробы, они тем не менее обеспечивали учет 92–95% “потенциальной” кумулятивной численности микроорганизмов. На стадии подсчета клеток микроорганизмов проточная цитометрия, по сравнению с эпифлуоресцентной микроскопией, становится значительно более эффективным методом, поскольку позволяет значительно сократить время при обработке большого числа проб.
Список литературы
Лебедева М.Н., Шумакова Г.В. K вопросу о достоверности данных, полученных методом прямого учета бактерий на фильтрах // Микробиология. 1969. Т. 38. № 2. С. 351–357.
Миронов О.Г. Бактериальная флора донных осадков // Основы биологической продуктивности Черного моря. Киев: Наукова Думка, 1979. С. 199–207.
Малахова Т.В., Канапацкий Т.А., Егоров В.Н., Малахова Л.В., Артёмов Ю.Г., Евтушенко Д.Б., Гулин С.Б., Пименов Н.В. Микробные процессы и генезис струйных метановых газовыделений прибрежных районов Крымского полуострова // Микробиология. 2015. Т. 84. № 6. С. 743–752.
Malakhova T.V., Kanapatskii T.A., Egorov V.N., Malakhova L.V., Artemov Yu.G., Evtushenko D.B., Gulin S.B., Pimenov N.V. Microbial processes and genesis of methane gas jets in the coastal areas of the Crimean Peninsula // Microbiology (Moscow). 2015. V. 84. P. 838–845.
Пименов Н.В., Егоров В.Н., Канапацкий Т.А., Малахова Т.В., Артемов Ю.Г., Сигалевич П.А., Малахова Л.В. Сульфатредукция и микробные процессы метановых сипов в осадках Свастопольской бухты // Микробиология. 2013. Т. 82. № 5. С. 614–624.
Pimenov N.V., Egorov V.N., Kanapatskii T.A., Malakhova T.V., Artemov Y.G., Sigalevich P.A., Malakhova L.V. Sulfate reduction and microbial processes of the methane cycle in the sediments of the Sevastopol Bay // Microbiology (Moscow). 2013. V. 82. P. 618–627.
Сорокин Ю.И. Черное море: природа, ресурсы. М.: Наука, 1982. 216 с.
Amalfitano S., Fazi S. Recovery and quantification of bacterial cells associated with streambed sediments // J. Microbiol. Methods. 2008. V. 75. P. 237–243.
Buesing N., Gessner M.O. Comparison of detachment procedures for direct counts of bacteria associated with sediment particles plant litter and epiphytic biofilm // Aquat. Microb. Ecol. 2002. V. 27. P. 29–36.
Danovaro R., Dellánno A., Trucco A., Serresi M., Vanucci S. Determination of virus abundance in marine sediments // Appl. Environ. Microbiol. 2001. V. 67. P. 1384–1387.
Danovaro R., Corinaldesi C., Filippini M., Fisher U.R., Gessner M.O., Jacquet S., Magagnini M., Velimiriv B. Viriobenthos in freshwater and marine sediments: a review // Freshwater Biol. 2008. V. 53. P. 1186–1213.
Danovaro R., Middelboe M. Separation of free virus particles from sediments in aquatic systems // Manual of Aquatic Viral Ecology / Eds. Wilhelm S.W., Weinbauer M.G., Suttle C. A. Washington, DC: ASLO, 2010. Ch. 8. P. 74–81.
Duhamel S., Jacquet S. Flow cytometric analysis of bacteria- and virus-like particles in lake sediments // J. Microbiol. Methods. 2006. V. 64. P. 316–332.
Egorov B.V., Artemov Y.G., Gulin S.B., Polikarpov G.G. Methane seeps in the Black Sea: discovery. quantification and environmental assessment // J. Black Sea/Mediterranean Environ. 2011. V. 17. P. 171–185.
Frischer M.E. Danforth J.M., Newton Healy M.A., Saunders F.M., Whole-cell versus total RNA extraction for analysis of microbial community structure with 16S rRNA-targeted oligonucleotide probes in salt marsh sediments // Appl. Environ. Microbiol. 2000. V. 66. P. 3037–3043.
Gasol J.M., Del Giorgio P.A. Using flow cytometry for counting natural planktonic bacteria and understanding the structure of planktonic bacterial communities // Scientia Marina. 2000. V. 64. P. 197–224.
Hobbie J.E., Daley R.J., Jasper S. Use of Nuclepore filters for counting bacteria by fluorescence microscopy // Appl. Environ. Microbiol. V. 1977. V. 33. P. 1225–1228.
Kallmeyer J., Smith D.C., Spivack A.J., D’Hondt S. New cell extraction procedure applied to deep subsurface sediments // Limnol. Oceanogr. 2008. Methods 6. P. 236–245.
Lein A., Pimenov N., Guillouc C., Martin J.-M., Lancelot C., Rusanov I., Yusupov S., Miller Yu., Ivanov M. Seasonal dynamics of the sulphate reduction rate on the north-western Black Sea shelf // Estuarine. Coastal and Shelf Science. 2002. V. 54. P. 385–401.
Leloup J., Loy A., Knab N.J., Borowski C., Wagner M., Jørgensen B.B. Diversity and abundance of sulfate-reducing microorganisms in the sulfate and methane zones of a marine sediment, Black Sea // Environ. Microbiol. 2007. V. 9. P. 131–142.
Lindahl V., Bakken L.R. Evaluation of methods for extraction of bacteria from soil // FEMS Microbiol. Ecol. 1995. V. 16. P. 135–142.
Lunau M., Lemke A., Walther K., Martens-Habbena W., Simon M. An improved method for counting bacteria from sediments and turbid environments by epifluorescence microscopy // Environ. Microbiol. 2005. V. 7. P. 961–968.
Marie D., Partensky F., Jacquet S., Vaulot D. Enumeration and cell cycle analysis of natural populations of marine picoplankton by flow cytometry using the nucleic acid stain SYBR Green I // Appl. Environ. Microbiol. 1997. V. 63. P. 186–193.
Morono Y., Takeshi T., Noriaki M., Inagaki F. Discriminative detection and enumeration of microbial life in marine subsurface sediments // ISME J. 2009. V. 3. P. 503–511.
Noble R.T., Fuhrman J.A. Use of SYBR Green I for rapid epifluorescence counts of marine viruses and bacteria // Aquat. Microb. Ecol. 1998. V. 14. P. 113–118.
Porter J., Pickup R., Edwards C. Evaluation of flow cytometric methods for the detection and viability assessment of bacteria from soil // Soil Biol. Biochem. 1997. V. 29. P. 91–100.
Schippers A., Kock D., Höft C., Köweker G., Siegert M. Quantification of microbial communities in subsurface marine sediments of the Black Sea and off Namibia // Front. Microbiol. 2012. V. 3. P. 16. https://doi.org/10.3389/fmicb.2012.00016
Siem-Jørgensen M., Glud R.N., Middelboe M. Viral dynamics in a coastal sediment: Seasonal pattern, controlling factors and relations to the pelagic-benthic coupling // Mar. Biol. Res. 2008. V. 4. P. 165–179: suppl. material.
Tarnovetskii I.Yu., Merkel A.Y., Kanapatskiy T.A., Ivanova E.A., Gulin M.B., Toshchakov S., Pimenov N.V. Decoupling between sulfate reduction and the anaerobic oxidation of methane in the shallow methane seep of the Black Sea // FEMS Microbiol. Lett. 2018. V. 365. Iss. 21. fny235. https://doi.org/10.1093/femsle/fny235
Thamdrup B., Rosselló-Mora R., Amann R. Microbial manganese and sulfate reduction in Black Sea shelf sediments // Appl. Environ. Microbiol. 2000. V. 66. P. 2888–2897.
Weinbauer M.G., Beckmann C., Höfle M.G. Utility of green fluorescent nucleic acid dyes and aluminium oxide membrane filters for rapid epifluorescence enumeration of soil and sediment bacteria // Appl. Environ. Microbiol. 1998. V. 64. P. 5000–5003.
Дополнительные материалы отсутствуют.