Микробиология, 2020, T. 89, № 1, стр. 42-51
Ancylobacter lacus sp. nov. И Ancylobacter plantiphilus sp. nov. – новые аэробные факультативно-метилотрофные бактерии
А. А. Чемодурова a, Е. Н. Капаруллина a, А. В. Мачулин a, К. Шпроер b, Э. Ланг b, Н. В. Доронина a, *
a ФИЦ ПНЦБИ РАН Институт биохимии и физиологии микроорганизмов
им. Г.К. Скрябина Российской академии наук
142290 Пущино, Россия
b Leibniz Institute DSMZ ‒ German Collection of Microorganisms and Cell Cultures
38124 Braunschweig, Germany
* E-mail: doronina@ibpm.pushchino.ru
Поступила в редакцию 03.06.2019
После доработки 02.07.2019
Принята к публикации 25.09.2019
Аннотация
Новые аэробные факультативно-метилотрофные бактерии выделены из воды пресного озера (штамм F30LT), ризосферных почв клевера белого Trifolium repens L. (штамм 1ТСT) и моркови дикой Daucus carota L. (штамм Dau2). Изоляты представлены грамотрицательными аспорогенными неподвижными плеоморфными/палочковидными клетками, размножающимися бинарным делением, являются факультативными метилотрофами, поскольку наряду с метанолом используют широкий спектр полиуглеродных соединений. Оптимально растут при 25‒29°С, рН 7.0‒7.5, 0.5% (об./об.) СН3OH, 0.05% (в./об.) NaCl. Штаммы реализуют рибулозобисфосфатный путь С1-метаболизма. Доминирующими фосфолипидами являются фосфатидилхолин, фосфатидилэтаноламин, фосфатидилглицерин и дифосфатидилглицерин. В жирнокислотном составе клеток преобладают C18:1 ω7c, C19:0 ω8c cyclo, C16:0 и С18:0 кислоты. Основной убихинон Q-10. На основании секвенирования генов 16S рРНК штамм F30LT имеет наибольший уровень сходства с Ancylobacter dichloromethanicus DM16T (97.8%), тогда как штаммы 1ТСT и Dau2 близки A. oerskovii DSM 18746Т (98.6%). Сходство нуклеотидных последовательностей гена 16S рРНК между штаммами 1ТСT и Dau2 составило 99.4%. ДНК‒ДНК гибридизация штамма F30LT с A. dichloromethanicus DM16T выявила только 22% гомологии, штамма 1ТСT с A. oerskovii DSM 18746Т 27%, тогда как штаммы 1ТСT и Dau2 между собой имели 77% гомологии. Основываясь на полученных данных, штамм F30LT идентифицирован как новый вид рода Ancylobacter – Ancylobacter lacus sp. nov. (ВКМ В-3280Т = DSM 106439T). Штаммы 1ТСТ и Dau2 (=ВКМ В-3227 = CCUG71988) отнесены к новому виду Ancylobacter plantiphilus sp. nov. с типовым штаммом 1ТСТ (=ВКМ В-3219Т = DSM 106438T).
Аэробные метилотрофные бактерии (метилотрофы) используют метанол, метиламин и другие окисленные и замещенные производные метана, но не метан, в качестве источников углерода и энергии. В настоящее время описано более 50 родов метилотрофов, относящихся к Alpha-, Beta- и Gammaproteobacteria, Verrucomicrobia, Firmibacteria, Actinobacteria и Flavobacteria (Троценко и соавт., 2010). Помимо таксономического разнообразия они проявляют поразительное экофизиологическое и цитобиохимическое разнообразие.
Из воды пресного озера г. Пущино (Московская область, Россия), ризосферных почв клевера белого (Trifolium repens L.) г. Москва (Россия) и моркови дикой (Daucus carota L.) г. Пущино (Московская область, Россия) нами на среде с метанолом выделены новые факультативно-метилотрофные штаммы ‒ F30LТ, 1ТСТ и Dau2 соответственно. Секвенирование генов 16S рРНК выявило принадлежность новых изолятов к роду Ancylobacter.
Род Ancylobacter входит в семейство Xanthobacteraceae, пор. Rhizobiales, кл. Alphaproteobacteria. Представители рода Ancylobacter ‒ факультативно-метилотрофные аэробные бактерии, представлены плеоморфными/палочковидными или бобовидными клетками с грамотрицательным типом клеточной стенки. В настоящее время род включает 9 валидно описанных видов, согласно LPSN (www.bacterio.net): Ancylobacter aquaticus (Ørskov, 1928; Raj, 1983), A. rudongensis (Xin et al., 2004), A. polymorphus (Xin et al., 2006), A. vacuolatus (Xin et al., 2006), A. oerskovii (Lang et al., 2008), A. dichloromethanicus (Firsova et al., 2009), A. defluvii (Poroshina et al., 2013), A. sonchi (Agafonova et al., 2017) и A. pratisalsi (Suarez et al., 2017). Представители этих видов были выделены из различных источников, таких как водная среда, донные осадки, почва, ризосфера растений.
Цель данной работы ‒ физиолого-биохимическая и таксономическая характеристика новых изолятов F30LT, 1ТСT и Dau2.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования и условия культивирования. Штамм F30L выделен из воды небольшого пресного озера г. Пущино, Московская область, Россия (54°49′13.8′′ с.ш., 37°34′42.5′′ в.д.). Штамм 1ТСТ выделен из ризосферной почвы клевера белого (Trifolium repens L.) г. Москва, Россия, а штамм Dau2 выделен из ризосферной почвы моркови дикой (Daucus carota) г. Пущино, Московская область (Россия). Образцы проб природной воды, ризосферных почв помещали в колбы Эрленмейера (750 мл) с 200 мл среды “К” и 0.5% (об./об.) метанола. Среда “К” содержала (г/л): KH2PO4 – 2.0; (NH4)2SO4 − 2.0; NaCl – 0.5; MgSO4 · · 7H2O – 0.1; FeSO4 · 7H2O – 0.002; pH 7.4. После трех пассажей в течение 2 сут на качалке (180 об./мин) при 29°C суспензию накопительных культур метилотрофов высевали истощающим посевом на агаризованную (“Difco”, США, 2%) среду “К” с метанолом. Реизолированные колонии пересевали на скошенный агар. Чистоту выделенных культур контролировали световой и электронной микроскопией, а также по однородности колоний на агаризованной среде с метанолом и R2A.
Изучение культуральных и физиологo-биохимических свойств изолятов. При описании колоний, изучении морфологии и подвижности клеток исследуемые штаммы выращивали на агаризованной среде “К”. Образование индола из триптофана (1 г/л) определяли колометрически на модифицированной среде “К”, где (NH4)2SO4 был заменен на 1 г/л KNO3, используя реактив Сальковского (Gordon, Weber, 1951). Калибровочную кривую строили со стандартными растворами индолилуксусной кислоты. Гидролиз крахмала оценивали по реакции с раствором Люголя после выращивания культуры на агаризованной среде “К” c добавлением 0.2% (в./об.) растворимого крахмала. Наличие оксидазы определяли, используя 1% (в./об.) раствор тетраметил-р-фенилендиамин дигидрохлорида. Активность каталазы выявляли, нанося 3%-ный раствор перекиси водорода на штрих исследуемых культур, выращенных на агаризованной среде.
Температурный диапазон роста определяли, выращивая культуры в жидкой среде “К” с метанолом в герметично закрытых флаконах на качалке (120 об./мин) при температуре 4‒42°C, а также на среде R2A. Рост изолятов при различных значениях pH исследовали на среде “К” в диапазоне pH 5.0‒10.0. Значения pH устанавливали добавлением 5 M NaOH и 5 н HCl.
При изучении способности изолятов использовать различные органические соединения в качестве источника углерода и энергии в минеральную среду вместо метанола вносили 0.3% (в./об.) испытуемого вещества, инокулировали аликвотой культуры из логарифмической фазы роста и инкубировали 14 сут при оптимальной температуре. Все летучие вещества вносили в количестве 0.5% по объему.
Для определения спектра используемых субстратов и выявления некоторых биохимических свойств исследуемых штаммов использовали также API тесты (API 20Е, API 20NЕ; “BioMerieux”, Франция), следуя инструкции производителя. Рост в атмосфере метана, дихлорметана или H2/CO2/O2 анализировали, как описано ранее (Kaparullina et al., 2017).
При исследовании способности культур использовать различные источники азота в среду “К” вместо сульфата аммония вносили эквивалентные по азоту количества тестируемых веществ.
Устойчивость к антибиотикам определяли с помощью дисков (“Bioanalyse”, Турция), пропитанных следующими антибиотиками (мкг/диск): линкомицин (10), эритромицин (15), пенициллин (10), оксациллин (5), налидиксовая кислота (30), гентамицин (10), хлорамфеникол (30), канамицин (30), стрептомицин (10), новобиоцин (30), тетрациклин (30) и неомицин (30).
Микроскопия. Изучение морфологии и подвижности клеток в режиме фазового контраста проводили с помощью оптического микроскопа Nikon Eclipse Ci (“Nikon”, Япония), оснащенного камерой ProgRes SpeedXT core5 (“Jenoptik”, Германия). Электронно-микроскопический анализ проводили на сканирующем электронном микроскопе JSM-6510LV (“Jeol”, Япония). Образцы фиксировали в 1.5%-ом растворе глутарового альдегида в 0.05 М какодилатном буфере (рН 7.2) при 4°C в течение 1 ч, затем трижды отмывали в том же буфере. Далее образцы дополнительно фиксировали в 1%-ом растворе OsO4 в 0.05 М какодилатном буфере (рН 7.2) в течение 3 ч при 20°C. После обезвоживания в серии спиртов возрастающей концентрации (начиная с 50 до 100% в течение 20 мин на каждом этапе) клетки дополнительно пропитывали в трет-бутиловом спирте (tert-Butanol, “Sigma-Aldrich”) в двух сменах по 20 мин при 26°C. Далее образцы замораживали в трет-бутиловом спирте и проводили процедуру замораживания‒высушивания в установке JFD-320 (“Jeol”, Япония) в соответствии с рекомендациями фирмы-производителя. На поверхность высушенных образцов наносили золото в напылительной установке JFC 1100 (“Jeol”, Япония).
Хемотаксономический анализ. Убихиноны экстрагировали из лиофильно-высушенных клеток, очищали по методу Коллинса (Collins, 1985) и анализировали на масс-спектрометре Finnigan МАТ 8430 MS (Германия).
Жирнокислотный состав клеток, выращенных на среде R2A в течение 48 ч, определяли известным методом (Doronina et al., 2012). Фосфолипидный состав клеток, выращенных на среде “К” с метанолом, анализировали двумерной тонкослойной хроматографией (Doronina et al., 2012).
Энзимологический анализ проводили в бесклеточном экстракте, как описано ранее (Trotsenko et al., 1986; Доронина и соавт., 2018). Активность ферментов выражали в наномолях потребленного субстрата или образованного продукта за 1 мин в пересчете на 1 мг белка. Количественное определение белка проводили методом Лоури (Lowry et al., 1951).
Выделение и анализ ДНК. ДНК выделяли с использованием набора ZR Fungal/Bacterial DNA MiniPrep (“Zymo Research”, США) в соответствии с рекомендациями фирмы-производителя.
Г + Ц состав ДНК определяли тепловой денатурацией на спектрофотометре “Beckman DU-8B” (США) при скорости нагрева 0.5°С/мин и рассчитывали, используя уравнение: мол. Г + Ц = = (Tпл × 2.08) – 106.4. В качестве стандарта использовали ДНК Escherichia coli K-12. ДНК‒ДНК гибридизацию проводили, как описано ранее (Lang et al., 2008).
Ген 16S рРНК амплифицировали ПЦР, используя универсальные для прокариот праймеры 27f и 1492r (Lane, 1991).
Филогенетический анализ. Предварительный филогенетический скрининг сходства последовательностей генов 16S рРНК проводили по базе данных GeneBank [NCBI] с помощью пакета программ BLAST [http://ncbi.nlm.nih.gov]. Для более точного определения филогенетического положения изолятов нуклеотидные последовательности генов 16S рРНК выравнивали c последовательностями референтных штаммов ближайших прокариот с помощью программы CLUSTAL W (Thompson et al., 1997). Филогенетический анализ выполнен при помощи программы MEGA 5 (Tamura et al., 2011). Филогенетические деревья (филограммы) строили методом присоединения соседей (“neighbor-joining”) (Saitou, Nei, 1987). Статистическую достоверность ветвления оценивали с помощью “bootstrap-анализа” 1000 альтернативных филограмм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Морфология. Исследуемые в работе изоляты представлены грамотрицательными клетками. Клетки штамма F30LТ имели грушевидную форму (рис. 1а, 1в), клетки штаммов 1ТСТ и Dau2 были представлены короткими овоидными палочками (рис. 1б, 1г). Для клеток штамма 1ТСТ характерно наличие капсулы. Все штаммы на 3 сут роста на агаризованной среде “К” с 0.5% метанола при 29°С образовывали точечные колонии с ровным краем, гладкой поверхностью, однородной структурой, белые (штамм F30LТ), светло-бежевые (штаммы 1ТСТ и Dau2). Спор и простек не образовывали, размножались бинарным делением.
Рис. 1.
Морфология клеток исследуемых штаммов. Фaзοвый кοнтpaст клеток штаммов: F30LT (a), 1ТСТ (б), длинa мaсштaбнοй мeтки 10 мкм. Скaниpующaя элeктpοннaя микpοскοпия клеток штаммов: F30LT (в), 1ТСТ (г). Длинa мaсштaбнοй мeтки ‒ 1 мкм.

Культуральные, физиолого-биохимические и хемотаксономические свойства. Изучаемые штаммы росли в жидкой среде “К” с метанолом без агрегации клеток, пигмент не образовывали. Изоляты оксидазо-, каталазо- и уреазоположительные, желатин не разжижали. На тестовых средах все штаммы гидролизовали эскулин и обладали β-галактозидазой, но не образовывали сероводород. Все исследуемые в работе штаммы росли на глюкозе, лактозе, фруктозе, мальтозе, манните, инозите, метаноле и этаноле, но не росли на α-кетоглутарате. В отличие от штамма F30LT, штаммы Dau2 и 1ТСТ росли на арабинозе, метиламине, диметиламине, формальдегиде, диметилсульфоксиде и глицерине. Штамм F30LT слабо рос на ксилозе, фруктозе, малате, ацетамиде, N-ацетил-D-глюкозамине. Штамм Dau2 не рос на сахарозе и серине, а рост на малате, сукцинате натрия, N-ацетил-D-глюкозамине и аланине отсутствовал у штамма 1TCT. Слабый рост на сукцинате натрия, формальдегиде и диметилсульфоксиде выявлен у штамма Dau2. Штамм 1ТСТ слабо рос на формиате натрия, серине, ацетамиде, формальдегиде и диметилсульфоксиде. Все изоляты оптимально росли при 25‒29°С и pH 7.0‒7.5, при 0.01‒3% (оптимально 0.5%) (об./об.) СН3OH, содержании NaCl 0.05% (в./об.); 2% NaCl в среде полностью ингибировало рост.
В жирнокислотном составе клеток преобладали C18:1 ω7c, C19:0 ω8c cyclo, C16:0 и С18:0 кислоты (табл. 1).
Таблица 1.
Состав жирных кислот клеток исследуемых штаммов и типовых видов рода Ancylobacter (% от общего содержания) Штаммы: 1 ‒ F30LT; 2 ‒ 1TCT; 3 ‒ Dau2; 4 ‒ A. sonchi VKM B-3145T (Agafonova et al., 2017); 5 ‒ A. dichloromethanicus VKM B-2484T (Firsova et al., 2009); 6 ‒ A. oerskovii DSM 18746T (Lang et al., 2008); 7 ‒ A. rudongensis DSM 17131T (Xin et al., 2004); 8 ‒ A. aquaticus DSM 101T (Ørskov, 1928; Raj, 1983); 9 ‒ A. vacuolatus DSM 1277T (Xin et al., 2006); 10 ‒ A. polymorphus DSM 2457T (Xin et al., 2006); 11 ‒ A. pratisalsi E130T (Suarez et al., 2017); 12 ‒ A. defluvii DSM 29296T (Poroshina et al., 2013)
| Жирные кислоты | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Неизвестные 13.957 | Сл. | Сл. | Сл. | 0.8 | 0.4 | 0.3 | 0.2 | 0.5 | – | 0.3 | ‒ | Сл. |
| Сумма жирных кислот 3 | 0.5 | 0.5 | 0.5 | 0.6 | 0.8 | 0.4 | 1.3 | 1.6 | 0.7 | 0.4 | 3.6 | 0.6 |
| 16:0 | 2.4 | 5.4 | 3.6 | 6.8 | 3.2 | 4.9 | 4.8 | 5.9 | 4.9 | 6.8 | 12.7 | 4.8 |
| 17:0 | ‒ | 0.4 | 0.1 | 0.7 | ‒ | 0.5 | 0.5 | 1.0 | 1.1 | 0.9 | ‒ | 0.5 |
| 18:1 ω7c | 96.1 | 82.6 | 86.2 | 81.4 | 69.1 | 82.7 | 60.9 | 75.8 | 76.1 | 71.5 | 64.4 | 85.0 |
| 18:0 | 1.1 | 1.3 | 1.2 | 0.8 | 0.5 | 1.6 | 1.5 | 1.0 | 1.2 | 2.0 | 1.6 | 1.1 |
| 18:1-11 methyl ω7c | ‒ | ‒ | ‒ | ‒ | ‒ | ‒ | 2.2 | – | 1.0 | 0.4 | ‒ | ‒ |
| Сумма жирных кислот 7 | ‒ | ‒ | ‒ | ‒ | ‒ | ‒ | – | – | – | 0.8 | ‒ | ‒ |
| 19:0 ω8c cyclo | ‒ | 9.9 | 8.4 | ‒ | 26.0 | 9.1 | 27.9 | 13.7 | 14.7 | 16.3 | 7.7 | 8.1 |
| 20:1 ω11c | ‒ | ‒ | ‒ | ‒ | ‒ | ‒ | – | – | – | – | ‒ | ‒ |
| 20:2 ω6,9c | ‒ | ‒ | ‒ | ‒ | ‒ | 0.2 | 0.4 | – | – | 0.2 | ‒ | ‒ |
Штаммы F30LT, 1ТСT и Dau2 синтезировали индолпроизводные на среде с триптофаном (2; 2.2 и 8 мкг/мл соответственно, при OД600 культуры 1.0).
Характеристики новых штаммов в сравнении с типовыми видами рода Ancylobacter представлены в табл. 2.
Таблица 2.
Дифференцирующие характеристики штаммов F30LT, 1TCT и Dau2 и типовых представителей рода Ancylobacter Штаммы: 1 ‒ F30LT; 2 ‒ 1TCT; 3 ‒ Dau2; 4 ‒ A. sonchi OsotT; 5 ‒ A. dichloromethanicus DM16T; 6 ‒ A. aquaticus DSM 101T; 7 ‒ A. rudongensis DSM 17131T; 8 ‒ A. polymorphus DSM 2457T; 9 ‒ A. vacuolatus DSM 1277T; 10 ‒ A. oerskovii DSM 18746T; 11 ‒ A. pratisalsi E130T; 12 ‒ A. defluvii SK15T
| Характеристика | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Морфология клеток | Груше-видные | Палочковидные | Палочковидные | Палочковидные | Бобо- видные | Бобо- видные | Бобо- видные | Бобо- видные | Бобо- видные | Плеоморфные | Палочковидные | Палочковидные |
| Рост при 42°C | – | – | – | – | – | – | – | + | – | – | – | – |
| Рост при 5% NaCl | – | – | – | – | +/‒ | – | – | + | – | Н.о. | + | +/– |
| Нитратредукция | – | – | – | – | – | + | – | – | + | – | + | + |
| Гидролиз желатины | – | – | – | – | – | – | + | + | + | – | Н.о. | Н.о. |
| Рост на дихлорметане | – | – | – | – | + | – | – | – | – | Н.о. | Н.o. | – |
| API 20NE: | ||||||||||||
| Нитратредукция | – | – | – | – | – | + | – | – | – | – | + | + |
| Уреаза | + | + | + | + | – | – | – | – | + | + | – | – |
| Гидролиз эскулина | + | + | + | + | + | + | + | + | + | +/– | + | + |
| β-Галактозидаза | + | + | + | + | + | + | + | + | + | – | + | – |
| Ассимиляция арабинозы | + | + | + | + | + | – | + | + | + | + | – | + |
| Ассимиляция глюконата | – | + | + | + | +/– | – | – | – | + | + | – | + |
| Ассимиляция малата | + | + | + | – | – | – | – | + | – | + | – | + |
| Ростовые субстраты: | ||||||||||||
| Лактоза | + | + | + | + | – | Н.о. | – | – | – | Н.о. | + | – |
| Формиат | – | +/– | + | + | – | + | + | + | + | + | + | – |
| Глицерин | – | + | + | + | +/– | – | + | – | – | – | Н.о. | Н.о. |
| Арабиноза | – | + | + | + | + | – | + | + | + | + | Н.о. | Н.о. |
| Ксилоза | +/– | + | + | + | + | +/– | + | + | – | +/– | Н.о. | Н.о. |
| Фруктоза | + | + | + | + | +/– | – | + | +/– | +/– | + | Н.о. | + |
| Сорбит | + | + | Н.о. | + | +/– | – | + | + | + | + | Н.о. | + |
| Источник выделения штамма | Вода озера | Ризосферная почва Tifolium repens L. | Ризосферная почва Daucus carota L. | Корни Sonchus arvensis L. | Загрязненная почва | Почва | Ризосфера Spartina anglica L. | Речной ил | Почва | Почва | Ризосфера Plantago winteri Wir | Загрязненная соленая вода |
Примечание. Все данные получены в этой работе, за исключением A. dichloromethanicus DM16T; A. oerskovii DSM 18746T; A. rudongensis DSM 17131T; A. aquaticus DSM 101T; A. vacuolatus DSM 1277T; A. polymorphus DSM 2457T (Firsova et al., 2009); A. sonchi OsotT (Agafonova et al., 2017); A. pratisalsi E130T (Suarez et al., 2017). Н.о. – не определяли; “+/‒” – слабый рост.
Метаболическая характеристика. Для выяснения путей первичного С1-метаболизма исследуемых штаммов определяли активности соответствующих ферментов в экстрактах клеток, выращенных на средах с метанолом или глюкозой.
Поскольку ферментные профили всех культур были сходными, в табл. 3 приведены активности ферментов только для штамма 1ТСТ. Исследуемые изоляты окисляли метанол классической метанолдегидрогеназой, проявляющей активность с феназинметосульфатом (ФМС) и активируемой цианидом или ионами аммония. Окисление формальдегида до формиата осуществлялось НАД-зависимой формальдегиддегидрогеназой, активность которой обнаружена также у клеток, выращенных на среде с глюкозой. Активность формальдегиддегидрогеназы с ФМС была очень низкой. Формиат далее подвергался превращению до СО2 формиатдегидрогеназой, активной как с ФМС, так и с НАД+. Активность этого фермента отсутствовала в экстрактах клеток, выращенных на глюкозе. При исследовании путей первичной ассимиляции углерода метанола не удалось выявить активности специфических ферментов серинового и гексулозофосфатного путей С1-ассимиляции: серин-глиоксилатаминотрансферазы и гексулозофосфатсинтазы (табл. 3). В то же время обнаружена оксипируватредуктаза и фосфорибулокиназа, активность которых была одинакова в экстрактах клеток, выращенных на метаноле и глюкозе. Напротив, рибулозобисфофаткарбоксилаза индуцировалась только при росте на С1-субстратах. Аммоний ассимилировался восстановительным аминированием α-кетоглутарата и через глутаматный цикл.
Таблица 3.
Активность ферментов первичного окисления, ассимиляции С1-соединений и азотного метаболизма у штамма 1ТСТ, выращенного на разных субстратах (нмоль/мин/мг белка)
| Фермент | Кофактор | Метанол | Глюкоза |
|---|---|---|---|
| Метанолдегидрогеназа | ФМС | 174 | 3 |
| Формальдегиддегидрогеназа | ФМС | 4 | 1 |
| НАД+ | 60 | 25 | |
| Формиатдегидрогеназа | ФМС | 28 | 0 |
| НАД+ | 44 | 0 | |
| Рибулобисфосфаткарбоксилаза | 135 | 0 | |
| Фосфорибулокиназа | 223 | 230 | |
| Оксипируватредуктаза | НАДН | 120 | 120 |
| НАДФН | 160 | 157 | |
| Серин-глиоксилатаминотрансфераза | НАДН | 0 | 0 |
| НАДФН | 0 | 0 | |
| Гексулозофосфатсинтаза | 0 | 0 | |
| Глутаматдегидрогеназа | НАДН | 0 | 0 |
| НАДФН | 19 | 20 | |
| Глутаматсинтаза | НАДН | 8 | 5 |
| Глутаминсинтетаза | Mg2+ | 18 | 16 |
Генотипическая характеристика. На основании секвенирования генов 16S рРНК штамм F30LT имел наибольший уровень сходства с Ancylobacter dichloromethanicus DM16T (97.8%), тогда как штаммы 1ТСT и Dau2 близки A. oerskovii DSM 18746Т (98.6%) (рис. 2). Сходство нуклеотидных последовательностей гена 16S рРНК между штаммами 1ТСT и Dau2 составило 99.4%. ДНК‒ДНК гибридизация штамма F30LT с A. dichloromethanicus DM16T выявила только 22% гомологии, штамма 1ТСT с A. oerskovii DSM 18746Т ‒ 27%, тогда как штаммы 1ТСT и Dau2 между собой имели 77% гомологии, что свидетельствует о принадлежности к одному виду.
Рис. 2.
Филогенетическое положение штаммов F30LT, 1ТСT и Dau2, основанное на результатах сравнительного анализа нуклеотидных последовательностей генов 16S рРНК. Масштаб соответствует 2 нуклеотидным заменам на каждые 100 нуклеотидов (эволюционное расстояние). Использован метод “neighbor-joining”. Корень определен включением последовательности Escherichia coli O157:H7 (AY513502) в качестве внешней группы.
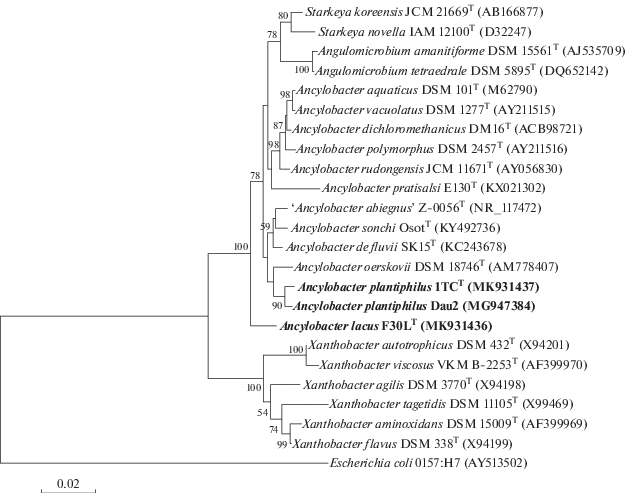
Филогенетическое дерево (рис. 2) свидетельствует о существенной полифилетичности рода Ancylobacter, и очевидно, что после секвенирования геномов всех типовых представителей можно будет провести его ревизию.
Согласно современным рекомендациям по систематике прокариот необходимо секвенирование генома нового таксона и сравнение его идентичности нуклеотидных последовательностей (ANI) и уровня ДНК‒ДНК гибридизации in silico c наиболее близкими представителями по данным секвенирования генов 16S рРНК. Однако геномы A. dichloromethanicus DM16T и A. oerskovii DSM 18746Т пока не секвенированы. В то же время считается, что если уровень сходства по генам 16S рРНК с известными типовыми представителями рода менее 98.7%, то есть полное основание для отнесения исследуемого штамма к новому виду (Chun et al., 2018).
Таким образом, проведенные исследования позволяют идентифицировать штамм F30LТ как новый вид Ancylobacter lacus sp. nov., а исследуемые штаммы 1TCT и Dau2 как новый вид Ancylobacter plantiphilus sp. nov., поскольку они отличались от ближайших представителей – A. dichloromethanicus DM16T и A. oerskovii DSM 18746Т соответственно, по филогенетическим (уровень сходства по 16S рРНК <98.6% и уровень ДНК‒ДНК гомологии <70%) и фенотипическим характеристикам (дифференцирующие характеристики новых штаммов представлены в табл. 2). В отличие от ближайшего представителя, штамм F30LТ не рос при 5% NaCl, на дихлорметане, глюконате, формиате, глицерине и арабинозе, но рос на лактозе, образовывал уреазу и ассимилировал малат. В отличие от ближайшего представителя A. oerskovii DSM 18746Т, типовой штамм 1ТСT гидролизовал эскулин и обладал β-галактозидазой, рос на глицерине.
Описание Ancylobacter lacus sp. nov.
Ancylobacter lacus (la’cus. L. masc. gen. n. lacus из озера, указывающий на источник выделения этого организма).
Грамотрицательные неспорообразующие неподвижные грушевидные клетки (1.0‒1.5 × × 2.0‒2.2 мкм), размножаются бинарным делением. На минеральной агаризованной среде с метанолом колонии точечные, матовые, белые, с выпуклым профилем, гладкой поверхностью и однородной структурой. Аэроб, образует каталазу, оксидазу и уреазу. Оптимально растет при 25–29°C, pH 7.0‒7.5 и 0.5% (об./об.) СН3OH, в присутствии 0.05‒1.5% NaCl. Растет на глюкозе, лактозе, мальтозе, раффинозе, фруктозе, сукцинате натрия, манните, инозите, сорбите, D,L-пролине, этаноле и метаноле. Слабо растет на ксилозе, сахарозе, малате, ацетамиде и N-ацетил-D-глюкозамине. Не обнаружен рост в атмосфере H2/O2/CO2, на дихлорметане, глюконате, арабинозе, α-кетоглутарате, формиате натрия, серине, метиламине, диметиламине, формальдегиде, диметилсульфоксиде и глицерине. В качестве источников азота использует соли аммония и нитраты. Синтезирует индолы из триптофана на среде, содержащей нитраты в качестве источников азота. Желатин не разжижает, не выделяет сероводород. Образует ацетоин. Крахмал не гидролизует. Реализует рибулозобисфосфатный путь С1-метаболизма. В ассимиляции ${\text{NH}}_{4}^{ + }$ принимают участие глутаматдегидрогеназа и глутаматный цикл (глутаматсинтаза, глутаминсинтетаза).
Клетки устойчивы к действию тетрациклина, стрептомицина, налидиксовой кислоты, пеницилина, линкомицина, хлорамфеникола. Чувствительны к новобиоцину, неомицину, эритромицину, гентамицину, канамицину. В жирнокислотном составе клеток преобладают С18:1 ω7с (91.6%), С16:0 (2.4%) и С18:0 (1.1%) кислоты. Основной убихинон ‒ Q10. В фосфолипидном составе клеток преобладают фосфатидилхолин, фосфатидилэтаноламин, фосфатидилглицерин и дифосфатидилглицерин. Содержание пар Г + Ц в ДНК штамма F30LТ составляет 67.5 мол. % (Tпл).
Типовой штамм F30LТ (ВКМ В-3280Т = DSM 106439T) изолирован из воды пресного озера г. Пущино (Московская область, Россия).
Последовательность гена 16S рРНК штамма F30LТ депонирована в GenBank под номером MK931436.
Описание Ancylobacter plantiphilus sp. nov.
Ancylobacter plantiphilus (plan.ti.phi’lus, L.n. planta, a plant; Gr. aji. philos, loving; M. L. masc. n. plantiphilus, plant-loving, живущий, растущий или находящийся на растениях).
Грамотрицательные неспорообразующие неподвижные короткие овоидные палочки (0.5‒0.6 × 1.0‒1.2 мкм), размножаются бинарным делением. На минеральной среде с метанолом колонии точечные, непрозрачные, светло-бежевые, блестящие, круглые, с выпуклым профилем, гладкой поверхностью и однородной структурой. Строгий аэроб, образует каталазу, оксидазу, уреазу. Оптимально растет при 25–29°C, pH 7.0‒7.5 и 0.5% (об./об.) СН3OH, в присутствии 0‒0.5% NaCl. Растет на арабинозе, глюкозе, ксилозе, лактозе, мальтозе, фруктозе, малате, манните, инозите, ацетамиде, аланине, диметилсульфоксиде, метаноле, метиламине, диметиламине, этаноле и глицерине. Не растет в атмосфере H2/O2/CO2, на сахарозе, дихлорметане, α-кетоглутарате и серине. В качестве источников азота использует соли аммония, нитраты, метиламин. Синтезирует индолы из триптофана на среде, содержащей нитраты в качестве источников азота. Желатин не разжижает, не выделяет сероводород. Не образует ацетоин. Крахмал не гидролизует. Реализует рибулозобисфосфатный путь С1-метаболизма. В ассимиляции ${\text{NH}}_{{\text{4}}}^{{\text{ + }}}$ принимают участие глутаматдегидрогеназа и глутаматный цикл (глутаматсинтаза, глутаминсинтетаза).
Клетки устойчивы к действию налидиксовой кислоты, пеницилина, линкомицина, эритромицина, хлорамфеникола. Чувствительны к тетрациклину, стрептомицину, новобиоцину, неомицину, канамицину, гентамицину. В жирнокислотном составе клеток преобладают С18:1 ω7с (82.6%), С19:0 ω8c cyclo (9.9%) и С16:0 (5.4%) кислоты. Основной убихинон ‒ Q10. В фосфолипидном составе преобладают фосфатидилхолин, фосфатидилэтаноламин, фосфатидилглицерин и дифосфатидилглицерин. Содержание пар Г + Ц в ДНК штамма 1ТСТ составляет 67.1 мол. % (Tпл).
Типовой штамм 1ТСТ (=ВКМ В-3219Т = DSM 106438Т) изолирован из ризосферной почвы клевера белого (Trifolium repens L.), г. Москва (Россия).
Последовательность гена 16S рРНК штамма 1ТСТ депонирована в GenBank под номером MK931437.
К данному виду относится также штамм Dau2, выделенный из ризосферной почвы моркови дикой (Daucus carota L.) (ВКМ В-3227 = ССUG71988).
Последовательность гена 16S рРНК штамма Dau2 депонирована в GenBank под номером MG947384.
Список литературы
Доронина Н.В., Торгонская М.Л., Федоров Д.Н., Троценко Ю.А. Аэробные метилобактерии – перспективные объекты современной биотехнологии (обзор) // Прикл. биохимия и микробиология. 2015. Т. 51. С. 111–121.
Doronina N.V., Torgonskaya M.L., Fedorov D.N., Trotsenko Yu.A. Aerobic methylobacteria promising objects of modern biotechnology (review) // Appl. Biochem. Microbiol. 2015. V. 51. P. 111–121.
Доронина Н.В., Капаруллина Е.Н., Чемодурова А.А., Троценко Ю.А. Paracoccus simplex sp. nov. – новый факультативный метилотроф, использующий метиламин // Микробиология. 2018. Т. 87. С. 541–550.
Doronina N.V., Kaparullina E.N., Chemodurova A.A., Trotsenko Yu.A. Paracoccus simplex sp. nov., a new methylamine-utilizing facultative methylotroph // Microbiology (Moscow). 2018. V. 87. P. 662–671.
Троценко Ю.А., Доронина Н.В., Торгонская М.Л. Аэробные метилобактерии. Пущино: ОНТИ ПНЦ РАН, 2010. 325 с.
Trotsenko Y.A., Doronina N.V., Torgonskaya M.L. Aerobic methylobacteria. Pushchino: ONTI PSC RAS, 2010 325 p.
Порошина М.Н., Доронина Н.В., Капаруллина Е.Н., Ковалевская Н.П., Троценко Ю.А. Галофильные и галотолерантные аэробные метилобактерии из техногенных биотопов // Микробиология. 2013. Т. 84. С. 473‒482.
Poroshina M.N., Doronina N.V., Kaparullina E.N., Kovalevskaya N.P., Trotsenko Y.A. Halophilic and halotolerant aerobic methylobacteria from the technogenic Solikamsk biotopes // Microbiology (Moscow). 2013. V. 82. P. 490‒498.
Agafonova N., Kaparullina E., Trotsenko Y., Doronina N. Ancylobacter sonchi sp. nov., a novel methylotrophic bacterium from roots of Sonchus arvensis L. // Int. J. Syst. Evol. Microbiol. 2017. V. 67. P. 4552‒4558.
Chun J., Oren A., Ventosa A., Christensen H., Arahal D.R., da Costa M.S., Rooney A.P., Yi H., Xu X.W., De Meyer S., Trujillo M.E. Proposed minimal standards for the use of genome data for the taxonomy of prokaryotes // Int. J. Syst. Evol. Microbiol. 2018. V. 68. P. 461–466.
Collins M.D. Analysis of isoprenoid quinones // Methods in Microbiology / Ed. Gottschalk G. N.Y.: Acad Press, 1985. V. 18. P. 329–366.
Doronina N.V., Gogleva A.A., Trotsenko Y.A. Methylophilus glucosoxydans sp. nov., a restricted facultative methylotroph from rice rhizosphere // Int. J. Syst. Evol. Microbiol. 2012. V. 62. P. 196‒201.
Firsova J., Doronina N., Lang E., Spröer C., Vuilleumier S., Trotsenko Y. Ancylobacter dichloromethanicus sp. nov. ‒ a new aerobic facultatively methylotrophic bacterium utilizing dichloromethane // Syst. Appl. Microbiol. 2009.V. 32. P. 227–232.
Gordon S.A., Weber R.P. Colorimetric estimation of indoleacetic acid // Plant Physiol. 1951. V. 26. P. 192–195.
Kaparullina E.N., Trotsenko Yu.A., Doronina N.V. Methylobacillus methanolivorans sp. nov., a novel non-pigmented obligately methylotrophic bacterium // Int. J. Syst. Evol. Microbiol. 2017. V. 67. P. 425‒431.
Lang E., Swiderski J., Stackebrandt E., Schumann P., Spröer C., Sahin N. Description of Ancylobacter oerskovii sp. nov. and two additional strains of Ancylobacter polymorphus // Int. J. Syst. Evol. Microbiol. 2008. V. 58. P. 1997–2002.
Lane D.J. 16S/23S rRNA sequencing in nucleic acid techniques in bacterial systematics // Nucleic Acid Techniques in Bacterial Systematics / Eds. Stackebrandt E., Goodfellow M. Chichester: John Wiley and Sons, 1991. P. 115–175.
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. Protein measurement with the Folin phenol reagent // J. Biol. Chem. 1951. V. 193. P. 265‒275.
Ørskov J. Beschreibung eines neuen Mikroben, Microcyclus aquaticus, mit eigentuemlicher Morphologie // Zentralbl. Bakteriol. Parasitenkd. Infektionskr. Hyg. Abt. I. 1928. V. 107. P. 180–184 (in German).
Raj H.D. Proposal of Ancylobacter gen. nov. as a substitute for the bacterial genus Microcyclus Ørskov 1928 // Int. J. Syst. Bacteriol. 1983. V. 33. P. 397–398.
Saitou N., Nei M. The neighbour-joining method: a new method for reconstructing phylogenetic trees // Mol. Biol. Evol. 1987. V. 4. P. 405–425.
Suarez Ch., Ratering S., Spröer J., Schnell S. Ancylobacter pratisalsi sp. nov. with plant growth promotion abilities frrom the rhizosphere of Plantago winteri Wirtg. // Int. J. Syst. Evol. Microbiol. 2017. V. 67. P. 4500‒4506.
Tamura K., Peterson D., Peterson N., Stecher G., Nei M., Kumar S. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods // Mol. Biol. Evol. 2011. V. 28. P. 2731–2739.
Thompson J.D., Gibson T.J., Plewniak F., Jeanmougin F., Higgins D.G. The ClustalX windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools // Nucleic Acids Res. 1997. V. 25. P. 4876–4882.
Trotsenko Y.A., Doronina N.V., Govorukhina N.I. Metabolism of non-motile obligately methylotrophic bacteria // FEMS Microbiol. Lett. 1986. V. 3. P. 293‒297.
Wayne L.G., Brenner D.J., Colwell R.R., Grimont P.A.D., Kandler O., Krichevsky M.I., Moore L.H., Moore W.E.S., Murray R.G.E., Stackebrandt E., Starr M.P. Truper H.G. Report of the ad hoc committee on reconciliation of approaches to bacterial systematics // Int. J. Syst. Bacteriol. 1987. V. 37. P. 463‒464.
Xin Y.H., Zhou Y.G., Zhou H.L., Chen W.X. Ancylobacter rudongensis sp. nov., isolated from roots of Spartina anglica // Int. J. Syst. Evol. Microbiol. 2004. V. 54. P. 385–388.
Xin Y.H., Zhou Y.G., Chen W.X. Ancylobacter polymorphus sp. nov. and Ancylobacter vacuolatus sp. nov. // Int. J. Syst. Evol. Microbiol. 2006. V. 56. P. 1185–1188.
Дополнительные материалы отсутствуют.


